Транзиторный констриктивный перикардит при болезни Брутона: клинический случай
Аннотация
Введение. Констриктивный перикардит представляет собой отдаленное последствие любого патологического процесса, развивающегося в перикарде в результате фибринозного утолщения и кальцификации его листков, что препятствует нормальному диастолическому заполнению камер сердца. Одной из его форм является преходящий констриктивный перикардит, который разрешается после проведения противовоспалительной терапии.
Краткое описание. 19-летний мужчина с известным анамнезом болезни Брутона поступил в клинику с жалобами на выраженную слабость, одышку в покое, кашель, боли в грудной клетке, повышение температуры тела до 380 С, снижение артериального давления до 80/60 мм рт.ст., увеличение в объеме живота. При первичном выполнении эхокардиографии результаты не вызвали серьезных подозрений, однако, учитывая достаточно специфическое движение межжелудочковой перегородки, была заподозрена констрикция перикарда.
Дискуссия. В ходе дообследования прицельная оценка эхокардиографических параметров позволила верифицировать диагноз констриктивного перикардита, что впоследствии было также подтверждено результатами зондирования камер сердца. Поскольку при исследовании уровня иммуноглобулинов выявлены значительные отклонения, было принято решение о возобновлении заместительной терапии препаратами иммуноглобулина с последующей переоценкой клинического статуса пациента.
В статье представлено клиническое описание пациента с констриктивным перикардитом, который явился проявлением болезни Брутона. При динамическом наблюдении за пациентом отмечалось разрешение констрикции на фоне возобновления заместительной терапии препаратами иммуноглобулина.
Перикардит, представляя собой воспалительный процесс перикарда, может быть как самостоятельной нозологической единицей, так и вторичным проявлением другого заболевания. При всем многообразии этиологических факторов поражения перикарда, поиск причины перикардита зачастую становится неразрешимой проблемой. Констриктивный перикардит является редким осложнением острого идиопатического перикардита, тогда как перикардит специфической этиологии: аутоиммунный, иммуноопосредованный или паранеопастический, коррелирует с повышенным риском развития констрикции [1][2]. Х-сцепленная агаммаглобулинемия (болезнь Брутона) представляет собой наследственное иммунодефицитное заболевание, характеризующееся отсутствием зрелых В-клеток, что приводит к тяжелому дефициту антител и рецидивирующим инфекциям [3]. Важное значение имеет ранняя диагностика этого заболевания для начала адекватной терапии, т. к. случаи спонтанной полной реконвалесценции или длительной ремиссии у больных с данной патологией казуистически редки. Данный клинический случай демонстрирует развитие транзиторного констриктивного перикардита у пациента с Х-сцепленной агаммаглобулинемией.
Клинический случай
Пациент Д., 19 лет, в декабре 2022г доставлен в клинику с жалобами на выраженную слабость, одышку в покое, кашель, боли в грудной клетке, повышение температуры тела до 38º С, снижение артериального давления до 80/60 мм рт.ст., увеличение в объеме живота.
Из анамнеза известно, что с 2-летнего возраста неоднократно переносил воспалительные заболевания различной локализации: гнойный гайморит, гнойный менингоэнцефалит, серозный менингит, пневмонии, пансинусит. В 2008г в возрасте 5 лет установлен диагноз: «Первичное иммунодефицитное состояние (агаммаглобулинемия Х-сцепленный вариант)», в связи с чем была рекомендована пожизненная внутривенная заместительная терапия препаратами иммуноглобулина, которую пациент получал нерегулярно: последняя трансфузия проведена в 2020г. В октябре 2022г развился рецидив пансинусита, на фоне проводимой антибактериальной терапии состояние с положительной динамикой. С ноября 2022г отмечает появление утомляемости, одышки при физической нагрузке, дискомфорта в грудной клетке, рецидив лихорадочного синдрома.
Данные объективного осмотра. Астеническое телосложение. Рост 173 см, вес 62 кг, индекс массы тела 21,3 кг/м². Кожные покровы и видимые слизистые оболочки бледные, панникулит правой голени, периферических отеков нет. Нормотермия. Артериальное давление 95/65 мм рт.ст., частота сердечных сокращений 115 уд./мин. Тоны сердца приглушены, патологические шумы не выслушиваются. В легких дыхание везикулярное, ослаблено в нижних отделах, больше справа, хрипов нет. Сатурация на воздухе снижена до 92%. Передняя брюшная стенка отечна, живот увеличен в объеме за счет асцита, болезненный при пальпации в правом подреберье. Печень пальпаторно увеличена, нижний край на 5-6 см выступает из-под реберной дуги.
По результатам лабораторных исследований отмечался нейтрофильный лейкоцитоз (16,4×10*9/л), умеренное снижение уровня гемоглобина до 108 г/л, повышение уровня печеночных трансаминаз (аспартатаминотрансфераза 470 Ед/л, аланинаминотрансфераза 1123 Ед/л). Уровень N-концевого промозгового натрийуретического пептида был также повышен до 2716 пг/мл.
При исследовании уровня иммуноглобулинов (Ig) выявлены значительные отклонения: IgА 0,35 г/л (норма 0,65-4,80), IgG 4,54 г/л (норма 6,50-16,00), IgМ 0,1 г/л (норма 0,30-2,90).
Инструментальные исследования
Электрокардиограмма. Синусовая тахикардия с частотой сердечных сокращений 132 уд./мин. Нарушение реполяризации в виде отрицательного зубца Т и депрессии сегмента ST в отведениях I, II, aVF, V3-V6 (рис. 1).

Рис. 1. Электрокардиограмма при поступлении.
В условиях приемного отделения выполнена фокусная эхокардиография (ЭхоКГ), по результатам которой выраженного снижения глобальной сократимости миокарда левого желудочка (ЛЖ) и клапанной патологии не выявлено, правые и левые отделы сердца не расширены. Обращало на себя внимание утолщение листков перикарда.
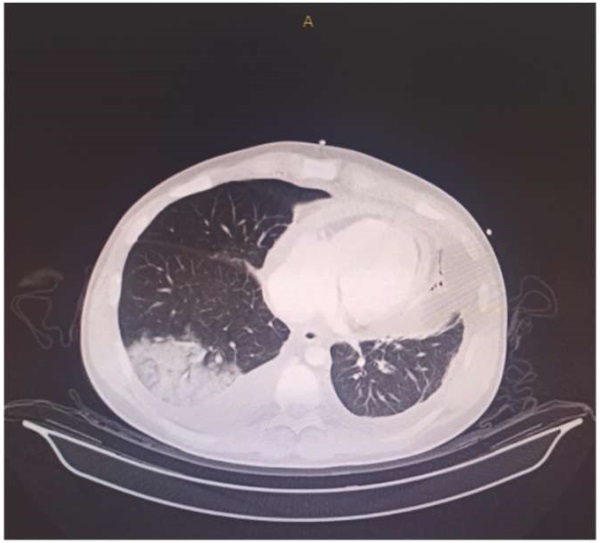
Учитывая наличие выраженной одышки, гипотонии и тахикардии, на этапе приемного отделения заподозрена тромбоэмболия легочной артерии (ТЭЛА), предтестовая вероятность по шкалам Wells и Geneva соответствовала средней. Зафиксировано повышение уровня Д-димера до 732 мг/л (норма до 500 мг/л), выполнена компьютерная томография органов грудной клетки с контрастированием легочных артерий (ЛА), по результатам которой выявлен тромбоз сегментарных артерий А8, А9, А10 справа, признаки инфаркт-пневмонии, двустороннего гидроторакса, гидроперикарда и асцита, также было выявлено утолщение листков перикарда до 2 мм (рис. 2-4). При дообследовании данных за тромбоз вен нижних конечностей не получено.

Рис. 2. Компьютерная томография органов грудной клетки в нативном виде.
Инфаркт-пневмония нижней доли правого легкого.
Определяется уплотнение листков перикарда до 2-3 мм.

Рис. 3, 4. Компьютерная томография органов грудной клетки с контрастированием ЛА.
Однако выявленная патология не обосновывала имеющиеся у пациента симптомы, такие как гидроторакс, гидроперикард и асцит, особенно в отсутствии периферических отеков — ТЭЛА была нетяжелой, без дисфункции правого желудочка (ПЖ), что продиктовало необходимость дальнейшего диагностического поиска.
ЭхоКГ демонстрировала нормальные показатели линейных размеров аорты, предсердий, желудочков, толщины стенок. Фракция выброса ЛЖ, оцененная по Симпсону, была ~50%. Отмечалось парадоксальное движение (диастолическое «дрожание») межжелудочковой перегородки (МЖП) и ее смещение в сторону ЛЖ на вдохе (рис. 5). Индексированный объем левого предсердия увеличен до 51 мл/м². Правые отделы сердца не расширены. Регистрировалась небольшая регургитация на митральном и трикуспидальном клапанах, реакция потоков наполнения на обоих клапанах зависела от фаз дыхания примерно на 15-20%. Расчетное систолическое давление в ЛА ~19 мм рт.ст., при этом диаметр нижней полой вены (НПВ) 22 мм, реакция ее на фазы дыхания отсутствовала (рис. 6). Обращали на себя внимание неравномерно утолщенные листки перикарда с изоэхогенными наслоениями толщиной ~7-8 мм на висцеральном листке перед ПЖ, за боковой стенкой ЛЖ. Движение листков перикарда относительно друг друга отсутствовало (рис. 7).

Рис. 5. Парастернальная позиция по короткой оси ЛЖ. Парадоксальное движение МЖП.

Рис. 6. Субкостальный доступ. Неадекватная реакция НПВ на фазы дыхания.
А — на вдохе, Б — на выдохе.

Рис. 7. Апикальная четырехкамерная позиция.
Красной стрелкой указаны изоэхогенные наслоения за боковой стенкой ЛЖ.
ЭхоКГ-параметры первоначально не вызвали серьезных подозрений, однако учитывая достаточно специфическое движение МЖП, мы заподозрили констрикцию перикарда. При допплерографии спектр трансмитрального потока наполнения указывал на увеличение отношения Е/А до 2,1 (пик Е ~90 см/с, пик А ~40 см/с). Время замедления раннего диастолического наполнения (DT) было укорочено до 120 мс. При оценке транстрикуспидального диастолического кровотока отмечается ускорение пика Е до 65 см/с. При тканевой допплерографии были получены нормальные скорости движения митрального фиброзного кольца.
С целью дообследования выполнено зондирование правых отделов сердца, по результатам которого выявлено небольшое увеличение давления заклинивания ЛА до 17 мм рт.ст., а также значительное повышение давления в правом предсердии до 20 мм рт.ст., при этом систолическое давление в ПЖ и ЛА составило ~27 мм рт.ст.
Пациент был консультирован гастроэнтерологом с целью оценки функции печени на предмет цирроза, однако ни ультразвуковое исследование, ни другие лабораторные данные, кроме повышенных трансаминаз, не указывали на данную патологию.
Принимая во внимание клиническую картину, наличие признаков высокого центрального венозного давления в отсутствие правожелудочковой дисфункции, тяжелой трикуспидальной недостаточности или легочной гипертензии, рестриктивный паттерн наполнения ЛЖ с реакцией на фазы дыхания и нормальными показателями тканевой допплерографии, достаточно специфичное движение МЖП в диастолу и его зависимость от вдоха, утолщение листков перикарда по данным ЭхоКГ и компьютерной томографии, позволили нам считать диагноз констриктивного перикардита верифицированным. Следует отметить, что на сегодняшний день в медицинской литературе недостаточно данных, свидетельствующих о патогенетической связи ТЭЛА с агаммаглобулинемией, в связи с чем данная находка интерпретирована как сопутствующая патология. Таким образом, установлен клинический диагноз:
Основное заболевание: Первичный иммунодефицит. Агаммаглобулинемия Х-сцепленный вариант.
Осложнение основного заболевания: Констриктивный перикардит. Хроническая сердечная недостаточность IIБ стадии, IV функционального класса по NYHA. Двусторонний гидроторакс.
Сопутствующее заболевание: Правосторонняя ТЭЛА низкого риска. Правосторонняя инфаркт-пневмония.
Поскольку радикальным методом лечения констриктивного перикардита является перикардэктомия, с целью решения вопроса о дальнейшей тактике ведения пациента был проведен кардиохирургический консилиум, однако от проведения оперативного лечения принято решение воздержаться по ряду причин. Во-первых, наличие в данный момент воспалительного синдрома, что наталкивало на мысль о возможной транзиторной констрикции на фоне подострого перикардита, хотя у пациента и имелись другие возможные причины воспаления (пневмония, панcинусит). Во-вторых, хороший клинический эффект от консервативного лечения. В-третьих, наличие иммунодефицита является серьезным фактором риска периоперационных инфекционных осложнений. Было принято решение о возобновлении заместительной терапии препаратами иммуноглобулина с последующей переоценкой клинического статуса пациента и показаний к хирургическому лечению.
Период госпитализации составил 21 день. Была проведена коррекция терапии — отменены бета-блокаторы, назначенные с симптоматической целью для купирования тахиаритмии, но вызывающие при констрикции уменьшение сердечного выброса, поскольку «запертый» в неподатливом перикарде ЛЖ не способен увеличить ударный объем. Проведена заместительная терапия препаратами иммуноглобулина в насыщающей дозе, симптоматическая терапия диуретиками, антикоагулянтная терапия согласно схеме лечения ТЭЛА, антибактериальная терапия. На фоне проводимой терапии состояние пациента с положительной динамикой за счет уменьшения одышки, регресса отечного синдрома, а также восстановления лабораторных показателей: N-концевой промозговой натрийуретический пептид 2716→398 пг/мл, аспартатаминотрансфераза 470→22 Ед/л, аланинаминотрансфераза 1123→24 Ед/л.
При контрольном осмотре через 1 мес. у пациента отсутствовали жалобы, в связи с чем принято решение продолжить консервативную терапию. Через 5 мес. по результатам ЭхоКГ отсутствовали какие-либо признаки констрикции перикарда: нормализовалось движение МЖП, реакция трансмитрального потока наполнения на фазы дыхания была минимальной, а НПВ не была расширенной и нормально спадалась на вдохе.
Обсуждение
Молекулярной основой Х-сцепленной агаммаглобулинемии является нарушение развития В-клеток в результате мутации гена тирозинкиназы Брутона, расположенного на длинном плече (q) Х-хромосомы (Xq21.3-Xq22) [3][4]. Наследование данной мутации препятствует экспрессии белка BTK, что приводит к остановке дифференцировки на стадии пре-В-клеток в костном мозге, вызывая глубокую нехватку зрелых В-лимфоцитов в периферической крови [5]. Без иммуноглобулинов пациенты становятся уязвимыми для инвазивных инфекций, вызванных инкапсулированными бактериями, такими как Streptococcus pneumoniae, Staphylococcus aureus и Haemophilus influenzae [6][7].
У пациентов с Х-сцепленной агаммаглобулинемией поражение сердца встречается редко и обусловлено рецидивирующими легочными инфекциями, приводящими к дилатации правых камер сердца и легочной гипертензии. На сегодняшний день в медицинской литературе описано лишь два случая развития гнойного перикардита у пациентов с данной врожденной патологией: один в сочетании с пневмонией, второй на фоне сепсиса вследствие менингита [8].
Представленный клинический случай демонстрирует развитие транзиторного констриктивного перикардита у пациента с болезнью Брутона. Учитывая клинические данные, дифференциальная диагностика проводилась прежде всего с другими причинами сердечной недостаточности с нормальной сократимостью ЛЖ: рестриктивная кардиомиопатия, правожелудочковая недостаточность, трикуспидальная недостаточность, тампонада сердца. Следует сказать и о ряде ограничений в нашей работе. При проведении ЭхоКГ мы не использовали в полной мере разработанные клиникой Мейо диагностические критерии констриктивного перикардита, в частности, экспираторный поток реверсии в печеночной вене [9]. Кроме того, при проведении катетеризации сердца мы не воспользовались возможностью зафиксировать взаимозависимость желудочков, что является гемодинамическим доказательством констрикции, а также не смогли задокументировать типичную для данной патологии кривую давления в ПЖ в виде ква
Заключение
В представленном клиническом случае последовательно продемонстрирован диагностический путь, позволивший установить верный диагноз. Следует подозревать констриктивный перикардит при внесердечных синдромах: изолированном асците, полисерозите, поражении печени неясной этиологии, рецидивирующем плевральном выпоте. Это трудный диагноз ввиду того, что сопровождается неспецифическими клиническими проявлениями, непримечательным протоколом ЭхоКГ-исследования, если он не выполнен с прицелом на данный диагноз. Однако именно ЭхоКГ является ключевым инструментом верификации диагноза, поскольку важна не анатомия (кроме ярких случаев «панцирного сердца»), а гемодинамика, и как она меняется при дыхании. Клиническая настороженность в отношении констриктивного перикардита и целенаправленная оценка критериев клиники Мейо позволит своевременно диагностировать данное заболевание. Также следует помнить о возможном транзиторной характере констрикции на фоне активного воспаления в перикарде и необходимости пробного консервативного лечения во избежание ненужного хирургического вмешательства.
Информация о полученном согласии у пациентов на проведение исследования: согласие на использование информации в научных целях получено.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Кручинова C.В., Скалецкий К.В., Донец Е.К., Намитоков А.М., Карибова М.В., Космачева Е.Д. Транзиторный констриктивный перикардит при болезни Брутона: клинический случай. Российский кардиологический журнал. 2024;29(2S):5726. https://doi.org/10.15829/1560-4071-2024-5726. EDN: KNPOLT
Скопировать