Клинический случай спонтанной диссекции левой коронарной артерии в послеродовом периоде
Аннотация
Спонтанная диссекция коронарных артерий — редкое заболевание, составляющее потенциальную угрозу жизни пациента. Зачастую данная патология осложняет течение беременности или послеродового периода. Редкая встречаемость и сложности при диагностике являются причиной недостаточного количества клинических данных и невозможности выработки единого алгоритма диагностики и тактики лечения спонтанной диссекции коронарных артерий.
В статье приводится краткая литературная справка и описание клинического случая спонтанной диссекции коронарных артерий в послеродовом периоде, а также обсуждается ряд моментов лечебной тактики.
Введение
Спонтанная диссекция коронарных артерий (СДКА) представляет собой достаточно редкую и коварную патологию, изучением которой в настоящее время занимаются специалисты по всему миру.
Высокий интерес к данной проблеме обусловлен, прежде всего, недостаточным количеством эмпирических данных, которые позволили бы выработать четкий протокол диагностики и лечения СДКА. Кроме того, немаловажным моментом являются особенности эпидемиологии СДКА, а именно — тот факт, что подавляющие большинство пациентов с СДКА — молодые женщины с низкими показателями традиционного сердечно-сосудистого риска.
В данной статье мы рассматриваем СДКА с точки зрения актуальных научных данных, а также приводим описание клинического случая, произошедшего в нашей клинике, и комментарии к нему.
Первое описание этого заболевания было сделано английским врачом Гарольдом Претти в 1931г по результатам аутопсии умершей от разрыва аневризмы правой коронарной артерии (ПКА) ранее здоровой 42-летней женщины [1].
СДКА — это спонтанное нетравматическое и неятрогенное расслоение стенки коронарной артерии (КА) с формированием ложного просвета [2]. При этом просвет может располагаться как между интимой и медией, так и между медией и адвентицией. В любом случае формируется интрамуральная гематома артериальной стенки, суживающая истинный просвет КА. Последнее, в свою очередь, приводит к снижению кровотока в бассейне данной артерии с развитием ишемии и повреждения миокарда.
Говоря об эпидемиологии СДКА, прежде всего следует сказать о том, что оценить истинную распространенность этого заболевания сложно ввиду недостаточной диагностики и вариабельности клинической манифестации.
Главная гендерная особенность СДКА — преимущественное поражение женщин. Соотношение женщины:мужчины составляет 90:10, хотя в ряде исследований встречаются менее полярные значения, порядка 60:40. Средний возраст больных — 50 лет (28-85 лет) [3].
СДКА обнаруживается у 8,7% женщин младше 50 лет с диагнозом острого коронарного синдрома (ОКС). При этом в подгруппе ОКС с элевацией сегмента ST эта цифра составляет 10,8% [2].
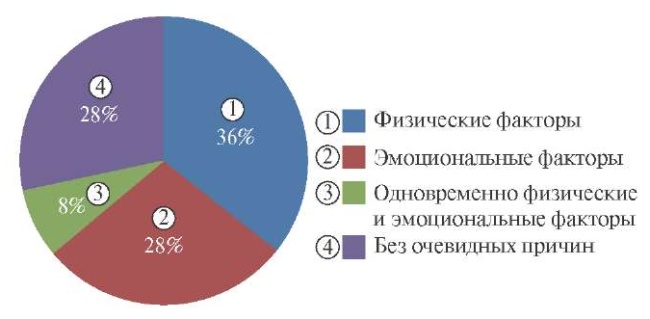
СДКА является мультифакторным заболеванием. Среди причин возникновения рассматриваются следующие (в скобках приведена распространенность ассоциации СДКА и заболевания): фибромускулярная дисплазия (25-86%); беременность (2-8%); высокий (4 и более родов) паритет (8,9-10%); наследственные артериопатии и болезни соединительной ткани (синдром Марфана, синдром Лоеса-Дитца, синдром Элерса-Данлоса, дефицит а1-антитрипсина, поликистозная болезнь почек) (1,2-3%); экзогенные гормоны (10,7-12,6%); системные воспалительные заболевания (>1-8,9%). Кроме того, имеются отдельные сведения об ассоциации СДКА с мигренью и коронарным вазоспазмом [4].
Отдельного внимания заслуживает ассоциация СДКА и беременности, отличающаяся большей тяжестью и худшим прогнозом от СДКА, не связанной с беременностью.
Большинство случаев СДКА, ассоциированной с беременностью, приходится на третий триместр и ранний послеродовый период, а частота встречаемости составляет 1,81:100000 случаев. Кроме того, СДКА является главной причиной инфаркта миокарда (ИМ) у беременных женщин и родильниц [4].
Среди 120 случаев СДКА, ассоциированной с беременностью, в 76% случаев наблюдалась элевация сегмента ST, в 24% — кардиогенный шок, в 16% — фибрилляция желудочков, а госпитальная летальность составила 4% [5].
Согласно данным регистра, созданного в клинике Мейо, 70% случаев СДКА происходят в течение первого месяца после родов или искусственного прерывания беременности. Кроме того, по данным этого регистра, в группе пациенток со СДКА, ассоциированной с беременностью, была меньше фракция выброса левого желудочка (ЛЖ) в момент установления диагноза (46±17%) в сравнении с пациентами, у которых СДКА была обусловлена другим фактором (53±7%) (p=0,0003). Кроме того, в этой группе выявлена более высокая частота диссекции в стволе левой КА (ЛКА) [6].
В настоящее время выделяется две теории патогенеза СДКА. Первая теория сводится к тому, что под влиянием этиологических факторов происходит повреждение эндотелия КА с формированием ложного просвета. Накопление крови в последнем приводит к сужению истинного просвета и нарушению кровотока по КА.
Согласно второй теории, причиной СДКА становится спонтанное кровотечение из vasa vasorum, формирующее интрамуральную гематому, приводящую к диссекции [3].
Клиническая картина СДКА весьма разнообразна. Манифестация может варьировать от легкого дискомфорта в грудной клетке до внезапной сердечной смерти. Однако наиболее распространенным вариантом манифестации СДКА является клиника ОКС, а такой симптом, как боль в грудной клетке, описывается у 95,9% пациентов со СДКА. Среди других частых симптомов выделяются иррадиация боли в руку (51,5%), тошнота или рвота (23,7%), иррадиация боли в шею (22,2%) и профузное потоотделение (21,1%) [3][4].
В лабораторной практике к настоящему времени не существует маркера, который четко позволил бы дифференцировать СДКА от классического атеросклеротического ОКС [3].
Говоря о методах инструментальной диагностики, следует отметить, прежде всего, что электрокардиография (ЭКГ) и эхокардиография так же, как и лабораторные методы, не обнаруживают специфических признаков СДКА. Золотым стандартом диагностики данной патологии принято считать коронароангиографию (КАГ), дополненную внутрисосудистым ультразвуковым исследованием (ВСУЗИ) или оптической когерентной томографией, которые позволяют исследователю оценить послойное строение КА и обнаружить интрамуральную гематому [3]. Однако методика выполнения когерентной томографией и ВСУЗИ предполагает проведение датчика непосредственно в просвет КА, что увеличивает риск ятрогенного распространения диссекции в связи с возможным попаданием датчика в ложный просвет и, соответственно, приводит к ограниченной распространенности данных методов.
В 2014г Jacqueline Saw предложена современная ангиографическая классификация СДКА. Согласно данной классификации, выделяется 3 типа СДКА:
- тип 1 — наличие на ангиограммах множественных рентген-негативных просветов и прокрашивания стенки КА;
- тип 2 — наличие на ангиограммах участков длинного и плавного диффузного сужения КА;
- тип 3 — наличие на ангиограммах фокусов локального сужения просвета КА, которые напоминают атеросклеротические бляшки [7].
Стратегия лечения СДКА на сегодняшний день остается дискутабельным вопросом. Все данные относительно консервативной терапии и оперативных вмешательств основываются исключительно на мнении экспертов, поскольку накоплено недостаточное количество сведений для того, чтобы разработать оптимальный протокол лечения СДКА. Учитывая редкую встречаемость и отсутствие единых подходов к диагностике, рандомизированные исследования в контексте лечения СДКА не представляются возможными.
Существует позиция, согласно которой лечение СДКА у стабильных пациентов без рецидивирующей боли в груди должно быть консервативным, поскольку большинство диссекций излечивается самопроизвольно [3]. Реваскуляризация должна быть рассмотрена у пациентов высокого риска, которые соответствуют хотя бы одному из нижеследующих критериев:
- нестабильность гемодинамики, кардиогенный шок;
- желудочковые аритмии, фибрилляция желудочков;
- персистирующая и повторная СДКА;
- длина интрамуральной гематомы >10 мм или её увеличение;
- диссекция ствола ЛКА, протяженная проксимальная диссекция передней нисходящей артерии (ПНА), огибающей артерии (ОА) или ПКА, устьевая диссекция ПНА, многососудистая диссекция.
Достоверных данных о различии чрескожного коронарного вмешательства (ЧКВ) и аортокоронарного шунтирования (АКШ), как методов реваскуляризации при СДКА, на сегодняшний день нет [2][3].
Временная шкала
Краткий обзор основных событий клинического случая представлен на рисунке 1.

Рис. 1. Основные события клинического случая.
Сокращения: АД — артериальное давление, АТ АФС — антитела, характерные для антифосфолипидного синдрома (антифосфолипидные антитела), ИМВ — интермедиальная ветвь, ЛКА — левая коронарная артерия, ОА — огибающая артерия, ОКС — острый коронарный синдром, ПНА — передняя нисходящая артерия, ПРИТ — палата реанимации и интенсивной терапии, СМП — скорая медицинская помощь, ЧКВ — чрескожное коронарное вмешательство, ЧСС — частота сердечных сокращений, ЧТКА — чрескожная транслюминальная коронарная ангиопластика, ЭКГ — электрокардиограмма.
Презентация случая
18 ноября 2021г в 06:14 утра в приемное отделение доставлена женщина 34 лет. При поступлении она предъявляла жалобы на давящие и пекущие боли за грудиной, иррадиирущие в левую руку и лопатку.
При опросе пациентки стало известно, что её состояние ухудшилось внезапно примерно в 01:00 ночи, когда на фоне полного благополучия у неё появились выраженные давящие и пекущие боли за грудиной с иррадиацией в левую руку и лопатку, затруднение дыхания и чувство нехватки воздуха. Прибывшей бригадой скорой медицинской помощи был диагностирован ОКС с элевацией сегмента ST и принято решение о транспортировке пациентки в ближайший ЧКВ-центр.
При сборе анамнеза выяснилось, что 28 дней назад у пациентки состоялись первые консервативные роды, которые наступили в результате четвертой попытки экстракорпорального оплодотворения (предыдущие 3 попытки были безуспешны), и в данный момент она находится в состоянии лактации. Кроме того, выяснилось, что пациентка является носительницей антифосфолипидных антител и предрасположена к тромбофилическим осложнениям.
Объективно состояние расценивалось как тяжелое. На момент поступления в приемное отделение сохранялась давяще-пекущая боль за грудиной с иррадиацией в левую руку и лопатку. Её пульс был 65 в мин, а артериальное давление (АД) 112/77 мм рт.ст. Тоны сердца были ясными и ритмичными, патологические сердечные и сосудистые шумы не выслушивались. Аускультативная картина в легких и другие физикальные данные не имели патологических отклонений.
ЭКГ, зарегистрированная в приемном отделении, представлена на рисунке 2.

Рис. 2. ЭКГ пациентки при поступлении. Элевация сегмента ST в отведениях V2-V6 до 7 мм. Патологический Q в V4-V6 и слабая динамика нарастания R в V1-V3.
В приемном отделении был осуществлен забор крови, в т.ч. для оценки уровня маркеров повреждения миокарда, однако результаты оценивались ретроспективно, т.к. имела место элевация сегмента ST. Уровень тропонина I составил 2,883 нг/мл; креатинфосфокиназа (КФК) — 243,0 ед./л; КФК-МВ — 33,7 ед./л. Учитывая полученные данные, пациентка была экстренно транспортирована в рентген-операционную для выполнения КАГ. По результатам КАГ стало известно, что у пациентки имеется окклюзия ПНА в проксимальном отделе (дистальное русло было крайне истончено и заполнялось по коллатералям из ЛКА) и 90% стеноз интермедиальной ветви (ИМВ). Были выполнены многократные манипуляции дилатации места окклюзии ПНА баллонным катетером 2,0х20 мм, под давлением до 12 атм., что позволило добиться визуализации дистального русла до среднего отдела, однако ПНА была крайне истончена. Учитывая отсутствие кровотока в дистальном отделе и крайне малый диаметр ПНА, от имплантации стента было решено воздержаться. Ангиограммы первого ЧКВ представлены на рисунке 3.

Рис. 3. Окклюзия ПНА в проксимальном отделе. Дистальное русло заполняется по коллатералям из ЛКА.
Для дальнейшего лечения пациентка была переведена в палату реанимации и интенсивной терапии (ПРИТ) кардиологического отделения. Состояние пациентки оставалось тяжелым. Учитывая результаты рентгенхирургического вмешательства, пациентке была назначена схема консервативной терапии при ИМ:
- ацетилсалициловая кислота: 300 мг (нагрузочная доза, однократно), затем 100 мг 1 раз/сут.;
- тикагрелор: 180 мг (нагрузочная доза, однократно), затем 90 мг 2 раза/сут.;
- эноксапарин натрия — 6000 Ед 2 раза/сут.;
- аторвастатин — 40 мг 1 раз/сут.;
- омепразол — 20 мг 1 раз/сут.
Кроме того, в первые сутки нахождения в ПРИТ у пациентки сохранялся выраженный болевой синдром, что потребовало применения наркотического анальгетика. Проводилась коррекция водно-электролитного баланса инфузией 4% раствора хлорида калия и раствора Рингера. По поводу развившегося пароксизма суправентрикулярной тахикардии, доставлявшего субъективный дискомфорт пациентке, проводилась инфузия 450 мг амиодарона с 250 мл 5% раствора глюкозы.
Учитывая послеродовый период и активную лактацию, консультирующим гинекологом был назначен каберголин 0,25 мг 2 раза/сут. с целью подавления лактации.
Повторное исследование уровня кардиоспецифических ферментов через 6 ч после поступления показало следующие результаты:
- тропонин I: >50,0 нг/мл;
- КФК-МВ: 307,7 ед./л.
Кроме того, были получены следующие лабораторные данные:
- КФК: 2081,0 ед./л;
- N-концевой промозговой натрийуретический пептид: 589,00 пг/мл;
- Агрегация тромбоцитов с аденозинфосфатом: 10%;
- Агрегация тромбоцитов с адреналином: 29%;
- Холестерин общий: 4,54 ммоль/л;
- Холестерин низкой плотности: 2,66 ммоль/л;
- Холестерин высокой плотности: 1,60 ммоль/л;
- Триглицериды: 0,61 ммоль/л.
Пациентке была выполнена эхокардиография, которая выявила снижение фракции выброса до 42%, акинез и истончение верхушечных сегментов ЛЖ и средней трети межжелудочковой перегородки.
На фоне проводимого лечения состояние пациентки в первые сутки оставалось стабильно тяжелым. Болевой синдром был купирован. АД колебалось в пределах 93/61-106/69 мм рт.ст., частота сердечных сокращений 63-78 уд./мин за время наблюдения. Суправентрикулярная тахикардия была купирована инфузией амиодарона и не рецидивировала.
Утром 19 ноября 2021г (05:00 утра) в рамках обхода дежурным врачом ПРИТ была зарегистрирована контрольная ЭКГ (рис. 4), на которой отмечалась закономерная динамика Q-позитивного ИМ передней стенки ЛЖ.

Рис. 4. Закономерная динамика Q-позитивного инфаркта передне-перегородочной области с вовлечением верхушки и боковой стенки.
В 09:38 утра пациентка стала предъявлять жалобы на выраженные давящие боли в левой половине грудной клетки, усиливающиеся на вдохе. АД составляло 105-110/70 мм рт.ст., частота сердечных сокращений 75-76 уд./мин. На ЭКГ отмечалась выраженная отрицательная ишемическая динамика по передней стенке ЛЖ (рис. 5).

Рис. 5. Вновь возникшая элевация сегмента ST в V2-V5 до 3 мм.
Было принято решение о повторном выполнении КАГ в экстренном порядке.
Осуществлен повторный забор крови для определения уровня кардиоспецифических ферментов, однако результаты вновь оценивались ретроспективно. Уровень тропонина I составил >50,0 нг/мл; КФКМВ — 168,3 ед./л.
Фокусная эхокардиография, выполненная до транспортировки в рентген-операционную, показала, помимо нарушений сократимости, обнаруженных ранее, гипокинез средней трети переднего сегмента. Фракция выброса оставалась на уровне 44-45%.
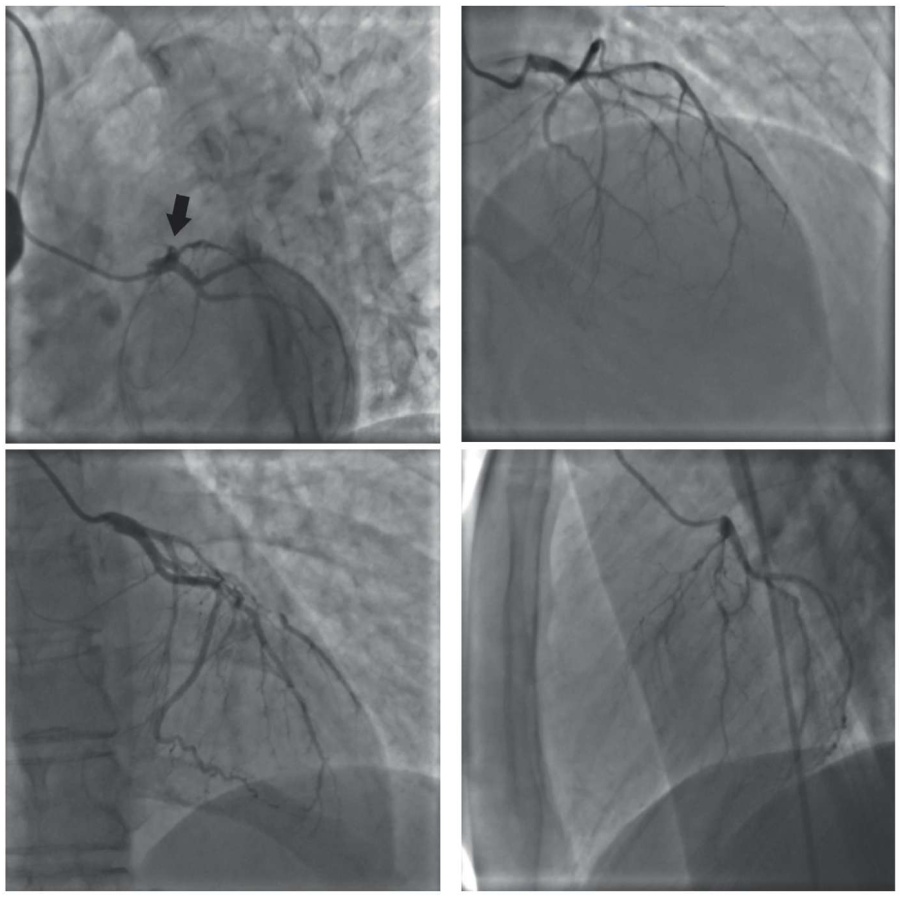
На повторной КАГ определялась линейная диссекция ствола ЛКА, с распространением на проксимальный отдел ПНА, ИМВ, ОА. В ПНА определялась окклюзия в проксимальном отделе, дистальное русло было истончено и заполнялось по коллатералям из ЛКА. В ИМВ определялась субокклюзия в среднем отделе, признаки диссекции. В ОА — признаки линейной диссекции в проксимальном отделе. В ветви тупого края (ВТК) — протяженный стеноз до 90% в проксимальном отделе с признаками диссекции. ПКА, задняя нисходящая артерия, левожелудочковая ветвь оставались проходимы (рис. 6).

Рис. 6. Обширная диссекция бассейна ЛКА.
Учитывая полученные данные, коллегиально было принято решение о выполнении чрескожной транслюминальной коронарной ангиопластики (ЧТКА) по жизненным показаниям. Выполнена имплантация 1 стента размером 3,0×32 мм в ВТК, 1 стента 3,0×28 мм в ОА, 3 стентов 2,5×24 мм, 3,0×32 мм и 3,5×32 мм в ствол ЛКА с переходом в ПНА. На контрольной ангиографии просвет артерий в местах имплантации стентов был восстановлен без признаков диссекции и дистальной эмболии. Контрольные ангиограммы после имплантации стентов представлены на рисунке 7.

Рис. 7. Результат имплантации 5 стентов.
Для дальнейшего лечения пациентка была транспортирована обратно в ПРИТ.
Схема медикаментозного лечения пациентки не изменилась, она продолжила получать двойную антитромбоцитарную терапию (ДАТТ) тикагрелором и ацетилсалициловой кислотой, а также антикоагулянтную терапию эноксапарином в течение 48 ч после операции. Рецидивирующая суправентрикулярная тахикардия потребовала назначения амиодарона 200 мг ежедневно. Проводилась коррекция уровня электролитов парентеральным введением раствора хлорида калия с последующим переходом на пероральные препараты (калия аспарагинат).
На фоне проводимой терапии отмечалась положительная динамика, пациентка нормально перенесла активизацию в пределах ПРИТ и на 5-е сут. госпитализации была переведена в общую палату кардиологического отделения в состоянии средней степени тяжести, а на 13-е сут. — выписана в удовлетворительном состоянии из клиники с заключительным диагнозом: «Основное заболевание: СДКА. Инфаркт миокарда с формированием патологических зубцов Q передней стенки левого желудочка. Тип 2 от 18.11.2021г. Рецидив инфаркта миокарда с формированием патологических зубцов Q передней стенки левого желудочка. Тип 2 от 19.11.2021г.
Операции и манипуляции: 18.11.2021г — экстренная операция — Попытка реканализации ПНА. 19.11.2021г — экстренная операция — Баллонная вазодилатация с установкой 5 стентов в сосуды (ЧТКА ВТК с имплантацией 1 стента «Promus PREMIER» 3,0×32 мм. ЧТКА ОА с имплантацией 1 стента «Promus PREMIER» 3,0×28 мм. ЧТКА ствола ЛКАПНА с имплантацией 3 стентов «Synergy» 2,5×24 мм, «Promus PREMIER» 3,0×32 мм и «Promus PREMIER» 3,5×32 мм).
Осложнения основного заболевания: острая сердечная недостаточность I Кillip.
Сопутствующие заболевания: Вероятный антифосфолипидный синдром. Хронический гастрит». Пациентке было рекомендовано продолжить ДАТТ в течение 1 года.
Спустя 3 мес. после выписки она прибыла на контрольный осмотр в поликлиническое отделение. Проведенное физикальное и лабораторно-инструментальное обследование не выявило отклонений в состоянии её здоровья.
Дискуссия
Ряд моментов, отраженных в описании клинического случая, требует, на наш взгляд, комментариев, поскольку тактика ведения каждого пациента со СДКА индивидуальна и нуждается в тщательной оценке всех «за» и «против».
1) Мы не исключаем вероятность того, что причиной развития ОКС с элевацией сегмента ST у нашей пациентки послужила диссекция 3 типа по классификации J. Saw. Диагностика этого типа СДКА представляется наиболее трудной, поскольку ангиографическая картина крайне схожа с типичным атеросклеротическим поражением коронарного русла. Принимая во внимание возраст, пол и недавние роды, вероятность наличия у этой женщины СДКА, ассоциированной с беременностью, была достаточно высокой. В связи с этим, несмотря на действующий протокол оказания медицинской помощи пациентам с ОКС с элевацией сегмента ST при предполагаемом времени доставки пациентки в ЧКВ-центр, превышающем 120 мин, фельдшеру скорой медицинской помощи во время консультативного звонка было рекомендовано воздержаться от проведения системного тромболизиса.
Показана серия клинических случаев ассоциированных с беременностью СДКА, в одном из которых перед ЧТКА был выполнен системный тромболизис. У 31-летней пациентки на 10-е сут. после родов развился ОКС с элевацией сегмента ST без явлений острой сердечной недостаточности. По данным КАГ была поражена ПКА, диагноз подтверждался ВСУЗИ. Результат лечения положительный [8].
Тем не менее после проведения первого ЧКВ нашей пациентке было принято решение о ведении пациентки по протоколу типичного ОКС с элевацией сегмента ST, поскольку, помимо прочего, имелись указания на наследственную предрасположенность к тромбофилии. В качестве второго антиагреганта был выбран тикагрелор, как наиболее эффективный, учитывая вышесказанное.
2) Ангиографическая картина во время выполнения второй КАГ полностью соответствовала диссекции 1 типа по классификации J. Saw. Решение об оперативном лечении нашей пациентки было принято, поскольку имело место многососудистое поражение коронарного русла с вовлечением ствола ЛКА.
Сообщают об успешном ЧТКА ПКА при развитии СДКА у пациента с нарастающими явлениями гипотонии, что так же согласуется с критериями для оперативного вмешательства, приведенными в обзоре Американской кардиологической ассоциации [4][9].
В то же время в научной литературе представлены данные об оперативном лечении СДКА при однососудистом поражении. Описан клинический случай СДКА, ассоциированной с беременностью, у 35-летней пациентки. Коронарная диссекция манифестировала как ОКС с элевацией сегмента ST. По данным КАГ был выявлен 70% стеноз в проксимальном сегменте ПНА с переходом на устье 1-ой диагональной ветви (ДВ1), и окклюзия ПНА в среднем сегменте.
Успешно выполнена ЧТКА ПНА, несмотря на то, что она являлась единственной пораженной артерией. В послеоперационном периоде пациентка получала ДАТТ аспирином и клопидогрелом [10].
Это согласуется с опытом НМИЦ ССХ им. А. Н. Бакулева, где было успешно выполнено стентирование в средней трети ПНА, в которой была обнаружена диссекция 3 типа [11].
Говоря об оперативном лечении СДКА, следует отметить, что в мировой практике имеется опыт выполнения АКШ при данной патологии. В обзоре 13 случаев ассоциированной с беременностью СДКА авторы приводят данные об успешном выполнении АКШ у 38-летней пациентки с этой патологией. СДКА манифестировала на 17 день послеродового периода кардиогенным шоком. По данным КАГ, были поражены ствол ЛКА, ПНА и ОА. Результат оперативного лечения положительный [8].
Однако в литературе представлены описания клинических случаев, когда было принято решение воздержаться от оперативного лечения СДКА. Так, в одном наблюдении протяженная диссекция ДВ1 у 43-летней пациентки проявила себя 40-минутным приступом загрудинных болей, купировавшихся самостоятельно, и более не беспокоила пациентку. Учитывая клинические и инструментальные данные, было принято решение воздержаться от оперативного вмешательства. На контрольной КАГ спустя 4 мес. признаков диссекции ДВ1 обнаружено не было [11].
Еще одни авторы сообщили об успешном консервативном лечении 51-летней пациентки со СДКА и многососудистым поражением (ПНА и ее ветви, ПКА). Ввиду анатомических особенностей от ЧТКА было решено воздержаться. Пациентка получала ДАТТ (аспирин и клопидогрел), нитраты для купирования болевого синдрома и гепарин в рамках протокола ОКС без элевации сегмента ST. Повторная ангиография показала почти полное исчезновение диссекции сосудов [12].
Описан случай, когда было проведено успешное консервативное лечение 36-летней пациентки с многососудистой СДКА в бассейне ЛКА с вовлечением всех её ветвей, манифестировавшей как ОКС без элевации сегмента ST. От оперативного лечения было принято воздержаться ввиду распространения зоны диссекции после селективной ангиографии ЛКА. Пациентка получала ацетилсалициловую кислоту в дозе 75 мг в качестве единственного антиагреганта. От антикоагуляции было решено воздержаться в связи с высоким риском усугубления диссекции [13].
3) Несмотря на то, что по результатам второй КАГ диагноз СДКА не вызывал сомнений, было принято решение о продолжении ДАТТ и антикоагулянтной терапии. В данном случае это было продиктовано объемом оперативного вмешательства (имплантация 5 стентов). По этой же причине не была произведена смена тикагрелора на клопидогрел, как более безопасную альтернативу, а срок ДАТТ, рекомендованный этой женщине, составил 1 год.
4) Во время нахождения в стационаре, согласно принятому протоколу лечения больных с ИМ с подъемом ST, пациентка получала терапию статинами. Учитывая, что научных данных относительно терапии ингибиторами ГМГ-КоА-редуктазы при СДКА недостаточно, и патогенетически такая терапия не обоснована, от назначения препаратов данной группы после выписки было решено воздержаться.
Почему мы показываем этот случай:
- СДКА — редкое жизнеугрожающее состояние, наиболее часто встречающееся у молодых женщин без факторов риска атеросклероза;
- Не существует надежных клинических признаков, позволяющих достоверно заподозрить СДКА на догоспитальном этапе; жалобы СДКА неспецифичны;
- Лечение СДКА не отражено в клинических рекомендациях, требует индивидуального подхода в терапии и при выборе хирургической тактики.
Заявление о получении информированного добровольного согласия у пациента. Пациентка госпитализирована в НИИ. Согласие на использование информации в научных целях получено одновременно с согласием на обследование и лечение.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Кузнецов А.А., Намитоков А.М., Сажнева А.В., Некрасов А.С., Космачёва Е.Д. Клинический случай спонтанной диссекции левой коронарной артерии в послеродовом периоде. Российский кардиологический журнал. 2022;27(3S):5059. https://doi.org/10.15829/1560-4071-2022-5059
Скопировать