Влияние синдрома старческой астении на сердечно-сосудистую смерть в течение 12 месяцев у пациентов старше 70 лет с инфарктом миокарда
Аннотация
Цель. Изучение влияния синдрома старческой астении (ССА) на риск сердечно-сосудистой смерти (ССС) в течение 12 мес. у пациентов старше 70 лет с инфарктом миокарда (ИМ).
Материал и методы. Было проведено проспективное исследование 92 пациентов с ИМ старше 70 лет, давших согласие на участие. Для выявления ССА применяли опросник «Возраст не помеха». Оценивали данные анамнеза, лабораторные и инструментальные показатели. Период наблюдения составил 12 мес. За конечную точку выбрано наступление неблагоприятного события — ССС. Применялись статистические непараметрические методы, ROC-анализ, анализ выживаемости по Каплану-Мейеру (p<0,05). Результаты. Спустя 12 мес. конечной точки достигло 19 пациентов (20,65%). Медиана (25%; 75% квартили) количества баллов по анкете "Возраст не помеха" была достоверно выше в группе умерших пациентов, чем в группе пациентов без неблагоприятных исходов — 4 (3; 5) и 2 (1; 4) баллов (p<0,001). Отношение рисков наступления ССС в течение 12 мес. при наборе >3 баллов по анкете «Возраст не помеха» составило 1,72; 95% доверительный интервал: 1,28-2,30 (p=0,001). При проведении ROC-анализа прогнозирования неблагоприятного исхода при наборе >3 баллов по анкете «Возраст не помеха» площадь под кривой (AUC) — 0,78 (p<0,001), чувствительность — 89%, специфичность — 60%. Заключение. Риск развития ССС в течение 12 мес. после ИМ у пациентов старше 70 лет при наличии ССА увеличивается на 72%. Включение в прогностические модели результатов опросника "Возраст не помеха" и оценка ССА у данной когорты пациентов позволит улучшить стратификацию риска.
В последние десятилетия демографические изменения в мире характеризуются увеличением численности лиц пожилого и старческого возраста. При этом одной из актуальных проблем, связанных со старением человека, является развитие синдрома старческой астении (ССА) [1]. ССА — гериатрический синдром, особенностью которого является формирование возраст-ассоциированного снижения физиологического резерва и функций многих систем организма, приводящее к повышенной уязвимости организма пожилого человека воздействиям эндо- и экзогенных факторов и высокому риску развития неблагоприятных исходов для здоровья, потери автономности и смерти. По этиологии развития ССА существует два подхода. Согласно первому, по Fried LP, et al., старческая астения рассматривается как генетически обусловленный фенотип, согласно второму, по Rockwood K, et al., как совокупность накопленного дефицита функций на фоне полиморбидной патологии [2][3].
Диагностика ССА проводится при проведении комплексной гериатрической оценки, однако наличие острого заболевания, в т.ч. острого инфаркта миокарда (ИМ), является противопоказанием для комплексной гериатрической оценки [4-6]. В этом случае применяют скрининговые анкеты на выявление ССА. Наиболее часто используются следующие инструменты для диагностики ССА: шкала критериев Fried, основанная на Cardiovascular Health Study, Индекс хрупкости, основанный на Канадском исследовании здоровья и старения населения (Canadian Study of Health and Aging), Клиническая шкала хрупкости Роквуда (Clinical Frailty Scale (CFS)), шкала старческой астении Эдмонтона (Edmonton Frail Scale (EFS)) и пятикомпонентная шкала FRAIL [7-10]. Самым актуальным в нашей стране скрининговым опросником является анкета «Возраст не помеха» — отечественный аналог шкалы FRAIL [6]. При наборе 0-2 баллов по шкале «Возраст не помеха» у пациента определяют отсутствие ССА, 3-4 баллов — диагностируется преастения, ?5 баллов — ССА [4][5]. Распространенность ССА среди лиц старше 65 лет составляет ~10,7%, увеличиваясь до 52% среди лиц старше 85 лет [11].
Наличие ССА является неблагоприятным фактором, увеличивающим риск неблагополучных исходов. Исследования последних лет свидетельствуют о самостоятельном прогностическом значении ССА у пациентов пожилого и старческого возраста с ИМ [12][13]. Так, в исследовании пациентов старше 70 лет с острым коронарным синдромом с подъемом сегмента ST, которым было проведено первичное чрескожное коронарное вмешательство (ЧКВ) в университете Лейдена, был оценен прогноз пациентов в зависимости от наличия ССА (30-дневная смертность, крупное кровотечение, почечная недостаточность de novo (контрастиндуцированная), клиническая смерть в течение 30 дней, острое нарушение мозгового кровообращения (ОНМК)). Хрупких пациентов определяли с использованием теста из 12 вопросов Safety Management Programme (SMP) при наборе >1 балла. Частота наступление конечных точек достоверно оказалась выше в группе пациентов с SMP ?1 балла [14].
Следует отметить, что гериатрический статус пациентов пожилого и старческого возраста с ИМ чаще всего не оценивается, что затрудняет стратификацию риска этой группы пациентов. При этом у лиц пожилого и старческого возраста риск развития неблагоприятных исходов чаще связан не с возрастом, а с наличием старческой астении. Таким образом, на практике «хрупкость» представляет собой не только гериатрический синдром, который необходимо диагностировать и лечить сам по себе, но и потенциальный компонент моделей риска. Определение вероятности наличия и выраженности ССА может стать самостоятельным маркером высокого риска неблагополучных исходов у пациентов пожилого и старческого возраста [15].
Целью исследования является изучение влияния ССА на риск сердечно-сосудистой смерти (ССС) в течение 12 мес. у пациентов старше 70 лет с ИМ.
Материал и методы
Проведено проспективное исследование, включившее 92 пациентов с ИМ с подъемом и без подъема сегмента ST старше 70 лет, проходивших лечение в кардиологических отделениях Клиник СамГМУ с 2020 по 2021гг и давших информированное согласие на участие. Проведение исследования одобрено на заседании Этического комитета ФГБОУ ВО «Самарский государственный медицинский университет» Минздрава России от 30.09.2020г. Критерии исключения: наличие эндокринной патологии (кроме сахарного диабета (СД) 2 типа); онкологических заболеваний с ожидаемой продолжительностью жизни <1 года; анамнестических данных о наследственной патологии системы гемостаза, выраженные когнитивные нарушения по шкале Mini-Mental State Examination (Краткая шкала оценки психического статуса), выраженная печеночная недостаточность (наличие цирроза печени, повышение активности аланинаминотрансферазы и аспартатаминотрансферазы более чем в 5 раз), выраженная почечная недостаточность (скорость клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м2 по формуле CKD-EPI), наличие острого повреждения почек и острого заболевания почек в текущую госпитализацию. Оценивали данные клиники и анамнеза, результаты общеклинических лабораторных исследований, структурно-функциональные параметры сердца (трансторакальная эхокардиография (ЭхоКГ) на аппаратах Philips Affiniti 50 (Нидерланды)). Обследование и лечение пациентов осуществлялось в соответствии с клиническими рекомендациями по ведению больных с острым ИМ с подъемом сегмента ST и без подъема сегмента ST электрокардиограммы (ЭКГ) [16][17]. Пациенты, включенные в исследование, были с острым заболеванием, поэтому мы для выявления ССА на этом этапе применяли скрининговый опросник «Возраст не помеха» [4][5], что позволило нам сделать предварительный вывод о возможном наличии ССА. Также определяли индекс коморбидности Чарлсона (Index Charlson). На основании результатов опросника «Возраст не помеха» пациенты были разделены на 2 группы: I группа (n=46) — с количеством баллов ?3 («хрупкие» и «прехрупкие» пациенты), II группа (n=46) — 0-2 баллов (пациенты без ССА). При поступлении проводилась оценка риска развития неблагоприятных исходов во время госпитализации у пациентов с острым коронарным синдромом без подъема сегмента ST на ЭКГ по шкале GRACE, а у пациентов с подъемом сегмента ST на ЭКГ — по шкале TIMI. Выполнялась оценка риска развития кровотечений во время госпитализации у пациентов с острым коронарным синдромом по шкале CRUSADE и риска развития кровотечений у пациентов после ЧКВ при использовании двойной антитромбоцитарной терапии (шкала PRECISE-DAPT). Выявление и определение тяжести гериатрических синдромов, в т.ч. ССА, проводилось врачом-кардиологом с использованием специализированных шкал на 5 сутки госпитализации после стабилизации состояния. Оценка двигательной активности осуществлялась с использованием теста «Встань и иди» с фиксацией времени и функциональной активности — по шкале оценки базовой функциональной активности Бартел (Barthel Activities of daily living Index), нутритивного статуса — по шкале Mini Nutritional Assessment (Краткая шкала оценки питания), морального статуса — Philadelphia geriatric morale scale (Филадельфийская гериатрическая шкала оценки морального статуса), умственного состояния — Mini-Mental State Examination (Краткая шкала оценки психического статуса). При проведении теста «Встань и иди» пациенту предлагалось сесть на устойчивый стул, облокотившись на спинку. Пациент должен был встать со стула, пройти 3 метра, развернуться, дойти обратно до стула и сеть на него, облокотившись на спинку. Фиксировалось время, потраченное пациентом на выполнение теста [3][4]. По истечении 12 мес. после госпитализации методом телефонного обзвона родственников пациентов определяли достижение конечной точки. За конечную точку выбрана ССС (фатальный повторный ИМ, ОНМК, декомпенсация хронической сердечной недостаточности (ХСН)). Далее пациенты были разделены на 2 группы: группа А — пациенты без неблагоприятного исхода и группа В — пациенты с неблагоприятным исходом. Применялись статистические непараметрические методы, ROC-анализ, анализ выживаемости по Каплану-Мейеру. Количественные признаки представлены в виде медианы (25%; 75% квартиль), различия между группами оценивались по U-критерию Манна-Уитни. Качественные признаки представлены в виде абсолютного количества и процента от целого. Сравнение качественных признаков проводилось согласно критерию ?2 Пирсона. За уровень статистической достоверности принято p<0,05. Для статистического анализа использовали программу Statistica 8.0.
Результаты
Средний возраст пациентов в исследуемой когорте составил 77,3±2,4 года. Мужчин было 47,8% (n=44). Пациенты были разделены на 2 группы по количеству набранных баллов по анкете «Возраст не помеха». I группу составили пациенты с возможной ССА и преастенией (?3 балла), n=46 (50%); II группу составили «нехрупкие» пациенты (0-2 балла), n=46 (50%). Клинико-анамнестическая характеристика пациентов по группам представлена в таблице 1. Пациенты I группы с возможной ССА и преастенией были достоверно старше, имели более низкую СКФ при поступлении, в анамнезе чаще застойную ХСН. Пациенты же из II группы достоверно чаще имели ИМ с подъемом сегмента ST ЭКГ. Достоверные различия были получены по содержанию эритроцитов, гемоглобина, калия и натрия. Пациенты с ССА и преастенией имели более низкий уровень гемоглобина и эритроцитов по сравнению с II группой. Так, медианы (25%; 75% квартили) уровня эритроцитов составили по группам 4,21 (3,84; 4,68) ?1012/л и 4,58 (4,24; 4,84) ?1012/л, соответственно, p=0,004, а гемоглобина — 125,00 (109,75; 138,25) г/л и 137,00 (129,50; 147,00) г/л, p=0,001. При этом у четверти пациентов из I группы имела место анемия легкой степени. По уровню вч-тропонина Т, компонентов липидного профиля, креатинина и других лабораторных параметров достоверных различий между группами получено не было. Медианы (25%; 75% квартили) при поступлении СКФ по CKD-EPI по группам составили 61,00 (42,50; 70,25) мл/мин/1,73 м2 и 65,00 (52,00; 78,25) мл/мин/1,73 м2, соответственно (p=0,102).
У пациентов из I группы был выявлен достоверно более высокий риск госпитальных неблагоприятных сердечно-сосудистых событий как у пациентов с подъемом сегмента ST, так и у пациентов без подъема сегмента ST на ЭКГ. Риск развития кровотечений как в течение госпитализации, так и во время приема двойной дезагрегантной терапии также оказался достоверно выше в группе пациентов с ССА и преастении по сравнению с «нехрупкими» пациентами. Распределение количества баллов по шкалам оценки риска неблагоприятных исходов и кровотечений в зависимости от наличия ССА представлено в таблице 2.
Включенные в исследование лица получали стандартную медикаментозную терапию в соответствии с действующими клиническими рекомендациями, в т.ч. двойную дезагрегантную терапию. Однако в I группе пациентов предпочтение в 70% случаев отдавалось клопидогрелу, также у них достоверно чаще назначались петлевые диуретики.
Всем пациентам была проведена оценка структурно-функционального состояния миокарда по данным трансторакальной ЭхоКГ в течение 24 ч с момента поступления в стационар. Сравнительный анализ данных ЭхоКГ приведен в таблице 3. Достоверные различия по группам были достигнуты по величине конечно-диастолического объема левого желудочка (ЛЖ) (p=0,028) и фракции выброса (ФВ) ЛЖ (p=0,021). Так, у представителей II группы чаще выявлялась сохраненная и умеренно сниженная ФВ (медиана ФВ составила 52%), а во I группе пациентов — умеренно сниженная и сниженная ФВ (медиана — 45,5%).
В первой группе по сравнению со второй достоверно выше оказались индекс объема левого предсердия (медианы составили, соответственно, 45,5 мл/м2 и 35,0 мл/м2, p=0,013) и уровень давления в легочной артерии (медиана 38,4 и 38,2 мм рт.ст., соответственно, p=0,023).
По тяжести диастолической дисфункции, величине индекса массы миокарда ЛЖ, относительной толщине миокарда ЛЖ, а также диаметру нижней полой вены значимых различий получено не было. Пациенты в I группе имели достоверно более высокую степень митральной регургитации (p=0,032).
В течение первых 24 ч с момента госпитализации все пациенты были направлены в рентгеноперационную для проведения коронарной ангиографии с возможным ЧКВ (ангиограф General Electric Innova 3100IQ). При этом достоверных различий между группами пациентов по количеству пораженных сосудов не было получено. Однако частота выполнения ЧКВ была достоверно выше в I группе — 72% vs 38% во II группе, p=0,003. Наиболее частыми причинами отказа от ЧКВ в обеих группах явились наличие трехсосудистого диффузного поражения, а также техническая невозможность выполнения ЧКВ. При оценке осложнений ЧКВ у пациентов по группам достоверных различий выявлено не было.
Сравнительный анализ гериатрических синдромов представлен в таблице 4. В I группе по сравнению с II группой наблюдалось достоверное различие по тяжести всех гериатрических синдромов и уровню индекса коморбидности. У пациентов I группы наблюдалось снижение двигательной активности умеренной степени. В обеих группах была выявлена деменция легкой степени, однако в большей степени она была выражена у «хрупких» и «прехрупких» пациентов (p=0,001). Также эти пациенты были достоверно более зависимы от постороннего ухода (умеренная степень зависимости по индексу Бартел). Пациенты в I группе имели удовлетворительное моральное состояние с риском развития депрессии, во II группе — хорошее моральное состояние без риска развития депрессии, различия по моральному статусу между группами достоверны. По нутритивному статусу обе группы пациентов оказались в зоне риска недостаточности питания, при этом достоверно более выражены нарушения в I группе.
Спустя 12 мес. методом телефонного созвона с родственниками пациентов установлено, что конечной точки достигли 19 пациентов. В зависимости от наличия неблагоприятного исхода далее были выделены группы: группу А составили 73 пациента (79,35%) без неблагоприятного исхода, группу Б — 19 пациентов с неблагоприятным исходом (20,65%). Среди лиц с неблагоприятным исходом 18 пациентов были из I группы.
При сравнении клинико-лабораторных параметров в зависимости от исхода (табл. 5, 6) были получены следующие достоверные различия. Так, пациенты из группы неблагоприятного исхода были старше, чаще имели перенесенный ИМ, СД и фибрилляцию предсердий (ФП) в анамнезе. В этой группе реже выявлялся подъем сегмента ST, выше частота регистрации блокады левой ножки пучка Гиса на ЭКГ при поступлении, а также выше класс острой сердечной недостаточности. По лабораторным показателям достоверные различия достигнуты по уровню гемоглобина, эритроцитов и СКФ. Также в группе лиц с неблагоприятным исходом выявлены более высокие индекс коморбидности Чарлсона и выраженность гериатрических синдромов.
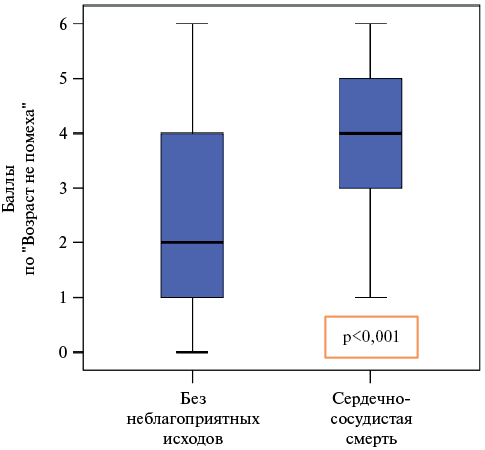
Распределение баллов по анкете «Возраст не помеха» в зависимости от исходов отражено в рисунке 1. Так, медианы (25%; 75% квартили) по группам составили, соответственно, 2 (1-4) и 4 (3; 5) при p<0,001.
По данным ROC-анализа для прогнозирования ССС в течение 12 мес. после ИМ у пациентов старше 70 лет найден прогностический неблагоприятный результат опроса по анкете «Возраст не помеха», равный 3 баллам. Площадь под кривой (AUC) составила 0,78, при чувствительности 89% и специфичности 60% (p=0,001). Отношение рисков (95% доверительный интервал) при наборе ?3 баллов по анкете «Возраст не помеха» для наступления неблагоприятного исхода для исследуемой категории пациентов составило 1,72 (1,28-2,30) при p=0,001. При построении кривых выживаемости Каплана-Мейера для пациентов в общей когорте прогноз ССС в течение 12 мес. был выше у пациентов, набравших ?3 балла по анкете «Возраст не помеха» (p=0,001) (рис. 2). На рисунке 3, где представлены кривые выживаемости, видно, что данная популяция пациентов сокращается на 40% к концу 1 года после перенесенного ИМ.
Таблица 1
Клинико-анамнестическая характеристика пациентов по группам в зависимости от количества баллов по анкете «Возраст не помеха»
|
Параметр |
I группа, N=46 (50%) |
II группа, N =46 (50%) |
?2 |
p |
|
Возраст, лет, Ме (Q25; Q75) |
81,50 (77,00; 84,25) |
72,00 (70,00; 77,25) |
<0,001 |
|
|
ИМТ, кг/м2, Ме (Q25; Q75) |
28,54 (24,38; 30,23) |
28,35 (25,23; 30,25) |
0,781 |
|
|
В анамнезе |
||||
|
Перенесенный инфаркт миокарда, n (%) |
22 (48) |
13 (28) |
2,95 |
0,086 |
|
ОНМК, n (%) |
10 (22) |
3 (7) |
3,22 |
0,073 |
|
Фибрилляция предсердий, n (%) |
17 (37) |
8 (17) |
3,52 |
0,061 |
|
Артериальная гипертензия, n (%) |
46 (100) |
45 (98) |
0,001 |
1,000 |
|
ХСН IIA и тяжелее, n (%) |
45 (98) |
33 (72) |
10,19 |
0,001 |
|
Сахарный диабет, 2 тип — инсулинопотребный, n (%) |
15 (33) 4 (9) |
11 (24) 2 (4) |
1,88 |
0,390 |
|
Атеросклероз периферических артерий, n (%) |
5 (11) |
6 (13) |
0,001 |
1,000 |
|
ЧКВ, n (%) |
3 (7) |
3 (7) |
0,001 |
1,000 |
|
ЧКВ (имплантация стента) в текущую госпитализацию |
16 (38) |
33 (72) |
8,75 |
0,003 |
|
АКШ, n (%) |
0 |
0 |
– |
– |
|
Хроническая болезнь почек, n (%): С1 С2 С3а С3б |
0 23 (50) 12 (26) 11 (24) |
2 (4) 25 (54) 16 (36) 3 (6) |
10,03 |
0,040 |
|
При поступлении |
||||
|
Класс ОСН по Killip, n (%): Killip I Killip II Killip III Killip IV |
29 (63) 5 (11) 7 (15) 5 (11) |
37 (81) 5 (11) 2 (4) 2 (4) |
5,03 |
0,169 |
|
Подъем ST на ЭКГ, n (%) |
9 (20) |
21 (46) |
5,98 |
0,014 |
Сокращения: АКШ — аортокоронарное шунтирование, ИМТ — индекс массы тела, ОНМК — острое нарушение мозгового кровообращения, ОСН — острая сердечная недостаточность, ХСН — хроническая сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство, ЭКГ — электрокардиограмма.
Таблица 2
Распределение баллов по шкалам оценки риска неблагоприятного события, в т.ч. кровотечения по группам пациентов в зависимости от количества баллов по анкете «Возраст не помеха»
|
Шкалы |
I группа (n=46), Ме (Q1; Q3) |
II группа (n=46), Ме (Q1; Q3) |
p |
|
Шкала CRUSADE, баллы |
43,00 (35,75; 54,50) |
35,50 (25,75; 46,75) |
0,012 |
|
Шкала GRACE, баллы |
174,00 (154,75; 195,75) |
153,00 (142,75; 166,25) |
<0,001 |
|
Шкала PRECISE-DAPT, баллы |
26,00 (19,75; 33,75) |
19,00 (15,00; 24,00) |
0,002 |
|
Шкала TIMI, баллы |
6,00 (4,00; 8,00) |
4,00 (3,00; 5,00) |
0,001 |
Таблица 3
Сравнительный анализ данных ЭхоКГ у пациентов по группам в зависимости от количества баллов по анкете «Возраст не помеха»
|
Параметр |
I группа (n=46), Ме (Q1; Q3) |
II группа (n=46), Ме (Q1; Q3) |
p |
|
ФВ по Симпсону, % |
45,50 (38,00; 54,25) |
52,00 (48,00; 56,25) |
0,021 |
|
КСО ЛЖ, мл |
50,50 (39,75; 75,25) |
55,00 (45,00; 73,25) |
0,529 |
|
КДО ЛЖ, мл |
105,50 (81,25; 126,25) |
119,50 (99,25; 139,50) |
0,028 |
|
КДО/м2 ЛЖ, мл/м2 |
61,00 (47,50; 70,50) |
61,00 (53,00; 73,00) |
0,385 |
|
ОТСЛЖ, доли от целого |
0,44 (0,37; 0,51) |
0,43 (0,39; 0,47) |
0,264 |
|
ИОЛП, мл/м2 |
40,50 (34,00; 47,00) |
35,00 (27,75; 41,25) |
0,013 |
|
ИНЛС |
1,60 (1,38; 1,93) |
1,40 (1,20; 1,60) |
0,036 |
|
ДНПВ, мм |
19,00 (18,00; 20,25) |
19,00 (18,00; 20,25) |
0,625 |
|
СДЛА, мм рт.ст. |
38,40 (33,93; 47,85) |
34,20 (28,75; 41,50) |
0,023 |
|
Е/А |
0,70 (0,60; 0,78) |
0,70 (0,60; 0,90) |
0,734 |
|
Е/е’ |
7,35 (6,00; 12,00) |
9,00 (6,50; 11,00) |
0,864 |
|
ИММЛЖ, г/м2 |
109,00 (85,00; 137,25) |
106,50 (91,25; 121,00) |
0,663 |
|
Недостаточность митрального клапана |
|||
|
Степень |
I группа, N (%) |
II группа, N (%) |
?2 (p=0,032) |
|
Нет |
3 (7) |
11 (24) |
8,84 |
|
1 степень |
31 (67) |
31 (67) |
|
|
2 степень |
11 (24) |
4 (9) |
|
|
3 степень |
1 (2) |
0 (0) |
|
Сокращения: ДНПВ — диаметр нижней полой вены, ИММЛЖ — индекс массы миокарда левого желудочка, ИНЛС — индекс нарушения локальной сократимости, ИОЛП — индекс объема левого предсердия, КДО — конечный диастолический объем, КДО/м2 — конечный диастолический объем, стандартизированный к площади поверхности тела, КСО — конечный систолический объем, ЛЖ — левый желудочек, ОТСЛЖ — относительная толщина стенки левого желудочка, СДЛА — систолическое давление в легочной артерии, ФВ — фракция выброса, Е/А — отношение раннего пика к позднему пику скорости трансмитрального кровотока, E/e’ — отношение позднего пика скорости трансмирального кровотока к ранней диастолической скорости движения митрального кольца.
Таблица 4
Сравнительный анализ данных результатов оценки отдельных гериатрических синдромов по группам пациентов в зависимости от количества баллов по анкете «Возраст не помеха»
|
Параметр |
I группа (n=46), Ме (Q1; Q3) |
II группа (n=46), Ме (Q1; Q3) |
p |
|
Анкета «Возраст не помеха», баллы |
4,00 (3,00; 5,00) |
1,00 (0,00; 2,00) |
<0,001 |
|
Индекс коморбидности Чарлсона, баллы |
6,50 (5,00; 7,00) |
5,00 (4,00; 6,00) |
<0,001 |
|
Время, затраченное на тест «Встань и иди», сек |
15,00 (13,75; 18,00) |
9,50 (9,00; 10,25) |
<0,001 |
|
Mini Nutritional Assessment, баллы |
19,00 (18,00; 20,78) |
21,00 (20,00; 22,50) |
<0,001 |
|
Philadelphia Geriatric Morale Scale, баллы |
52,50 (43,75; 60,00) |
44,00 (36,00; 55,25) |
0,029 |
|
Mini-Mental State Examination, баллы |
20,00 (18,00; 23,00) |
22,00 (20,75; 24,00) |
0,001 |
|
Barthel Activities of Daily Living Index, баллы |
80,00 (70,00; 90,00) |
95,00 (95,00; 95,00) |
<0,001 |
Таблица 5
Различия пациентов в зависимости от исхода по клинико-лабораторным параметрам
|
Параметр |
Группа А (без неблагоприятного исхода), Me (Q1; Q3), n=73 |
Группа В (СCС), |
р |
|
Возраст, лет |
76,00 (71,00; 81,50) |
82,00 (74,00; 85,00) |
0,010 |
|
Длительность госпитализации, дни |
10,00 (8,00; 11,50) |
11,50 (8,75; 13,75) |
0,170 |
|
Анкета «Возраст не помеха», баллы |
2,00 (1,00; 4,00) |
4,00 (3,00; 5,00) |
<0,001 |
|
Индекс коморбидности Чарлсона, баллы |
5,00 (5,00; 6,00) |
7,00 (7,00; 8,00) |
<0,001 |
|
Время, затраченное на тест «Встань и иди», сек |
11,00 (9,00; 15,00) |
14,00 (12,00; 18,00) |
0,008 |
|
Нутритивный статус, баллы |
20,70 (19,00; 22,00) |
19,00 (18,00; 20,00) |
0,024 |
|
Функциональная активность Бартел, баллы |
95,00 (85,00; 95,00) |
80,00 (65,00; 95,00) |
0,002 |
|
Эритроциты, ?1012/л |
4,56 (4,18; 4,83) |
3,95 (3,52; 4,26) |
<0,001 |
|
Гемоглобин, г/л |
136,00 (125,50; 146,00) |
120,00 (108,00; 129,00) |
0,001 |
|
Глюкоза, ммоль/л |
6,15 (5,13; 7,90) |
8,96 (6,32; 12,91) |
0,002 |
|
Мочевина, ммоль/л |
6,30 (4,98; 8,13) |
9,90 (8,10; 14,40) |
0,001 |
|
Креатинин, мкмоль/л |
83,00 (71,00; 101,60) |
115,30 (74,60; 135,20) |
0,006 |
|
СКФ по CKD-EPI, мл/мин/1,73 м2 |
65,00 (52,00; 78,50) |
45,00 (39,00; 62,00) |
0,001 |
Сокращения: СКФ — скорость клубочковой фильтрации, ССС — сердечно-сосудистая смерть.
Таблица 6
Различия пациентов в зависимости от исхода по клинико-лабораторным параметрам (продолжение)
|
Параметр |
Группа А (без неблагоприятного исхода), n=73 (79,35%) |
Группа В (ССС), |
p |
|
Перенесенный ИМ в анамнезе |
21 (29) |
14 (74) |
0,001 |
|
Сахарный диабет |
16 (22) |
10 (53) |
0,014 |
|
Класс острой левожелудочковой недостаточности при поступлении: |
0,015 |
||
|
Killip I |
57 (78) |
9 (47) |
|
|
Killip II |
5 (7) |
5 (26) |
|
|
Killip III |
5 (7) |
4 (21) |
|
|
Killip IV |
6 (8) |
1 (5) |
|
|
Подъем ST |
28 (32) |
2 (11) |
0,042 |
|
БЛНПГ |
4 (6) |
8 (42) |
0,001 |
|
Фибрилляция/трепетание предсердий |
13 (18) |
10 (53) |
0,005 |
|
ЧКВ в текущую госпитализацию |
44 (62) |
5 (29) |
0,031 |
Сокращения: БЛНПГ — блокада левой ножки пучка Гиса, ИМ — инфаркт миокарда, ССС — сердечно-сосудистая смерть, ЧКВ — чрескожное коронарное вмешательство.

Рис. 1. Распределение баллов по анкете «Возраст не помеха» в зависимости от исхода пациентов.

Рис. 2. ROC-кривая прогнозирования ССС в течение 12 мес. после ИМ у пациентов старше 70 лет при наборе ?3 баллов по анкете «Возраст не помеха».

Рис. 3. Анализ выживаемости пациентов в зависимости от количества баллов по шкале «Возраст не помеха».
Обсуждение
Полученные нами данные по распространенности вероятной ССА среди исследуемой популяции не противоречат данным литературы — 17,4%. У этой категории лиц нами выявлен достоверно более высокий уровень коморбидности и риска неблагоприятных исходов, а также кровотечений, что согласуется с данными других исследователей [11]. Пациенты с неблагоприятным исходом достоверно чаще имели в анамнезе перенесенный ИМ (p=0,001) и СД (p=0,014), при поступлении на ЭКГ регистрировался чаще подъем ST (p=0,042) или блокады левой ножки пучка Гиса (p=0,001), ФП или трепетание предсердий (p=0,005). В группе неблагоприятного исхода по сравнению с выжившими пациентами медиана (25%; 75% квартили) ФВ по Симпсону составила 37,00% (34,00; 44,00) и 52,00% (47,00; 56,00), индекса объема левого предсердия — 42,00 (35,00; 53,00) мл/м2 и 36,00 (30,00; 42,50) мл/м2; систолического давления в легочной артерии — 45,70 (38,60; 63,30) мм рт.ст. и 35,00 (31,50; 40,50) мм рт.ст., соответственно (p<0,05).
Также необходимо отметить, что в нашем исследовании в группе пациентов с вероятной старческой астенией и преастенией предпочтение чаще отдавалось консервативной тактике ведения пациентов. Согласно данным литературы, такие пациенты действительно реже подвергаются ЧКВ. В том числе это связано с неблагоприятным коморбидным фоном у этой категории пациентов. С высокой частотой в анамнезе пожилых пациентов встречается перенесенный ИМ, ОНМК, ФП и атеросклероз периферических артерий, что согласуется с данными нашего исследования [18][19]. По данным некоторых исследователей у лиц пожилого возраста значительно ниже вероятность успешного использования инвазивных диагностических и терапевтических вмешательств, в связи с этим сохраняется высокий риск неблагоприятных исходов и осложнений [20]. Однако на сегодняшний день во многих исследованиях было показано преимущество инвазивной стратегии для улучшения прогноза пациентов пожилого и старческого возраста с ИМ [21]. По данным нашего исследования по длительности госпитализации достоверных различий у пациентов в зависимости от исхода получено не было, что говорит о нецелесообразности необоснованного продления госпитализации.
Нами выявлено, что пациенты старше 70 лет с возможной ССА и преастенией имеют худший прогноз наступления ССС в течение 12 мес. после ИМ. Выживаемость в течение года после ИМ у пациентов старше 70 лет по нашим данным составила ~60%, что также не противоречит данным литературы [22]. При наборе ?3 баллов по скрининговому опроснику «Возраст не помеха» риск ССС в течение года после ИМ у пациентов по нашим данным оказался выше в среднем на 72%. По данным литературы этот показатель находится на том же уровне, а риск общей летальности в течение 3 лет возрастает в 2,5-4 раза [23].
Необходимо отметить, что тяжелая коморбидная патология также усугубляет прогноз у пациентов пожилого и старческого возраста. Так, Rockwood К, et al. рассматривают ССА как совокупность накопленного дефицита функций на фоне полиморбидной патологии [3]. В нашем исследовании наличие вероятного ССА и преастении также ассоциировано с более тяжелым коморбидным фоном. Индекс коморбидности Чарлсона достоверно выше в I группе пациентов. Однако развитие ССА рассматривается как самостоятельный предиктор неблагоприятного исхода у пациентов с ИМ данной возрастной категории. Это дает возможность построения математических моделей прогнозирования риска неблагоприятного исхода у данной категории пациентов с учетом наличия ССА и/или количества баллов по скрининговому опроснику «Возраст не помеха». Работа в данном направлении представляется перспективной для улучшения стратификации риска у пациентов пожилого и старческого возраста с ИМ и будет продолжена авторами.
Таким образом, ССА является важным маркером неблагоприятных сердечно-сосудистых событий у пациентов с ИМ старше 70 лет. При ведении пациентов с ИМ пожилого и старческого возраста необходимо оценивать гериатрический статус и учитывать его при стратификации риска этой категории пациентов. Лечение и наблюдение за этими пациентами должно проводиться мультидисциплинарной командой врачей совместно с врачом-гериатром. Коррекция ССА будет способствовать улучшению исходов у этой категории пациентов. Ограничением данного исследования может служить небольшой объем выборки.
Заключение
По результатам анкетирования пациентов старше 70 лет с ИМ по опроснику «Возраст не помеха» доля пациентов, имевших 0-2 балла (без ССА), составила 50% (n=46), пациентов, у которых предполагалась преастения (3-4 балла) — 32,6% (n=30) и пациентов с возможным ССА (?5 баллов) — 17,4% (n=16). Пациенты с возможным ССА имели достоверно более высокий уровень коморбидности (хроническая болезнь почек, СД, анемия, застойная ХСН, ФП) и риск неблагоприятных исходов при высоком риске кровотечений. При наборе ?3 баллов по анкете «Возраст не помеха» риск ССС в течение 12 мес. у пациентов старше 70 лет с ИМ повышался на 72%.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Айдумова О.Ю., Щукин Ю.В., Пискунов М.В. Влияние синдрома старческой астении на сердечно-сосудистую смерть в течение 12 месяцев у пациентов старше 70 лет с инфарктом миокарда. Российский кардиологический журнал. 2023;28(2S):5391. https://doi.org/10.15829/1560-4071-2023-5391
Скопировать