Системная воспалительная реакция после транскатетерной замены аортального клапана. Клинический случай
Аннотация
Введение. Растущее число транскатетерных имплантаций аортального клапана (TAVI) за последние несколько лет сформировало уникальный набор событий и осложнений, которые требуют раннего выявления и персонифицированного ведения для улучшения прогноза, порой с привлечением мультидисциплинарной команды.
Краткое описание случая. Мы представляем случай 79-летней женщины с тяжелым аортальным стенозом, которая перенесла процедуру TAVI, осложнившуюся в послеоперационном периоде гектической лихорадкой без выявленного источника инфекции. После исключения всех возможных источников лихорадки был установлен диагноз постимплантационного синдрома, и назначенная терапия глюкокортикостероидами привела к выздоровлению пациентки.
Обсуждение. Системная воспалительная реакция может возникать после эндоваскулярной пластики аневризмы аорты у части пациентов. Эта воспалительная реакция называется постимплантационным синдромом и включает утомляемость или другие гриппоподобные симптомы, лихорадку и лабораторные признаки воспаления. Наш клинический случай описывает сложности в дифференциальной диагностике постимплантационного синдрома как возможного осложнения TAVI, а также демонстрирует важность междисциплинарного подхода к таким пациентам.
Наиболее распространенной формой порока сердца в западных странах является стеноз аортального клапана [1]. Его распространенность среди пациентов старше 65 лет составляет от 2% до 7% [2]. Этиологически наиболее распространенной причиной является кальцификация клапана [1]. Хирургическая замена аортального клапана в настоящее время является золотым стандартом лечения стеноза аортального клапана у пациентов с низким или промежуточным риском [3].
Транскатетерная имплантация аортального клапана (TAVI) — малоинвазивная хирургическая процедура, которая изначально разрабатывалась как альтернативный метод лечения пациентов с высоким уровнем периоперационного риска и с тех пор зарекомендовала себя в этой области [4]. TAVI включает имплантацию протеза клапана, введенного с помощью катетера через трансфеморальный, трансапикальный, трансаксиллярный/подключичный или прямой трансаортальный доступ [5]. Обычно предпочтение отдается трансфеморальному доступу, поскольку не требуются торакотомии. Доступ трансапикальный распространен, если тяжелое атеросклеротическое заболевание не позволяет ретроградно ввести катетер [6]. Первая операция TAVI была проведена Cribier, et al. в 2002г. И с этого момента наблюдается ежегодный прирост числа пациентов, прооперированных именно таким малоинвазивным методом. В 2013г в Германии количество TAVI (10441) впервые превысило число открытых хирургических процедур (9899) [7]. Поскольку количество хирургических вмешательств в течение этого времени оставалось практически постоянным, TAVI применяли для пациентов, для которых ранее был доступен только консервативный подход. На заре выполнения TAVI в качестве анестезии использовался общий наркоз [8]. В последние годы данный вид замены аортального клапана осуществляется под местной анестезией [7]. Для анестезиологов TAVI является сложной задачей по многим причинам. Во-первых, многие пациенты имеют серьезное сопутствующее заболевание и, следовательно, относятся к группе высокого риска [5]. Во-вторых, эти пациенты подвергаются заметным гемодинамическим колебаниям во время процедуры TAVI. Для снижения риска сердечно-легочной декомпенсации требуется высокоспецифичный и междисциплинарный подход к лечению.
Критерии Valve Academic Research Consortium 3 стандартизировали послеоперационные осложнения, такие как инфаркт миокарда, инсульт, кровотечение, острая почечная недостаточность, сосудистые осложнения и состояние клапана, а также риск смертности [9]. Неправильное положение, миграция/эмболизация клапана, переход к открытой операции, почечная недостаточность, необходимость имплантации кардиостимулятора, инсульт и инфаркт миокарда, блокирование устьев коронарных артерий, ограничение подвижности передней створки митрального клапана и нарушение атриовентрикулярной проводящей системы являются серьезными осложнениями после TAVI [10].
Системная воспалительная реакция может возникать после эндоваскулярной пластики аневризмы аорты у части пациентов. Эта воспалительная реакция называется постимплантационным синдромом (ПИС) и включает утомляемость или другие конституциональные (гриппоподобные) симптомы, лихорадку и лабораторные признаки воспаления [11]. Данное осложнение может встречаться у каждого пятого пациента после эндоваскулярной пластики аорты [12].
Этиология ПИС обусловлена ответом на эндоваскулярную реконструкцию в виде системной воспалительной реакции. Происходит высвобождение различных воспалительных маркеров, таких как фактор некроза опухоли альфа, интерлейкин-6, -8, -10, Д-димер, фибриноген и тромбоциты. Эта воспалительная реакция может быть вызвана эндотелиальной дисфункцией, что указывает на синергетическую связь между материалом трансплантата и эндоваскулярным хирургическим доступом [13]. Исход ПИС у пациентов с высоким риском (пожилые люди с сопутствующими заболеваниями) неизвестен, несмотря на хорошую переносимость пациентами. Усталость и лихорадка являются симптомами ПИС, которые коррелируют с повышением воспалительных биомаркеров [13]. Тип воспалительных маркеров и их пороговые значения все еще являются предметом споров.
В нашем клиническим случае мы опишем сложности в постановке диагноза и методы борьбы с ПИС, развившемся после эндоваскулярной замены клапана в аортальной позиции.
Клинический случай
Пациентка М. 79 лет поступила в кардиологическое отделение с жалобами на одышку при ходьбе до 10 м, приступы ночного удушья, давящие боли в межлопаточной области в покое длительностью до 10-15 мин, чувство тяжести в грудной клетке без связи с физической нагрузкой. Вышеописанные жалобы беспокоят в течение последних 6 мес. Из анамнеза выяснилось, что пациентка >10 лет страдает артериальной гипертензией и сахарным диабетом 2 типа, по поводу чего регулярно принимает гипотензивную и сахароснижающую терапию. При общем осмотре больного: нормотермия, пульс 98 уд./мин, артериальное давление на правой руке в положении лежа 140/90 мм рт.ст., на левой руке 130/80 мм рт.ст., частота дыхания 20 в минуту, при перкуссии сердца расширение границ сердца влево на 2 см, грубый систолический шум на аортальном клапане. Исследования мочеполовой, дыхательной и центральной нервной системы показали нормальные результаты. Рентгенограмма грудной клетки выявила кардиомегалию и венозный застой в легких (рис. 1).
По данным электрокардиограммы выявлен нормальный синусовый ритм без признаков ишемии миокарда, лабораторные исследования соответствовали референтным значениям.
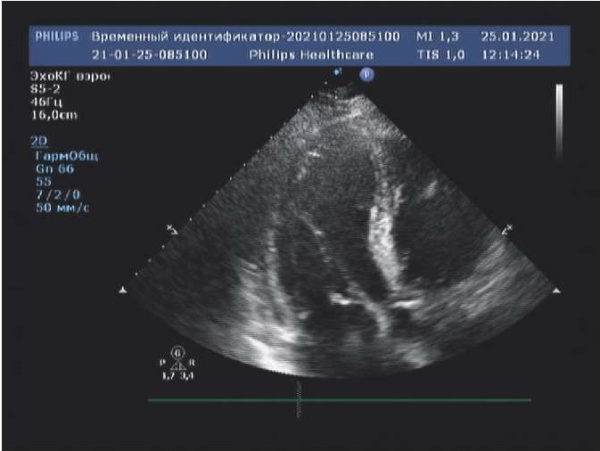
По данным эхокардиографии (ЭхоКГ) диагностирован тяжелый аортальный стеноз со средним градиентом давления 42 мм рт.ст., фиброзным кольцом аортального клапана 20 мм, выраженным кальцинозом створок клапана с переходом на фиброзное кольцо и распространенным кальцинозом восходящей аорты. Отмечено выраженное нарушение локальной и глобальной сократимости миокарда (фракция выброса 22%, акинез нижней и нижнебоковой стенок в базальных и средних сегментах, гипокинез межжелудочковой перегородки и верхушки левого желудочка) (рис. 2).
По данным коронароангиографии не выявлены гемодинамически значимые стенозы.
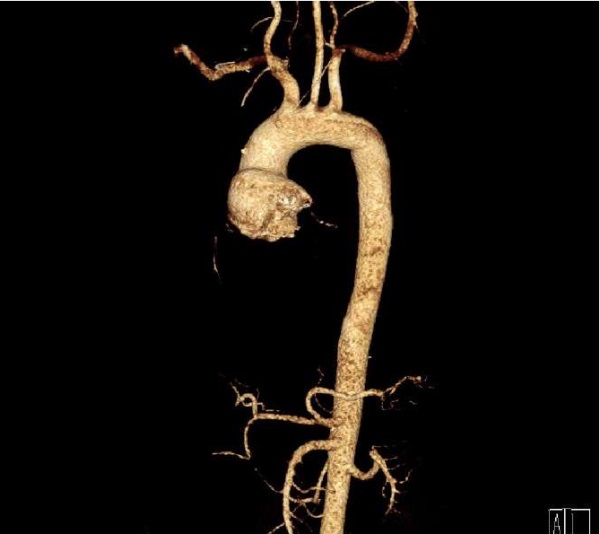
По данным мультиспиральной компьютерной томографии-аортографии отмечено наличие фиброзного кольца аортального клапана малого диаметра (20 мм) и низкое отхождение коронарных артерий от фиброзного кольца (правой — до 8 мм и левой — до 12 мм) (рис. 3).
Учитывая тяжесть аортального стеноза, ухудшение клинического течения заболевания пациентке было рекомендовано протезирование аортального клапана.
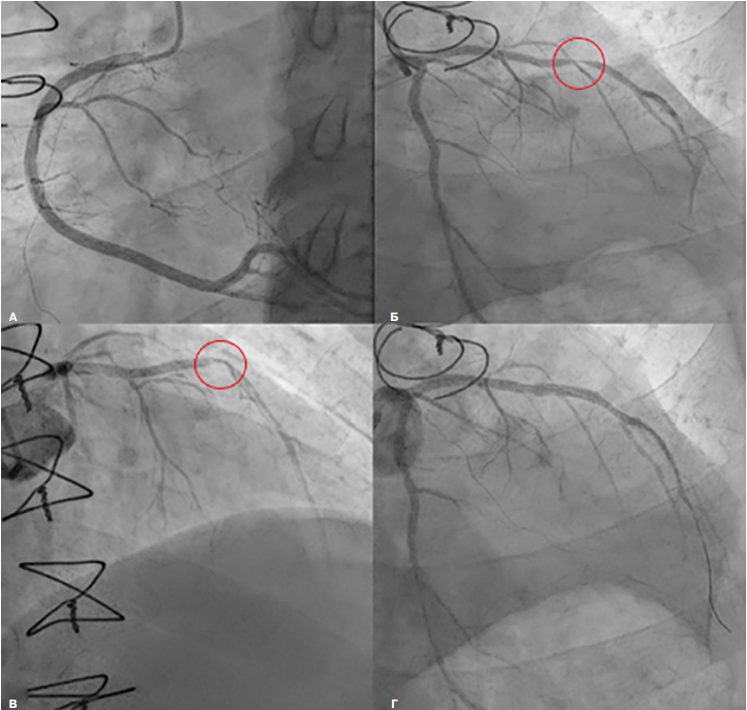
При расчете хирургического риска при помощи стратификационных шкал был определен высокий риск неблагоприятных исходов: EUROSCORE II — 10,27%, STS — 5,57%. Данные стратификационных шкал, а также выраженный кальциноз фиброзного кольца аортального клапана и восходящего отдела аорты исключили возможность открытого хирургического протезирования клапана, вследствие чего было решено выполнить транскатетерное протезирование. Была выполнена трансфеморальная имплантация сердечного клапана «ACURATE Neo2» М (REF — SYM-SV25-004 SN — SMM447210) в аортальную позицию (рис. 4).
Течение раннего послеоперационного периода осложнилось острой сердечно-сосудистой недостаточностью, потребовавшей инотропной поддержки, а также прогрессирующей дыхательной недостаточностью с необходимостью подключения искусственной вентиляции легких. С целью исключения повторного острого инфаркта миокарда была выполнена экстренная коронароангиография, не выявившая патологии. Также отмечались явления кето- и лактатацидоза, корректируемые внутривенным введением инсулина, пароксизмом трепетания предсердий (с успешной фармакологической кардиоверсией амиодароном 900 мг в сутки внутривенно (в/в) капельно с последующим переходом на пероральный прием препарата по схеме).
С первых суток после операции отмечались ежедневные подъемы температуры тела с максимумом в течении суток до 39 С, на фоне чего у пациентки отмечалась выраженная слабость, невозможность самообслуживания.
С целью определения причин лихорадки проводился дифференциальный диагноз между: инфекционным эндокардитом, сепсисом, пневмонией, коронавирусной инфекцией, урологической инфекцией, инфекцией клапана сердца, перикардитом, синдромом Дресслера, васкулитом, обострением аутоиммунного заболевания, манифестацией лейкоза на фоне послеоперационного стресса. Для исключения инфекционного процесса (пневмония, пиелонефрит, панкреатит, холецистит и другие воспалительные заболевания органов брюшной полости и забрюшинного пространства) неоднократно выполнялась компьютерная томография органов грудной клетки, брюшной полости и малого таза, выполнялись посевы крови, мочи, удаленного центрального венозного катетера. Для исключения раннего вторичного протезного эндокардита, перикардита проводилась ЭхоКГ трансторакально и чреспищеводно, однако вегетаций на клапанах и/или значимой клапанной регургитации выявлено не было. Для исключения вирусной инфекции (в частности, коронавирусной инфекции, вируса гриппа А, В, H1N1, парагриппов) анализировался мазок из носоглотки методом полимеразной цепной реакции. Для исключения аутоиммунного заболевания проводился анализ крови на антинуклеарные антитела IgG и М, антитела класса IgG к двуспиральной (нативной) ДНК (исключение системной красной волчанки), антитела к ядерным антигенам (ANA) и антитела к митохондриям (исключение системной склеродермии, системной красной волчанки, синдрома Рейно, ревматоидного артрита, синдрома Шегрена, миастении, полимиозита), а также антинейтрофильные антитела (для исключения васкулитов). Клинические проявления наиболее распространенных васкулитов также были исключены (табл. 1).
С целью исключения острого лейкоза проводился подсчет лейкоцитарной формулы в окрашенном мазке крови под микроскопом. Бластные клетки и феномен «лейкемического зияния» (отсутствие промежуточных стадий между бластами и зрелыми клетками) обнаружены не были, соотношение форменных элементов в крови было в пределах нормального диапазона.
Однако все попытки поиска причины лихорадки не привели к положительному результату. При этом лабораторно отмечалась реакция системного воспалительного ответа с повышением лейкоцитов (максимально до 20,5 10Е9/л), нейтрофилов (максимально до 16,22 10Е9/л) и С-реактивного белка (СРБ) (максимально до 90 мг/л). Вместе с тем прокальцитониновый тест крови был отрицательный (0,02 нг/мл). Назначенная антибиотикотерапия (левофлоксацин 500 мг в/в 2 раза в день + цефтриаксон 2 г в/в 1 раз в день в течение 5 дней, затем смена на меропенем 1 г в/в 2 раза в день + колистин 1 млн ЕД ингаляционно 2 раза в день) и терапия нестероидными противовоспалительными препаратами (кетопрофен 100 мг 2 раза в день в комбинации с парацетамолом 10 мг внутривенно капельно 1 раз в сутки на высоте лихорадки) не приводили к положительным результатам. У пациентки продолжалась гектическая лихорадка с подъемами температуры в вечернее время до 39 С. На основании клинической картины и лабораторных данных был заподозрен ПИС. И на 14 день от момента оперативного вмешательства было принято решение об отмене антибактериальных препаратов и назначении пульс-терапии преднизолоном (250 мг в/в капельно в течение 3 сут. с последующим переходом на таблетированные формы из расчета 0,5 мг на кг массы тела). После первой инфузии глюкокортикоида эпизоды лихорадки купировались и больше не рецидивировали. Лабораторные показатели с положительной динамикой. Динамика таких маркеров воспаления, как нейтрофилы, лейкоциты и СРБ, в течение госпитализации представлена на рисунке 5.
На фоне лечения отмечалась положительная динамика клинических и лабораторных показателей и к концу второй недели наблюдения признаки системной воспалительной реакции были полностью купированы. Следовательно, клиническая картина и результаты лабораторных анализов противоречили инфекционной этиологии, и диагноз ПИС был подтвержден не только клиническим статусом, но и положительной динамикой воспалительных маркеров на фоне лечения стероидными препаратами, несмотря на отмену антибактериальных препаратов.

Рис. 1. Рентгенограмма пациентки при поступлении.

Рис. 2. ЭхоКГ пациентки при поступлении.
Сокращения: ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек.

Рис. 3. Компьютерная томография сердца и аорты пациентки.

Рис. 4. Окончательный вид имплантированного клапана в аортальную позицию.
Таблица 1
Дифференциальный диагноз васкулитов в сравнении с клиническими симптомами пациентки М.
|
Васкулит |
Признак |
Проявления у пациентки М. |
|
Синдром Черджа-Стромма |
гранулематозно-некротизирующий васкулит, протекающий с поражением сосудов мелкого и среднего размеров с вовлечением в воспаление респираторного тракта (по типу астмы) |
нет |
|
почечный синдром |
нет |
|
|
аллергический синусит, ринит |
нет |
|
|
полиневропатия |
нет |
|
|
эозинофилия в крови |
нет |
|
|
Микроскопический полиангиит |
артралгия и/или миалгия |
нет |
|
почечный синдром, который начинается с нарушения мочеиспускания и заканчивается терминальной почечной недостаточностью |
нет |
|
|
кашель с кровохарканьем или без него |
нет |
|
|
пальпируемая пурпура на коже (красные или фиолетовые пятна, которые можно ощутить при прощупывании) |
нет |
|
|
множественный мононеврит — одновременное поражение двух или более периферических нервов в разных частях тела, что проявляется болью, онемением, слабостью и потерей контроля над мышцами в зоне поражённых нервов |
нет |
|
|
судороги и другие неспецифические неврологические жалобы |
нет |
|
|
боль в животе |
нет |
|
|
желудочно-кишечное кровотечение |
нет |
|
|
синусит (насморк, заложенность носа) |
нет |
|
|
Гранулематоз Вегенера |
поражение верхних дыхательных путей (насморк с гнойно-кровянистым отделяемым, изъязвление полости носа, развитие синуситов) |
нет |
|
рецидивирующий серозный или гнойный средний отит |
нет |
|
|
поражение лёгких (двусторонний инфильтративный процесс) |
нет |
|
|
поражение почек (проявления гломерулонефрита) |
нет |
|
|
поражение глаз (кератит, склерит, эписклерит, увеит, язва роговицы, склеромаляция и т. д.) |
нет |
|
|
поражения кожи (специфические высыпания: узелки, папулы, пузырьки, язвы) |
нет |
|
|
поражения суставов (артралгии, артриты) |
нет |
|
|
поражение нервной системы (мононевриты, полинейропатии) |
нет |
|
|
поражение пищеварительного тракта (боли в животе, диарея, кровотечение) |
нет |
|
|
Криоглобулинемия |
геморрагическая сыпь (обычно располагается на голенях и бедрах (реже на ягодицах или животе), симметрично, не сопровождается зудом) |
нет |
|
артралгии (преимущественно вовлечены пястно-фаланговые, межфаланговые, коленные, голеностопные, тазобедренные суставы, боль в суставах и миалгии усиливаются при охлаждении) |
нет |
|
|
периферическая полинейропатия |
нет |
|
|
синдром Рейно |
нет |
|
|
гломерулонефрит |
нет |

Рис. 5. Динамика маркеров воспаления пациентки в течение госпитализации.
Обсуждение
Мониторинг пациентов после TAVI на наличие воспалительных маркеров и/или лихорадки важен, т. к. это может указывать на периоперационное осложнение. Однако, если не удается найти инфекционное происхождение, объясняющее наблюдаемую воспалительную реакцию, ПИС остается правдоподобным и вероятным объяснением. Тем не менее реальная частота ПИС не совсем ясна, и даже критерии диагностики этого синдрома не установлены [14]. В предыдущем исследовании ПИС определяли как лихорадку и повышение уровня СРБ [12]. Таким образом, периферическая вазодилатация, потеря объема из-за повышения проницаемости капилляров, дисфункция миокарда и основных органов также рассматривается в качестве патогенетических аспектов развития и течения ПИС [15]. В описанном клиническом сценарии триада факторов: возраст пациента, выраженная систолическая дисфункция левого желудочка и сахарный диабет, вероятно, послужили ключевыми триггерами, драматично повлиявшими на тяжесть послеоперационного периода и развитие ПИС.
Сообщаемая частота ПИС в литературе широко варьируется от 14% до 60% [16]. Эти колебания можно объяснять отсутствием общепринятого определения. Некоторые авторы описывали ПИС как наличие лихорадки, совпадающей с повышенным уровнем СРБ в сыворотке, в то время как другие рассматривали его как наличие лихорадки в сочетании с лейкоцитозом с различными пороговыми значениями последнего [17].
Причина воспалительной реакции после TAVI точно не установлена. Важно определить индексное событие, вызвавшее воспалительную реакцию. В случаях TAVI в качестве возможных причинных факторов предполагается количество контрастного вещества, материала эндотрансплантата и тип анестезии [18]. В предыдущих исследованиях было обнаружено, что использование полиэфирного эндотрансплантата при внутрисосудистом протезировании аорты независимо предсказывало ПИС и коррелировало с более чем в 10 раз более высоким риском воспалительной реакции.
Текущая литература предоставляет скудные доказательства и не имеет установленного алгоритма относительно типа и продолжительности лечения ПИС. Некоторые авторы рекомендовали агрессивное рутинное использование противовоспалительных препаратов, в то время как большинство других предпочитают более консервативный подход [19]. Akin I, et al. не наблюдали каких-либо клинических преимуществ продления лечения антибиотиками после эндоваскулярного вмешательства у пациентов с ПИС [20]. Недавно опубликованное проспективное рандомизированное исследование оценивало влияние предоперационных высоких доз глюкокортикоидов на ПИС и сообщало об ослаблении воспалительной реакции с более быстрым выздоровлением у пациентов с протезированием аорты, получавших противовоспалительные препараты [21]. Однако рутинное назначение таких препаратов, как стероиды или нестероидные противовоспалительные препараты, вызывает серьезную озабоченность из-за их побочных эффектов, особенно у пациентов с рядом сопутствующих заболеваний, включая почечную недостаточность, сердечную недостаточность или заболевание коронарной артерии [11]. Вполне разумно, что некоторым пациентам с выраженной воспалительной реакцией, ведущей к длительной госпитализации или даже повторной госпитализации, может быть полезна противовоспалительная терапия. Будущие исследования могут быть сосредоточены на влиянии рутинной или симптоматической противовоспалительной терапии на исходы у пациентов с ПИС после TAVI.
Заключение
Помимо того, что в данной статье впервые демонстрируется возникновение редкого осложнения с возможной связью с TAVI, этот клинический случай также иллюстрирует важность мультидисциплинарного подхода к этим сложным пациентам.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Татаринцева З.Г., Казарьянц К.А., Чумаченко Н.В., Барбухатти К.О., Космачева Е.Д., Точена А.С. Системная воспалительная реакция после транскатетерной замены аортального клапана. Клинический случай. Российский кардиологический журнал. 2024;29(3S):5936. https://doi.org/10.15829/15604071-2024-5936. EDN: TCTGNT
Скопировать