Контроль аритмий с помощью технологий мобильного здравоохранения: цифровые медицинские технологии для специалистов по сердечному ритму. Консенсус экспертов 2021
- Введение
1.1. Обзор документа и обоснование данных - Технологии мобильного здравоохранения
2.1. Амбулаторный мониторинг электрокардиограммы
2.2. Новые методы мониторинга аритмий на основе мобильных технологий в здравоохранении
2.2.1. Технологии, основанные на регистрации ЭКГ
2.2.1.1. Портативные устройства
2.2.1.2. Носимые сенсорные патчи
2.2.1.3. Сенсоры, интегрированные в одежду
2.2.1.4. Смартфоны и устройства на базе умных часов
2.2.2. Методы мониторинга, основанные на других принципах, кроме регистрации ЭКГ
2.2.2.1. ФПГ
2.2.2.2. Осциллометрия
2.2.2.3. Механокардиография
2.2.2.4. Бесконтактная видеоплетизмография
2.2.2.5. Умные колонки - Мобильные технологии mHEALTH для контроля аритмий
3.1. Фибрилляция предсердий
3.1.1. Выявление недиагностированной ФП
3.1.2. Целенаправленный скрининг ФП у лиц с высоким риском
3.1.3. Диагностика у лиц с ранее известной ФП
3.1.4. Лечение ФП
3.2. Внезапная сердечная смерть - Сопутствующие заболевания
4.1. Ишемическая болезнь сердца
4.2. Сердечная недостаточность
4.2.1. Мобильные технологии в ведении пациентов с СН
4.2.2. Гибридная телереабилитация у больных СН
4.3. Сахарный диабет
4.4. Артериальная гипертония
4.5. Другие расстройства, включая апноэ сна (См. также Раздел по ХСН 4.2.1.)
4.6. Модификация образа жизни (См. рис. 5)
4.6.1. ФА
4.6.2. Диета - Самоконтроль пациентов как интегрированный длительный подход к терапии
5.1. Активная роль пациента
5.2. Модификация поведения
5.3. Пациент как участник сообщества (врач-пациент)
5.4. Поддержание активной роли пациента
5.5. Электронно-цифровой барьер (цифровое неравенство) - Клинические исследования
- Эксплуатационные задачи (операционные задачи)
7.1. Система здравоохранения — мониторинг электронного здравоохранения и госпитальная экосистема
7.2. Рекомендации по кибербезопасности для устройств мобильного здравоохранения
7.2.1. Стратегии взлома данных в технологиях мобильного здравоохранения
7.2.2. Рекомендации по защите информации для медицинских компаний-производителей
7.2.3. Рекомендации по защите информации для клиницистов и администраторов
7.2.4. Рекомендации в отношении пациентов
7.3. Возмещение расходов
7.4. Нормативно-правовая база в электронном здравоохранении - Прогностический анализ данных
- Возможные перспективы развития

Главный рисунок
1. Введение
1.1. Обзор документа и обоснование данных
Цифровое здравоохранение — это комплексное понятие, заключающееся в использовании цифровой информации, данных и коммуникационных технологий для сбора, обмена и анализа медицинских сведений с целью улучшения здоровья пациентов, повышения их информированности и улучшения качества медицинской помощи (https://www.fcc.gov/general/five-questions-you-can-ask-your-doctor-aboutdigital-health#ab) (Turakhia, 2016). Данная концепция включает применение телемедицинских технологий, электронных медицинских карт (ЭМК), мониторинг имплантируемых устройств, обработку данных носимых регистраторов, использование аналитики и искусственного интеллекта (ИИ), поведенческое здоровье и персонализированную медицину. Среди этих направлений отдельно можно выделить мобильное здравоохранение — или “mHealth” — это компонент цифрового здравоохранения, определяемый Всемирной организацией здравоохранения как “медицинская клиническая практика и практика общественного здравоохранения, основанная на данных мобильных устройств, включая мобильные телефоны, мониторы, персональные цифровые помощники и другие беспроводные устройства” (https://www.who.int/goe/publications/goe_mhealth_web.pdf) (https://apps.who.int/gb/ebwha/pdf_files/WHA71/A71_20-en.pdf?ua=1). В последние годы использование подобных устройств стало все более востребованным среди людей, заботящихся о своем здоровье, и, вероятно, будет далее широко распространяться, но уже с интеграцией в рамки формализованных медицинских клинических условий. Мобильное здравоохранение развивается в большей степени интуитивно, на основании опыта специалистов в области лечения аритмий, которые первоначально использовали данные, полученные в результате удаленного мониторинга (УМ) имплантируемых электронных устройств (ИЭУ), таких как кардиостимуляторы и имплантируемые кардиовертеры-дефибрилляторы (ИКД) (Varma 2010). Большинство исследований, проведенных за последние 10-15 лет, подтверждают эффективность динамического наблюдения с помощью удаленных технологий, которые в настоящий момент представляют собой стандартный подход к лечению пациентов (Varma 2013; Slotwiner 2015). Однако результаты УM ИЭУ не могут в полном объеме распространяться на мобильное здравоохранение. Так, использование вышеуказанного метода (УМ) ограничивается пациентами с кардиальной патологией (в основном аритмиями и сердечной недостаточностью (СН)), т.е. группой, уже определенной как “имеющие заболевания”. Тактика реализации технологии УМ ИЭУ также достаточно хорошо определена и включает вопросы оплаты и локального возмещения расходов, к примеру, в Соединенных Штатах Америки и ряде других стран. Для сравнения, в мобильном здравоохранении есть ряд важных отличий: во-первых, технологии более широко доступны в виде потребительских товаров, которыми пользуется большая часть общества, включая людей без официального медицинского диагноза; во-вторых, мобильные технологии могут применяться к более широкой группе заболеваний; данные могут контролироваться самостоятельно, а не оцениваться специалистами здравоохранения; но модели возмещения расходов в этой области не отработаны. Действительно, некоторые возможности отслеживания сердечного ритма могут быть косвенно реализованы в электронных продуктах, приобретаемых для различных целей, и затем, при необходимости, использоваться в медицинских целях. И наоборот, в сфере медицины мобильные приложения используются специалистами здравоохранения недостаточно часто, при этом отсутствуют убедительные доказательства их эффективности в отношении ведения ряда заболеваний, а тактика их реализации также остается разноречивой и не до конца определенной. Тем не менее, при правильной реализации пересечение этих двух технологий открывает широкий спектр возможностей: от скрининга населения и эпидемиологического учета недиагностированных заболеваний, до длительного наблюдения пациентов с различной патологией и, что важно, вовлечения пациентов в их собственный процесс лечения, что позволяет оказывать более качественную медицинскую помощь с применением независимых подходов, основанных на виртуализации данных. Ценность подобного подхода и степень интеграции в практическую медицину будут различаться в зависимости от принятой системы здравоохранения в разных странах.
Мобильное здравоохранение имеет ценность только в том случае, если полученная информация приводит к принятию тактических решений, которые улучшают результат лечения. Это требует четкой маршрутизации информационного потока и разработки, применимых на практике алгоритмов действий. Более того, все заинтересованные стороны должны быть осведомлены о возможной последовательности действий, чтобы каждый знал, что ожидать при использовании мобильных технологий и каким образом распределяются обязанности всех участников (возможно, включая поставщиков устройств). Точно так же действия, предпринятые на основе отслеживаемой информации, должны быть прозрачными и понятными для всех заинтересованных сторон. Например, для пациента, который регистрирует и передает данные о нерегулярном сердечном ритме через носимое устройство, необходимо следовать назначенному процессу принятия решения, чтобы подтвердить, является ли ритм фибрилляцией предсердий (ФП) или нет, требуется ли подтверждение другим диагностическим тестом, как будет организовано дополнительное обследование, и, наконец, какая терапия должна быть проведена и в какие разумные сроки? Очевидно, что существуют риски увеличения стоимости медицинского скрининга и повышения уровня беспокойства у потребителей, которые в результате обращения за дополнительной диагностикой переходят уже в разряд “пациентов”. Опять же, подобный прецедент уже существует на примере опыта использования ИЭУ. Исследования, продемонстрировавшие улучшение результатов с помощью телемониторинга, были успешными, если технологии были интегрированы в четкую логистическую структуру для конкретного варианта тактики лечения определенного заболевания (например, INTIME для УМ пациентов с сердечной ресинхронизирующей терапией, CARDIOMEMS) (Abraham, 2011, Hindricks 2014, Varma 2013). Воспроизведение этого подхода с помощью мобильного здравоохранения может создать проблемы для поставщиков медицинских услуг, и на самом деле задача выходит далеко за рамки технологических возможностей оборудования для мониторинга и передачи данных. Реализация потребует определенных целей и фундаментальных изменений существующих рабочих процессов и распределения ответственности. Такие изменения обычно трудно осуществить сразу в полном объеме. Помимо организационных вопросов, проблема компенсации расходов может также влиять на ситуацию. Важность вышеописанных факторов значимо возросла в условиях пандемии вирусом SARS-CoV-2, во время которой предлагались телемедицинские решения для сокращения контактов пациентов со специалистами здравоохранения, но при этом сохранялась возможность обеспечения необходимой медицинской помощью в полном объеме (Varma 2020).
Ввиду быстрого технологического развития и популярности носимых и других мобильных устройств, а также необходимости анализа и планирования инфраструктуры мобильного здравоохранения, ISHNE (Международное общество холтеровского мониторирования и неинвазивной электрокардиологии), HRS (Общество сердечного ритма), EHRA (Европейская Ассоциация сердечного ритма) и APHRS (АзиатскоТихоокеанская Ассоциация сердечного ритма) признали необходимость и своевременность данного консенсусного документа. Целью этого документа является освещение имеющихся современных технологий мобильного здравоохранения и возможностей их использования для контроля аритмий, включая будущие перспективы их клинического применения. Таким образом, основные разделы документа посвящены обсуждению различных технологий мобильного здравоохранения, доступных в настоящее время или находящихся в разработке, используемым методам сбора данных, связанных со здоровьем, и их потенциальному применению, включая диагностику и лечение заболеваний. Также документ включает анализ результатов клинических исследований, оценку роли пациента как активного участника лечебного процесса и другие важные вопросы, которые необходимо решить в будущем, чтобы обеспечить оптимальную реализацию технологий мобильного здравоохранения. Кроме того, обсуждение распространяется на способы эффективного контроля с помощью технологий мобильного здравоохранения сопутствующих заболеваний, потенциально влияющих на тактику ведения пациента с аритмиями (к примеру, ожирение и синдром апноэ сна) и находящихся в зоне ответственности специалистов по нарушениям сердечного ритма (Chung 2020).
Литература/References
1.
1.1.
Abraham WT, Adamson PB, Bourge RC, et al. Wireless pulmonary artery haemodynamic monitoring in chronic heart failure: a randomised controlled trial. Lancet. 2011;377:658-66. doi:10.1016/S0140-6736(11)60101-3.
Chung MK, Eckhardt LL, Chen LY, et al.; American Heart Association Electrocardiography and Arrhythmias Committee and Exercise, Cardiac Rehabilitation, and Secondary Prevention Committee of the Council on Clinical Cardiology; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular and Stroke Nursing; and Council on Lifestyle and Cardiometabolic Health. Lifestyle and Risk Factor Modification for Reduction of Atrial Fibrillation: A Scientific Statement From the American Heart Association. Circulation. 2020;141:e750-e772. doi:10.1161/CIR.0000000000000748.
Hindricks G, Taborsky M, Glikson M, et al.; IN-TIME study group. Implant-based multiparameter telemonitoring of patients with heart failure (IN-TIME): a randomised controlled trial. Lancet. 2014;384:583-90.
Slotwiner DJ, Varma N, Akar JG, et al. HRS Expert Consensus Statement on remote interrogation and monitoring for cardiovascular implantable electronic devices. Heart Rhythm 2015;12(7):e69-e100. doi:10.1016/j.hrthm.2015.05.008.
Turakhia MP, Desai SA, Harrington RA. The Outlook of Digital Health for Cardiovascular Medicine: Challenges but Also Extraordinary Opportunities. Journal of the American Medical Association Cardiol. 2016;1:743-4. doi:10.1001/jamacardio.2016.2661.
Varma N, Epstein AE, Irimpen A, et al. Efficacy and Safety of Automatic Remote Monitoring for Implantable Cardioverter-Defibrillator Follow-Up. Circulation. 2010;122:325-32.
Varma N, Ricci RP. Telemedicine and cardiac implants: what is the benefit? European Heart Journal. 2013;34:1885-95. doi:10.1093/eurheartj/ehs388.
Varma N, Marrouche NF, Aguinaga L, et al. HRS/EHRA/APHRS/LAHRS/ACC/AHA Worldwide Practical Guidance for Telehealth and Arrhythmia Monitoring During and After a Pandemic. Journal of the American College of Cardiology. 2020;76:1363-74. doi:10.1016/j.jacc.2020.06.019.
https://www.fcc.gov. https//www.fcc.gov/general/five-questions-you-can-ask-your-doctorabout-digital-health#ab. World Health Organization. mHealth New horizons for health through mobile technologies. Switzerland. 2011. Available at: https://www.who.int/goe/publications/goe_mhealth_web.pdf.
World Health Organization. mHealth: Use of appropriate digital technologies for public health.Switzerland. 2018. Available at: https://apps.who.int/gb/ebwha/pdf_files/WHA71/A71_20-en.pdf?ua=1.
2. Технологии мобильного здравоохранения
Специализированные приложения и сенсорные датчики, интегрированные в мобильные устройства связи или использующиеся в дополнение к ним, позволяют пользователям отслеживать, собирать и обмениваться данными, отражающими физиологические параметры и сведения о состоянии здоровья. Функции подобных приложений в основном включают диагностику, поддержку принятия решений, контроль симптомов заболевания и оценку приверженности к терапии, но данные мобильного здравоохранения могут использоваться также для образовательных целей и клинических исследований (рис. 1). Такие возможности позволяют достичь лучшего контроля аритмии и коррекции сопутствующих заболеваний с модификацией образа жизни пациентов.

Рис. 1. Применение цифровых технологий здравоохранения в аритмологии (многие из указанных направлений взаимосвязаны).
Цели использования в аритмологии:
- Диагностика
— оценка состояния пациентов с симптомами, предположительно указывающими на аритмию;
— оценка ответа пациентов на фармакологическую терапию и инвазивное лечение аритмий. - Скрининг
— усиление акцента на раннее выявление ФП.
2.1. Амбулаторный мониторинг электрокардиограммы
Данный метод имеет ключевое значение в диагностике аритмий, при этом оптимальный выбор техники и временных рамок проведения исследования зависит от того, присутствуют ли симптомы (например, сердцебиение, обмороки) и как часто они возникают (рис. 2). Поскольку XXIв ознаменовался эрой эпидемии ФП, акцент сместился на скрининг бессимптомных пациентов с высоким риском развития данной аритмии или пациентов с криптогенным эмболическим инсультом (ESUS), с целью обеспечения ранней диагностики и своевременного лечения в надежде предотвратить инсульт и другие серьезные осложнения. Новые мобильные инструменты расширяют возможности и временные рамки, в течение которых осуществляется сбор информации, позволяя преодолевать существующие ограничения традиционных методов, например, обычного физикального осмотра или периодической электрокардиографии (ЭКГ) в отношении обнаружения преимущественно бессимптомных аритмий.

Рис. 2. Технологии мобильного здравоохранения для мониторинга аритмий, применяющиеся по различным показаниям.
Примечание: традиционные носимые мониторы используются в течение определенного короткого периода времени. Преимуществами являются возможность непрерывного мониторирования и использование нескольких отведений, что является важным в дифференциальном диагнозе аритмий. Как правило, они применяются для выявления причины сердцебиения, обмороков и определения морфологии QRS комплекса. Использование технологий mHealth продлевает время мониторинга на неопределенный срок, определяемый пользователем, и дает возможность отслеживать другие параметры одновременно с ЭКГ в тесной связи с технологиями машинного обучения. Обычно в устройствах mHealth используется одноканальная ЭКГ или усредненная ЧСС, с применением прерывистого мониторинга.
Сокращения: АД — артериальное давление, ФП — фибрилляция предсердий, СН — сердечная недостаточность, ЧСС — частота сердечных сокращений, ЭКГ — электрокардиография, LQT — длинный интервал QT.
- Обычные амбулаторные устройства ЭКГ с возможностью “непрерывной” или “прерывистой” регистрации сигнала (например, холтеровский монитор, мобильная кардиотелеметрия (МКТ)) имеют хорошую диагностическую ценность при подозрении на аритмию, но в то же время и ряд ограничений, включая недостаточную продолжительность мониторинга, низкую чувствительность или специфичность в отношении обнаружения ФП, достаточно высокую стоимость, а также потенциальный дискомфорт и неудобства для пациента, что остается важным препятствием для внедрения. Дополнительные сведения об этих традиционных системах регистрации ЭКГ доступны в ранее опубликованном консенсусном заключении экспертов (Steinberg 2017).
- Имплантируемые петлевые регистраторы (ILR) непрерывно контролируют сердечный ритм, аналогично традиционным внешним петлевым регистраторам, но записывают ЭКГ только незадолго до и после активации пациентом или с помощью автоматического алгоритма. Общий период мониторинга ограничен только сроком службы батареи (примерно 2-4 года). В более новых устройствах используются специальные алгоритмы, которые представляют большой интерес в отношении их использования для обнаружения ФП, особенно после ESUS.
В настоящее время доступно к использованию и одобрено несколько типов устройств — ILR (Musat 2018, Sakhi 2019, Tomson 2015), и к тому же получены результаты ряда исследований по оценке их диагностической точности (Ciconte 2017, Hindricks 2010, Mittal 2016, Nolker 2016, Sanders 2016). Поскольку приборы ILR представляют собой инвазивную и достаточно дорогостоящую технологию, ряд функций может быть передан в сферу мобильного здравоохранения.
2.2. Новые методы мониторинга аритмий на основе мобильных технологий в здравоохранении
В целом, выделяют два направления развития методов мониторинга аритмий:
- регистрация записи ЭКГ (одно или несколько отведений, в прерывистом или непрерывном формате, различной продолжительности);
- применение технологий, основанных не на записи ЭКГ, а, к примеру, использование пульсовой фотоплетизмографии (ФПГ).
Инструменты мобильного здравоохранения позволяют реализовывать неограниченный мониторинг, что расширяет возможности их применения для целого ряда состояний и групп пациентов. Быстро развиваются различные типы диагностических датчиков, которые интегрируются в бытовые пользовательские устройства, такие как умные часы, фитнесбраслеты и смартфоны. Однако валидация данных, полученных посредством “умных устройств” (или лежащих в их основе алгоритмов), и механизм оценки данных профессионалами (по аналогии с ИЭУ и МКТ) пока в настоящее время недостаточно разработаны (см. Раздел 7). Поэтому это может сопровождаться риском невыявления значимых событий и/или назначения неадекватной терапии — например, регистрации ложноположительных эпизодов ФП — если не будет проводиться верификация данных опытными клиницистами.
2.2.1. Технологии, основанные на регистрации ЭКГ
Чаще всего используются портативные системы и сенсорные патчи для регистрации ЭКГ, которые в настоящее время наиболее хорошо валидированы.
2.2.1.1. Портативные устройства
Некоторые автономные портативные устройства могут работать без дополнительного оборудования. Эти устройства, как правило, снабжены двумя или тремя регистрационными электродами и способны генерировать короткие записи ЭКГ длительностью от 30 сек до 1 мин в одном или нескольких отведениях. Некоторые из них отображают ЭКГ на мониторе. Большинство подобных систем оснащено специальными автоматическими алгоритмами обнаружения аритмий и обычно ориентированы на выявление ФП, распознавание которой, как правило, основывается на анализе регулярности интервалов RR. Устройства могут сохранять в памяти записи ЭКГ, которые могут быть загружены в компьютер для просмотра и обычно доступны для анализа специалистов через облачные хранилища и веб-платформы. В недавних исследованиях в различных популяционных группах документально была подтверждена диагностическая ценность портативных устройств в плане скрининга ФП путем краткосрочного мониторинга ритма (Desteghe 2017, Doliwa 2009, Hendrikx 2014, Kaasenbrood 2016, Poulsen 2017, Svennberg 2017, Tavernier 2018, Tieleman 2014, Vaes 2014) (табл. 2).
Таблица 2
Примерные валидационные исследования для различных технологий мобильного здравоохранения


Сокращения: АД — артериальное давление, ФПГ — фотоплетизмография, ЭКГ — электрокардиография.
Литература/References
Bumgarner JM, Lambert CT, Hussein AA, et al. Smartwatch Algorithm for Automated Detection of Atrial Fibrillation. Journal of the American College of Cardiology. 2018;71:2381-8. doi:10.1016/j.jacc.2018.03.003.
Chan PH, Wong CK, Poh YC, et al. Diagnostic Performance of a Smartphone-Based Photoplethysmographic Application for Atrial Fibrillation Screening in a Primary Care Setting. Journal of the American Heart Association. 2016;5:e003428. doi:10.1161/JAHA.116.003428.
Cooke G, Doust J, Sanders S. Is pulse palpation helpful in detecting atrial fibrillation? A systematic review. The Journal of Family Practice. 2006;55:130-4.
Doliwa PS, Frykman V, Rosenqvist M. Short-term ECG for out of hospital detection of silent atrial fibrillation episodes. Scandinavian Cardiovascular Journal. 2009;43:163-8.
Kearley K, Selwood M, Van den Bruel A, et al. Triage tests for identifying atrial fibrillation in primary care: a diagnostic accuracy study comparing single-lead ECG and modified BP monitors. BMJ Open 2014;4:e004565.
Lau JK, Lowres N, Neubeck L, et al. iPhone ECG application for community screening to detect silent atrial fibrillation: a novel technology to prevent stroke. International Journal of Cardiology. 2013;165:193-4.
McManus DD, Chong JW, Soni A, et al. PULSE-SMART: Pulse-Based Arrhythmia Discrimination Using a Novel Smartphone Application. Journal of Cardiovascular Electrophysiology. 2016;27:51-7. doi:10.1111/jce.12842.
Proesmans T, Mortelmans C, Van Haelst R, et al. Mobile Phone-Based Use of the Photoplethysmography Technique to Detect Atrial Fibrillation in Primary Care: Diagnostic Accuracy Study of the FibriCheck App. JMIR Mhealth and Uhealth. 2019;7:e12284.
Tieleman RG, Plantinga Y, Rinkes D, et al. Validation and clinical use of a novel diagnostic device for screening of atrial fibrillation. Europace 2014;16:1291-5.
Wiesel J, Fitzig L, Herschman Y, Messineo FC. Detection of atrial fibrillation using a modified microlife blood pressure monitor. American journal of hypertension. 2009;22:848-52.
2.2.1.2. Носимые сенсорные патчи
Традиционные проводные регистрационные системы все чаще заменяются носимыми устройствами с электродами, интегрированными в специальные наклеивающиеся патчи. Наиболее распространенные имеющиеся в продаже патчи можно носить до 14 дней (Barrett 2014, Turakhia 2013). В отличие от клейких электродов для проводных систем, водостойкие патчи не удаляются в течение периода мониторинга, что приводит к возможности увеличения периода их ношения, большему объему анализируемых данных и минимизирует ошибки при неверном наложении электродов самим пациентом. Накожные патч-мониторы обычно одноразовые и осуществляют запись ЭКГ в одном отведении в непрерывном режиме, либо только в определенные периоды времени при автоматической активации записи или по решению пациента. Большинство из них имеют встроенную функцию, позволяющую пациенту отметить время появления симптомов на регистрируемом графике ритма. После окончания периода мониторинга устройство, как правило, направляется производителю для извлечения записей данных, анализа с помощью запатентованного алгоритма и дальнейшей вторичной оценки выявленных потенциальных нарушений ритма медицинскими специалистами. Затем диагностический отчет отправляется лечащему врачу, и этот процесс уже может занимать более продолжительный период времени (до нескольких недель).
Несмотря на то, что подобные патчи регистрируют ЭКГ только в одном отведении, была продемонстрирована высокая корреляция данных (P<0,001) с результатами холтеровского мониторирования в нескольких отведений в плане выявления пароксизмов ФП и оценки общей аритмической нагрузки (т.е. бремени ФП) (Barrett 2014, Rosenberg 2013). Поскольку сенсорный патч не имеет внешних электродов, считается, что его удобнее носить по сравнению с обычными мониторами ЭКГ. Согласно литературным данным, до 94% пациентов предпочитают данный вид мониторинга аритмических событий (Barrett 2014). В дополнение к валидационным исследованиям возможность двухнедельного непрерывного мониторинга для выявления ФП в популяции пациентов группы высокого риска была изучена Turakhia, et al. (2015). При этом носимые патч-регистраторы успешно использовались также для определения распространенности субклинической ФП среди общей популяции (Rooney 2019).
Современные сенсорные патч-системы позволяют осуществлять аналитику данных почти в реальном времени и непрерывно передают регистрируемую информацию в облачное хранилище. Это значительно ускоряет сбор данных и диагностику нарушений ритма. Многопараметрический мониторинг может быть доступен в период ношения регистрационных патчей в течение до 3 мес. (Stehlik 2020).
2.2.1.3. Сенсоры, интегрированные в одежду
Сенсорные системы для мониторинга ЭКГ, интегрированные в повседневные предметы из текстиля или различную одежду, изначально были разработаны для обеспечения комфорта пациентов во время повседневной деятельности и ориентированы прежде всего на потребности людей, ведущих активный образ жизни. Подобные системы обычно представляют собой жилеты и эластичные ленты, которые легко адаптируются к движениям пациентов, что особенно важно для тех, кто выполняет физические нагрузки, которые могут быть при обычном мониторировании лимитированы наличием электродов. Эти биомедицинские устройства улавливают электрокардиографический сигнал через электроды, встроенные в одежду, что позволяет неинвазивным способом регистрировать сигнал ЭКГ в течение периода до 30 дней. Кроме того, в подобных системах доступен выбор одного/нескольких отведений (вплоть до регистрации 12 отведений) и активация событий по требованию пациента. Записи ЭКГ могут храниться на картах памяти и впоследствии анализироваться, а также передаваться в режиме реального времени через функцию Bluetooth на смартфон (а оттуда на облачную платформу) вместе с другой информацией, включая данные акселерометра и GPS. Помимо стандартной регистрации ЭКГ некоторые устройства предоставляют данные об интенсивности физической активности (ФА), функции дыхания и качестве сна. Возможен автоматический анализ данных с последующей ручной верификацией. На рынке в настоящий момент доступно несколько систем для мониторинга ЭКГ на основе электродов, встроенных в повседневные предметы из текстиля или одежду. Некоторые модели способны регистрировать сигнал со специальных нагрудных ремней или пояса, оснащенного сенсорным датчиком. Возможной проблемой при использовании данных устройств представляется поддержание достаточного заряда мощности батареи. Подобные системы применялись для испытания у спортсменов во время физической нагрузки, у пациентов с ESUS, а также у лиц, имеющих эпизоды ускоренного ритма предсердий по данным имплантированных кардиостимуляторов (Eliot 2019, Eysenck 2019, Fabregat 2014, Feito 2019, Pagola 2018).
Применяющиеся в настоящее время носимые кардиовертеры-дефибрилляторы регистрируют 2 канала ЭКГ и передают информацию в онлайн-базу данных, что позволяет осуществлять УМ пациентов из группы высокого риска. Недавно было разработано устройство, оснащенное системой оценки звучания сердечных тонов, которая может прогнозировать декомпенсацию СН. В настоящий момент идет тестирование данной системы в проспективном исследовании (исследование HEARIT-Reg ClinicalTrials.gov, идентификатор: NCT03203629).
2.2.1.4. Смартфоны и устройства на базе умных часов
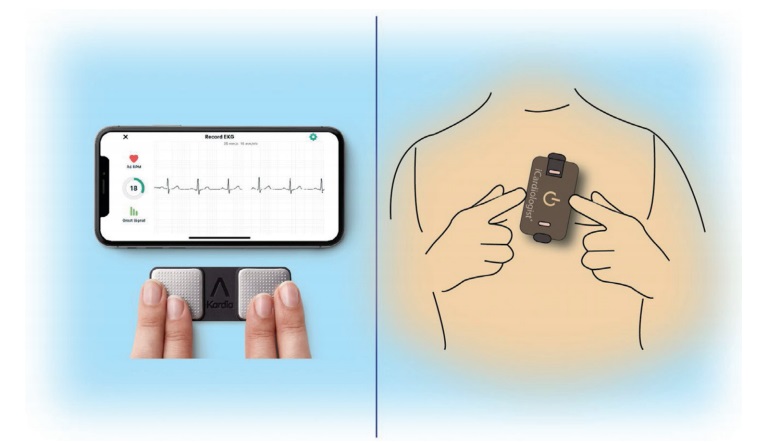
Совсем недавно появились устройства, сопряженные со смартфоном, но отличающиеся принципом использования от традиционных носимых мониторов. Подобные устройства (например, см. табл. 2 и работу Varma 2020) позволяют осуществлять “выборочную регистрацию” короткой записи ЭКГ в одном отведении, обычно продолжительностью до 30 сек или дольше, помещая палец каждой руки на два сенсорных электрода, как правило, расположенных на корпусе телефона или внешней карте-носителе (рис. 3). Электрический сигнал ЭКГ передается по беспроводной сети на смартфон со встроенным приложением для интерпретации данных. Записи ЭКГ в дальнейшем могут быть просмотрены на смартфоне, сохранены в электронном виде или переданы для просмотра провайдеру пользователя, если это необходимо. В основном вышеописанные приложения направлены на скрининг ФП.

Рис. 3. Мобильные приложения для регистрации ЭКГ для iPhone.
Примечание: слева — записи ЭКГ, регистрирующиеся при соприкосновении с кончиками пальцев, справа — карта для записи прижата к поверхности грудной клетки.
Автоматизированные алгоритмы могут классифицировать полученные записи как: “Вероятно наличие ФП” на основе критериев наличия и отсутствия зубца P и неравномерности интервала RR; “Нормальный” или “Синусовый ритм” и “Неклассифицированный ритм”, когда детектор указывает на слишком сильные помехи для адекватной записи, возможные вследствие движения тела или плохого контакта между электродами и кожей пациента. В настоящий момент протестировано несколько версий автоматизированных алгоритмов AliveCor (Chan 2016, Chan 2017, Desteghe 2017, Lowres 2014, Tarakji 2015) на устройствах, разработанных как инструмент скрининга лиц, находящихся в группе риска развития ФП (Halcox 2017, Lowres 2014). На практике при использовании часов Apple Watch алгоритм эффективен, когда частота сердечных сокращений (ЧСС) находится в пределах от 50 до 150 уд./мин, отсутствует или минимально выражена экстрасистолия, а форма сигнала, время и продолжительность каждого сокращения находятся в рамках нормальных индивидуальных значений для пациента (рис. 4).

Рис. 4. Технология Apple Watch.
Сокращения: ЧСС — частота сердечных сокращений, ЭКГ — электрокардиография.
Чувствительность и специфичность зависят от программного обеспечения (которое может быть при необходимости откалибровано по данным параметрам), исследуемой популяции (например, у пожилых людей более выражен тремор и/или имеются трудности с удерживанием устройства, что приводит к большему количеству помех в записи) и общей распространенности ФП среди населения. Поэтому можно сделать вывод, что использование подобных устройств всегда требует тщательной оценки показаний в каждом предполагаемом варианте использования. Для умных часов разработаны специальные дополнительные браслеты, позволяющие регистрировать ЭКГ в одном отведении с автоматическим анализом наличия ФП посредством встроенных датчиков, которые передают информацию в приложение для часов, сопряженное с мобильным телефоном. Недавно для подобных часов был разработан новый корпус с 6 отведениями, позволяющий записывать в течение 30 сек 6 канальную ЭКГ (отведения от конечностей) путем одновременного считывания сигнала с каждого из трех электродов, соприкасающихся с кожей пациента. Также на основании данного метода можно вычислить интервал QT (https://cardiacrhythmnews.com/kardiamobile-6l-can-be-usedto-measure-qt-duration-incovid-19-patients/ (Chung 2015, Garabelli 2016). Однако пока недостаточно данных, могут ли такие параметры, как корригированный интервал QTc, зарегистрированный на ЭКГ в одном отведении (или при ограниченном числе отведений), являться полноценной заменой информации, полученной при записи ЭКГ в 12 отведениях. В одном из исследований интервал QT оценивался с помощью записи одного отведения ЭКГ по данным смартфона (Koltowski 2019), но результаты часто были недостаточно достоверными. Но имеются предварительные данные, указывающие на возможность мониторинга ST при ишемии с помощью подобных смарт-устройств (рис. 3, Раздел 4.1).
Возможным преимуществом использования мобильных устройств по сравнению с ЭКГ в 12 отведениях для клиницистов представляется быстрая регистрация короткой записи ритма, которую нетрудно интерпретировать. Кроме того, пациенты могут использовать эти устройства для ситуационной или рутинной оценки своего ритма в домашних условиях. Данные ЭКГ могут быть мгновенно переданы для автоматической интерпретации, но всегда остается возможность для пациента получить по запросу расшифровку от специалиста.
- Возможные ограничения метода
а. Устройства для регистрации ЭКГ в одном отведении, особенно при использовании активными пациентами, которые реже находятся в состоянии покоя, часто двигаются и меняют положение тела, могут иметь недостатки в плане регистрации значительных электрических артефактов во время записи. Как правило, получить четкую запись при отсутствии шумов будет сложнее у пожилых пациентов или людей с физическими ограничениями (тремор, перенесенный инсульт и т.д.).
б. Хотя алгоритмы интерпретации ЭКГ обычно контролируются действующими практическими рекомендациями, они все равно нередко могут неверно классифицировать ритмы, ошибочно диагностируя ФП вместо синусового ритма и наоборот, что может принести потенциальный вред пациенту, если не последует грамотная оценка записи со стороны клинициста. К примеру, в недавнем исследовании работы пользовательских устройств — регистраторов ЭКГ, направленных на скрининг ФП, около одной трети записей расценивались прибором как “неклассифицируемые”, однако оказалось, что они могут быть успешно классифицированы экспертами (Bumgarner 2018), поэтому для некоторых типов мобильных устройств в настоящее время существуют ограничения в плане их диагностической значимости. Например, технология Apple Watch не может достоверно оценить ЭКГ при ФП, если частота пульса >150 или <50 уд./мин (https://www.apple.com/healthcare/docs/site/Apple_Watch_Arrhythmia_Detection.pdf), поэтому по рекомендации Управления FDA, ее лучше использовать у лиц с ранее недиагностированной ФП, т.к. это повышает информативность исследования (рис. 4) (https://support.apple.com/en-us/HT208931, по состоянию на 2 января 2020г) (См. Раздел 6: Клинические испытания).
в. Необходимо помнить, что при использовании технологии “умных часов”, находящихся в широком доступе для потребителей, ЭКГ диагностика ФП считается предварительной и не может служить основанием для принятия каких-либо клинических решений без оценки записи специалистом.
г. Классификация других отдельных нарушений ритма (предсердная (ПЭ) и желудочковая экстрасистолия (ЖЭ), желудочковая тахикардия (ЖТ)) в настоящее время остается недоступной.
2.2.2. Методы мониторинга, основанные на других принципах, кроме регистрации ЭКГ
2.2.2.1. ФПГ
Использование устройств, доступных для широкого потребления, таких как смартфоны и умные часы, нередко требует дополнительного программного обеспечения и аксессуаров, что часто сопровождается внеплановыми затратами и расходами. Напротив, технологии ФПГ позволяют обнаруживать аритмию с помощью оборудования, уже имеющегося на большинстве потребительских устройств (умных часов и фитнес-браслетов), через загружаемое приложение. ФПГ представляет собой оптический метод, который можно использовать для обнаружения ФП путем измерения и анализа формы периферической пульсовой волны. Используя источник света и фотодетектор, форму импульса можно измерить на основании степени изменения интенсивности света, которые отражают объем кровотока в поверхностных тканях (кончик пальца, мочка уха или лицевая область) (Conroy 2017, McManus 2013). Автоматический алгоритм может впоследствии проанализировать сгенерированную форму импульса на предмет выявления ФП. Применение ФПГ позволяет избежать нестабильности и двигательных артефактов, которые присущи регистрационным датчикам ЭКГ, и является хорошей альтернативой, особенно при пассивной записи сигнала.
Технология совместима со смартфонами, использующими камеру телефона для измерения формы пульсовой волны, регистрируемой на кончиках пальцев. Быстрая нерегулярная ФП может вызывать изменения в пульсовом давлении, что затрудняет диагностику в отдельных случаях (Choi 2017). Было доказано, что эффективность алгоритмов интерпретации сигналов ФПГ хорошо коррелирует с данными коротких записей ЭКГ (ритмограмм), полученных при помощи мобильных устройств (McManus 2013, McManus 2016, Proesmans 2019). По данным литературы, приложения ФПГ для смартфонов использовались у лиц группы риска для выявления ФП и в качестве инструмента скрининга среди общей популяции (Verbrugge 2019) (См. Раздел 6: Клинические исследования).
Технология ФПГ также интегрирована в умные часы для измерения ЧСС и оценки ритма (Dorr 2019, Guo 2019). Рядом исследователей разработаны прототипы манжеты, которая включает функции одновременной регистрации одноканальной ЭКГ, многоволновой ФПГ и 3D акселерометрии на частоте 128 Гц (Nemati 2016), в то время как другие разработчики используют данные нейросетей на основе датчиков ФПГ для обнаружения ФП (https://www.mobihealthnews.com/content/study-apple-watchpaired-deep-neural-network-detects-atrial-fibrillation97-percent-accuracy; http://www.mrhythmstudy.org). Если результаты, полученные при анализе ФПГ или данных оптических регистраторов, будут соответствовать основным характеристикам ритма на основе стандартной ЭКГ, можно ожидать повышения качества медицинской помощи пациентам с ФП, что постепенно будет способствовать снижению применения традиционной офисной или амбулаторной ЭКГ в целях скрининга ФП.
2.2.2.2. Осциллометрия
При нерегулярном пульсе можно ожидать менее точного измерения артериального давления (АД). Эта характеристика используется автоматическими осциллометрическими мониторами АД, которые алгоритмически определяют регулярность сердечного ритма (Chen 2017). На основании этих данных можно расценивать применение автоматизированных мониторов АД как дополнительное средство для выявления ФП. Исследования продемонстрировали, что ряд устройств от двух производителей зарекомендовали себя более надежными с чувствительностью и специфичностью, превышающими 85% (Kane 2016). Считается, что подобные устройства для измерения АД со встроенными алгоритмами для обнаружения аритмий перспективны в качестве инструментов скрининга ФП, по сравнению с ручной пальпацией пульса. Эти функции можно добавить и к устройствам непрерывной регистрации АД (Kario 2016). Отдельно взятое устройство на основании осциллометрии определяет ритм как возможную ФП, если, по крайней мере, два из трех последовательных измерений показывают нерегулярность пульсовой волны. Вопросы диагностической точности (Chan 2017, Chen 2017, Gandolfo 2015, Kearley 2014, Marazzi 2012, Stergiou 2009, Wiesel 2009, Wiesel 2014) при использовании подобных устройств в качестве инструмента скрининга ФП рассматриваются в недавних клинических работах и многоцентровых исследованиях (Chan 2017, Omboni 2016, Wiesel 2017).
Предварительное изучение прошли следующие:
2.2.2.3. Механокардиография
Принцип механокардиографии основан на использовании акселерометров и гироскопии для определения механической активности сердца. Точность этой технологии для обнаружения ФП с помощью встроенного в смартфон акселерометра и датчиков гироскопа оценивалась в рамках недавней экспериментальной работы (Jaakkola 2018). В ходе исследования технологии Sony Experia датчик помещали на переднюю поверхность груди пациентам в положении лежа на спине для регистрации микроамплитудных движений грудной клетки. Возможно, ношение этого устройства в кармане также может быть полезным в плане выявления ФП, но при записи можно ожидать наложение двигательных артефактов (например, при ходьбе).
2.2.2.4. Бесконтактная видеоплетизмография
Технология бесконтактного видеомониторинга дыхания и пульса была разработана <15 лет назад (Takano 2007, Verkruysse 2008). В 2014г впервые исследователи описали концепцию бесконтактной видеодетекции ФП (Couderc 2015). Принцип метода заключается в том, что тщательное изучение видео лица пациента может помочь идентифицировать ФП, исследуя нерегулярность пульсирующей перфузии подкожных сосудов (Yan 2018). Это метод мониторинга, воспринимающий сигналы, подобные фотоплетизмографическим, из стандартной цифровой компонентной видеозаписи кожного покрова (в частности, лица пациента). Видеоплетизмографический сигнал регистрирует пик поглощения окружающего света гемоглобином кожи лица. Было проведено несколько исследований для валидации метода, который достаточно чувствителен в плане регистрации каждого отдельного сердечного сокращения и дает представление о вариабельности пульса для каждого удара. Технология HealthKam работает с использованием шкалы цветового тона с видеокамер (Dautov 2018, Tsouri 2015) и может быть легко интегрирована в любое портативное компьютерное устройство с камерой (смартфон, планшет и т.д.). Благодаря использованию мобильных устройств, оснащенных виртуальными камерами, применение данной технологии становится простым и воспроизводимым на практике, поскольку не требует использования каких-либо дополнительных устройств. Подобная система может существенно изменить подходы к скринингу ФП, который на данном этапе может проводиться только для одного пациента в единицу времени. Более высокая производительность в плане обнаружения ФП у нескольких пациентов одновременно с использованием одной цифровой камеры и предварительно обученной глубокой нейронной сети (DCNN) продемонстрирована в пилотном исследовании (Yan 2020).
Возможные ограничения метода
Одно из основных требований для реализации данной технологии — постоянная фокусировка на объекте: таким образом, движущиеся объекты представляют проблему. Важно избегать записи, отправки или передачи персональных видео с пациентом, тем самым соблюдая принципы конфиденциальности. Применение видеотехнологий в телемедицине способствовало появлению ряда новых социальных и этических проблем, которые постоянно пересматриваются и становятся более актуальными, например, во время пандемии COVID-19. Вопросы, касающиеся приватности данных, конфиденциальности, а также юридических и этических обязательств в ходе лечения пациентов, являются решающими и требуют большого внимания при широкомасштабном применении подобных технологий (Turakhia 2019).
2.2.2.5. Умные колонки
Представлены предварительные отчеты по использованию интеллектуальной усовершенствованной системы звуковых колонок для детекции агонального дыхания (Chan 2019, Wang 2019). Выявление аномальных паттернов сердечного ритма может стать возможным посредством преобразования интеллектуальных динамиков в гидролокатор, который способен генерировать звуковые волны неслышимых частот с последующим их отражением и приемом для детекции движения. Данные технологии не относятся к бытовой сфере повседневного потребления, но потенциально имеют широкие возможности для применения.
Литература/References
2.
2.1.
Ciconte G, Saviano M, Giannelli L, et al. Atrial fibrillation detection using a novel three-vector cardiac implantable monitor: the atrial fibrillation detect study. Europace. 2017;19:1101-8. doi:10.1093/europace/euw181.
Hindricks G, Pokushalov E, Urban L, et al.; XPECT Trial Investigators. Performance of a new leadless implantable cardiac monitor in detecting and quantifying atrial fibrillation: Results of the XPECT trial. Circulation Arrhythmia and electrophysiology. 2010;3:141-7. doi:10.1161/circep.109.877852.
Mittal S, Rogers J, Sarkar S, et al. Real-world performance of an enhanced atrial fibrillation detection algorithm in an insertable cardiac monitor. Heart Rhythm. 2016;13(8):1624-30. doi:10.1016/j.hrthm.2016.05.010.
Musat DL, Milstein N, Mittal S. Implantable Loop Recorders for Cryptogenic Stroke (Plus Real-World Atrial Fibrillation Detection Rate with Implantable Loop Recorders). Cardiac Electrophysiology Clinics. 2018;10:111-8. doi:10.1016/j.ccep.2017.11.011.
N?lker G, Mayer J, Boldt LH, et al. Performance of an Implantable Cardiac Monitor to Detect Atrial Fibrillation: Results of the DETECT AF Study. Journal of Cardiovascular Electrophysiology. 2016;27:1403-10. doi:10.1111/jce.13089.
Sakhi R, Theuns DAMJ, Szili-Torok T, Yap SC. Insertable cardiac monitors: current indications and devices. Expert Review of Medical Devices. 2019;16:45-55. doi:10.1080/17434440.2018.1557046.
Sanders P, Purerfellner H, Pokushalov E, et al.; Reveal LINQ Usability Investigators. Performance of a new atrial fibrillation detection algorithm in a miniaturized insertable cardiac monitor: Results from the Reveal LINQ Usability Study. Heart Rhythm. 2016;13:1425-30. doi:10.1016/j.hrthm.2016.03.005.
Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Annals of Noninvasive Electrocardiology. 2017;22(3):e12447. doi:10.1111/anec.12447.
Tomson TT, Passman R. The Reveal LINQ insertable cardiac monitor. Expert review of medical devices. 2015;12:7-18. doi:10.1586/17434440.2014.953059.
Varma N, Marrouche NF, Aguinaga L, et al. HRS/EHRA/APHRS/LAHRS/ACC/AHA Worldwide Practical Guidance for Telehealth and Arrhythmia Monitoring During and After a Pandemic. Journal of the American College of Cardiology. 2020;76:1363-74. doi:10.1016/j.jacc.2020.06.019.
2.2.
2.2.1.1.
Desteghe L, Raymaekers Z, Lutin M, et al. Performance of handheld electrocardiogram devices to detect atrial fibrillation in a cardiology and geriatric ward setting. Europace. 2017;19:29-39. doi:10.1093/europace/euw025.
Doliwa PS, Frykman V, Rosenqvist M. Short-term ECG for out of hospital detection of silent atrial fibrillation episodes. Scandinavian cardiovascular journal. 2009;43:163-8. doi:10.1080/14017430802593435.
Hendrikx T, Rosenqvist M, Wester P, et al. Intermittent short ECG recording is more effective than 24-hour Holter ECG in detection of arrhythmias. BMC cardiovascular disorders. 2014;14:41. doi:10.1186/1471-2261-14-41.
Kaasenbrood F, Hollander M, Rutten FH, et al. Yield of screening for atrial fibrillation in primary care with a hand-held, single-lead electrocardiogram device during influenza vaccination. Europace. 2016;18:1514-20. doi:10.1093/europace/euv426.
Poulsen MB, Binici Z, Dominguez H, et al. Performance of short ECG recordings twice daily to detect paroxysmal atrial fibrillation in stroke and transient ischemic attack patients. International Journal of Stroke. 2017;12:192-6. doi:10.1177/1747493016669883.
Svennberg E, Stridh M, Engdahl J, et al. Safe automatic one-lead electrocardiogram analysis in screening for atrial fibrillation. Europace. 2017;19:1449-53. doi:10.1093/europace/euw286.
Tavernier R, Wolf M, Kataria V, et al. Screening for atrial fibrillation in hospitalised geriatric patients. Heart. 2018;104:588-93. doi:10.1136/heartjnl-2017-311981.
Tieleman RG, Plantinga Y, Rinkes D, et al. Validation and clinical use of a novel diagnostic device for screening of atrial fibrillation. Europace. 2014;16:1291-5. doi:10.1093/europace/euu057.
Vaes B, Stalpaert S, Tavernier K, et al. The diagnostic accuracy of the MyDiagnostick to detect atrial fibrillation in primary care. BMC family practice. 2014;15:113. doi:10.1186/1471-2296-15-113.
2.2.1.2.
Barrett PM, Komatireddy R, Haaser S, et al. Comparison of 24-hour Holter monitoring with 14-day novel adhesive patch electrocardiographic monitoring. The American Journal of Medicine. 2014;127:95.e11-7. doi:10.1016/j.amjmed.2013.10.003.
Rooney MR, Soliman EZ, Lutsey PL, et al. Prevalence and Characteristics of Subclinical Atrial Fibrillation in a Community-Dwelling Elderly Population: The ARIC Study. Circulation: Arrhythmia and Electrophysiology. 2019;12:e007390. doi:10.1161/CIRCEP.119.007390.
Rosenberg MA, Samuel M, Thosani A, Zimetbaum PJ. Use of a noninvasive continuous monitoring device in the management of atrial fibrillation: a pilot study. Pacing and Clinical Electrophysiology. 2013;36:328-33. doi:10.1111/pace.12053. PMC3618372.
Stehlik J, Schmalfuss C, Bozkurt B, et al. Continuous Wearable Monitoring Analytics Predict Heart Failure Hospitalization: The LINK-HF Multicenter Study. Circulation Heart Failure. 2020;13:e006513. doi:10.1161/CIRCHEARTFAILURE.119.006513.
Turakhia MP, Hoang DD, Zimetbaum P, et al. Diagnostic utility of a novel leadless arrhythmia monitoring device. American Journal of Cardiology. 2013;112:520-4. doi:10.1016/j.amjcard.2013.04.017.
Turakhia MP, Ullal AJ, Hoang DD, et al. Feasibility of extended ambulatory electrocardiogram monitoring to identify silent atrial fibrillation in high-risk patients: the Screening Study for Undiagnosed Atrial Fibrillation (STUDY-AF). Clinical cardiology. 2015;38:285-92. doi:10.1002/clc.22387. PMC4654330.
2.2.1.3.
Elliot CA, Hamlin MJ, Lizamore CA. Validity and Reliability of the Hexoskin Wearable Biometric Vest During Maximal Aerobic Power Testing in Elite Cyclists. The Journal of Strength & Conditioning Research. 2019;33:1437-44. doi:10.1519/JSC.0000000000002005.
Eysenck W, Freemantle N, Sulke N. A randomized trial evaluating the accuracy of AF detection by four external ambulatory ECG monitors compared to permanent pacemaker AF detection. Journal of Interventional Cardiac Electrophysiology. 2019;57:361-9. doi:10.1007/s10840-019-00515-0.
Fabregat-Andres O, Munoz-Macho A, Adell-Beltran G, et al. Evaluation of a New Shirt-Based Electrocardiogram Device for Cardiac Screening in Soccer Players: Comparative Study With Treadmill Ergospirometry. Cardiology Research. 2014;5:101-7. doi:10.14740/cr333w.
Feito Y, Moriarty TA, Mangine G, Monahan J. The use of a smart-textile garment during highintensity functional training: a pilot study. The Journal of Sports Medicine and Physical Fitness. 2019;59:947-54. doi:10.23736/S0022-4707.18.08689-9.
Pagola J, Juega J, Francisco-Pascual J, et al.; CryptoAF investigators. Yield of atrial fibrillation detection with Textile Wearable Holter from the acute phase of stroke: Pilot study of Crypto-AF registry. International Journal of Cardiology. 2018;251:45-50. doi:10.1016/j.ijcard.2017.10.063.
2.2.1.4.
Bumgarner JM, Lambert CT, Hussein AA, et al. Smartwatch Algorithm for Automated Detection of Atrial Fibrillation. Journal of the American College of Cardiology. 2018;71:2381-8. doi:10.1016/j.jacc.2018.03.003.
Chan PH, Wong CK, Poh YC, et al. Diagnostic Performance of a Smartphone-Based Photoplethysmographic Application for Atrial Fibrillation Screening in a Primary Care Setting. Journal of the American Heart Association. 2016;5(7):e003428. doi:10.1161/jaha.116.003428.
Chung EH, Guise KD. QTC intervals can be assessed with the AliveCor heart monitor in patients on dofetilide for atrial fibrillation. Journal of Electrocardiology. 2015;48:8-9. doi:10.1016/j. jelectrocard.2014.10.005.
Desteghe L, Raymaekers Z, Lutin M, et al. Performance of handheld electrocardiogram devices to detect atrial fibrillation in a cardiology and geriatric ward setting. Europace. 2017;19:29-39. doi:10.1093/europace/euw025.
Garabelli P, Stavrakis S, Albert M, et al. Comparison of QT Interval Readings in Normal Sinus Rhythm Between a Smartphone Heart Monitor and a 12-Lead ECG for Healthy Volunteers and Inpatients Receiving Sotalol or Dofetilide. Journal of Cardiovascular Electrophysiology. 2016;27:827-32. doi:10.1111/jce.12976.
Halcox JPJ, Wareham K, Cardew A, et al. Assessment of Remote Heart Rhythm Sampling Using the AliveCor Heart Monitor to Screen for Atrial Fibrillation: The REHEARSE-AF Study. Circulation. 2017;136:1784-94. doi:10.1161/circulationaha.117.030583.
Lowres N, Neubeck L, Salkeld G, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thrombosis and Haemostasis. 2014;111:1167-76. doi:10.1160/th14-03-0231.
Koltowski L, Balsam P, Renata Gl?owczynska R, et al. Kardia Mobile Applicability in Clinical Practice: A Comparison of Kardia Mobile and Standard 12-lead Electrocardiogram Records in 100 Consecutive Patients of a Tertiary Cardiovascular Care Center. Cardiology Journal. 2019. doi:10.5603/CJ.a2019.0001.
Tarakji KG, Wazni OM, Callahan T, et al. Using a novel wireless system for monitoring patients after the atrial fibrillation ablation procedure: the iTransmit study. Heart Rhythm. 2015;12:554-9. doi:10.1016/j.hrthm.2014.11.015.
Varma N, Marrouche NF, Aguinaga L, et al. HRS/EHRA/APHRS/LAHRS/ACC/AHA Worldwide Practical Guidance for Telehealth and Arrhythmia Monitoring During and After a Pandemic. Journal of the American College of Cardiology. 2020;76:1363-74. doi:10.1016/j.jacc.2020.06.019.
https://support.apple.com/en-us/HT208931
https://www.apple.com/healthcare/docs/site/Apple_Watch_Arrhythmia_Detection.pdf
https://cardiacrhythmnews.com/kardiamobile-6l-can-be-used-to-measure-qt-duration-incovid-19.
2.2.2.
2.2.2.1.
Conroy T, Guzman JH, Hall B, et al. Detection of atrial fibrillation using an earlobe photoplethysmographic sensor. Physiological measurement. 2017;38:1906-18. doi:10.1088/1361-6579/aa8830.
Choi A, Shin H. Photoplethysmography sampling frequency: pilot assessment of how low can we go to analyze pulse rate variability with reliability? Physiol Measurement. 2017;38:586-600.
D?rr M, Nohturfft V, Brasier N, et al. The WATCH AF Trial: SmartWATCHes for Detection of Atrial Fibrillation. Journal of the American College of Cardiology Clinical Electrophysiology. 2019;5:199-208. doi:10.1016/j.jacep.2018.10.006.
McManus DD, Lee J, Maitas O, et al. A novel application for the detection of an irregular pulse using an iPhone 4S in patients with atrial fibrillation. Heart Rhythm. 2013;10:315-9. doi:10.1016/j.hrthm.2012.12.001. PMC3698570.
McManus DD, Chong JW, Soni A, et al. PULSE-SMART: Pulse-Based Arrhythmia Discrimination Using a Novel Smartphone Application. Journal of Cardiovascular Electrophysiology. 2016;27:51-7. doi:10.1111/jce.12842. PMC4768310.
Nemati S, Ghassemi MM, Ambai V, et al. Monitoring and detecting atrial fibrillation using wearable technology. Conference proceedings: Annual International Conference of the IEEE Engineering in Medicine and Biology Society IEEE Engineering in Medicine and Biology Society Annual Conference. 2016;2016:3394-7. doi:10.1109/embc.2016.7591456.
Proesmans T, Mortelmans C, Van Haelst R, et al. Mobile Phone-Based Use of the Photoplethysmography Technique to Detect Atrial Fibrillation in Primary Care: Diagnostic Accuracy Study of the FibriCheck App. Journal of Medical Internet Research mHealth and uHealth. 2019;7:e12284. doi:10.2196/12284.
Verbrugge FH, Proesmans T, Vijgen J, et al. Atrial fibrillation screening with photoplethysmography through a smartphone camera. Europace. 2019;21:1167-75. doi:10.1093/europace/euz119.
https://www.mobihealthnews.com/content/study-apple-watch-paired-deep-neural-networkdetects-atrial-fibrillation-97-percent-accuracy; https:mrhythmstudy.org.
2.2.2.2.
Chan PH, Wong CK, Pun L, et al. Head-to-Head Comparison of the AliveCor Heart Monitor and Microlife WatchBP Office AFIB for Atrial Fibrillation Screening in a Primary Care Setting. Circulation. 2017;135:110-2. doi:10.1161/circulationaha.116.024439.
Chen Y, Lei L, Wang JG. Atrial fibrillation screening during automated blood pressure measurement-Comment on “Diagnostic accuracy of new algorithm to detect atrial fibrillation in a home blood pressure monitor”. The Journal of Clinical Hypertension. 2017;19:1148-51. doi:10.1111/jch.13081.
Gandolfo C, Balestrino M, Bruno C, et al. Validation of a simple method for atrial fibrillation screening in patients with stroke. Neurological sciences. 2015;36:1675-8. doi:10.1007/s10072-015-2231-0.
Kane SA, Blake JR, McArdle FJ, et al. Opportunistic detection of atrial fibrillation using blood pressure monitors: a systematic review. Open Heart. 2016;3:e000362.
Kario K. Evidence and Perspectives on the 24-hour Management of Hypertension: Hemodynamic Biomarker-Initiated ‘Anticipation Medicine’ for Zero Cardiovascular Event. Progress in cardiovascular diseases. 2016;59:262-81. doi:10.1016/j.pcad.2016.04.001.
Kearley K, Selwood M, Van den Bruel A, et al. Triage tests for identifying atrial fibrillation in primary care: a diagnostic accuracy study comparing single-lead ECG and modified BP monitors. British Medical Journal Open. 2014;4:e004565. doi:10.1136/bmjopen-2013-004565.
Marazzi G, Iellamo F, Volterrani M, et al. Comparison of Microlife BP A200 Plus and Omron M6 blood pressure monitors to detect atrial fibrillation in hypertensive patients. Advances in therapy. 2012;29:64-70. doi:10.1007/s12325-011-0087-0.
Omboni S, Verberk WJ. Opportunistic screening of atrial fibrillation by automatic blood pressure measurement in the community. British Medical Journal Open. 2016;6:e010745. doi:10.1136/bmjopen-2015-010745.
Stergiou GS, Karpettas N, Protogerou A, et al. Diagnostic accuracy of a home blood pressure monitor to detect atrial fibrillation. J Hum Hypertens. 2009;23:654-8. doi:10.1038/jhh.2009.5.
Wiesel J, Arbesfeld B, Schechter D. Comparison of the Microlife blood pressure monitor with the Omron blood pressure monitor for detecting atrial fibrillation. American Journal of Cardiology. 2014;114:1046-8. doi:10.1016/j.amjcard.2014.07.016.
Wiesel J, Fitzig L, Herschman Y, Messineo FC. Detection of atrial fibrillation using a modified microlife blood pressure monitor. American journal of hypertension. 2009;22:848-52. doi:10.1038/ajh.2009.98.
Wiesel J, Salomone TJ. Screening for Atrial Fibrillation in Patients >/=65 Years Using an Automatic Blood Pressure Monitor in a Skilled Nursing Facility. American Journal of Cardiology. 2017;120:1322-4. doi:10.1016/j.amjcard.2017.07.016.
2.2.2.3.
Jaakkola J, Jaakkola S, Lahdenoja O, et al. Mobile Phone Detection of Atrial Fibrillation With Mechanocardiography: The MODE-AF Study (Mobile Phone Detection of Atrial Fibrillation). Circulation. 2018;137:1524-7. doi:10.1161/circulationaha.117.032804.2.2.2.4.
Couderc J-P, Kyal S, Mestha LK, et al. Detection of atrial fibrillation using contactless facial video monitoring. Heart Rhythm. 2015;12:195-201.
Dautov R, Savur C, Tsouri G. On the Effect of Face Detection on Heart Rate Estimation in Videoplethysmography. 2018 IEEE Western New York Image and Signal Processing Workshop (WNYISPW). Rochester, NY, USA, 2018, pp. 1-5, doi:10.1109/wnyipw.2018.8576439.
Takano C, Ohta Y. Heart rate measurement based on a time-lapse image. Medical Engineering & Physics-Journal. 2007;29:853-7.
Tsouri GR, Li Z. On the benefits of alternative color spaces for noncontact heart rate measurements using standard red-green-blue cameras. Journal of Biomedical Optics. 2015;20:48002.
Turakhia MP. Diagnosing With a Camera From a Distance-Proceed Cautiously and Responsibly. JAMA Cardiology. 2020;5(1):107. doi/10.1001/jamacardio.2019.4572.
Verkruysse W, Svaasand LO, Nelson JS. Remote plethysmographic imaging using ambient light. Optics Express. 2008;16:21434-45.
Yan BP, Lai WHS, Chan CKY, et al. High-Throughput, Contact-Free Detection of Atrial Fibrillation From Video With Deep Learning. Journal of the American Medical Association Cardiology. 2020;5:105-7. doi:10.1001/jamacardio.2019.4004.
Yan BP, Lai WHS, Chan CKY, et al. Contact-Free Screening of Atrial Fibrillation by a Smartphone Using Facial Pulsatile Photoplethysmographic Signals. Journal of the American Heart
Association. 2018;5(7):e008585. doi:10.1161/JAHA.118.008585.
2.2.2.5.
Chan J, Rea T, Gollakota S, Sunshine JE. Contactless cardiac arrest detection using smart devices. NPJ Digital Medicine. 2019;2:52. doi:10.1038/s41746-019-0128-7.
Wang A, Sunshine JE, Gollakota S. Contactless infant monitoring using white noise. https://homes.cs.washington.edu/~gshyam/Papers/whitenoise.pdf.
3. Мобильные технологии mHEALTH для контроля аритмий
Как правило, большинство пациентов с симптомами учащенного сердцебиения и головокружением обследуются с использованием различных мобильных технологий, подробно рассматриваемых в Разделе 2.1 (Steinberg 2017). Устройства, способные регистрировать, по крайней мере, одно отведение ЭКГ, позволяют клиницисту, интерпретирующему запись, различать ритмы с широким и узким комплексом QRS, эпизоды брадикардии и тахикардии и, таким образом, разграничивать различные подлежащие аритмии. Кроме того, смарт-технологии могут быть полезны в педиатрической практике (Gropler 2018).
3.1. Фибрилляция предсердий
Данная патология нередко является интермиттирующей и может протекать бессимптомно, что приводит к несвоевременной постановке диагноза (McCabe 2015, Strickberger 2005, Verma 2013) и, в дальнейшем, к неверной оценке аритмической нагрузки (Boriani 2015, Garimella 2015), тем самым увеличивая риск осложнений у пациентов с нелеченной ФП. Новые цифровые технологии здравоохранения и сенсорные устройства имеют хороший потенциал в отношении раннего выявления ФП, открывая возможности для скрининга, который затем может сопровождаться контролем аритмии на основе фактически зарегистрированных данных. Мобильные технологии могут быть адресованы различным группам пациентов: скрининг в общей популяции, ведение пациентов с уже диагностированной ФП, оценка ответа на проводимое лечение, контроль сопутствующих заболеваний и модификация образа жизни (Раздел 4) (рис. 5). В целом, технологии мобильного здравоохранения могут облегчить понимание взаимосвязи между бременем ФП, ее прогрессированием и риском сердечно-сосудистых осложнений (Wong 2018).
3.1.1. Выявление недиагностированной ФП
Классические эпидемиологические данные указывают на то, что ранняя диагностика улучшает выявляемость ФП и, вероятно, способствует снижению показателей летальности. (1) Известно, что наличие ФП ассоциируется с 5-кратным увеличением риска инсульта (Wolf 1991) и удвоением смертности (Kirchhof 2016); (2) Кроме того, распространенность недиагностированной ФП составляет не <1,5% для пациентов старше 65 лет (Orchard 2018); (3) Примерно у четверти пациентов, перенесших инсульт вследствие ФП, нарушения мозгового кровообращения являются первым проявлением аритмии (Friberg 2014), в то время как у других пациентов с ФП сначала развивается застойная СН; (4) Риск инсульта не зависит от симптомов и остается одинаково высоким для любого типа ФП (Xiong 2015); (5) Диагностика аритмии часто требует повторного или длительного мониторинга ЭКГ; в то время как (6) пероральные антикоагулянты (ОАК) высокоэффективны в снижении риска кардиоэмболического инсульта, смертности и, возможно, деменции у пациентов с ФП (Ding 2018, Friberg 2018).
Выявление ФП зависит от факторов, связанных с самой аритмией, т.е. комбинации распространенности и плотности ФП (Charitos 2012), а также от факторов, связанных с детекцией аритмии, таких как частота и продолжительность мониторинга и выполнения диагностических тестов (Ramkumar 2018). В нескольких исследованиях с участием пациентов с различными факторами риска (ФР) инсульта использовались технологии mHealth для выявления недиагностированной ФП (табл. 2, 3), но, как правило, в подобной ситуации может потребоваться подтверждение ЭКГ в качестве золотого стандарта диагностики.
Литература/References
Berge T, Lyngbakken MN, Ihle-Hansen H, et al. Prevalence of atrial fibrillation and cardiovascular risk factors in a 63-65 years old general population cohort: the Akershus Cardiac Examination (ACE) 1950 Study. BMJ Open. 2018;8:e021704.
Chan PH, Wong CK, Poh YC, et al. Diagnostic Performance of a Smartphone-Based Photoplethysmographic Application for Atrial Fibrillation Screening in a Primary Care Setting. Journal of the American Heart Association. 2016 Jul 21;5(7):e003428. doi:10.1161/ JAHA.116.003428.
Doliwa Sobocinski P, Angg?rdh Rooth E, Frykman Kull V, et al. Improved screening for silent atrial fibrillation after ischaemic stroke. Europace. 2012(14):1112-6. doi:10.1093/europace/eur431.
Engdahl J, Andersson L, Mirskaya M, Rosenqvist M. Stepwise screening of atrial fibrillation in a 75-year-old population: implications for stroke prevention. Circulation. 2013;127:930-7.
Guo Y, Wang H, Zhang H, et al.; MAFA II Investigators. Mobile Photoplethysmographic Technology to Detect Atrial Fibrillation. Journal of the American College of Cardiology. 2019;74:2365-75. doi:10.1016/j.jacc.2019.08.019.
Halcox JPJ, Wareham K, Cardew A, et al. Assessment of Remote Heart Rhythm Sampling Using the AliveCor Heart Monitor to Screen for Atrial Fibrillation: The REHEARSE-AF Study. Circulation. 2017;136:1784-94. doi:10.1161/circulationaha.117.030583.
Heckbert SR, Austin TR, Jensen PN, et al. Yield and consistency of arrhythmia detection with patch electrocardiographic monitoring: The Multi-Ethnic Study of Atherosclerosis. Journal of Electrocardiology. 2018;51:997-1002. doi:10.1016/j.jelectrocard.2018.07.027.
Kaasenbrood F, Hollander M, de Bruijn SH, et al. Opportunistic screening versus usual care for diagnosing atrial fibrillation in general practice: a cluster randomised controlled trial. British Journal of General Practice. 2020;70(695):e427-e433. doi:10.3399/bjgp20X708161.
Kemp Gudmundsdottir K, Fredriksson T, Svennberg E, et al. Stepwise mass screening for atrial fibrillation using N-terminal B-type natriuretic peptide: the STROKESTOP II study. Europace. 2020;22:24-32. doi:10.1093/europace/euz255.
Lowres N, Neubeck L, Salkeld G, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thrombosis & Haemostasis. 2014;111:1167-76. doi:10.1160/th14-03-0231.
Perez MV, Mahaffey KW, Hedlin H, et al.; Apple Heart Study Investigators. Large-Scale Assessment of a Smartwatch to Identify Atrial Fibrillation. New England Journal of Medicine. 2019;381:1909-17. doi:10.1056/NEJMoa1901183.
Rooney MR, Soliman EZ, Lutsey PL, et al. Prevalence and Characteristics of Subclinical Atrial Fibrillation in a Community-Dwelling Elderly Population: The ARIC Study. Circulation: Arrhythmia and Electrophysiology. 2019;12(10):e007390. doi:10.1161/CIRCEP.119.007390.
Steinhubl SR, Waalen J, Edwards AM, et al. Effect of a Home-Based Wearable Continuous ECG Monitoring Patch on Detection of Undiagnosed Atrial Fibrillation: The mSToPS Randomized Clinical Trial. Journal of the American Medical Association. 2018;320:146-55.
Svennberg E, Engdahl J, Al-Khalili F, et al. Mass Screening for Untreated Atrial Fibrillation: The STROKESTOP Study. Circulation. 2015;131:2176-84.
Tavernier R, Wolf M, Kataria V, et al. Screening for atrial fibrillation in hospitalised geriatric patients. Heart. 2018;104:588-93. doi:10.1136/heartjnl-2017-311981.
Tieleman RG, Plantinga Y, Rinkes D, et al. Validation and clinical use of a novel diagnostic device for screening of atrial fibrillation. Europace. 2014;16:1291-5.
Turakhia MP, Ullal AJ, Hoang DD, et al. Feasibility of extended ambulatory electrocardiogram monitoring to identify silent atrial fibrillation in high-risk patients: the Screening Study for Undiagnosed Atrial Fibrillation (STUDY-AF). Clinical Cardiology. 2015(38):285-92. doi:10.1002/clc.22387.
Точность диагностических методов
Положительная прогностическая ценность выявления события ФП по данным портативного устройства будет различаться в зависимости от предтестовой вероятности ФП в данной популяции (например, у лиц с установленным диагнозом или одним или несколькими ФР). Это особенно справедливо для “здоровых лиц”, ранее не имевших признаков заболеваний. Многие технологии для выявления ФП в настоящее время широко доступны, и ими могут воспользоваться люди без сердечно-сосудистых заболеваний (ССЗ), поэтому они не рассматриваются как индивидуальные интервенционные вмешательства или проекты общественного здравоохранения. Скорее, потребители, владеющие этими технологиями, такими как умные часы или подключенные к смартфону регистраторы ЭКГ, сами предпочитают использовать эти технологии. Следовательно, идентификация ФП по инициативе потребителей — это не то же самое, что скрининг ФП по инициативе здравоохранения. Выявление ФП с помощью подобных устройств требует подтверждения, т.к. эти инструменты скрининга ФП имеют различную специфичность (табл. 2), что повышает вероятность высокого уровня ложноположительных результатов в популяции с низкой распространенностью заболевания и, тем самым, увеличивает риски ненужного лечения.
Как описано в недавних систематических обзорах (Giebel 2019, Lowres 2019, O’Sullivan 2020), было проведено почти 500 исследований по оценке точности технологий мобильного здравоохранения в отношении скрининга ФП. Их возможности варьировались в зависимости от используемых технологий, условий и исследуемых групп. Недавно также сообщалось о двух крупномасштабных скрининговых исследованиях по данной тематике (см. Раздел 6).
Клинические исходы
До настоящего времени не проводилось крупных исследований результатов скрининга ФП, детектированной по данным мобильных устройств, и также не были проанализированы значимые сердечно-сосудистые исходы (включая инсульты и летальные исходы).
Несмотря на то, что случайная диагностика ФП во время скрининга, по-видимому, ассоциируется с повышением риска инсульта и сопровождается назначением антикоагулянтной терапии (Freedman 2016, Martinez 2014, Tsivgoulis 2019), клинические исследования в отношении роли мобильных технологий в выявлении аритмии еще не завершены и до сих пор продолжаются (Gudmundsdottir 2019, Steinhubl 2018, Svennberg 2015, Heartline study https://www.heartline.com). Текущие исследования направлены главным образом на подтверждение того факта, что ФП в ходе скрининга может обнаруживаться у пациентов с исходно низким риском осложнений, поэтому требуется тщательная переоценка показаний к антикоагулянтной терапии, исходя из предполагаемой эффективности профилактики и соотношения риск/польза. Это необходимо делать до выдачи каких-либо рекомендаций. (В настоящее время еще нет единого мнения о том, как лечить эти аритмии, даже у пациентов с высокими показателями по шкале CHA2DS2-VASc).
Европейские и американские рекомендации действительно регламентируют направленный скрининг для раннего выявления недиагностированной ФП у пациентов в возрасте ?65 лет (Freedman 2017, January 2019, Kirchhof 2016). С другой стороны, Ра — бочей группой по профилактике в США в настоящее время не установлено достаточно убедительных рекомендаций по систематическому скринингу ФП с помощью ЭКГ, зарегистрированной мобильными устройствами (Jonas 2018).
3.1.2. Целенаправленный скрининг ФП у лиц с высоким риском
Криптогенный инсульт/Транзиторная ишемическая атака
Около трети всех ишемических инсультов ассоциируются с эмболией головного мозга, развивающейся на фоне ФП (Hannon 2010). Кроме того, риск рецидива тромбоэмболии очень высокий, если ФП не выявляется и не лечится (Furie 2012, KolominskyRabas 2001). Следовательно, важно проводить длительный мониторинг ритма, направленный на поиск ФП у пациентов, перенесших инсульт (January 2019, Kirchhof 2016, Schnabel 2019). Частота выявления ФП в постинсультном периоде неодинакова и зависит не только от типа используемого устройства для мониторинга и продолжительности периода наблюдения, но также от формы перенесенного инсульта и приверженности пациента к выбранной тактике ведения (Kishore 2014, Sanna 2014, Zungsontiporn 2018). Недавний метаанализ продемонстрировал, что поэтапный подход к выявлению ФП у пациентов, перенесших инсульт, способствует обнаружению аритмии у 23,7% пациентов (Sposato 2015), в то время как комбинированный анализ двух рандомизированных клинических исследований (РКИ) и двух обсервационных исследований показал снижение частоты случаев повторного инсульта на 55% после длительного мониторинга ритма сердца и коррекции тактики лечения на фоне полученных данных (Tsivgoulis 2019). Однако оптимальный порог продолжительности ФП для принятия решения о начале антикоагуляции в настоящее время неизвестен и может быть более низким в популяции пациентов, перенесших инсульт, по сравнению с теми, кто имеет меньше ФР ССЗ (Kaplan 2019).
При развитии ESUS остается крайне высоким риск недиагностированной ФП, которая могла послужить причиной развития осложнений. В настоящее время проведено много исследований, оценивающих эффективность эмпирической терапии новыми ОАК по сравнению с антиагрегантной терапией в условиях, когда для старта терапии доказательство наличия ФП не требуется. При этом два из этих исследований, NAVIGATE ESUS (Hart 2018) и RESPECT-ESUS (Diener 2018), не доказали снижения частоты повторных инсультов у пациентов, получающих новые ОАК. Следует подчеркнуть, что простое обнаружение ФП после перенесенного эмболического инсульта неясной этиологии не обязательно является доказательством положительной причинно-следственной связи. Третье крупное исследование продолжается в настоящий момент и включает пациентов с предполагаемой миопатией предсердий (увеличенные размеры предсердия, повышенный уровень NT-proBNP или уширение зубцов P по ЭКГ) (Kamel 2019).
Эти результаты подчеркивают необходимость выявления ФП до начала терапии ОАК у пациентов с ESUS, церебральными эмболиями неясной этиологии или ишемическим инсультом известного происхождения, а технологии мобильного здравоохранения могут облегчить диагностический поиск в подобных ситуациях (Zungsontiporn 2018). При этом порог аритмической нагрузки на фоне ФП может очень сильно различаться у пациентов, предположительно имеющих кардиоэмболический механизм инсульта, и у лиц без анамнеза тромботических событий (Kaplan 2019).
Остальные пациенты из группы высокого риска
Ключевую роль в повышении эффективности выявления и идентификации ФП на ранних стадиях или в доклиническом периоде играет целенаправленный отбор пациентов с повышенной вероятностью наличия недиагностированной ФП, а не сплошной скрининг в общей популяции. Так как в настоящее время часто применяются портативные электронные устройства (включая приложения для смартфонов или часы), их вполне можно использовать в качестве мобильных регистраторов и осуществлять кратковременную регулярную (например, 30-секундную) запись ЭКГ на протяжении продолжительного периода времени. Подобные устройства особенно хорошо подходят для регистрации пароксизмальных нарушений ритма, которые возникают непостоянно, однако вполне вероятно, что потребуется частая активация функции записи периодических приступов аритмии, и даже при ежедневном “моментальном” мониторинге ЭКГ возможно пропустить информацию почти по половине эпизодов ФП (Charitos 2012, Yano 2016). Общая аритмическая нагрузка (“бремя ФП”), которая все чаще признается мощным независимым предиктором инсульта (Chen 2018), хотя и точно измеряется имплантированными устройствами (Varma 2005), не может быть с уверенностью рассчитана на основании прерывистой регистрации ЭКГ. Использование умных часов с пассивным периодическим наблюдением посредством ФПГ с ЭКГ-подтверждением может быть более эффективным инструментом скрининга ФП, но перспективы данного метода в настоящее время только предстоит изучить (Heartline Study https://www.heartline.com).
По данным статистики, мобильный скрининг ЭКГ, проведенный надлежащим образом, гораздо чаще выявляет клинически значимые случаи впервые диагностированной ФП, по сравнению с методикой регистрации офисной ЭКГ (табл. 3). Значимость выявления аритмии увеличивается в присутствии ФР, таких как пожилой возраст и высокий балл по шкале CHA2DS2-VASc. В нескольких исследованиях (Chan 2017, Chan 2017a, Proietti 2016) был проведен скрининг ФП на примере случайных групп населения, что способствовало выявлению впервые диагностированной ФП в менее чем 1% наблюдений. Но при направленном поиске аритмии среди лиц пожилого возраста (75-76 лет), имеющих более высокий риск, результаты шведских исследований демонстрируют выявление новых случаев ФП у 3% участников, тогда как при более строгом учете дополнительных ФР (помимо возраста) частота выявляемости возрастает до 7,4% (Engdahl 2013, Gudmundsdottir 2019, Svennberg 2015). По данным метаанализа Lowres, et al. (2019), распространение ФП прогрессивно увеличивается с возрастом: данный показатель составляет 0,34% для лиц моложе 60 лет и достигает уровня 2,73% в возрастной группе старше 85 лет. Важно отметить, что количество пациентов, которых нужно направить на скрининг для выявления ФП, которая требует назначения антикоагулянтной терапии, составляет 1089 для лиц моложе 60 лет, в то время как в возрастной группе старше 65 лет данный показатель значительно меньше — 83 человека.
Таблица 3
Характеристика отдельных скрининговых исследований новых мобильных технологий в лечении ФП


Сокращения: АГ — артериальная гипертензия, ТИА — транзиторная ишемическая атака, ТП — трепетание предсердий, ФПГ — фотоплетизмография, ФП — фибрилляция предсердий, ЭКГ — электрокардиограмма.
3.1.3. Диагностика у лиц с ранее известной ФП
Мобильные технологии имеют важное значение для выбора тактики ведения пациентов с уже диагностированной ФП. С помощью длительного непрерывного или периодического мониторинга ЭКГ можно оценить некоторые ключевые характеристики ФП, которые могут играть важную роль в лечении пациентов.
Более того, несмотря на то, что в нескольких работах удалось продемонстрировать неплохую чувствительность и специфичность новых устройств для обнаружения ФП, на сегодняшний день ни одно исследование не было направлено на оценку клинической пользы мобильного здравоохранения в отношении влияния на исходы пациентов. Подобным вопросам будет посвящено текущее исследование iPhone, помогающее оценить ритм ФП с помощью мобильных технологий (iHEART), представляющее собой одноцентровое проспективное контролируемое РКИ, а также исследование Heartline (Caceres 2019, Hickey 2016, https://www.heartline.com).
3.1.4. Лечение ФП
Бремя ФП
В настоящее время действующие рекомендации по антикоагулянтной терапии основаны преимущественно на наличии ФР и факте подтвержденного диагноза клинической ФП, независимо от продолжительности, симптомности или тяжести аритмии (January 2019). Данный подход действует, даже если ФП длительное время оставалась бессимптомной или полностью исчезла в результате реализации стратегии контроля ритма, включая антиаритмические препараты, катетерную аблацию или модификацию ФР (January 2019). Однако появляются данные, что объем аритмической нагрузки (бремя ФП) имеет значение: к примеру, предполагается, что пароксизмальные эпизоды могут иметь меньший риск тромбоэмболии, чем стойкая ФП (Chen 2018). Это предположение было основано на данных непрерывного мониторинга с помощью ИЭУ, которые отображают эпизоды ФП с высокой степенью детализации. Контрольные показатели аритмологической нагрузки “число дней ФП” изменились и в настоящее время включают более широкие параметры: совокупное бремя аритмии (часы/дни) и ее плотность (частота регистрации приступов ФП в ходе наблюдения) (Varma 2005). Эти показатели, вероятно, будут иметь важное значение для определения тактики при выявлении ФП, обнаруженной мобильными устройствами.
Имплантируемые электронные устройства
Понятие аритмической нагрузки (бремя ФП) можно охарактеризовать как процент времени нахождения на нерегулярном ритме (на фоне общего времени мониторинга), с учетом наибольшей продолжительности и плотности ФП. Данные, зарегистрированные с помощью ИЭУ, дают представление о естественном течении ФП и потенциально возможных последствиях аритмии (Healey 2012, Kaplan 2019, Van Gelder 2017, Varma 2005). В связи с этим проводились исследования по применению ОАК в целях предотвращения инсульта, основываясь на длительности эпизодов зарегистрированной ФП (Lopes 2017, Martin 2015). Полученные данные позволяют предположить, что существует определенный порог, ниже которого риск тромбоэмболического инсульта остается невысоким, а предполагаемое соотношение риск/польза может не оправдывать хроническое назначение ОАК. Так, анализ информации, зарегистрированной ИЭУ показывает, что короткие субклинические эпизоды ФП сопровождаются меньшим риском, чем более продолжительные (и, следовательно, с большей вероятностью симптомные) события (Al-Turki 2019). Детектируемые устройством “субклинические” эпизоды частого предсердного ритма продолжительностью от 6 мин до 24 ч ассоциируются с повышением риска инсульта, но при этом абсолютный риск значительно ниже, чем можно было ожидать, если исходить только из имеющихся ФР (Glotzer 2003, Healey 2012, van Gelder 2017). Вопрос, требуется ли антикоагулянтная терапия лицам из группы высокого риска, остается предметом текущих исследований и до конца не ясен (Kirchof 2017, Lopes 2017, van Gelder 2017). Важно отметить, что очень короткие эпизоды ФП (начало и завершение которых регистрировались в пределах одной строки записи эндограммы) не ассоциировались с неблагоприятными исходами (Swiryn 2016), что может быть важно для обоснования мониторинга, основанного на технологиях мобильного здравоохранения.
Технологии мобильного здравоохранения
Выявление ФП с помощью цифровых мобильных технологий позволяет получить дополнительную информацию о пациентах без показаний для имплантации устройств. Тактика mHealth расширяет возможности скрининга ФП для более молодых пациентов без ССЗ, у которых тромбоэмболический риск может быть низким. Тем не менее, у пациентов с высокой аритмической нагрузкой (определяемой как общий процент времени ФП ?11,4%; средняя продолжительность 11,7 ч), выявленной при 14-суточном беспроводном мониторировании ЭКГ, частота тромбоэмболических событий была выше по сравнению с теми, у кого бремя ФП было более низким (Go 2018). В настоящее время нет единого мнения по лечению пациентов с ФП, детектированной по данным имплантированных устройств, в плане использования антикоагулянтной терапии (Perino 2019). Это может быть связано с отсутствием клинической определенности в отношении оптимальной точки отсчета длительности эпизода ФП для назначения ОАК, даже несмотря на то, что данные регистров показывают, что прием антикоагулянтов способствует снижению риска инсульта для пароксизмов аритмии продолжительностью >24 ч и, возможно, для случаев регистрации ФП продолжительностью 6-24 ч (Perino 2019).
Таким образом, пока достоверно не разработано валидированных контрольных точек исследования или моделей риска, которые учитывали бы объем бремени ФП в ходе принятия решений относительно методов профилактики инсульта.
Имеющиеся ключевые нерешенные вопросы:
- Предстоит определить основные категории (продолжительность, количество эпизодов/плотность аритмии) и ФР, которые определяют решение о применении антикоагулянтов при ФП, обнаруженной с помощью мобильных электронных устройств.
Стратегии контроля ритма и контроля ЧСС
- Контроль ритма. Пока проводятся исследования по изучению роли и сроков назначения ОАК при ФП, обнаруженной с помощью мобильных электронных устройств, первое выявление подобной аритмии должно инициировать длительный мониторинг ЭКГ для оценки сохранения нормального синусового ритма, продолжительности интервала QT (важно для пациентов, получающих некоторые антиаритмические препараты (Garebelli 2016)) и обсуждение возможностей коррекции ФР ССЗ и модификации образа жизни, поскольку ФП сосуществует с сопутствующими заболеваниями, которые могут способствовать возникновению приступов и влиять на естественное течение аритмии (см. Раздел 4). Доказано, что снижение потребления алкоголя, лечение обструктивного апноэ сна, умеренные физические упражнения и снижение веса достоверно уменьшают степень аритмической нагрузки и улучшают контроль симптомов у пациентов с ФП (Congrete 2018, Kanagala 2003, Pathak 2015, Voskoboinik 2020).
- Контроль ЧСС. Хотя основной целью контроля ЧСС является минимизация симптомов, связанных с ФП, продолжительная тахикардия может привести к снижению толерантности к физической нагрузке и/или формированию тахииндуцированной кардиомиопатии, в то время как чрезмерно низкие целевые значения сердечного ритма могут увеличить риск брадиаритмий, которые также могут сопровождаться симптомами и потенциально потребовать имплантации устройства. Европейское общество кардиологов (ЕОК) рекомендует мягкие целевые значения ЧСС для пациентов с ФП в состоянии покоя (<100-110 уд./ мин), тогда как американские рекомендации ACC/AHA/HRS позиционируют более строгий контроль ЧСС с целевыми значениями в пределах <80 уд./мин. Часто целевые показатели устанавливаются индивидуально для каждого пациента на основании выраженности симптомов, наличия или предрасположенности к формированию осложнений, прежде всего признаков хронической сердечной недостаточности (ХСН). В данном случае мобильные технологии можно использовать для оценки частоты желудочковых сокращений на фоне ФП в рамках длительного мониторинга ритма, а также с целью контроля эффективности терапии, направленной на поддержание целевого уровня ЧСС (Kirchof 2016, January 2019).
3.2. Внезапная сердечная смерть
(См. также Раздел 4.1. Ишемическая болезнь сердца)
Желудочковые аритмии
Возможности мобильного здравоохранения для диагностики желудочковых аритмий используются значительно реже, чем, к примеру, в лечении пациентов с ФП (Раздел 3.1). В литературе есть сообщения о детекции симптомных ЖТ с помощью кардиомонитора AliveCor (AliveCor, Сан-Франциско, США) и устройства SmartWatch (Ringwald 2019, Waks 2015). Сложный автоматический анализ 2-минутной записи ФПГ камерой коммерческого смартфона (iPhone 4S, Apple) позволяет отличить ФП, ПЭ и ЖЭ от синусового ритма с высокой чувствительностью (0,733) и специфичностью (0,976 для ЖЭ) (Chong 2015, McManus 2016). Диагностика ЖЭ может быть затруднена для устройств, основанных на принципе ФПГ, т.к. преждевременные эктопические желудочковые сокращения могут сопровождаться снижением перфузии, и при аппаратной регистрации пульсовой волны возможны ошибки (Billet 2019). Следовательно, контроль записи ЭКГ в любом случае необходим для облегчения диагностики ритма и предотвращения ошибочной классификации “медленной частоты пульса при ФПГ” (брадисфигмии) просто как “брадикардии”.
Синкопальные состояния
Ведение пациентов с синкопами остается нерешенной проблемой в сфере мобильного здравоохранения. В то время как длительный амбулаторный мониторинг с использованием медицинских устройств (носимых и имплантируемых) является основой диагностики сердечного ритма во время синкопальных эпизодов, активируемые пользователем системы должны либо активироваться пациентом во время продромальных симптомов (если есть и позволяет время), либо иметь циклическую запись, позволяющую регистрировать ЭКГ в постсинкопальном периоде (Steinberg 2017). Но данная возможность не реализована в популярных в настоящее время носимых устройствах, распространенных на потребительском уровне. Тем не менее, контролируемое РКИ AliveCor, сравнивающее мобильный мониторинг с обычным лечением у участников с учащенным сердцебиением или пресинкопе, продемонстрировало лучшую и более быструю частоту выявления симптоматических аритмий в группе вмешательства, предполагая, что, по крайней мере, при развитии пресинкопальных состояний, детекция ритма, активированная пациентом при помощи имеющихся в продаже электронных устройств, имеет ценное значение (Reed 2019). Выявленные события, сообщаемые мобильными устройствами, которые основываются на анализе ЧСС, вероятно, потребуют дальнейшей медицинской оценки и валидации, с регистрацией ЭКГ во время эпизода аритмии.
Часто могут выявляться схожие причины для преходящей потери сознания и механических падений при ортостатической гипотензии, неврологических или ортопедических проблемах. Особенно выраженные последствия это имеет у пожилых пациентов, но при этом нередко данные эпизоды остаются незарегистрированными (Davis 2010, Heinrich 2010). Мобильные приложения, которые объединяют функции анализа мониторинга сердечного ритма вместе с фиксацией эпизодов падений, определения местоположения по GPS, видеозаписи с отображением окружающей обстановки пациента и возможностью отправки сигналов, инициируемых пациентом в случае появления симптомов или автоматически в случае обнаружения падений, могут иметь крайне важное значение.
Внезапная остановка сердца
Диагностика внезапной остановки сердца (ВОС) и своевременная реакция на нее — это та сфера применения, в которой приложения мобильного здравоохранения могут спасти жизнь пациента. Поскольку неотложное проведение лечебных мероприятий при остановке сердца достоверно ассоциируется с улучшением выживаемости, превентивное выявление лиц из группы риска, качественная детекция ЭКГ с возможностью своевременного обнаружения остановки сердечной деятельности, оповещение находящихся поблизости прохожих и профессиональных специалистов по оказанию первой помощи, а также обучение принципам сердечно-легочной реанимации (СЛР) и контроль качества выполнения реанимационных мероприятий должны в полной мере быть реализованы в сфере мобильного здравоохранения, особенно в тех социальных группах, где мобильные смартфоны распространены повсеместно.
Прогностическое значение
Возможно, что электронные мобильные устройства, которые непрерывно отслеживают сердечный ритм и другие физиологические данные, смогут лучше прогнозировать вероятную ВОС, даже с использованием показателей, которые ранее не демонстрировали достаточной специфичности или чувствительности при периодических измерениях, к примеру, вариабельность сердечного ритма (Lee 2016). Однако подобный непрерывный мониторинг уже присутствует в ИЭУ, но пока не получено достоверных доказательств его прогностической ценности и значимого клинического преимущества (Au-Yeung 2018). Таким образом, прогнозирование вероятности жизнеугрожающих осложнений и ВОС с помощью технологий мобильного здравоохранения остается перспективным проектом, который еще только предстоит реализовать.
Отправка уведомлений и способы реагирования
При остановке сердечной деятельности необходимо обеспечить ее неотложную диагностику с немедленным оповещением служб экстренной помощи. Носимые устройства, которые сочетают в себе возможности мониторинга основных физиологических функций, передачу данных по GPS и сотовую связь для взаимодействия с экстренными службами, хорошо подходят для обеспечения почти мгновенного оповещения, а также передачи информации о местоположении пациента (Kwon 2019, Praveen 2019). Ранее устройства, использующие пьезоэлектрический датчик для обнаружения пульса, могли отправлять экстренные предупреждения в систему неотложной медицинской помощи или другим службам реагирования, если детекция пульса внезапно прекращалась, а часы (и, следовательно, их владелец) оставались неподвижными (Rickard 2011). Предварительные результаты показывают, что интеллектуальные динамики в бытовых электронных смарт-устройствах возможно обучить детекции паттернов агонального дыхания с целью своевременной диагностики терминальных состояний, в т.ч. внезапной сердечной смерти (ВСС) (Chan J 2019). Но обсуждать потенциальные преимущества данных алгоритмов пока преждевременно, и в дальнейшем потребуются более крупные исследования возможностей мобильных решений для пациентов с повышенным риском ВСС.
Повсеместное распространение мобильных телефонов на современном этапе дает возможность более быстрого уведомления служб экстренной помощи в случае неотложных ситуаций. В ходе контакта с диспетчером возможен более полноценный сбор информации о происходящем от очевидцев события с последующим их инструктированием и коррекцией действий по оказанию неотложной помощи и СЛР. Внедрение данного принципа реагирования позволяет значимо улучшить клинические исходы при различных чрезвычайных ситуациях (Wu 2012). Кроме того, мобильные устройства способны подавать различные сигналы с целью уведомления окружающих, находящихся в непосредственной близости от пациента с остановкой сердца. Слепое РКИ, проведенное в Стокгольме (Швеция), продемонстрировало, что использование подобных систем способствует увеличению частоты успешной СЛР, проводимой сторонними наблюдателями, оказавшимися рядом с пациентом в неотложной ситуации (Ringh 2015). Так, недавно проведено исследование, где в течение 18 мес. было включено почти 10 тыс. добровольцев, которых обучали пользоваться мобильными приборами, способными отправлять уведомления. Но за весь период наблюдения было проведено только 667 активаций устройства, что говорит о низком уровне использования данной технологии участниками исследования, даже после получения сигналов предупреждения по мобильному телефону.
Независимо от того, с кем осуществляется связь по мобильному устройству в неотложной ситуации (обученный профессионал или сторонний очевидец без навыков оказания неотложной помощи), подобные технологии также могут быть полезны для предоставления голосовых (или видео) инструкций от диспетчера или от самого устройства. Изучение эффективности подходов с использованием предварительно записанного аудио, видео в реальном времени или инструкций на основе анимации показало улучшение навыков населения в отношении проведения СЛР и использования автоматических наружных дефибрилляторов (АНД), хотя исследования в данной области продолжаются (Bolle 2009, Choa 2008, Merchant 2010, You 2008). Одним из возможных ограничений является отсутствие единых принципов регуляции работы подобных мобильных приложений, кроме того, в ряде моделей не реализованы алгоритмы базовой реанимационной помощи, и также они могут быть неудобны в использовании (Kalz 2014). Следует учитывать и возможные временные задержки начала СЛР и вызова службы экстренной помощи из-за отвлечения внимания спасателя на работу с мобильным приложением (Paal 2012).
Использование АНД при остановке сердца достоверно ассоциируется с улучшением выживаемости, но их применение в реальности остается низким (Weisfeldt 2010). Возможным выходом представляется использование мобильных приложений, которые могут показывать информацию по местоположению и правилам использования АНД. В этом направлении ведутся дальнейшие исследования, и было разработано несколько приложений, помогающих определять местоположение АНД в непосредственной близости от пользователя, хотя результаты при их тестовом использовании были неоднозначными (Sakai 2011, Hatakeyama 2018, Neves Briard 2019). Возможными ограничениями метода являются следующие факторы: точность данных местоположения АНД, размер базы пользователей мобильных приложений, интерфейс используемых приложений и недостаточно широкая распространенность их применения. Так, в настоящее время доступны только несколько приложений, тогда как единый утвержденный региональный, национальный или международный стандарт их использования отсутствует. В данной ситуации одним из возможных выходов является транспортировка АНД с помощью специальных беспилотных устройств к месту неотложной ситуации, где произошла остановка сердца. Этот подход, как ожидается, сократит время до дефибрилляции, особенно в сельской местности (Boutilier 2017), и при этом его реализация является выполнимой задачей, как продемонстрировано в недавнем исследовании (Claesson 2017).
Клинические исследования
Полная последовательность работы данного алгоритма с активацией мобильного приложения среди гражданских респондентов была протестирована в исследовании Heartrunner (Andelius 2020) в регионе с населением почти 2 млн человек. Результаты показали, что участники, в итоге проводившие первые реанимационные мероприятия при внегоспитальной остановке сердца, прибывали на место происшествия в 42% случаев раньше, чем службы экстренной помощи, что сопровождалось трехкратным увеличением числа случаев успешной дефибрилляции со стороны непрофессионалов, оказавшихся случайными свидетелями, и в дальнейшем также приводило к улучшению 30 дневной выживаемости пациентов. Данная тенденция была более заметной, когда время прибытия специализированных бригад неотложной помощи в чрезвычайной ситуации оказывалось более долгим, например, в сельской местности.
Литература/References
3.
Gropler MRF, Dalal AS, Van Hare GF, Silva JNA. Can smartphone wireless ECGs be used to accurately assess ECG intervals in pediatrics? A comparison of mobile health monitoring to standard 12-lead ECG. PLoS One. 2018;13:e0204403. doi:10.1371/journal.pone.0204403
Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Annals of Noninvasive Electrocardiology. 2017;22:e12447. doi:10.1111/anec.12447.
3.1.
Boriani G, Laroche C, Diemberger I, et al. Asymptomatic atrial fibrillation: clinical correlates, management, and outcomes in the EORP-AF Pilot General Registry. The American Journal of Medicine. 2015;128:509-18.e2.
Garimella RS, Chung EH, Mounsey JP, et al. Accuracy of patient perception of their prevailing rhythm: a comparative analysis of monitor data and questionnaire responses in patients with atrial fibrillation. Heart Rhythm. 2015;12:658-65.
McCabe PJ, Chamberlain AM, Rhudy L, DeVon HA. Symptom Representation and TreatmentSeeking Prior to Diagnosis of Atrial Fibrillation. Western Journal of Nursing Research. 2015;38:200-15.
Strickberger SA, Ip J, Saksena S, et al. Relationship between atrial tachyarrhythmias and symptoms. Heart Rhythm. 2005;2:125-31.
Verma A, Champagne J, Sapp J, et al. Discerning the incidence of symptomatic and asymptomatic episodes of atrial fibrillation before and after catheter ablation (DISCERN AF): a prospective, multicenter study. Journal of the American Medical Association Internal Medicine. 2013;173:149-56. doi:10.1001/jamainternmed.2013.1561.
Wong JA, Conen D, Van Gelder I, et al. Progression of device-detected subclinical atrial fibrillation and the risk of heart failure. Journal of the American College of Cardiology. 2018;71:2603-11.
3.1.1.
Charitos EI, Stierle U, Ziegler PD, et al. A comprehensive evaluation of rhythm monitoring strategies for the detection of atrial fibrillation recurrence: insights from 647 continuously monitored patients and implications for monitoring after therapeutic interventions. Circulation. 2012;126:806-14. doi:10.1161/CIRCULATIONAHA.112.098079.
Ding M, Qiu C. Atrial Fibrillation, Cognitive Decline, and Dementia: an Epidemiologic Review. Current Epidemiology Reports. 2018;5:252-61. doi:10.1007/s40471-018-0159-7.
Freedman B, Potpara TS, Lip GY. Stroke prevention in atrial fibrillation. Lancet. 2016;388:806-17. doi:10.1016/S0140-6736(16)31257-0.
Freedman B, Cann J, Calkins H, et al. A Report of the AF-SCREEN International Collaboration. Circulation. 2017;135; 1851-67.
Friberg L, Rosenqvist M. Less dementia with oral anticoagulation in atrial fibrillation. European Heart Journal. 2018;39:453-60. doi:10.1093/eurheartj/ehx579.
Friberg L, Rosenqvist M, Lindgren A, et al. High prevalence of atrial fibrillation among patients with ischemic stroke. Stroke. 2014;45:2599-605. doi:10.1161/STROKEAHA.114.006070.
Giebel GD, Gissel C. Accuracy of mHealth Devices for Atrial Fibrillation Screening: Systematic Review. JMIR Mhealth Uhealth. 2019;7:e13641. doi:10.2196/13641.
Gudmundsdottir K, Fredriksson T, Svennberg E, et al. Stepwise mass screening for atrial fibrillation using N-terminal B-type natriuretic peptide: the STROKESTOP II study. Europace. 2020;22:24-32. doi:10.1093/europace/euz255.
January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation. 2019;140:e125-e151. doi:10.1161/CIR.0000000000000665.
Jonas DE, Kahwati LC, Yun JDY, et al. Screening for Atrial Fibrillation With Electrocardiography: Evidence Report and Systematic Review for the US Preventive Services Task Force. Journal of the American Medical Association. 2018;320:485-98. doi:10.1001/jama.2018.4190.
Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Endorsed by the European Stroke Organisation (ESO). European Heart Journal. 2016;37:2893-962. doi:10.1093/eurheartj/ehw210.
Lowres N, Olivier J, Chao TF, et al. Estimated stroke risk, yield, and number needed to screen for atrial fibrillation detected through single time screening: a multicountry patient-level metaanalysis of 141,220 screened individuals. PLoS Med. 2019;16:e1002903. doi:10.1371/journal.pmed.1002903.
Martinez C, Katholing A, Freedman SB. Adverse prognosis of incidentally detected ambulatory atrial fibrillation. A cohort study. Thrombosis and Haemostasis. 2014;112:276-86.
Orchard JJ, Neubeck L, Freedman B, et al. Atrial Fibrillation Screen, Management And Guideline Recommended Therapy (AF SMART II) in the rural primary care setting: an implementation study protocol. British Medical Journal Open. 2018;8:e023130. doi:10.1136/bmjopen-2018-023130.
O’Sullivan JW, Grigg S, Crawford W, et al. Accuracy of Smartphone Camera Applications for Detecting Atrial Fibrillation: A Systematic Review and Meta-analysis. Journal of the American Medical Association Netw Open. 2020;3:e202064. doi:10.1001/jamanetworkopen.2020.2064.
Ramkumar S, Nerlekar N, D’Souza D, et al. Atrial fibrillation detection using single lead portable electrocardiographic monitoring: a systematic review and meta-analysis. British Medical Journal Open. 2018;8:e024178. doi:10.1136/bmjopen-2018-024178.
Steinhubl SR, Waalen J, Edwards AM, et al. Effect of a Home-Based Wearable Continuous ECG Monitoring Patch on Detection of Undiagnosed Atrial Fibrillation: The mSToPS Randomized Clinical Trial. Journal of the American Medical Association. 2018;320:146-55.
Svennberg E, Engdahl J, Al-Khalili F, et al. Mass Screening for Untreated Atrial Fibrillation: The STROKESTOP Study. Circulation. 2015;131:2176-84.
Tsivgoulis G, Katsanos AH, K?hrmann M, et al. Duration of Implantable Cardiac Monitoring and Detection ofAtrial Fibrillationin Ischemic Stroke Patients: A Systematic Review and MetaAnalysis. Journal of Stroke. 2019;21:302-11. doi:10.5853/jos.2019.01067.
Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. 1991;22:983-8.
Xiong Q, Proietti M, Senoo K, Lip GY. Asymptomatic versus symptomatic atrial fibrillation: A systematic review of age/gender differences and cardiovascular outcomes. International Journal of Cardiology. 2015;191:172-7. doi:10.1016/j.ijcard.2015.05.011.
https://www.heartline.com/.
3.1.2.
Chan NY, Choy CC. Screening for atrial fibrillation in 13122 Hong Kong citizens with smartphone electrocardiogram. Heart. 2017;103:24-31. doi:10.1136/heartjnl-2016-309993.
Chan PH, Wong CK, Pun L, et al. Head-to-Head Comparison of the AliveCor Heart Monitor and Microlife WatchBP Office AFIB for Atrial Fibrillation Screening in a Primary Care Setting. Circulation. 2017;135:110-2. doi:10.1161/CIRCULATIONAHA.116.024439.
Charitos EI, Stierle U, Ziegler PD, et al. A comprehensive evaluation of rhythm monitoring strategies for the detection of atrial fibrillation recurrence: insights from 647 continuously monitored patients and implications for monitoring after therapeutic interventions. Circulation. 2012;126:806-14. doi:10.1161/CIRCULATIONAHA.112.098079.
Chen LY, Chung MK, Allen LA, et al.; American Heart Association Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Quality of Care and Outcomes Research; and Stroke Council. Atrial Fibrillation Burden: Moving Beyond Atrial Fibrillation as a Binary Entity: A Scientific Statement From the American Heart Association. Circulation. 2018;137:e623-e644. doi:10.1161/CIR.0000000000000568.
Diener HC, Sacco RL, Easton JD, et al.; RE-SPECT ESUS Steering Committee and Investigators. Dabigatran for Prevention of Stroke after Embolic Stroke of Undetermined Source. New England Journal of Medicine. 2019;380:1906-17. doi:10.1056/NEJMoa1813959.
Engdahl J, Andersson L, Mirskaya M, Rosenqvist M. Stepwise screening of atrial fibrillation in a 75-year-old population: implications for stroke prevention. Circulation. 2013;127:930-7.
Furie KL, Goldstein LB, Albers GW, et al.; American Heart Association Stroke Council; Council on Quality of Care and Outcomes Research; Council on Cardiovascular Nursing; Council on Clinical Cardiology; Council on Peripheral Vascular Disease.Oral antithrombotic agents for the prevention of stroke in nonvalvular atrial fibrillation: a science advisory for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2012;43:3442-53. doi:10.1161/STR.0b013e318266722a.
Gudmundsdottir K, Fredriksson T, Svennberg E, et al. Stepwise mass screening for atrial fibrillation using N-terminal B-type natriuretic peptide: the STROKESTOP II study. Europace. 2020;22:24-32. doi:10.1093/europace/euz255.
Hannon N, Sheehan O, Kelly L, et al. Stroke associated with atrial fibrillation-incidence and early outcomes in the north Dublin population stroke study. Cerebrovascular Diseases. 2010;29:43-9. doi:10.1159/000255973.
Hart RG, Sharma M, Mundl H, et al. NAVIGATE ESUS Investigators. New England Journal of Medicine. 378, 2191-201. doi:10.1056/NEJMoa1802686.
January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation. 2019;140:e125-e151. doi:10.1161/CIR.0000000000000665.
Kamel H, Longstreth WT, Tirschwell DL, et al. The AtRial Cardiopathy and Antithrombotic Drugs In prevention After cryptogenic stroke randomized trial: Rationale and methods. International Journal of Stroke. 2019;14:207-14. doi:10.1177/1747493018799981.
Kaplan RM, Koehler J, Ziegler PD, et al. Stroke Risk as a Function of Atrial Fibrillation Duration and CHA2DS2-VASc Score. Circulation. 2019;140:1639-46. doi:10.1161/CIRCULATIONAHA.119.041303.
Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESCEndorsed by the European Stroke Organisation (ESO). European Heart Journal. 2016;37:2893-962. doi:10.1093/eurheartj/ehw210.
Kishore A, Vail A, Majid A, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and meta-analysis. Stroke. 2014;45:520-6. doi:10.1161/STROKEAHA.113.003433.
Kolominsky-Rabas PL, Weber M, Gefeller O, et al. Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence, and long-term survival in ischemic stroke subtypes: a population-based study. Stroke. 2001;32:2735-40.
Lowres N, Olivier J, Chao TF, et al. Estimated stroke risk, yield, and number needed to screen for atrial fibrillation detected through single time screening: a multicountry patient-level metaanalysis of 141,220 screened individuals. PLoS Medicine. 2019;16:e1002903. doi:10.1371/journal.pmed.1002903.
Proietti M, Mairesse GH, Goethals P, et al.; Belgian Heart Rhythm Week Investigators. A population screening programme for atrial fibrillation: a report from the Belgian Heart Rhythm Week screening programme. Europace. 2016;18:1779-86. doi:10.1093/europace/euw069.
Sanna T, Diener HC, Passman RS, et al.; CRYSTAL AF Investigators. Cryptogenic stroke and underlying atrial fibrillation. New England Journal of Medicine. 2014;370:2478-86. doi:10.1056/NEJMoa1313600.
Schnabel RB, Haeusler KG, Healey JS, et al. Searching for Atrial Fibrillation Poststroke: A White Paper of the AF-SCREEN International Collaboration. Circulation. 2019;140:1834-50. doi:10.1161/CIRCULATIONAHA.119.040267.
Sposato LA, Cipriano LE, Saposnik G, et al. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack: a systematic review and meta-analysis. Lancet Neurology. 2015;14:377-87. doi:10.1016/S1474-4422(15)70027-X.
Svennberg E, Engdahl J, Al-Khalili F, et al. Mass Screening for Untreated Atrial Fibrillation: The STROKESTOP Study. Circulation. 2015;131:2176-84. doi:10.1161/CIRCULATIONAHA.114.014343.
Tsivgoulis G, Katsanos AH, K?hrmann M, et al. Duration of Implantable Cardiac Monitoring and Detection of Atrial Fibrillationin Ischemic Stroke Patients: A Systematic Review and MetaAnalysis. Journal of Stroke. 2019;21:302-11. doi:10.5853/jos.2019.01067.
Varma N, Stambler B, Chun S. Detection of atrial fibrillation by implanted devices with wireless data transmission capability. Pacing and Clinical Electrophysiology. 2005;28(Suppl 1):S133-6.
Yano Y, Greenland P, Lloyd-Jones DM, et al. Simulation of Daily Snapshot Rhythm Monitoring to Identify Atrial Fibrillation in Continuously Monitored Patients with Stroke Risk Factors. PLoS One. 2016;11:e0148914. doi:10.1371/journal.pone.0148914.
Zungsontiporn N, Link MS. Newer technologies for detection of atrial fibrillation. British Medical Journal. 2018;363:k3946. doi:10.1136/bmj.k3946.
https://www.heartline.com/.
3.1.3.
Caceres BA, Hickey KT, Bakken SB, et al. Mobile Electrocardiogram Monitoring and HealthRelated Quality of Life in Patients With Atrial Fibrillation: Findings From the iPhone Helping Evaluate Atrial Fibrillation Rhythm Through Technology (iHEART) Study. The Journal of Cardiovascular Nursing. 2020;35(4):327-36. doi:10.1097/JCN.0000000000000646.
Hickey KT, Hauser NR, Valente LE, et al. A single-center randomized, controlled trial investigating the efficacy of a mHealth ECG technology intervention to improve the detection of atrial fibrillation: the iHEART study protocol. BMC Cardiovascular Disorders. 2016;16:152. doi:10.1186/s12872-016-0327-y.
Heartline study https://www.heartline.com/.
3.1.4.
Al-Turki A, Marafi M, Russo V, et al. Subclinical Atrial Fibrillation and Risk of Stroke: Past, Present and Future Medicina. 2019;55:611. doi:10.3390/medicina55100611.
Chen LY, Chung MK, Allen LA, et al.; American Heart Association Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Quality of Care and Outcomes Research; and Stroke Council. Atrial Fibrillation Burden: Moving Beyond Atrial Fibrillation as a Binary Entity: A Scientific Statement Fromthe American Heart Association. Circulation. 2018;137:e623-e644. doi:10.1161/CIR.0000000000000568.
Congrete S, Bintvihok M, Thongprayoon C, et al. Effect of obstructive sleep apnea and its treatment of atrial fibrillation recurrence after radiofrequency catheter ablation: A metaanalysis. Journal of Evidence-Based Medicine. 2018;11:145-51. doi:10.1111/jebm.12313.
Garabelli P, Stavrakis S, Albert M, et al. Comparison of QT Interval Readings in Normal Sinus Rhythm Between a Smartphone Heart Monitor and a 12-Lead ECG for Healthy Volunteers and Inpatients Receiving Sotalol or Dofetilide. Cardiovascular Electrophysiology. 2016;27:827-32.
Glotzer TV, Hellkamp AS, Zimmerman J, et al. and Investigators MOST. Atrial High Rate Episodes Detected by Pacemaker Diagnostics Predict Death and Stroke: Report of the Atrial Diagnostics Ancillary Study of the MOde Selection Trial (MOST). Circulation. 2003;107:1614-9.
Go AS, Reynolds K, Yang J, et al. Association of Burden of Atrial Fibrillation With Risk of Ischemic Stroke in Adults With Paroxysmal Atrial Fibrillation: The KP-RHYTHM Study. Journal of the American Medical Association Cardiology. 2018;3:601-8.
Healey JS, Connolly SJ, Gold MR, et al. Subclinical atrial fibrillation and the risk of stroke. New England Journal of Medicine. 2012;366:120-9.
January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation. 2019;140:e125-e151. doi:10.1161/CIR.0000000000000665.
Kanagala R, Murali NS, Friedman PA, et al. Obstructive sleep apnea and the recurrence of atrial fibrillation. Circulation. 2003;107:2589-94.
Kaplan RM, Koehler J, Ziegler PD, et al. Stroke Risk as a Function of Atrial Fibrillation Duration and CHA2DS2-VASc Score. Circulation. 2019;140:1639-46. doi:10.1161/CIRCULATIONAHA.119.041303.
Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Endorsed by the European Stroke Organisation (ESO). European Heart Journal. 2016;37:2893-962. doi:10.1093/eurheartj/ehw210.
Kirchhof P, Blank BF, Calvert M, et al. Probing oral anticoagulation in patients with atrial high rate episodes: Rationale and design of the Non-vitamin K antagonist Oral anticoagulants in patients with Atrial High rate episodes (NOAH-AFNET 6) trial. American Heart Journal. 2017;190:12-8.
Lopes RD, Alings M, Connolly SJ, et al. Rationale and design of the Apixaban for the Reduction of Thrombo-Embolism in Patients With Device-Detected Sub-Clinical Atrial Fibrillation (ARTESiA) trial. American Heart Journal. 2017;189:137-45.
Martin DT, Bersohn MM, Waldo AL, et al.; IMPACT Investigators Randomized trial of atrial arrhythmia monitoring to guide anticoagulation in patients with implanted defibrillator and cardiac resynchronization devices. European Heart Journal. 2015;36:1660-8.
Pathak RK, Middeldorp ME, Meredith M, et al. Long-Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort: A Long-Term Follow-Up Study (LEGACY). Journalof the American College of Cardiology. 2015;65:2159-69. doi:10.1016/j.jacc.2015.03.002.
Perino AC, Fan J, Askari M, et al. Practice Variation in Anticoagulation Prescription and Outcomes After Device-Detected Atrial Fibrillation. Circulation. 2019;139:2502-12. doi:10.1161/CIRCULATIONAHA.118.038988.
Swiryn S, Orlov MV, Benditt DG, et al. Clinical Implications of Brief Device-Detected Atrial Tachyarrhythmias in a Cardiac Rhythm Management Device Population: Results from the Registry of Atrial Tachycardia and Atrial Fibrillation Episodes. Circulation. 2016;134:1130-40. doi:10.1161/CIRCULATIONAHA.115.020252.
Van Gelder IC, Healey JS, Crijns H, et al. Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT. European Heart Journal. 2017;38:1339-44.
Varma N, Stambler B, Chun S. Detection of atrial fibrillation by implanted devices with wireless data transmission capability. Pacing and Clinical Electrophysiology. 2005;28(Suppl 1):S133-6.
Voskoboinik A, Kalman JM, De Silva A, et al. Alcohol Abstinence in Drinkers with Atrial Fibrillation. New England Journal of Medicine. 2020;382:20-8. doi:10.1056/NEJMoa181759.
3.2.
Andelius L, Hansen MC, Lippert FK, et al. Smartphone Activation of Citizen Responders to Facilitate Defibrillation in Out-of-Hospital Cardiac Arrest. Journal of the American College of Cardiology. 2020;76:43-53. doi:10.1016/j.jacc.2020.04.073.
Au-Yeung WM, Reinhall PG, Bardy GH, Brunton SL. Development and validation of warning system of ventricular tachyarrhythmia in patients with heart failure with heart rate variability data. PloS One. 2018;13:e0207215.
Billet S, Rollin A, Mondoly P, et al. Hemodynamic consequences of premature ventricular contractions: Association of mechanical bradycardia and postextrasystolic potentiation with premature ventricular contraction-induced cardiomyopathy. Heart Rhythm. 2019;16:853-60.
Bolle SR, Scholl J, Gilbert B. Can video mobile phones improve CPR quality when used for dispatcher assistance during simulated cardiac arrest? Acta Anaesthesiologica Scandinavica. 2009;53:116-20.
Boutilier JJ, Brooks SC, Janmohamed A, et al.; Rescu Epistry Investigators. Optimizing a Drone Network to Deliver Automated External Defibrillators. Circulation. 2017;135:2454-65.
Claesson A, B?ckman A, Ringh M, et al. Time to Delivery of an Automated External Defibrillator
Using a Drone for Simulated Out-of-Hospital Cardiac Arrests vs Emergency Medical Services. Journal of the American Medical Association. 2017;317:2332-4.
Chan J, Rea T, Gollakota S, Sunshine JE. Contactless cardiac arrest detection using smart devices. NPJ Digital Medicine. 2019;2:52. doi:10.1038/s41746-019-0128-7.
Choa M, Park I, Chung HS, et al. The effectiveness of cardiopulmonary resuscitation instruction: Animation versus dispatcher through a cellular phone. Resuscitation. 2008;77:87-94.
Chong JW, Esa N, McManus DD, Chon KH. Arrhythmia Discrimination using a Smart Phone. IEEE Journal of Biomedical and Health Informatics. 2018;19:815-24.
Davis JC, Robertson MC, Ashe MC, et al. International comparison of cost of falls in older adults living in the community: a systematic review. Osteoporosis International. 2010;21:1295-306.
Hatakeyama T, Nishiyama C, Shimamoto T, et al. Smartphone Application to Reduce the Time to Automated External Defibrillator Delivery After a Witnessed Out-of-Hospital Cardiac
Arrest: A Randomized Simulation-Based Study. Simulation in Healthcare. 2018;13:387-93.
Heinrich S, Rapp K, Rissmann U, et al. Cost of falls in old age: a systematic review. Osteoporosis International. 2010;21:891-902.
Kalz M, Lenssen N, Felzen M, et al. Smartphone apps for cardiopulmonary resuscitation training and real incident support: a mixed-methods evaluation study. Journal of Medical Internet Research. 2014;16:e89.
Kwon JM, Lee Y, Lee Y, et al. An Algorithm Based on Deep Learning for Predicting In-Hospital Cardiac Arrest. Journal of the American Heart Association. 2018;7:e008678. doi:10.1161/JAHA.118.008678.
Lee H, Shin SY, Seo M, et al. Prediction of Ventricular Tachycardia One Hour before Occurrence Using Artificial Neural Networks. Scientific Reports. 2016;6,32390. McManus DD, Chong JW, Soni A, et al. PULSESMART: Pulse-based Arrhythmia Discrimination Using a Novel Smartphone Application. Journal of Cardiovascular Electrophysiology. 2016;27:51-7.
Merchant RM, Abella BS, Abotsi EJ, et al. Cell phone cardiopulmonary resuscitation: Audio instructions when needed by lay rescuers: A randomized, controlled trial. Annals of Emergency Medicine. 2010;55:538-43.
Neves Briard J, Grou-Boileau F, El Bashtaly A, et al. Automated External Defibrillator Geolocalization with a Mobile Application, Verbal Assistance or No Assistance: A Pilot Randomized Simulation (AED G-MAP). Prehospital Emergency Care. 2019;23:420-9.
Paal P, Pircher I, Baur T, et al. Mobile phone-assisted basic life support augmented with a metronome. Journal of Emergency Medicine. 2012;43:472-7.
Praveen Kumar D, Amgoth T, Annavarapu CSR. Machine learning algorithms for wireless sensor networks: A survey. Information Fusion. 2019;49:1-25.
Reed MJ, Grubb NR, Lang CC, et al. Multi-centre Randomised Controlled Trial of a Smartphone-based Event Recorder Alongside Standard Care Versus Standard Care for Patients Presenting to the Emergency Department with Palpitations and Presyncope: The IPED (Investigation of Palpitations in the ED) study. EClinicalMedicine. 2019;8:37-46.
Rickard J, Ahmed S, Baruch M, et al. Utility of a novel watch-based pulse detection system to detect pulselessness in human subjects. Heart Rhythm. 2011;8:1895-9.
Ringh M, Rosenqvist M, Hollenberg J, et al. Mobile-phone dispatch of laypersons for CPR in out-of-hospital cardiac arrest. New England Journal of Medicine. 2015;372:2316-25.
Ringwald M, Crich A, Beysard N. Smart Watch Recording of Ventricular Tachycardia: Case Study. The American Journal of Emergency Medicine. 2019;38(4).849.e3-849.e5. doi:10.1016/j.ajem.2019.10.040.
Sakai T, Iwami T, Kitamura T, et al. Effectiveness of the new “Mobile AED Map” to find and retrieve an AED: a randomized controlled trial. Resuscitation. 2011;82:69-73.
Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Annals of Noninvasive Electrocardiology. 2017;22:e12447. doi:10.1111/anec.12447.
Waks JW, Fein AS, Das S. Wide Complex Tachycardia Recorded With a Smartphone Cardiac Rhythm Monitor. Journal of the American Medical Association Internal Medicine. 2015;175:437-9.
Weisfeldt ML, Sitlani CM, Ornato JP, et al.; ROC Investigators. Survival after application of automatic external defibrillators before arrival of the emergency medical system: evaluation in the resuscitation out-comes consortium population of 21 million. Journal of the American College of Cardiology. 2010;55:1713-20.
Wu O, Briggs A, Kemp T, et al. Mobile phone use for contacting emergency services in life threatening circumstances. Journal of Emergency Medicine. 2012;42:291-8.
You JS, Park S, Chung SP, Park JW. Performance of cellular phones with video telephony in the use of automated external defibrillators by untrained laypersons. Emergency Medicine Journal. 2008;25:597-600.
4. Сопутствующие заболевания
Известно, что довольно большая часть нарушений ритма сердца возникает под влиянием сопутствующих заболеваний. Их лечение может напрямую отражаться на частоте рецидивов аритмий и клинических исходах. Таким образом, модификация образа жизни и коррекция сопутствующей патологии (рис. 5) становится одной из основных целей в лечении аритмий (Chung 2020), при этом данный подход имеет высокий уровень доказательности (Класс I) в современных руководствах по ведению пациентов с нарушениями ритма (January 2019). Использование технологий мобильного здравоохранения также потенциально может способствовать повышению эффективности контроля сопутствующих заболеваний (рис. 6).
4.1. Ишемическая болезнь сердца
Раннее вмешательство (например, первичная ангиоплоастика) при остром коронарном синдроме (ОКС) может уменьшить объем зоны инфаркта и снизить вероятность развития желудочковых аритмий, таким образом, способствуя улучшению клинических исходов. При этом считается, что развитие ФП после перенесенного инфаркта миокарда (ИМ) ухудшает прогноз пациентов (Pizzetti 2011).
Амбулаторный этап
По данным перекрёстных РКИ, оценивающих эффективность технологии мониторинга сегмента ST, которая интегрирована в стандартные ИКДаппараты, в экспериментальной группе получено явное клиническое преимущество, т.к. наблюдается сокращение времени от начала возникновения ишемии до обращения в стационар (Gibson 2019, Holmes DR Jr 2019). Система AngelMed Guardian (Angel Medical Systems, Итонтаун, Нью Джерси) одобрена к применению в США у пациентов с первичным ОКС и с высоким риском повторного ОКС. У пациентов из группы более низкого риска технологии мобильного здравоохранения могут способствовать своевременному распознаванию клинических симптомов и, тем самым, ускорять обращение в стационар, улучшая важные временные показатели, к примеру “время от начала симптомов до госпитализации” (Moser 2006).
Носимые устройства с функцией непрерывного мониторирования физиологических параметров имеют большие перспективы в плане диагностики и возможного предотвращения острого ИМ на ранних стадиях путем раннего оповещения пациента и/ или бригады скорой помощи. Недавно было разработано неинвазивное устройство, регистрирующее три канала ЭКГ, с беспроводным подключением к специальному смартфону (Van Heuverswyn 2019). Кроме того, три основных отведения ЭКГ (а также производные от них усиленные отведения) могут быть записаны при помощи доступных в продаже смарт-часов (Avila 2019). Однако возможность применения данных технологий ограничена ситуациями, когда пациент или оказывающий помощь специалист постоянно имеют при себе регистрирующее устройство или мобильное приложение, а также умеют ими правильно воспользоваться при возникновении симптомов.
Перспективной является технология (www.heartbeam.com) по применению устройства размером с кредитную карту, которое необходимо прижать к грудной клетке для регистрации записи ЭКГ (рис. 3). Данное приложение воспринимает и записывает ЭКГ-сигналы, применяя новый трехмерный векторный метод. Далее информация перенаправляется в облачное хранилище, где данные анализируются и сопоставляются с образцом рутинной записи ЭКГ этого пациента, зарегистрированной заранее в момент отсутствия симптомов. Специальный алгоритм объединяет анализ сигналов с анамнезом пациента и указанными симптомами. Полученная информация вместе с диагностическими рекомендациями и записью ЭКГ отправляется лечащему врачу пациента, который выносит окончательное заключение и сообщает его пациенту. Подобная система применяется в условиях телемедицинского наблюдения пациентов с ишемической болезнью сердца (ИБС) для исключения ИМ при болевом синдроме в грудной клетке.
Неотложная помощь
На следующем этапе ведения пациентов использование мобильных технологий для передачи зарегистрированной ЭКГ в стационар с целью оценки и принятия клинического решения способствует значительному снижению затрат времени до выполнения реваскуляризации, менее выраженному повышению уровня маркеров некроза миокарда (тропонина и креатинфосфокиназы), предотвращает снижение уровня фракции выброса левого желудочка в постинфарктном периоде, а также сокращает продолжительность госпитализации по сравнению с пациентами, чьи ЭКГ не передавались в стационар на этапе появления симптомов (Clemmensen 2010, Sanchez-Ross 2011). В настоящее время этот подход получил широкое распространение, тогда как основными препятствиями к его внедрению остаются технические причины, такие как возможные ошибки в момент передачи данных и недостаточная область интернет-покрытия и мобильной связи.
Наблюдение после выписки из стационара
Этап после выписки из стационара, особенно в первые дни, часто тревожит пациентов, которые плохо разбираются в назначенных им препаратах, последующих обследованиях и дальнейших назначениях (Horwitz 2013, Ziaeian 2013). Это может приводить к частым повторным госпитализациям. В этой ситуации мобильные технологии могут обеспечить индивидуальный контакт между пациентами и медицинскими работниками. В крупном РКИ было продемонстрировано, что возможность контакта с врачом по телефону способствует повышению комплаентности у пациентов с ИБС (Vollmer 2014). Также было показано, что возможность обмена текстовыми сообщениями со специалистом повышает приверженность к приему лекарств и снижает сердечно-сосудистые ФР (Chow 2015, Unal 2018). Но, вероятно, имеющиеся данные по проблеме ведения пациентов на постгоспитальном этапе характеризуются рядом ограничений: короткий период наблюдения, различное восприятие рекомендаций пациентами и самооценка приверженности к лечению по данным опросников, т.е. полученная информация не всегда объективна (Shariful Islam 2019). Поэтому эффективность метода может быть увеличена с помощью персонализации текстовых сообщений с указаниями от специалистов и их своевременности, особенно в случае изменения дозировок препаратов, увеличения частоты переписки и использования дополнительных приложений или интернет-ресурсов (Park 2014). Именно в данном контексте применение электронных медицинских регистрирующих устройств может значительно упростить подходы к ведению пациентов.
Реабилитация пациентов с ИБС
Было продемонстрировано, что комплексная реабилитация способна значительно улучшить исходы и результаты лечения у пациентов с заболеваниями сердца, но данный метод до сих пор недостаточно применяется на практике. Целью инициативы Million Hearts Cardiac Rehabilitation Collaborative является включение в реабилитационный процесс ?70% пациентов с кардиологической патологией к 2022г (Ritchey 2020). Мобильные приложения и интегрированные датчики для измерения ЧСС, показателей дыхания и других физиологических параметров, как правило, лишены основных ограничений, характерных для традиционных подходов, являются доступными по стоимости и удобными в использовании, и поэтому могут быть более приемлемыми для пациентов с ИБС во многих клинических ситуациях (Zwisler 2016). Контролируемое РКИ эффективности традиционного госпитального этапа реабилитации при дополнительном использовании мобильных технологий продемонстрировало улучшение восприятия врачебных рекомендаций, приверженности к терапии и увеличение количества пациентов, продолжающих реабилитацию в домашних условиях после перенесенного ИМ (Varnfield 2014). (См. также гибридную телереабилитацию у пациентов с ХСН. Раздел 4.2.2.).
4.2. Сердечная недостаточность
ХСН имеет довольно высокую распространенность, сопровождается дорогостоящими затратами на лечение и ухудшает исход пациентов с ССЗ (Benjamin 2017, Albert 2019). ХСН может быть триггером ФП и желудочковых аритмий, а, в свою очередь, наличие ФП способствует возникновению или прогрессированию имеющейся СН. УМ, направленный, к примеру, на контроль соблюдения диеты и приверженности к приему медикаментов (см. Раздел 4.6.2), детекцию возможных аритмий (см. Раздел 3), выявление преходящей ишемии (см. Раздел 4.1), диагностику ортопноэ, изменений ЧСС во время ФА и во сне (см. Раздел 4.5), может позволить дистанционно корректировать лечение для сокращения вызовов бригады неотложной помощи и незапланированных госпитализаций, обусловленных прогрессированием ХСН.
Однако, несмотря на многообещающие перспективы, большинство многоцентровых РКИ достоверно не продемонстрировали улучшения результатов лечения у пациентов с ХСН и устройствами УМ (табл. 4) (Boyne 2012, Chaudhry 2010, Dickinson 2018, Koehler 2011, Ong 2016, Takahashi 2012). По-видимому, необходимо использовать комбинацию алгоритмов, основанных на анализе множества параметров (Ono 2017). Из общего ряда выделяется одно исследование TIM-HF2, где пациенты с СН были рандомизированы либо в группу дистанционного ведения в сочетании с обычными визитами, либо в обычную амбулаторную группу, где наблюдение продолжалось около года (Koehler 2018). Результаты показали снижение частоты достижения комбинированной конечной точки (незапланированной госпитализации и смертности от всех причин) в экспериментальной группе. Тем не менее, сердечно-сосудистая смертность была одинаковой между группами УМ и группами стандартной медицинской помощи. В следующих работах показано, что имплантированные устройства для контроля легочного АД могут быть полезны у отдельных пациентов при использовании в структурированных программах наблюдения (Dickinson 2018). Положительные результаты исследования CHAMPION (CardioMEMS Heart Sensor Allows Monitoring of Pressure to Improve Outcomes in NYHA Functional Class III Heart Failure Patients) и последующее одобрение FDA способствовали возобновлению интереса к применению удаленных технологий в ведении пациентов с ХСН (Abraham 2016, Carbo 2018, Desai 2017). Реализация программ УМ требует ежедневной загрузки данных гемодинамики с последующим их анализом, а также заранее определенного плана лечения, в котором возможны коррекции, исходя из полученных результатов. Кроме того, в настоящее время доступны приложения, которые оценивают комплаентность пациентов, предупреждают пациента об ошибках отправки сообщений, напоминают о приеме лекарств и позволяют проводить проверку дозировки и титрацию медикаментов.
Таблица 4
Независимые РКИ эффективности УМ пациентов

Сокращения: АД — артериальное давление, УМ — удаленный мониторинг, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений, ЭКГ — электрокардиография.
Литература/References
Boyne JJ, Vrijhoef HJ, Crijns HJ, et al.; TEHAF investigators. Tailored telemonitoring in patients with heart failure: results of a multicentre randomized controlled trial. European Journal of Heart Failure. 2012;14:791-801.
Chaudhry SI, Mattera JA, Curtis JP, et al. Telemonitoring in patients with heart failure. New England Journal of Medicine. 2010;363:2301-9.
Koehler F, Winkler S, Schieber M, et al.; Telemedical Interventional Monitoring in Heart Failure Investigators. Impact of remote telemedical management on mortality and hospitalizations in ambulatory patients with chronic heart failure: the Telemedical Interventional Monitoring in Heart Failure study. Circulation. 2011;123:1873-80.
Ong MK, Romano PS, Edgington S, et al. Better Effectiveness After Transition–Heart Failure (BEAT-HF) Research Group. Effectiveness of remote patient monitoring after discharge of hospitalized patients with heart failure: the Better Effectiveness After Transition — Heart Failure (BEAT-HF) randomized clinical trial. Journal of the American Medical Association Internal Medicine. 2016;176:310-8.
Takahashi PY, Pecina JL, Upatising B, et al. A randomized controlled trial of telemonitoring in older adults with multiple health issues to prevent hospitalizations and emergency department visits. Archives of Internal Medicine. 2012;172:773-9.
Stehlik J, Schmalfuss C, Bozkurt B, et al. Continuous Wearable Monitoring Analytics Predict Heart Failure Hospitalization: The LINK-HF Multicenter Study. Circulation Heart Failure. 2020;13:e006513. doi:10.1161/CIRCHEARTFAILURE.119.006513.
4.2.1. Мобильные технологии в ведении пациентов с СН
Концепция объединения УМ и мобильных технологий является привлекательной в плане наблюдения и лечения пациентов с ХСН (Carbo 2018, Cipresso 2012). Как правило, наиболее часто регистрируемые параметры включают определение ЧСС по данным ЭКГ, уровня АД и оценку динамики веса. Кроме того, у пациентов с ХСН могут также применяться сенсорные устройства, определяющие частоту и паттерн дыхательных движений посредством оценки экскурсии грудной клетки с помощью датчиков давления, растяжения или акселерометрии. Определение нарушений дыхания с использованием специального микрофона (с помощью оценки звуков), выявление изменения импеданса или пульсоксиметрия также могут использоваться для контроля дыхательной функции. Последние разработки включают возможность интеграции ряда перечисленных опций в различные предметы из текстиля или одежду (Molinaro 2018).
Некоторые исследования направлены на внедрение технических средств повышения приверженности к терапии, включая предупреждения о приеме лекарств, голосовые подсказки, обучающие видеоролики и различные формы отслеживания ФА (см. Раздел 4.6.1). В большинстве работ период наблюдения пациентов составлял 6 мес., тогда как мониторирование витальных функций и оценка комплайнса проводились ежедневно. Установлено, что подобный подход позволяет снизить продолжительность госпитализаций, связанных с декомпенсацией ХСН (Carbo 2018). Еще в ряде исследований сообщалось о высокой приверженности пациентов и хорошей частоте использования мобильных технологий при ХСН, но подобных результатов не так много (Chaudhry 2010, Hamilton 2018).
Предварительные итоги применения одноразового мультисенсорного нагрудного регистратора событий в исследовании LINK-HF были обнадеживающими (Stehlik 2020). Так, ношение прибора позволило выявлять предварительные признаки декомпенсации ХСН примерно за неделю до развития клинических проявлений, что способствовало уменьшению количества госпитализаций за счет своевременной амбулаторной коррекции выявленных нарушений (чувствительность метода в пределах от 76% до 88% и специфичность 85%).
4.2.2. Гибридная телереабилитация у больных СН
Несмотря на то, что физические упражнения рекомендованы всем пациентам со стабильным течением ХСН (Piepoli 2011, Ponikowski 2016), гибридная кардиологическая телереабилитация представляет собой качественно новый подход в ведении пациентов. Телереабилитации — это удаленная курация пациентов и проведение комплексной кардиологической реабилитации на расстоянии, включая: телемониторинг (минимально инвазивный, как правило, с использованием сенсорных датчиков), дистанционную оценку физического статуса (общего состояния пациента), дистанционные рекомендации (посредством телеконсультаций среднего медицинского персонала, психологической поддержки), телетерапию (коррекция лечения в диалоге с пациентом), телетренировку (с проведением предварительного инструктажа и поддержкой специалиста), дистанционное консультирование и дистанционное наблюдение за выполнением физических упражнений (Piotrowicz 2016). В данных условиях применимы подходы с использованием различных электронных устройств, начиная от мониторирования ЧСС (Smart 2005) и телефонного ЭКГ-мониторирования (Kouidi 2006), до телемониторирования ЭКГ при помощи удаленных технологий (Piotrowicz 2015), регистрации ЭКГ в режиме реального времени, а также голосовой записи информации и ее передачи посредством телефонной связи (Ades 2000).
Телереабилитация в домашних условиях продемонстрировала безопасность и эффективность при условии высокой приверженности пациентов. Доказано, что подобный подход улучшает физическую работоспособность (Piotrowicz 2015) и психологический статус пациентов (Piotrowicz 2016), причем улучшение качества жизни сопоставимо со стандартной реабилитацией (Piotrowicz 2015). Первое проспективное многоцентровое РКИ (TELEREH-HF) показало, что гибридная телереабилитация в сочетании с удаленной поддержкой пациентов с ХСН была более эффективна, чем обычная тактика ведения, что проявлялось в улучшении основных клинически значимых показателей: пикового потребления O2, расстояния теста 6-мин ходьбы и результатов опросника качества жизни, хотя и не было ассоциировано со снижением 24-мес. смертности и госпитализации, за исключением самых опытных центров (Piotrowicz 2019, Piotrowicz 2019).
Данному вопросу был посвящен ряд публикаций, где основное значение имеет недавний консенсус Американской Ассоциации реабилитации пациентов с сердечно-сосудистой и легочной патологией, разработанный совместно с Американской Ассоциацией сердца, также поддерживающий мнение, что комплексная реабилитация в домашних условиях с использованием телемедицины является перспективным новым направлением в ведении пациентов с ХСН и другими ССЗ (Thomas 2019).
4.3. Сахарный диабет
Сахарный диабет (СД) является важным ФР заболеваемости и смертности от кардиологических причин и ассоциируется с целым рядом ССЗ. Патогенез метаболического синдрома (повышение уровня глюкозы крови в сочетании с инсулинорезистентностью) включает опосредованные механизмы, приводящие к развитию микро- и макрососудистых осложнений, формированию вегетативной нейропатии, диастолической дисфункции, почечной недостаточности, а также увеличивает риск возникновения ФП. Важными целями в ведении таких пациентов являются изменения образа жизни (к примеру, коррекция диеты и увеличение ФА: см. следующий Раздел) для предотвращения развития заболевания и достижения жесткого контроля гликемии, особенно при СД 1 типа, который требует пожизненного строгого самоконтроля (Balakumar 2016, Donnelan 2019, Goudis 2015, Wang 2019, Wilkinson 2019, Wingerter 2019). Оптимальные технологии самоконтроля гликемии и оценки динамики заболевания при помощи мобильных устройств подробно рассматриваются в недавно опубликованных Рекомендациях ЕОК, посвященных лечению СД и других ССЗ (Cosentino 2019).
Адекватный контроль гликемии способен снижать риск развития ФП и частоту рецидивов аритмии (Chao 2012, Chang 2014, Gu 2011, Otake 2009).
Мобильные приложения могут способствовать улучшению самоконтроля у пациентов с СД, напоминая о регулярной оценке необходимых параметров и приеме лекарств, а также предоставляя дополнительные образовательные материалы и мотивационную поддержку пациентов. Регулярная передача информации по мониторингу уровня глюкозы крови от пациентов к лечащему врачу может осуществляться посредством SMS-оповещений, электронной почты или различных веб-сервисов. Широко распространены глюкометры с поддержкой Bluetooth (Andres 2019, Garabedian 2015). BlueStar (Welldoc, Columbia, MD), впервые получившие разрешение FDA США на применение у пациентов с СД, которые поставляются с приложением, требующим рецепта врача и позволяющим пациентам титровать дозировку инсулина с помощью фирменного калькулятора инсулина. Также используется на практике приложение Freestyle Libre Link (Abbott Laboratories, Abbott Park, IL), которое считывает информацию, предоставляемую устройством непрерывного мониторинга глюкозы, и отображает тренды гликемии во времени (Fokkert 2017).
Недавно был опубликован обзор имеющихся мобильных приложений для самоконтроля состояния пациентов с СД (Fleming 2020). Качество измерений и краткосрочного мониторинга таких параметров, как гликированный гемоглобин, можно значимо улучшить при использовании подобных приложений, особенно в сочетании с клинической поддержкой, но ограничение заключается в том, что многие из них неудобны в использовании (Veazie 2018). Эффективным способом улучшения гликемического контроля является регулярный телефонный контакт специалистов клинической поддержки с пациентами, который позволяет значимо повысить степень соблюдения врачебных рекомендаций по сравнению со стандартным лечением (Liang 2011, Pillay 2015, Saffari 2014). Тем не менее, общая эффективность контроля гликемии с помощью мобильных технологий в контролируемых РКИ показала смешанные результаты (Agarwal 2019, Quinn 2011). Один из метаанализов показал, что применение смартфонов в целью самоконтроля при СД незначительно снижает уровень гликированного гемоглобина (в среднем на 0,2-0,5% в течение 6 мес. наблюдения), где более выраженный эффект наблюдается у пациентов с СД 2 типа по сравнению с пациентами с СД 1 типа (Pal 2014). На клинические результаты также влияет динамика расходов на медицинское обслуживание, которые снижаются при использовании мобильных технологий за счет уменьшения потребности личного контакта с медицинскими работниками, предотвращения новых госпитализаций и улучшения прогноза пациентов. Так, в ретроспективном исследовании использование технологий mHealth было связано с сокращением медицинских расходов на 21,9% по сравнению с контрольной группой в течение первого года (Whaley 2019). По-видимому, ключевыми факторами, определяющими успешное внедрение мобильных приложений поддержки принятия решений, будут их удобство и доступность для пользователя, а также возможность обмена электронными сообщениями и обратной связи между пациентом и клиническими специалистами.
4.4. Артериальная гипертония
Учитывая высокую распространенность артериальной гипертонии, данная патология считается наиболее значимым ФР развития ФП (Huxley 2011).
Методы мобильного здравоохранения, используемые в лечении артериальной гипертонии, включают в себя ряд технологий, адресованных как профессионалам, так и широкому кругу потребителей и, как правило, представляют собой беспроводные электронные диагностические и клинические инструменты поддержки принятия решений, направленные на мониторинг состояния здоровья и улучшение результатов лечения. УМ АД является одним из наиболее часто используемых методов и включает в себя дистанционную передачу данных об уровне АД в комбинации с клинической информацией от пациентов из дома или из специальных пунктов связи в центральную службу, где они рассматриваются и анализируются лечащим врачом с последующим принятием решений по тактике. В ряде клинических исследований показано, что телемониторинг АД может быть более эффективным, чем обычная тактика ведения в плане достижения целевых значений АД (Bosworth 2011, Kim 2015, McManus 2010). Недавний метаанализ продемонстрировал, что по сравнению с обычным лечением УМ АД способствовал достоверному снижению офисного систолического и диастолического АД на 3,99 мм рт.ст. (95% доверительный интервал (ДИ): 5,06-2,93; Р<0,001) и 1,99 мм рт.ст. (95% ДИ: от -2,60 до -1,39; Р<0,001), соответственно (Duan 2017). Кроме того, телемониторинг АД в совокупности с более сложными вмешательствами, включая дополнительную клиническую поддержку, такую как очное консультирование, телеконсультации, обучение пациентов, контроль поведения и оценку приверженности к терапии, характеризуется дополнительными преимуществами и более устойчивым клиническим эффектом (Duan 2017, Tucker 2017).
Технологии мобильного здравоохранения потенциально могут улучшать самоконтроль симптомов у пациентов с АГ и, при использовании в дополнение к врачебным назначениям, подчеркивают центральную роль пациента как активного участника лечебного процесса с возможностью принятия решений по выбору клинической тактики. Действительно, открытое контролируемое РКИ TASMINH4 показало, что пациенты, которые практиковали самоконтроль АД для титрования дозы антигипертензивных препаратов, с телемониторингом или без него, достигали лучшего контроля АД, чем те, кто использовал стандартные подходы к лечению (McManus 2018). Пациенты в группе самоконтроля, применяющие телемониторинг, быстрее достигали снижения АД до целевых значений, чем пациенты в группе самоконтроля, не имевшие поддержки телемониторинга, но через 1 год наблюдения показатели достоверно не отличались. Анализ стоимости затрат на лечение показывает, что самоконтроль в данном контексте является экономически эффективным по NICE критериям, т.е. стоит значительно меньше 20 тыс. фунтов стерлингов по показателю QALY, отражающему скорректированные на качество жизни годы (Monahan 2019).
Несмотря на потенциальную эффективность и возможности мобильного здравоохранения в лечении гипертонии, технологические барьеры, высокая стоимость, разнообразие электронных устройств и приложений на современном рынке и отсутствие единых стандартов затрудняют их клиническое применение. Действующие Рекомендации ЕОК 2019г по лечению артериальной гипертонии подчеркивают важность самоконтроля АД пациентами и регламентируют возможное использование мобильных технологий на базе смартфонов. Тем не менее они не рекомендуют использовать подобные мобильные приложения в качестве независимого средства измерения АД без дополнительной валидации результатов (Williams ESC/ESH Guidelines 2018).
4.5. Другие расстройства, включая апноэ сна (См. также Раздел по ХСН 4.2.1.)
Нарушения сна широко распространены в клинической практике и вносят свой вклад в повышение сердечно-сосудистого риска и риска развития аритмий, особенно ФП (Daghlas 2019, Hirshkowitz 2015, Mehra 2006, May 2016, May 2017), (Institute of Me — dicine Report: Sleep Disorders and Sleep Deprivation: An Unmet Public Health Problem), (Institute of Medicine (US) Committee on Sleep Medicine and Research. www.ncbi.nlm.nih.gov/books/NBK19961). Возможно, это обусловлено тесной взаимосвязью нарушений сна с циркадными ритмами и балансом вегетативной нервной системы (Burgess 1997). В настоящее время разработан и валидирован стандарт диагностики нарушений сна, но подобные системы требует технической поддержки для облегчения сбора данных и анализа полученных результатов. К примеру, полисомнография уже давно признана золотым стандартом для получения обширных мультимодальных кардионейрореспираторных объективных физиологических данных с целью определения структуры сна, общего времени сна и диагностики кардиореспираторных нарушений и в первую очередь используется в выявлении обструктивного апноэ сна. Актиграфия — метод регистрации движений с помощью актиграфа имеет преимущество сбора объективных данных в дневное и ночное время и применяется для измерения времени сна и бодрствования, с анализом структуры и эффективности сна, в дополнение к основным показателям циркадных ритмов. Однако данные методики могут быть слишком нагрузочны для пациентов и имеют высокую стоимость.
- Лечение сонного апноэ способствует уменьшению общей аритмической нагрузки (бремени ФП) (Qureshi 2015, Youssef 2018).
Современные пользовательские мобильные технологии, применяемые в медицине сна, могут иметь революционное значение в диагностике и лечении указанных нарушений. Поскольку подобные приложения предустановлены на многих смартфонах, отслеживание сна может быть одним из наиболее широко применяемых направлений мобильного здравоохранения (Khosla 2018). Разработки в указанной области включают приложения для мобильных телефонов, носимые и встроенные устройства (используются в зоне сна пациента), наручные браслеты и кольца (https://bodimetrics.com/product/circul-sleepand-fitness-ring) с интеграцией вспомогательных диагностических сенсоров (например, для мониторинга оксиметрии, регистрации ЭКГ), а также способы оценки приверженности к терапии при расстройствах сна. Некоторые коммерчески доступные носимые устройства точно измеряют общее время сна, но не оценивают конкретные параметры, такие как эффективность сна и его различные стадии (Mantua 2016). Предварительные данные исследований свидетельствуют о том, что носимые устройства способны диагностировать апноэ сна с хорошей точностью, сравнимой с золотым стандартом — полисомнографией (Selvaraj 2014), и могут в будущем изменить подходы к скринингу, диагностике и лечению расстройств сна. Доказано, что нарушения сна, диагностированные при 7-дневной записи актиграфии с помощью портативных устройств на запястье, ассоциируются с повышенным риском неблагоприятных сердечно-сосудистых событий (Huang 2020). Кроме того, в недавних работах продемонстрировано, что использование носимых устройств может способствовать изменению модели поведения пациентов и улучшению качества сна (Berryhill 2020). В связи с этим мобильные приложения и другие технологии электронного здравоохранения для диагностики и лечения нарушений сна перспективны с точки зрения контроля ритма сердца.
4.6. Модификация образа жизни (См. рис. 5)
4.6.1. ФА
ФА — это любое движение тела за счет сокращения скелетных мышц, приводящее к повышению расхода энергии выше базального уровня. Спортивная активность варьирует от любительского спорта до соревновательного уровня. Имеются убедительные доказательства того, что регулярные аэробные упражнения на уровне, рекомендованном Комитетом по ФА (Physical Activity Guidelines Advisory Committee), снижают риск развития различных ССЗ, в т.ч. ФП (Everett 2011, Mozaffarian 2008, Piercy 2018). Однако большинство населения не поддерживает индивидуальную ФА на рекомендуемом уровне (Piercy 2018). Доказано, что среди пациентов с ССЗ уровень ФА, оцениваемой автоматически с помощью ИКД, коррелировал с выживаемостью после имплантации ИКД (Kramer 2015). В настоящее время в сфере фитнеса на рынке представлено огромное количество электронных мобильных устройств, которые потенциально могут внести значительный вклад в улучшение контроля состояния здоровья широкого круга пользователей цифровых технологий. Так, уже в 2017г было доступно >318 тыс. приложений из сферы “Фитнес и здоровье”, что почти вдвое больше, чем два года назад (IQUIVA Institute 2017). Многие подобные приложения, доступные в настоящее время, отслеживают ежедневную ФА пользователей и мотивируют к поддержанию здорового образа жизни, подсчитывая количество шагов в день с возможностями регулярных онлайн-тренировок и индивидуального консультирования участников (McConnell 2018).
- Кардиореспираторные нагрузки имеют обратную взаимосвязь с частотой развития ФП, т.е. способствуют снижению риска ее возникновения (Faselis 2015).
- Повышение толерантности к физической нагрузке на 2 метаболических единицы у людей с избыточным весом может удвоить вероятность удержания синусового ритма (Pathak 2015).
Наиболее распространенные фитнес-технологии для потребителей включают в себя индивидуальные фитнес-трекеры, которые могут применяться самостоятельно; устройства, сопряженные с соответствующим приложением, а также автономные программы, которые можно загрузить на мобильный телефон с последующим использованием функционала смартфона для измерения уровня ФА и оценки сна. Точность этих измерений варьируется между различными устройствами и даже отличается для измерений одним и тем же устройством (Rosenberger 2016). Кроме того, в то время как методика суточной оценки количества шагов хорошо известна, оценка интенсивности физических упражнений с помощью смарт-устройств более сложна. Хотя подобные фитнес-технологии имеют великолепный потенциал для повышения уровня ФА среди населения, их эффективность в мотивации изменения поведения остается не до конца изученной (Sullivan 2017).

Рис. 5. Применение мобильных технологий при ФП включает скрининг в общей популяции и среди групп высокого риска, контроль лечения сопутствующих заболеваний и коррекцию образа жизни, а также управление терапией у пациентов с уже диагностированной ФП.
Сокращения: СР — синусовый ритм, ФП — фибрилляций предсердий, СН — сердечная недостаточность, ЧСС — частота сердечных сокращений.
В недавней работе оценивалась эффективность модификации образа жизни при использовании фитнес-трекеров по сравнению со стандартными подходами (Jakicic 2016). Две группы участников получали сходные инструкции по увеличению ФА и изменению питания. Через 6 мес. после вмешательства половина участников была обеспечена наручными фитнес-трекерами с системой мобильной онлайн-поддержки. Другая половина регистрировала и отслеживала свою ФА и эффективность диеты на веб-сайте исследования. Следует отметить, что в группе пациентов, которые носили фитнес-трекеры, удалось достичь меньшего снижения веса, чем в группе, где не применялись данные приборы. Более того, изменения в ФА между двумя группами существенно не различались. Эти результаты ставят под сомнение роль фитнес-трекеров в повышении ФА населения, следовательно, необходимы дополнительные исследования для оценки эффективности подобного подхода (см. Раздел 5).
Профессиональные спортсмены
Люди, профессионально занимающиеся спортом, представляют собой уникальную категорию пациентов. Спортсмены, тренирующиеся в силовых видах спорта и выполняющие упражнения на выносливость, могут иметь повышенный риск ФП (Abdulla 2009, Andersen 2013). Дистанционная оценка записей ЭКГ может быть полезна в тех условиях, когда перед соревнованиями проводится предварительный ЭКГскрининг всем участникам (Brunetti 2014, Orchard 2019). Различные электронные устройства и мобильные приложения способны регистрировать комплекс клинических и физиологических данных, которые могут быть использованы для самоконтроля в ходе тренировочного процесса (Aroganam 2019, Li 2016, Peake 2018, Peart 2019, Seshadri 2019). Полученные данные о степени физической нагрузки и уровне производительности участников тренировок могут регулярно оцениваться как тренерами, так и самими
спортсменами. Также была предложена коррекция программы тренировок, основываясь на ежедневном мониторинге параметров вариабельности сердечного ритма (ВСР), но доказательных данных в пользу подобного подхода пока недостаточно (Coppetti 2017, Dobbs 2019, Singh 2018). Мобильные устройства обеспечивают возможность оперативного мониторинга основных физиологических показателей в режиме реального времени во время тренировок и соревнований в помещении и на открытом воздухе. Оценка ЧСС дает информацию как об интенсивности нагрузки, так и об уровне подготовки спортсмена, и также может иметь ценное значение в плане выявления нарушений сердечного ритма. Диагностика любого вида пароксизмальной аритмии у спортсменов, выявленной при помощи мобильного мониторинга, который, как правило, предназначен только для оценки ЧСС, должна сопровождаться дальнейшим полным кардиологическим обследованием. Учитывая более высокий риск развития ФП у профессиональных спортсменов, мобильные устройства могут служить ценным инструментом скрининга для ее выявления.
Важно отметить, что технологии мобильного здра — воохранения обеспечивают возможность быстрого доступа к медицинским данным спортсменов. Подобный подход может представлять особый интерес для контроля за здоровьем профессиональных атлетов во время соревнований, в т.ч. проводимых за рубежом.
4.6.2. Диета
В 2010г Американская Ассоциация сердца обнародовала стратегию “Life’s Simple 7” как проект общественного здравоохранения по улучшению сердечно-сосудистого здоровья населения под девизом: “7 маленьких шагов к большим переменам. Это легко и просто. Любой может это сделать. Начните с одного или двух!” К сожалению, исследования показали, что соответствовать подобной стратегии не так просто: практически ни один взрослый (<1% населения) не следует всем рекомендациям, а среди пациентов только 42% выполняют часть рекомендованных мероприятий (в среднем, от 0 до 2) (Folsom 2011). Хотя достоверно доказано, что снижение веса и поддержание идеальной массы тела позволяет снизить бремя симптомов ФП, эта рекомендация выполняется неудовлетворительно; в числе причин среди прочего неспособность объективно отслеживать объем питания пациентами (Abed 2013, Donnellan 2019, Pathak 2015).
Подход, включающий снижение веса в сочетании с модификацией ФР, имеет высокий уровень доказательности при лечении ФП (Класс Рекомендаций I) (B-R) (January 2019).
Снижение веса более чем на 10% и/или достижение целевых значений индекса массы тела <27 кг/м2 достоверно уменьшает вероятность развития ФП (Pathak 2015).
В настоящее время существует множество ориентированных на потребителя мобильных приложений для смартфонов (apps), предназначенных для контроля питания, но польза в подсчете углеводов ограничена из-за их дизайна (El-Gayar 2013). Как правило, подобные ориентированные на потребителя приложения требуют пошагового руководства по их использованию. Например, пользователь вводит тип и объем потребляемых продуктов, а затем прокручивает результаты поиска в соответствии с базой данных продуктов питания и ценности питательных веществ, отображаемых в функционале программы. Затем, найдя подходящий тип продуктов, пользователь должен оценить и ввести количество. Подобные приложения требуют пошагового введения комплекса данных пользователем и довольно больших затрат времени, при этом допуская вероятность ошибки. Кроме того, они также проигрывают в точности определения калорийности продуктов. Недавние исследования показали, что калькуляторы нутриентов от ведущих мобильных приложений отслеживания питания, как правило, занижали результаты, по сравнению с результатами использования классификации системы Nutrition Data System for Research (NDSR), которая применяется для анализа состояния питания на уровне официальных исследований (Griffiths 2018).
В отличие от ранее разработанных программ, мобильные приложения, основанные на визуализации с помощью технологии Assisted Dietary Assessment (TADA), лишены вышеупомянутых недостатков (Boushey 2017, Six 2010, Zhu 2010). Данный проект находится в стадии оценки клинической эффективности. Система TADA состоит из двух основных компонентов: (1) приложения для смартфонов, которое работает на базе устройств iPhone (iOS) или Android: Mobile Food Record (mFR) и (2) облачного сервера, который взаимодействует с mFR, обрабатывает и хранит изображения продуктов питания. Используя систему TADA, пользователь делает снимок продуктов с помощью камеры своего смартфона. Затем, на основании анализа и сравнения геометрических моделей, система TADA оценивает размер каждой порции продуктов с точностью до 15% от фактического количества (Dounavi 2019). Таким образом, современные цифровые технологии на базе смартфонов могут эффективно способствовать контролю веса за счет облегчения отслеживания состояния питания пользователей.
Несмотря на большое разнообразие мобильных приложений, имеющихся на рынке и позволяющих осуществлять коррекцию диеты и контролировать вес, а также тенденции к популяризации здорового образа жизни во многих социальных сферах, на данном этапе недостаточно доказательств того, что подобные приложения действительно эффективны (Fang 2015), в связи с чем требуется планирование и проведение дальнейших исследований.
Литература/References
4.
Chung MK, Eckhardt LL, Chen LY, et al. Lifestyle and Risk Factor Modification for Reduction of Atrial Fibrillation: A Scientific Statement From the American Heart Association. Circulation. 2020;141:e750-e772. doi:10.1161/CIR.0000000000000748.
January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation. 2019;140:e125-e151. doi:10.1161/CIR.0000000000000665.
4.1.
Avila CO. Novel Use of Apple Watch 4 to Obtain 3-Lead Electrocardiogram and Detect Cardiac Ischemia. The Permanente Journal. 2019;23:19-25.
Chow CK, Redfern J, Hillis GS, et al. Effect of Lifestyle-Focused Text Messaging on Risk Factor Modification in Patients With Coronary Heart Disease: A Randomized Clinical Trial. Journal of the American Medical Association. 2015;314:1255-63.
Clemmensen P, Loumann-Nielsen S, Sejersten M. Telemedicine fighting acute coronary syndromes. Journal of Electrocardiology. 2010;43:615-8.
Gibson CM, Holmes D, Mikdadi G, et al. Implantable Cardiac Alert System for Early Recognition of ST-Segment Elevation Myocardial Infarction. Journal of the American College of Cardiology. 2019;73:1919-27.
Holmes DR Jr, Krucoff MW, Mullin C, et al. Implanted Monitor Alerting to Reduce Treatment Delay in Patients With Acute Coronary Syndrome Events. Journal of the American College of Cardiology. 2019;74:2047-55.
Horwitz LI, Moriarty JP, Chen C, et al. Quality of discharge practices and patient understanding at an academic medical center. Journal of the American Medical Association Internal Medicine. 2013;173:1715-22.
Moser DK, Kimble LP, Alberts MJ, et al.; American Heart Association Council on Cardiovascular Nursing and Stroke Council. Reducing delay in seeking treatment by patients with acute coronary syndrome and stroke: a scientific statement from the American Heart Association Council on Cardiovascular Nursing and Stroke Council. Circulation. 2006;114:168-82.
Park LG, Beatty A, Stafford Z, Whooley MA. Mobile Phone Interventions for the Secondary Prevention of Cardiovascular Disease. Progress in Cardiovascular Diseases. 2016;58:639-50.
Pizzetti F, Turazza FM, Franzosi MG, et al.; GISSI-3 Investigators. Incidence and prognostic significance of atrial fibrillation in acute myocardial infarction: the GISSI-3 data. Heart. 2001;86:527-32.
Ritchey MD, Maresh S, McNeely J, et al. Tracking cardiac rehabilitation participation and completion among medicare beneficiaries to in- form the efforts of a national initiative.
Circulation: Cardiovascular Quality and Outcome. 2020;13:e005902.
Sanchez-Ross M, Oghlakian G, Maher J, et al. The STAT-MI (ST-Segment Analysis Using Wireless Technology in Acute Myocardial Infarction) trial improves outcomes. Journal of the American College of Cardiology. 2011;4:222-7.
Shariful Islam SM, Farmer AJ, Bobrow K, et al. Mobile phone text-messaging interventions aimed to prevent cardiovascular diseases (Text2PreventCVD): Systematic review and individual patient data meta-analysis. Open Heart. 2019;6:e001017.
Unal E, Giakoumidakis K, Khan E, Patelarou E. Mobile phone text messaging for improving secondary prevention in cardiovascular diseases: A systematic review. Heart Lung. 2018;47:351-9.
Van Heuverswyn F, De Buyzere M, Coeman M, et al. Feasibility and performance of a device for automatic self-detection of symptomatic acute coronary artery occlusion in outpatients with coronary artery disease: a multicentre observational study. Lancet Digital Health. 2019;1:e90-e99.
Varnfield M, Karunanithi M, Lee CK, et al. Smartphone-based home care model improved use of cardiac rehabilitation in postmyocardial infarction patients: results from a randomised controlled trial. Heart. 2014;100:1770-9.
Vollmer WM, Owen-Smith AA, Tom JO, et al. Improving adherence to cardiovascular disease medications with information technology. The American Journal of Managed Care. 2014;20(SP17):SP502-SP510.
Ziaeian B, Araujo KL, Van Ness PH, Horwitz LI. Medication reconciliation accuracy and patient understanding of intended medication changes on hospital discharge. Journal of General Internal Medicine. 2012;27:1513-20.
Zwisler AD, Norton RJ, Dean SG, et al. Home-based cardiac rehabilitation for people with heart failure: A systematic review and meta-analysis. International Journal of Cardiology. 2016;221:963-9.
4.2.
Abraham WT, Stevenson LW, Bourge RC, et al.; CHAMPION Trial Study Group. Sustained efficacy of pulmonary artery pressure to guide adjustment of chronic heart failure therapy: complete follow-up results from the CHAMPION randomized trial. Lancet. 2016;387:453-61.
Albert C, Estep JD. Economic impact of chronic heart failure management in today’s costconscious environment. Cardiac Electrophysiology Clinics. 2019;11:1-9. Benjamin EJ, Blaha MJ, Chiuve SE, et al.; American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 2017;135:e146-e603.
Boyne JJ, Vrijhoef HJ, Crijns HJ, et al.; TEHAF investigators. Tailored telemonitoring in patients with heart failure: results of a multicentre randomized controlled trial. European Journal of Heart Failure. 2012;14:791-801.
Carbo A, Gupta M, Tamariz L, et al. Mobile technologies for managing heart failure: a systematic review and meta-analysis. Telemedicine and e-Health. 2018;24(12): 958-68. doi:10.1089/tmj.2017.0269.
Chaudhry SI, Mattera JA, Curtis JP, et al. Telemonitoring in patients with heart failure. New England Journal of Medicine. 2010;363:2301-9.
Desai AS, Bhimaraj A, Bharmi R, et al. Ambulatory hemodynamic monitoring reduces heart failure hospitalizations in “real-world” clinical practice. Journal of the American College of Cardiology. 2017;69:2357-65.
Dickinson M, Allen L, Albert NA, et al. Consensus Statement. Remote monitoring of patients with heart failure: a white paper from the Heart Failure Society of America Scientific Statements Committee. Journal of Cardiac Failure. 2018;24:682-94. doi:10.1016/j. cardfail.2018.08.011.
Koehler F, Koehler K, Deckwart O, et al. Efficacy of telemedical interventional management in patients with heart failure (TIM-HF2): a randomised, controlled, parallel-group, unmasked trial. Lancet. 2018;392:1047-57. doi:10.1016/S0140-6736(18)31880-4.
Koehler F, Winkler S, Schieber M, et al.; Telemedical Interventional Monitoring in Heart Failure Investigators. Impact of remote telemedical management on mortality and hospitalizations in ambulatory patients with chronic heart failure: the Telemedical Interventional Monitoring in Heart Failure study. Circulation. 2011;123:1873-80.
Ong MK, Romano PS, Edgington S, et al.; Better Effectiveness After Transition-Heart Failure (BEAT-HF) Research Group. Effectiveness of remote patient monitoring after discharge of hospitalized patients with heart failure: the Better Effectiveness After Transition-Heart Failure (BEAT-HF) randomized clinical trial. Journal of the American Medical Association Internal Medicine. 2016;176:310-8.
Ono M, Varma N. Remote monitoring to Improve long-term prognosis in heart failure patients with implantable cardioverter-defibrillators. Expert Review of Medical Devices. 2017;14:335-42.
Takahashi PY, Pecina JL, Upatising B, et al. A randomized controlled trial of telemonitoring in older adults with multiple health issues to prevent hospitalizations and emergency department visits. Archives of Internal Medicine. 2012;172:773-9.
4.2.1.
Carbo A, Gupta M, Tamariz L, et al. Mobile technologies for managing heart failure: a systematic review and meta-analysis. Telemedicine and e-Health. 2018;24:958-68. doi:10.1089/tmj.2017.0269.
Chaudhry SI, Mattera JA, Curtis JP, et al. Telemonitoring in patients with heart failure. New England Journal of Medicine. 2010;363:2301-9.
Cipresso P, Serino S, Villani D, et al. Is your phone so smart to affect your states? An exploratory study based on psychophysiological measures. Neurocomputing. 2012;84:23-30.
Hamilton SJ, Mills B, Birch EM, Thompson SC. Smartphones in the secondary prevention of cardiovascular disease: a systematic review. BMC Cardiovascular Disorders. 2018;18:25.
Molinaro N, Massaroni C, Lo Presti D, et al. Wearable Textile Based on Silver Plated Knitted Sensor for Respiratory Rate Monitoring. Conference Proceedings IEEE Engineering in Medicine and Biology Society (EMBC) 2018;2865-8. doi:10.1109/EMBC.2018.8512958.
Stehlik J, Schmalfuss C, Bozkurt B, et al. Continuous Wearable Monitoring Analytics Predict Heart Failure Hospitalization The LINK-HF Multicenter Study. Circulation Heart Failure. 2020;13:e006513. doi:10.1161/CIRCHEARTFAILURE.119.006513.
4.2.2.
Ades PA, Pashkow FJ, Fletcher G, et al. A controlled trial of cardiac rehabilitation in the home setting using electrocardiographic and voice transtelephonic monitoring. American Heart Journal. 2000;139:543-8.
Kouidi E, Farmakiotis A, Kouidis N, Deligiannis A. Transtelephonic electrocardiographic monitoring of an outpatient cardiac rehabilitation programme. Clinical Rehabilitation. 2006;20:1100-4.
Piepoli MF, Conraads V, Corr? U, et al. Exercise trainin g in heart failure: from theory to practice. A consensus document of the Heart Failure Association and the European Association for Cardiovascular Prevention and Rehabilitation. European Journal of Heart Failure. 2011;13:347-57.
Piotrowicz E, Pencina MJ, Opolski G, et al. Effects of a 9-Week Hybrid Comprehensive Telerehabilitation Program on Long-term Outcoms in Patients With Heart Failure. The Telerehabilitation in Heart Failure Patients (TELEREH-HF) Randomized Clinical Trial. Journal of the American Medical Association Cardiology. 2019;5(3):300-8. doi:10.1001/jamacardio.2019.5006.
Piotrowicz E, Piepoli MF, Jaarsma T, et al. Telerehabilitation in heart failure patients: The evidence and the pitfalls. International Journal of Cardiology. 2016;220:408-13.
Piotrowicz E, Piotrowicz R, Opolski G, et al. Hybrid comprehensive telerehabilitation in heart failure patients (TELEREH-HF): A randomized, multicenter, prospective, open-label, parallel group controlled trial-Study design and description of the intervention. American Heart Journal. 2019;217:148-58.
Piotrowicz E, Piotrowski W, Piotrowicz R. Positive Effects of the Reversion of Depression on the Sympathovagal Balance after Telerehabilitation in Heart Failure Patients. Annals of Noninvasive Electrocardiology. 2016;21:358-68.
Piotrowicz E, Stepnowska M, Leszczyn?ska-Iwanicka K, et al. Quality of life in heart failure patients undergoing home-based telerehabilitation versus outpatient rehabilitation — a randomized controlled study. European Journal of Cardiovascular Nursing. 2015;14:256-63.
Piotrowicz E, Zielin?ski T, Bodalski R, et al. Home-based telemonitored Nordic walking training is well accepted, safe, effective and has high adherence among heart failure patients, including those with cardiovascular implantable electronic devices — a randomized controlled study. European Journal of Preventive Cardiology. 2015;22:1368-77.
Ponikowski P, Voors AA, Anker SD, et al.; ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 2016;37:2129-200.
Smart N, Haluska B, Jeffriess L, Marwick TH. Predictors of a sustained response to exercise training in patients with chronic heart failure: a telemonitoring study. American Heart Journal. 2005;150:1240-7.
Thomas RJ, Beatty AL, Beckie TM, et al. Home-Based Cardiac Rehabilitation. A Scientific Statement From the American Association of Cardiovascular and Pulmonary Rehabilitation the American Heart Association, and the American College of Cardiology. Journal of the American College of Cardiology. 2019;74:133-53.
4.3.
Agarwal P, Mukerji G, Desveaux L, et al. Mobile app for improved self-management of type 2 diabetes: multicenter pragmatic randomized controlled trial. JMIR Mhealth and Uhealth. 2019;7:e10321.
Andr?s E, Meyer L, Zulfiqar AA, et al. Telemonitoring in diabetes: evolution of concepts and technologies, with a focus on results of the more recent studies. Journal of Medicine and Life. 2019;12:203-14.
Balakumar P, Maung-U K, Jagadeesh G. Prevalence and prevention of cardiovascular disease and diabetes mellitus. Pharmacological Research. 2016;113(Pt A):600-9.
Chang SH, Wu LS, Chiou MJ, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort and in vitro studies. Cardiovascular Diabetology. 2014;13:123. doi:10.1186/s12933-014-0123-x.
Chao TF, Leu HB, Huang CC, et al. Thiazolidinediones can prevent new onset atrial fibrillation in patients with non-insulin dependent diabetes. International Journal of Cardiology. 2012;156:199-202. doi:10.1016/j.ijcard.2011.08.081.
Cosentino F, Grant PJ, Aboyans V, et al.; ESC Scientific Document Group. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. European Heart Journal. 2020;41:255-323. doi:10.1093/eurheartj/ehz486.
Donnelan E, Aagaard P, Kanj M, et al. Association Between Pre-Ablation Glycemic Control and Outcomes Among Patients With Diabetes Undergoing Atrial Fibrillation Ablation. Journal of the American Medical Association Clinical Electrophysiology. 2019;5:397-903.
Fleming GA, Petrie JR, Bergenstal RM, et al. Diabetes Digital App Technology: Benefits, Challenges, and Recommendations. A Consensus Report by the European Association for the Study of Diabetes (EASD) and the American Diabetes Association (ADA) Diabetes Technology Working Group. Diabetes Care. 2020;43:250-60. doi:10.2337/dci19-0062.
Fokkert MJ, van Dijk PR, Edens MA, et al. Performance of the FreeStyle Libre Flash glucose monitoring system in patients with type 1 and 2 diabetes mellitus. BMJ Open Diabetes Research & Care. 2017;5(1):e000320. doi:10.1136/bmjdrc-2016-000320.
Fokkert M, van Dijk P, Edens M, et al. Improved well-being and decreased disease burden after 1-year use of flash glucose monitoring (FLARE-NL4). BMJ Open Diabetes Research and Care. 2019;7:e000809. doi:10.1136/bmjdrc-2019-0008093.
Garabedian LF, Ross-Degnan D, Wharam JF. Mobile Phone and Smartphone Technologies for Diabetes Care and Self-Management. Current Diabetes Reports. 2015;15:109.
Goudis CA, Korantzopoulos P, Ntalas IV, et al. Diabetes mellitus and atrial fibrillation: Pathophysiological mechanisms and potential upstream therapies. International Journal of Cardiology. 2015;184:617-22.
Gu J, Liu X, Wang X, et al. Beneficial effect of pioglitazone on the outcome of catheter ablation in patients with paroxysmal atrial fibrillation and type 2 diabetes mellitus. Europace. 2011;13(9):1256-61. doi:10.1093/europace/eur131.
Liang X, Wang Q, Yang X, et al. Effect of mobile phone intervention for diabetes on glycaemic control: a meta-analysis. Diabetic Medicine. 2011;28:455-63.
Otake H, Suzuki H, Honda T, Maruyama Y. Influences of autonomic nervous system on atrial arrhythmogenic substrates and the incidence of atrial fibrillation in diabetic heart. International Heart Journal. 2009;50(5):627-41. doi:10.1536/ihj.50.627.
Pal K, Eastwood SV, Michie S, et al. Computer-based interventions to improve self-management in adults with type 2 diabetes: a systematic review and meta-analysis. Diabetes Care. 2014;37:1759-66.
Pillay J, Armstrong MJ, Butalia S, et al. Behavioral Programs for Type 1 Diabetes Mellitus: A Systematic Review and Meta-analysis. Annals of Internal Medicine. 2015;163:836-47.
Quinn C, Shardell M, Terrin M, et al. Cluster-randomized trial of a mobile phone personalized behavioral intervention for blood glucose control. Diabetes Care. 2011;34:1934-42.
Saffari M, Ghanizadeh G, Koenig HG. Health education via mobile text messaging for glycemic control in adults with type 2 diabetes: a systematic review and meta-analysis. Primary Care Diabetes. 2014;8:275-85.
Veazie S, Winchell K, Gilbert J, et al. Rapid Evidence Review of Mobile Applications for Selfmanagement of Diabetes. Journal of General Internal Medicine. 2018;33:1167-76.
Wang A, Green JB, Halperin JL, Piccini J P Sr. Atrial Fibrillation and Diabetes Mellitus. Journal of the American College of Cardiology. 2019;74:1107-15.
Whaley CM, Bollyky JB, Lu W, et al. Reduced medical spending associated with increased use of a remote diabetes management program and lower mean blood glucose values. Journal of Medical Economics. 2019;22:869-77.
Wilkinson MJ, Zadourian A, Taub PR. Heart Failure and Diabetes Mellitus: Defining the Problem and Exploring the Interrelationship. American Journal of Cardiology. 2019;124(Suppl 1):S3-S11.
Wingerter R, Steiger N, Burrows A, Estes NAM. Impact of Lifestyle Modification on Atrial Fibrillation. American Journal of Cardiology. 2020;125:289-97. doi:10.1016/j.amjcard.2019.10.018.
4.4.
Bosworth HB, Powers BJ, Olsen MK, et al. Home blood pressure management and improved blood pressure control: results from a randomized controlled trial. Archives of Internal Medicine. 2011;171:1173-80.
Duan Y, Xie Z, Dong F, et al. Effectiveness of home blood pressure telemonitoring: a systematic review and meta-analysis of randomised controlled studies. Journal of Human Hypertension. 2017;31:427-37.
Huxley RR, Lopez FL, Folsom AR, et al. Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 2011;123:1501-8.
Kim Y-N, Shin DG, Park S, Lee CH. Randomized clinical trial to assess the effectiveness of remote patient monitoring and physician care in reducing office blood pressure. Hypertension Research. 2015;38:491-7.
McManus RJ, Mant J, Bray EP, et al. Telemonitoring and self-management in the control of hypertension (TASMINH2): a randomised controlled trial. Lancet. 2010;376:163-72.
McManus RJ, Mant J, Franssen M, et al.; TASMINH4 investigators. Efficacy of self-monitored blood pressure, with or without telemonitoring, for titration of antihypertensive medication (TASMINH4): an unmasked randomised controlled trial. Lancet. 2018;391:949-59.
Monahan M, Jowett S, Nickless A, et al. Cost-Effectiveness of Telemonitoring and SelfMonitoring of Blood Pressure for Antihypertensive Titration in Primary Care (TASMINH4). Hypertension. 2019;73:1231-9.
Tucker KL, Sheppard JP, Stevens R, et al. Self-monitoring of blood pressure in hypertension: A systematic review and individual patient data meta-analysis. PLoS Medicine 2017;14:e1002389.
Williams B, ManciaG, Spiering W, et al. ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. European Heart Journal. 2018;39:3021-104.
4.5.
Berryhill S, Morton CJ, Dean A, et al. Effect of Wearables on Sleep in Healthy Individuals: A Randomized Crossover Trial and Validation Study. Journal of Clinical Sleep Medicine. 2020;16:775-83.
Burgess HJ, Trinder J, Kim Y, Luke D. Sleep and circadian influences on cardiac autonomic nervous system activity. The American Journal of Physiology. 1997;273:H1761-8.
Daghlas I, Dashti HS, Lane L, et al. Sleep duration and myocardial infarction. Journal of the American College of Cardiology. 2019;74:1304-14.
Hirshkowitz M, Whiton K, Albert SM, et al. National Sleep Foundation’s updated sleep duration recommendations: Final report. Sleep Health. 2015;1:233-43.
Huang T, Mariani S, Redline S. Sleep Irregularity and Risk of Cardiovascular Events: The Multi-Ethnic Study of Atherosclerosis. Journal of the American College of Cardiology. 2020;75:991-9. doi:10.1016/j.jacc.2019.12.054.
Khosla S, Deak MC, Gault D, et al.; American Academy of Sleep Medicine Board of Directors. Consumer Sleep Technology: An American Academy of Sleep Medicine Position Statement. Journal of Clinical Sleep Medicine. 2018;14:877-80.
Mantua J, Gravel N, Spencer RM. Reliability of Sleep Measures from Four Personal Health Monitoring Devices Compared to Research-Based Actigraphy and Polysomnography. Sensors. 2016;16:646. doi:10.3390/s16050646.
May AM, Blackwell T, Stone PH, et al.; MrOS Sleep (Outcomes of Sleep Disorders in Older Men) Study Group. Central sleep-disordered breathing predicts incident atrial fibrillation in older men. American Journal of Respiratory Critical Care Medicine. 2016;193:783-91.
May AM, Van Wagoner DR, Mehra R. OSA and Cardiac Arrhythmogenesis: Mechanistic Insights. Chest. 2017;151:225-41.
Mehra R, Benjamin EJ, Shahar E, et al.; Sleep Heart Health Study. Association of nocturnal arrhythmias with sleep-disordered breathing: the Sleep Heart Health Study. American Journal of Respiratory Critical Care Medicine. 2006;173:910-6.
Qureshi WT, Nasir UB, Alqalyoobi S, et al. Meta-analysis of continuous positive airway pressure as a therapy of atrial fibrillation in obstructive sleep apnea. American Journal of Cardiology. 2015;116:1767-73. doi:10.1016/j.amjcard.2015.08.046.
Selvaraj N, Narasimhan R. Automated prediction of the apnea-hypopnea index using a wireless patch sensor. Conference Proceedings IEEE Eng Med Biol Soc. 2014;2014:1897-900. doi:10.1109/EMBC.2014.6943981.
Youssef I, Kamran H, Yacoub M, et al. Obstructive sleep apnea as a risk factor for atrial fibrillation: a meta-analysis. Journal of Sleep Disorders & Therapy. 2018;7:282. doi:10.4172/2167-0277.1000282.
https://bodimetrics.com/product/circul-sleep-and-fitness-ring
Institute of Medicine (US) Committee on Sleep Medicine and Research; Colten HR AB, editors. Sleep Disorders and Sleep Deprivation: An Unmet Public Health Problem. Washington (DC): National Academies Press (US); 2006. 3, Extent and Health Consequences of Chronic Sleep Loss and Sleep Disorders. Available from: http://www.ncbi.nlm.nih.gov/books/NBK19961/. doi:10.17226/11617.
4.6.1.
Abdulla J, Nielsen JR. Is the risk of atrial fibrillation higher in athletes thanin the general population? A systematic review and meta-analysis. Europace. 2009;11:1156-9. doi:10.1093/europace/eup197.
Andersen K, Farahmand B, Ahlbom A, et al. Risk of arrhythmias in 52 755 long-distance crosscountry skiers: a cohort study. European Heart Journal. 2013;34:3624-31. doi:10.1093/eurheartj/eht188.
Aroganam G, Manivannan N, Harrison D. Review on Wearable Technology Sensors Used in Consumer Sport Applications. Sensors. 2019;19:1983. doi:10.3390/s19091983.
Brunetti ND, Dellegrottaglie G, Di Giuseppe G, et al. Young Football Italian amateur players Remote electrocardiogram Screening with Telemedicine (YOU FIRST) study: preliminary results. International Journal of Cardiology. 2014;176:1257-8.
Coppetti T, Brauchlin A, M?ggler S, et al. Accuracy of smartphone apps for heart rate measurement. European Journal of Preventive Cardiology. 2017;24:1287-93.
Dobbs WC, Fedewa MV, MacDonald HV, et al. The Accuracy of Acquiring Heart Rate Variability from Portable Devices: A Systematic Review and Meta-Analysis. Sports Medicine. 2019;2019(49):417-35. doi:10.1007/s40279-019-01061-5.
Everett BM, Conen D, Buring JE, et al. Physical activity and the risk of incident atrial fibrillation in women. Circulation Cardiovascular Quality Outcomes. 2011;4:321-7.
Faselis C, Kokkinos P, Tsimploulis A, et al. Exercise capacity and atrial fibrillation risk in veterans: a cohort study. Mayo Clinical Proceedings. 2016;91(5):558-66. doi:10.1016/j.mayocp.2016.03.002.
Jakicic JM, Davis KK, Rogers RJ, et al. Effect of Wearable Technology Combined With a Lifestyle Intervention on Long-term Weight Loss: The IDEA Randomized Clinical Trial. Journal of the American Medical Association. 2016;316:1161-71.
Kramer DB, Mitchell SL, Monteiro J, et al. Patient Activity and Survival Following Implantable Cardioverter-Defibrillator Implantation: The ALTITUDE Activity Study. Journal of the American Heart Association. 2015;4:e001775. doi:10.1161/JAHA.115.001775.
Li RT, Kling SR, Salata MJ, et al. Wearable Performance Devices in Sports Medicine. Sports Health. 2016;8:74-8.
McConnell MV, Turakhia MP, Harrington RA, et al. Mobile Health Advances in Physical Activity, Fitness, and Atrial Fibrillation: Moving Hearts. Journal of the American College of Cardiology. 2018;71:2691-701.
Mozaffarian D, Furberg CD, Psaty BM, Siscovick D. Physical activity and incidence of atrial fibrillation in older adults — The cardiovascular health study. Circulation. 2008;118:800-7.
Orchard JJ, Neubeck L, Orchard JW, et al. ECG-based cardiac screening programs: Legal, ethical, and logistical considerations. Heart Rhythm. 2019;16:1584-91.
Pathak RK, Elliott A, Middeldorp ME, et al. Impact of CARDIOrespiratory FITness on Arrhythmia Recurrence in Obese Individuals With Atrial Fibrillation: the CARDIO-FIT Study. Journal of the American College of Cardiology. 2015;66:985-96. doi:10.1016/j.jacc.2015.06.488.
Peake JM, Kerr G, Sullivan JP. A Critical Review of Consumer Wearables, Mobile Applications, and Equipment for Providing Biofeedback, Monitoring Stress, and Sleep in Physically Active Populations. Front Physiol. 2018;9:743. doi:10.3389/fphys.2018.00743.
Peart DJ, Balsalobre-Fern?ndez C, Shaw MP. Use of Mobile Applications to Collect Data in Sport, Health, and Exercise Science: A Narrative Review. The Journal of Strength & Conditioning Research. 2019;33:1167-77.
Piercy KL, Troiano RP, Ballard RM, et al. The Physical Activity Guidelines for Americans. Journal of the American Medical Association. 2018;320:2020-8. doi:10.1001/jama.2018.14854.
Rosenberger ME, Buman MP, Haskell WL, et al. Twenty-four Hours of Sleep, Sedentary Behavior, and Physical Activity with Nine Wearable Devices. Medicine and Science in Sports and Exercise. 2016;4:457-65.
Seshadri DR, Li RT, Voos JE, et al. Wearable sensors for monitoring the internal and external workload of the athlete. NPJ Digital Medicine. 2019;2:71.
Singh N, Moneghetti KJ, Christle JW, et al. Heart Rate Variability: An Old Metric with New Meaning in the Era of Using mHealth technologies for Health and Exercise Training Guidance. Part Two: Prognosis and Training. Arrhythmia & Electrophysiology Review. 2018;7:247-55.
Sullivan AN, Lachman ME. Behavior Change with Fitness Technology in Sedentary Adults: A Review of the Evidence for Increasing Physical Activity. Frontiers in Public Health. 2017;4:289. doi:10.3389/fpubh.2016.00289.
IQUIVA Institute. The Growing Value of Digital Health: Evidence and Impact on Human Health and the Healthcare System. 2017. Available at: https://www.iqvia.com/insights/the-iqviainstitute/reports/the-growing-value-of-digital-health.
4.6.2.
Abed HS, Wittert GA, Leong DP, et al. Effect of Weight Reduction and Cardiometabolic Risk Factor Management on Symptom Burden and Severity in Patients With Atrial Fibrillation A Randomized Clinical Trial. Journal of the American Medical Association. 2013;310:2050-60.
Boushey CJ, Spoden M, Zhu FM, et al. New mobile methods for dietary assessment: review of image-assisted and image-based dietary assessment methods. The Proceedings of the Nutrition Society. 2017;76:283-94.
Donnellan E, Wazni O, Kanj M, et al. Outcomes of Atrial Fibrillation Ablation in Morbidly Obese Patients Following Bariatric Surgery Compared With a Nonobese Cohort. Circulation: Arrhythmia and Electrophysiology. 2019;12:e007598.
Donnellan E, Wazni OM, Kanj M, et al. Association between pre-ablation bariatric surgery and atrial fibrillation recurrence in morbidly obese patients undergoing atrial fibrillation ablation. Europace. 2019;21:1476-83.
Dounavi K, Tsoumani O. Mobile Health Applications in Weight Management: A Systematic Literature Review. American Journal of Preventive Medicine. 2019;56:894-903.
El-Gayar O, Timsina P, Nawar N, Eid W. Mobile applications for diabetes self-management: status and potential. Journal of Diabetes Science and Technology. 2013;7:247-62.
Fang S, Liu C, Zhu F, et al. Single-View Food Portion Estimation Based on Geometric Models. ISM: IEEE International Symposium on Multimedia: proceedings IEEE International Symposium on Multimedia. 2015;2015:385-90.
Folsom AR, Yatsuya H, Nettleton JA, et al., Investigators AS (2011). Community prevalence of ideal cardiovascular health, by the American Heart Association definition, and relationship with cardiovascular disease incidence. Journal of the American College of Cardiology. 2011;57:1690-6.
Griffiths C, Harnack L, Pereira MA. Assessment of the accuracy of nutrient calculations of five popular nutrition tracking applications. Public Health Nutrition. 2018;21:1495-502.
Pathak RK, Middeldorp ME, Meredith M, et al. Long-Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort A Long-Term Follow-Up Study (LEGACY). Journal of the American College of Cardiology. 2015;65:2159-69.
Six BL, Schap TE, Zhu FQM, et al. Evidence-Based Development of a Mobile Telephone Food Record. Journal of the American Dietetic Association. 2010;110:74-9.
Zhu FQ, Bosch M, Woo I, et al. The Use of Mobile Devices in Aiding Dietary Assessment and Evaluation. IEEE Journal of Selected Topics in Signal Processing. 2010;4:756-66.
5. Самоконтроль пациентов как интегрированный длительный подход к терапии
Как правило, структурированные программы контроля, включающие интенсивное обучение пациентов, способны улучшить результаты лечения (Hendriks 2012, Lin 2014, Angaran 2015). Этому может способствовать применение технологий цифрового здравоохранения.
5.1. Активная роль пациента
Использование мобильных технологий в лечении дает возможность более эффективно охватить большее число пациентов. Данные программы могут способствовать активному вовлечению в лечебный процесс пациентов, особенно в регионах, где затруднен доступ к высокотехнологичным методам вследствие высокой стоимости терапии, временных затрат, отдаленных расстояний, различий социальных классов, неодинакового доступа к возможностям здравоохранении и т.д. Таким образом, технологии mHealth могут облегчить информирование пользователей о различных видах нарушений ритма и способах их коррекции и обеспечить двустороннее взаимодействие между пациентами и медицинскими работниками без необходимости задействовать сложную инфраструктуру (Chow 2016, Walsh 2014) (рис. 6). Приложения могут помочь медицинскими работниками объяснить состояние здоровья и различные варианты лечения, используя видео, аватары и шкалы индивидуальной оценки риска, позволяя лучше понять состояние здоровья и психологические особенности пациентов, поощряя обоюдный обмен информацией для достижения согласованного решения по выбору лечебного алгоритма.
Доступ пациентов к собственным медицинским данным
Недавно опубликованный консенсус Ассоциации ритма сердца постулирует необходимость прозрачного и безопасного доступа пациентов к своим цифровым данным (Slotwiner 2019). Это обеспечивает активное участие пациента в ходе лечебного процесса и соответствующий самоконтроль. Например, многие пациенты с ФП заинтересованы в том, чтобы следить за частотой возникновения приступов аритмии, тяжестью симптомов и основными физиологическими параметрами, подобно тому, как пациенты с гипертонией отслеживают свой уровень АД или пациенты с СД контролируют свой уровень глюкозы крови. Недавние систематические обзоры возможных пациент-ориентированных технологий, направленных на лечение ССЗ, свидетельствуют о том, что пациентов привлекает возможность самоконтроля симптомов и измерений основных физиологических параметров, а также ежедневное отслеживание модели поведения в отношении здоровья, получение информации о своем заболеваний, функции напоминания и онлайн-взаимодействие с медицинскими работниками (Coorey 2018, Gandhi 2017, Park 2016, Pfaeffli 2016). При некоторых ССЗ изолированный самоконтроль состояния здоровья и процесса лечения пациентом (без какого-либо участия медицинских работников) достоверно способствует улучшению результатов терапии (Hagglund 2015, Varnfield 2014).
В теории предполагается, что при использовании технологий мобильного здравоохранения пациенты берут на себя ответственность за своевременный самоконтроль состояния здоровья и отслеживание симптомов с проведением коррекции лечения, если это необходимо. Данный подход возможно реализовать, если основные данные, отражаемые в мобильном приложении, будут изложены в формате, понятном для широкого круга пользователей, не имеющих профессионального медицинского образования. Активная роль пациента в процессе принятия решений по выбору тактики особенно подчеркивается современными клиническими руководствами по лечению ФП. Так, повышение информированности пациентов о своем заболевании позволяет улучшить понимание возможных вариантов развития симптомов, принципов их коррекции и профилактики осложнений, а также помогает наладить взаимодействие пациентов и членов их семей с клиническими специалистами, что сопровождается лучшей приверженностью к назначаемой терапии. В настоящее время консорциумом CATCH ME в сотрудничестве с ЕОК (Kotecha 2018) разработаны два цифровых приложения, посвященных вопросам ФП — одно для пациентов, а другое для медицинских работников, но они пока не прошли официальное тестирование. В работе китайских авторов (Guo 2017) продемонстрировано, что мобильное приложение для лечения ФП (mAFA), включающее поддержку принятия решений и обучение пациентов, значительно улучшает информированность лиц с ФП о своем заболевании, повышает приверженность к медикаментозной терапии, качество жизни и позволяет достичь лучшего режима приема антикоагулянтов по сравнению с обычным подходом.
Следует отметить возможные ограничения:
Самоконтроль с помощью мобильных устройств в ряде случаев может быть сложным даже для мотивированных пациентов. Поэтому работа с приложением должна быть достаточно простой для пользователя, функции должны быть понятны, а интерпретация данных и смена настроек при необходимости не должны вызывать затруднений.
5.2. Модификация поведения
В настоящее время индивидуальный статус здоровья пациента рассматривается как наиболее сильный предиктор смертности и неблагоприятных сердечно-сосудистых событий (Rumsfeld 2013).
Активное применение цифровых технологий может способствовать повышению эффективности лечения за счет достижения положительных изменений в поведении пациента. Этим можно объяснить лучшую выживаемость пациентов с сердечными имплантированными устройствами, вероятно, за счет более тщательного дистанционного мониторинга (Varma 2015). Мобильные приложения могут контролировать процесс лечения пациентов с помощью отправки текстовых сообщений (Chow 2015), напоминаний о дозах и времени приема лекарств, а также о запланированных медицинских осмотрах (но не всегда удается достичь синхронизации данных с провайдерами медицинских услуг и или статистикой электронных медицинских регистраторов). Оптимальным представляется использование принципа “Just in time adaptive intervention: своевременное адаптационное вмешательство”, который заключается в предоставлении соответствующей индивидуальной клинической и психологической поддержки пациентам в нужное время, с возможностью адаптации в зависимости от текущих индивидуальных и ситуационных факторов (Nahum Shani 2018). Технологии цифрового здравоохранения являются идеальной платформой для реализации данного принципа за счет возможности предоставления персонализированной информации в режиме реального времени, которая может быть использована в целях повышения эффективности лечения пациентов. Использование данной программы перспективно в отношении поддержки изменения образа жизни пациентов, но доказательства ее эффективности пока ограничены (Gustafson 2014, Patrick 2009, Riley 2008). Важным является четкое соблюдение расписания по своевременному приему препаратов, режиму ФА и готовность пациентов к сотрудничеству в онлайн-режиме (Nahum-Shani 2015). Как правило, наиболее эффективно мобильные технологии реализуются в игровой форме с использованием интерактивных мотивационных сообщений и других видов индивидуального взаимодействия (Coorey 2018, Gandhi 2017, Park 2016, Pfaeffli 2016).
Модификация поведенческой модели пациента с помощью включения игровых стратегий (например, использования электронных вознаграждений, призов, стикеров, проведения виртуального соревнования лидеров и других форм интерактивного взаимодействия) более привлекательна с точки зрения участников и способствует достижению здорового поведения на более ранних этапах (Blondon 2017, Cugelman 2013, Edwards 2016, Johnson 2016, Sardi 2017). Тем не менее, этот подход пока не является широко распространенным, и только 4% (64 из 1680) наиболее популярных англоязычных мобильных приложений для самоконтроля здоровья включают хотя бы одну игровую функцию (Edwards 2016), в то время как доказательных данных по влиянию подобных технологий на эффективность лечения пациентов с нарушениями ритма пока не достаточно.
Методы изменения саморегуляции поведения, такие как обратная связь и мониторинг (включая самоконтроль), сравнение поведения, вознаграждения, стимулы и угрозы, а также социальная поддержка, являются наиболее распространенными методами изменения поведения, используемыми в приложениях геймификации, и часто используются в успешных приложениях без игр, нацеленных на укрепление здоровья и вторичную профилактику (Conroy 2014, Direito 2014, Edwards 2016). Отдельным аспектом положительного влияния мобильных приложений в игровом формате на комплайнс пациентов считается улучшение их психологического статуса, что приводит к лучшему соблюдению врачебных рекомендаций (Johnson 2016).
5.3. Пациент как участник сообщества (врач-пациент)
Для пациента важным преимуществом при использовании мобильных приложений является возможность стать участником социального онлайн-сообщества, включающего остальных пользователей, врачей-консультантов и других специалистов, занимающихся лечением нарушений ритма (Fox 2011). Подобные онлайн-группы позволяют людям общаться в виртуальном пространстве, делиться своим опытом, обсуждать лечение, а также получать дополнительную поддержку от медицинских работников или организаций пациентов (Fox 2011, Swan 2009, Swan 2012). Но следует учитывать, что при создании подобных групп и привлечении внимания общественности через интернет и социальные сети, когда происходит обмен информацией среди большого количества людей, нужно во многом более критично относиться к поступающим данным, т.к. проверить достоверность и точность информации в значительной степени не удается (Besaleva & Weaver 2014).
5.4. Поддержание активной роли пациента
Поддержание здоровой модели поведения и минимизация отклонений от предписанных врачебных назначений имеют первостепенное значение для обеспечения качества лечения, особенно в долгосрочной перспективе. Хотя технологии мобильного здравоохранения помогают сохранить мотивацию пациентов к лечению, имеющиеся данные демонстрируют, что для пациентов возможен синдром так называемого “выгорания”, когда они теряют интерес к проводимой терапии с последующим снижением комплайнса в ходе лечебных мероприятий, направленных на модификацию ФР и коррекцию хронических заболеваний, даже когда люди говорят, что им нравится методика и отрицают подобную возможность снижения эффективности лечения (Chaudhry 2010, Flores Mateo 2015, Fukuoka 2015, Morgan 2017, Owen 2015, Simblett 2018, Whitehead 2016, Endeavour Partners, Perez 2019).
Наглядный опыт одного из пациентов описан ниже:
“Несколько лет назад (в 2017г) один мой друг рассказал мне о новом приложении, которое он установил на свой iPhone, и которое позволяет ему измерять частоту сердечных сокращений с помощью детекции пульсации на кончике пальца. Так как у меня диагностирована аритмия, контролируемая с помощью лекарств, мне было очень интересно попробовать новое приложение. Я думал, что это даст мне возможность узнать больше о себе, особенно о том, как мое сердце работает в условиях стресса и в разное время дня, до, во время и после физических нагрузок и спорта, включая мой любимый теннис, гольф, велосипед и рыбалку.
Поначалу я был вполне доволен элементарными расчетами. Затем во время командировок и деловых поездок я заметил, что устройство часто не работает в ночное время, и поначалу думал, что это обусловлено обновлением приложения. Я также заметил, что несколько раз показания прибора были абсолютно неточными, особенно в ранние утренние часы. Приложение просто не соответствовало стандартам традиционных устройств мониторинга. Я также обнаружил повышенное внимание со стороны компании-производителя продукта, которые предпринимали навязчивые возрастающие попытки повысить продажи премиальных пакетов услуг и других онлайн-инструментов управления здоровьем, что совсем удручало.
Вскоре я почувствовал себя почти зависимым от этого устройства и в конце концов совсем бросил его применять. Оглядываясь назад, я думаю, что, если бы я должным образом ознакомился с устройством с помощью консультации квалифицированного специалиста, у меня, возможно, были бы другие ожидания от этого онлайн-инструмента, как его использовать и как интерпретировать его результаты работы.”
Данный пример еще раз иллюстрирует, что понимание основ здоровой модели поведения, в т.ч. при пользовании мобильными устройствами, имеет жизненно важное значение для эффективного контроля заболевания (Dunton 2018). Многие приложения, в т.ч. доступные на веб-сайтах национальных кардиологических сообществ, способны эффективно работать в плане поддержания здорового образа жизни, но их эффективность во многом остается непроверенной или ограничена дизайном исследования (т.е., небольшие размеры выборки, неверные критерии отбора и т.д.). Стоимость подключения услуги и достоверность получаемой информации являются важными факторами. И немаловажно, что активное использование подобных технологий пациентами может быть поставлено под угрозу из-за беспокойства о конфиденциальности и безопасности персональных данных (Burke 2015, Chow 2016, Kumar 2013, Steinhubl 2015).
Продолжение клинической поддержки
Уровень и продолжительность необходимой клинической поддержки, скорее всего, будут зависеть от исходного состояния здоровья пациента и целей лечения. Сокращение обязательных рутинных обследований, требующих обращения в клинику, и смещение акцента на длительный дистанционный мониторинг достоверно улучшают качество наблюдения пациентов с имплантированными сердечными устройствами на долгосрочном этапе (Varma 2014). В одном из исследований, посвященных СН, прирост ФА пациентов был связан с длительностью дистанционного обучения. Указывает ли это на то, что эффективность активной программы наблюдения на определенном этапе достигает пика и стабилизируется, или что, напротив, ее необходимо продолжать, пока неясно (Varma 2020). В идеале, программа поддержки должна быть все-таки ограничена по времени, а результат обучения на выходе должен сохраняться как можно дольше в целях повышения эффективности.
5.5. Электронно-цифровой барьер (цифровое неравенство)
Хотя электронные приложения и мобильные устройства представляют собой весьма перспективный инструмент, способный изменить структуру традиционного здравоохранения, их использование потенциально может усугубить определенный барьер, заключающийся в неодинаковой доступности цифровых технологий для разных социально-демографических групп населения.
Считается, что пожилым людям менее доступны подобные программы, и они реже пользуются мобильными приложениями. Опрос Pew Research Center 2017г показал, что 92% людей в возрасте 18- 29 лет владеют смартфонами, в то время как в возрасте 50-64 лет таких людей только 74% (Smith 2017). Однако основным препятствием все-таки является не отсутствие интереса к цифровым технологиям, а, прежде всего, техническое отсутствие навыков пользования ими и даже отсутствие мобильных устройств (Coorey 2018, Gallagher 2017, Tarakji 2018). Пожилые пользователи, как правило, предпочитают получать персонализированную информацию, которая четко представлена и в которой легко ориентироваться (Neubeck 2015).
Кроме того, пользователи могут иметь неодинаковый уровень образования: смартфонами пользуются 57% населения с неполным средним образованием и 91% людей, окончивших высшие учебные заведения.
Частота использования смартфонов различается в зависимости от уровня доходов, при этом смартфонами пользуются 67% населения с годовым доходом ? $30 тыс. и 93% населения с доходом ? $75 тыс. (PR.C Mobile 2018). В США предполагается, что, хотя существуют некоторые различия в использовании мобильных технологий, связанные с этнической принадлежностью, в целом все пациенты находятся примерно в одинаковом положении (Martin 2012). Современный дизайн цифровых приложений позволяет адаптировать интерфейс приложения к любым языкам, включая функцию речевого воспроизведения текста, а также учитывать возможные особенности и культурные различия с целью облегчения адаптации пациентов к лечению (Coorey 2018, Neubeck 2017, Redfern 2016).
Также необходимо принимать во внимание неодинаковую доступность технологий mHealth в разных странах и регионах (Varma 2020). Некоторые из часто используемых и одобренных FDA технологий, имеющих марку CE, могут быть в настоящее время не везде доступны из-за нормативных или маркетинговых правил или просто иметь высокую стоимость как для отдельных пользователей, так и для всей системы здравоохранения в целом.
Поскольку на современном этапе структура здравоохранения в большинстве стран включает элементы, основанные на цифровых принципах, крайне важным является формирование стратегии по обеспечению надлежащей высококачественной медицинской помощью тех групп населения, кто не имеет доступа к подобным технологиям. Эта важнейшая инициатива требует согласованных действий всех заинтересованных сторон, включая специалистов
здравоохранения, госпитальных систем, страховых компаний, а также государственных и федеральных правительственных организаций. Таким образом, предполагается, что мобильные технологии во многом способны улучшить результаты лечения пациентов, особенно в условиях ограниченных ресурсов или отсутствия возможности очных визитов и регулярных посещений клинических учреждений (Bhavnani 2017).
Литература/References
5.
Angaran P, Mariano Z, Dragan V, et al. The Atrial Fibrillation Therapies after ER visit: Outpatient Care for Patients with Acute AF: the AFTER3 study. Journal of Atrial Fibrillation. 2015;7:1187. doi:10.4022/jafib.1187.
Lin JS, O’Connor EA, Evans CV, et al. Behavioral Counseling to Promote a Healthy Lifestyle for Cardiovascular Disease Prevention in Persons With Cardiovascular Risk Factors: An Updated Systematic Evidence Review for the U.S. Preventive Services Task Force [Internet] Rockville (MD): Agency for Healthcare Research and Quality (US); U.S. Preventive Services Task Force Evidence Syntheses, formerly Systematic Evidence Reviews. 2014. Report No.: 13-05179-EF-1.
Hendriks JM, de Wit R, Crijns HJ, et al. Nurse-led care vs. usual care for patients with atrial fibrillation: results of a randomized trial of integrated chronic care vs. routine clinical care in ambulatory patients with atrial fibrillation. European Heart Journal. 2012;33(21):2692-9. doi:10.1093/eurheartj/ehs071.
5.1.
Chow CK, Ariyarathna N, Islam SM, et al. mHealth in Cardiovascular Health Care. Heart Lung & Circulation. 2016;25:802-7.
Coorey GM, Neubeck L, Mulley J, Redfern J. Effectiveness, acceptability and usefulness of mobile applications for cardiovascular disease self-management: Systematic review with meta-synthesis of quantitative and qualitative data. European Journal of Preventive Cardiology. 2018;25:505-21.
Gandhi S, Chen S, Hong L, et al. Effect of Mobile Health Interventions on the Secondary Prevention of Cardiovascular Disease: Systematic Review and Meta-analysis. Canadian Journal of Cardiology. 2017;33:219-31.
Guo Y, Chen Y, Lane DA, et al. Mobile health technology for atrial fibrillation management integrating decision support, education and patient involvement: mAF App trial. The American Journal of Medicine. 2017;130:1388-96.e6. doi:10.1016/j.amjmed.2017.07.003.
Hagglund E, Lynga P, Frie F, et al. Patient-centred home-based management of heart failure. Findings from a randomised clinical trial evaluating a tablet computer for self-care, quality of life and effects on knowledge. Scandinavian Cardiovascular Journal. 2015;49:193-9.
Kotecha D, Chua WWL, Fabritz L, et al.; European Society of Cardiology (ESC) Atrial Fibrillation Guidelines Taskforce, the CATCH ME consortium and the European Heart Rhythm Association (EHRA). European Society of Cardiology smartphone and tablet applications for patients with atrial fibrillation and their health care providers. Europace. 2018;20:225-33. doi:10.1093/europace/eux299.
Park LG, Beatty A, Stafford Z, Whooley MA. Mobile Phone Interventions for the Secondary Prevention of Cardiovascular Disease. Progress in Cardiovascular Diseases. 2016;58:639-50.
Pfaeffli Dale L, Dobson R, Whittaker R, Maddison R. The effectiveness of mobile-health behaviour change interventions for cardiovascular disease self-management: A systematic review. European Journal of Preventive Cardiology. 2016;23:801-17.
Slotwiner DJ, Tarakji KG, Al-Khatib SM, et al. Transparent sharing of digital health data: A call to action. Heart Rhythm. 2019;16:e95-e106. doi:10.1016/j.hrthm.2019.04.042.
Walsh JA 3rd, Topol EJ, Steinhubl SR. Novel wireless devices for cardiac monitoring. Circulation. 2014;130:573-81.
Varnfield M, Karunanithi M, Lee CK, et al. Smartphone-based home care model improved use of cardiac rehabilitation in postmyocardial infarction patients: results from a randomised controlled trial. Heart. 2014;100:1770-9.
U.S. Department of Veterans Affairs. VA to provide capability for veterans to access their VA health data on Apple iPhones. Available at: https://www.va.gov/opa/pressrel/pressrelease.cfm?id55199.
5.2.
Blondon K, Meyer P, Lovis C, Ehrler F. Gamification and mHealth: a model to bolster cardiovascular disease self-management. Swiss Medical Informatics. 2017 2017;33(00):00398. doi:10.4414/smi.33.00398.
Chow CK, Redfern J, Hillis GS, et al. Effect of Lifestyle-Focused Text Messaging on Risk Factor Modification in Patients With Coronary Heart Disease: A Randomized Clinical Trial. Journal of the American Medical Association. 2015;314:1255-63.
Conroy DE, Yang CH, Maher JP. Behavior change techniques in top-ranked mobile apps for physical activity. American Journal of Preventive Medicine. 2014;46:649-52.
Coorey GM, Neubeck L, Mulley J, Redfern J. Effectiveness, acceptability and usefulness of mobile applications for cardiovascular disease self-management: Systematic review with meta-synthesis of quantitative and qualitative data. European Journal of Preventive Cardiology. 2018;25:505-21. doi:10.1177/2047487317750913.
Cugelman B. Gamification: what it is and why it matters to digital health behavior change developers. JMIR Serious Games. 2013;1:e3.
Direito A, Dale LP, Shields E, et al. Do physical activity and dietary smartphone applications incorporate evidence-based behaviour change techniques? BMC Public Health. 2014;14:646.
Edwards EA, Lumsden J, Rivas C, et al. Gamification for health promotion: systematic review of behaviour change techniques in smartphone apps. British Medical Journal Open. 2016;6:e012447.
Gustafson DH, McTavish FM, Chih MY, et al. A smartphone application to support recovery from alcoholism: a randomized clinical trial. Journal of the American Medical Association Psychiatry. 2014;71:566-72.
Johnson D, Deterding S, Kuhn KA, et al. Gamification for health and wellbeing: A systematic review of the literature. Internet Interventions. 2016(6):89-106.
Nahum-Shani I, Smith SN, Spring BJ, et al. Just-in-Time Adaptive Interventions (JITAIs) in Mobile Health: Key Components and Design Principles for Ongoing Health Behavior Support. Annals of Behavioral Medicine. 2018;52:446-62.
Nahum-Shani I, Hekler EB, Spruijt-Metz D. Building health behavior models to guide the development of just-in-time adaptive interventions: A pragmatic framework. Health Psychology. 2015;34s:1209-19.
Patrick K, Raab F, Adams MA, et al. A text message-based intervention for weight loss: randomized controlled trial. Journal of Medical Internet Research. 2009;11:e1.
Pfaeffli Dale L, Dobson R, Whittaker R, Maddison R. The effectiveness of mobile-health behaviour change interventions for cardiovascular disease self-management: A systematic review. European Journal of Preventive Cardiology. 2016;23:801-17.
Riley W, Obermayer J, Jean-Mary J. Internet and mobile phone text messaging intervention for college smokers. Journal of American College Health. 2008;57:245-8.
Rumsfeld JS, Alexander KP, Goff DC Jr, et al.; American Heart Association Council on Quality of Care and Outcomes Research, Council on Cardiovascular and Stroke Nursing, Council on Epidemiology and Prevention, Council on Peripheral Vascular Disease, and Stroke Council. Cardiovascular Health: The Importance of Measuring Patient-Reported Health Status A Scientific Statement From the American Heart Association. Circulation. 2013;127:2233-49. doi:10.1161/CIR.0b013e3182949a2e.
Sardi L, Idri A, Fernandez-Aleman JL. A systematic review of gamification in e-Health. Journal of Biomedical Informatics. 2017;71:31-48.
Varma N, Piccini JP, Snell J, et al. The Relationship Between Level of Adherence to Automatic Wireless Remote Monitoring and Survival in Pacemaker and Defibrillator Patients. Journal of the American College of Cardiology. 2015;65:2601-10. doi:10.1016/j.jacc.2015.04.033.
5.3.
Besaleva LI, Weaver AC. CrowdHelp: m-Health Application for Emergency Response Improvement through Crowdsourced and Sensor-Detected Information. Available at https://ieeexplore.ieee.org/document/6693335. doi:10.1109/WTS.2014.6835005.
Fox S. The Social Life of Health Information. https://www.pewresearch.org/facttank/2014/01/15/the-social-life-of-health-information/.
Swan M. Emerging patient-driven health care models: an examination of health social networks, consumer personalized medicine and quantified self-tracking. International Journal of Environmental Research and Public Health. 2009;6:492-525.
Swan M. Health 2050: The Realization of Personalized Medicine through Crowdsourcing, the Quantified Self, and the Participatory Biocitizen. Journal of Personalized Medicine. 2012;2:93-118.
5.4.
Burke LE, Ma J, Azar KM, et al. Current science on consumer use of mobile health for cardiovascular disease prevention: A scientific statement from the American Heart Association. Circulation. 2015;132:1157-213.
Chaudhry SI, Mattera JA, Curtis JP, et al. Telemonitoring in patients with heart failure. New England Journal of Medicine. 2010;363:2301-9.
Dunton GF. Sustaining Health-Protective Behaviors Such as Physical Activity and Healthy Eating. Journal of the American Medical Association. 2018;320:639-40. doi:10.1001/jama.2018.6621.
Flores Mateo G, Granado-Font E, Ferre-Grau C, et al. Mobile Phone Apps to Promote Weight Loss and Increase Physical Activity: A Systematic Review and Meta-Analysis. Journal of Medical Internet Research. 2015;17:e253.
Fukuoka Y, Gay C, Haskell W, et al. Identifying Factors Associated With Dropout During Prerandomization Run-in Period From an mHealth Physical Activity Education Study: The mPED Trial. JMIR Mhealth Uhealth. 2015;3:e34.
Kumar S, Nilsen WJ, Abernethy A, et al. Mobile health technology evaluation: the mHealth evidence workshop. American Journal of Preventive Medicine. 2013;45:228-36.
Morgan JM, Kitt S, Gill J, et al. Remote management of heart failure using implantable electronic devices. European Heart Journal. 2017;38:2352-60.
Owen JE, Jaworski BK, Kuhn E, et al. mHealth in the Wild: Using Novel Data to Examine the Reach, Use, and Impact of PTSD Coach. JMIR Mental Health. 2015;2:e7.
Perez MV, Mahaffey KW, Hedlin H, et al.; Apple Heart Study Investigators. Large-Scale Assessment of a Smartwatch to Identify Atrial Fibrillation. New England Journal of Medicine. 2019;381:1909-17. doi:10.1056/NEJMoa1901183.
Simblett S, Greer B, Matcham F, et al. Barriers to and facilitators of engagement with remote measurement technology for managing health: systematic review and content analysis of findings. Journal of Medical Internet Research. 2018;20:e10480.
Steinhubl SR, Muse ED, Topol EJ. The emerging field of mobile health. Science Translational Medicine. 2015;7:283rv283.
Whitehead L, Seaton P. The Effectiveness of Self-Management Mobile Phone and Tablet Apps in Long-term Condition Management: A Systematic Review. Journal of Medical Internet Research. 2016;18:e97.
Varma N, Michalski J, Stambler B, Pavri BB; TRUST Investigators. Superiority of automatic remote monitoring compared with in-person evaluation for scheduled ICD follow-up in the TRUST trial-testing execution of the recommendations. European Heart Journal. 2014;35:1345-52. doi:10.1093/eurheartj/ehu066.
Varma N. Remote Patent Management Of Heart Failure Patients — How Long Should It Go On? Lancet digital health. 2020;2(ISSUE 1):E2-E3. doi:10.1016/S2589-7500(19)30221-3. American Heart Association. Sustaining healthy behaviours (AHA Simple 7). 2019. Available at https://www.heart.org/en/healthy-living/healthy-lifestyle/my-life-check—lifes-simple-7.
British Heart Foundation. Our healthy recipe finder app. Available at http://www.bhf.org.uk/heart-health/prevention/healthy-eating/our-healthy-recipe-finder-app.aspx.
Endeavour Partners. Inside wearables: how the science of human behavior change offers the secret to long-term, https://medium.com/@endeavourprtnrs/insidewearable-howthe-science-of-human-behavior-change-offers-the-secret-to-long-term-engagementa15b3c7d4cf3.
5.5.
Bhavnani SP, Sola S, Adams D, et al.; ASEF-VALUES Investigators. A Randomized Trial of Pocket-Echocardiography Integrated Mobile Health Device Assessments in Modern Structural Heart Disease Clinics. Cardiovascular Imaging. 2018;11:546-57. doi:10.1016/j.jcmg.2017.06.019.
Coorey GM, Neubeck L, Mulley J, Redfern J. Effectiveness, acceptability and usefulness of mobile applications for cardiovascular disease self-management: Systematic review with meta-synthesis of quantitative and qualitative data. European Journal of Preventive Cardiology. 2018;25:505-21. doi:10.1177/2047487317750913.
Coorey GM, Neubeck L, Mulley J, et al. Mobile technology use across age groups in patients eligible for cardiac rehabilitation: Survey study. JMIR Mhealth Uhealth. 2017;5:e161.
Martin T. Assessing mHealth: opportunities and barriers to patient engagement. Journal of Health Care for the Poor and Underserved. 2012;23:935-41.
Neubeck L, Lowres N, Benjamin EJ, et al. The mobile revolution-using smartphone apps to prevent cardiovascular disease. Nature Reviews. Cardiology. 2015;12:350-60.
Neubeck L, Cartledge S, Dawkes S, Gallagher R. Is there an app for that? Mobile phones and secondary prevention of cardiovascular disease. Current Opinion Cardiology. 2017;32:567-71.
Smith A. 2017. Record shares of Americans now own smartphones, have home broadband. Pew Research Center, https://www.pewresearch.org/fact-tank/2017/01/12/evolutionof-technology/.
Tarakji KG, Vives CA, Patel AS, et al. Success of pacemaker remote monitoring using appbased technology: Does patient age matter? Pacing and Clinical Electrophysiology. 2018;41:1329-35.
Mobile Fact Sheet. 2018. http://www.pewinternet.org/fact-sheet/mobile/.
Redfern J, Santo K, Coorey G, et al. Factors Influencing Engagement, Perceived Usefulness and Behavioral Mechanisms Associated with a Text Message Support Program. PLoS One. 2016;11:e0163929.
Varma N. Remote Patent Management Of Heart Failure Patients — How Long Should It Go On? Lancet digital health 2020;2. doi:10.1016/S2589-7500(19)30221-3.
6. Клинические исследования
Технологии мобильного здравоохранения могут иметь важное значение для организации и проведения исследований у пациентов с нарушениями сердечного ритма. Традиционно, клинические испытания, оценивающие эффективность медикаментозного лечения или работу электронных устройств для выявления и лечения аритмий, основываются на результатах анализа времени до наступления события и исходов, к примеру, первый рецидив ФП после “слепого периода” (Piccini 2017). Пациенты, рандомизированные в группы вмешательства и контроля, обычно периодически контролируются либо с помощью амбулаторных методов наблюдения, либо при посещении клиники. Подобный мониторинг имеет ограниченную чувствительность в отношении рецидивирующих аритмий как при наличии симптомов, так и в бессимптомных эпизодах. Кроме того, время до первого события может не совсем точно отражать снижение бремени аритмии, что также было показано в недавних РКИ (Andrade 2019). Несмотря на то, что электронные имплантируемые устройства, такие как кардиостимуляторы и дефибрилляторы, можно использовать для непрерывного мониторинга (Varma 2005), эти исследования не распространяются на более крупные популяционные группы без ИЭУ. Имплантируемые регистраторы событий могут иметь потенциальную роль в организации наблюдения пациентов, но являются дорогостоящими и, если не используются по клиническим показаниям, их применение часто трудно оправдать только необходимостью фиксации события во времени в ходе исследования.
Существует множество видов портативных мониторов ЭКГ, некоторые из которых имеют встроенные алгоритмы автоматического определения ФП (табл. 1). Однако многие из них не имеют возможности передавать информацию по сотовой связи или через интернет и поэтому обычно не могут транслировать результаты исследования в реальном времени. Именно здесь технологии обнаружения аритмии и пульса с использованием смарт-устройств имеют большие перспективы. Подобный подход может способствовать улучшению диагностики событий, а также сделать возможным удаленный или виртуальный сбор данных без необходимости посещения исследовательских центров. Примером может служить удаленная оценка ритма с помощью регистрации ЭКГ в одном или нескольких отведений с помощью смартфонов или смарт-часов, а также автоматическое определение места госпитализации с использованием функции геолокации на смартфоне (Nguyen 2017). Внедрение похожих технологий для улучшения контроля заболевания, в свою очередь, способно повысить информированность пользователей о своем здоровье, снизить затраты на лечение и организовать мониторинг больших групп населения одновременно. Примером является продолжающееся исследование Health eHeart, включающее пациентов с ССЗ, в котором проводится анализ данных, полученных от самих пациентов, информации беспроводных носимых сенсоров, электронных медицинских записей и других импортируемых больших массивов данных, с формированием быстрых периодических отчетов (https://www.health-eheartstudy.org/). Показано, что этот подход позволяет значимо уменьшить расходы на проведение интервенционных и обсервационных исследований при сердечно-сосудистой патологии.
Таблица 1
Методы мониторинга аритмий на основе мобильного здравоохранения


Сокращения: АД — артериальное давление, ПК — персональный компьютер, ФП — фибрилляция предсердий, ЧСС — частота сердечных сокращений, ЭКГ — электрокардиография.
Этап скрининга пациентов
Результаты двух недавних наиболее крупных РКИ подчеркивают потенциальные преимущества использования технологий мобильного здравоохранения для скрининга и лечения ФП.
- Исследование Apple Heart Study
Это уникальное крупномасштабное практическое исследование, направленное на оценку эффективности и безопасности алгоритма обнаружения нерегулярного ритма и выявления ФП на основе ФПГ с помощью устройства Apple Watch (Perez 2019, Turakhia 2019). Исследование проводилось дистанционно, соблюдая концепцию использования собственных устройств, когда для того, чтобы присоединиться к проекту, всем участникам требовалось зарегистрировать онлайн свой личный смартфон и связанные с ним часы для регистрации информации. Все этапы исследования, включая проверку корректности полученной информации, обработку, регистрацию и оценку данных, выполнялись через специальное мобильное приложение для исследования, которое можно было загрузить из магазина приложений. Если участник получал уведомление о выявлении нерегулярного пульса, последующие визиты в исследовании проводились с применением видеоконференцсвязи для оценки состояния пациента лечащим врачом непосредственно с помощью приложения. В исследование было включено >419 тыс. участников без анамнеза предшествующей ФП всего за 8 мес., во многом благодаря практически ориентированному виртуальному дизайну, доступности и удобству использования (рис. 4). Установлено, что алгоритм имеет положительную прогностическую ценность в плане выявления ФП по данным однократной записи ЭКГ, равную приблизительно 0,84 (Perez 2019). За время исследования только 0,5% среди всех участников получали уведомления о нерегулярном пульсе, но в пересчете на пациентов в возрасте ?65 лет данный показатель составил уже 3,2%. Тем не менее, среди всех случаев регистрации нерегулярного ритма только у 153/450 (34%) пациентов в дальнейшем была верифицирована ФП на ЭКГ. Но это можно объяснить не высокой частотой ложноположительных результатов, а, более вероятно, редкими пароксизмами ФП на ранней стадии заболевания. Поскольку в исследовании проводился мониторинг ЭКГ только пациентам с уведомлением о нерегулярном ритме, а не всей когорте участников, и также отсутствовала группа контроля, прогностическая ценность отрицательного результата не оценивалась. Следует отметить, что исследование Apple Heart Study проводилось среди людей без анамнеза ФП, поэтому выявленные в результате испытаний характеристики и диагностическая ценность подобных тестов могут значительно отличаться в популяции с уже известной ФП, и, кроме того, данное программное обеспечение не валидировано к использованию для контроля ФП при уже установленном диагнозе.
- Исследование Huwaei heart study
Аналогичное исследование было проведено с использованием технологии ФПГ на базе электронных смарт-устройств (фитнес-браслет Huawei или умные часы) (Guo JACC 2019). Предварительно алгоритм был отработан с помощью анализа более чем 29485 сигналов ФПГ перед началом исследования. Всего >246 тыс. человек загрузили на телефон мобильное приложение для скрининга ФПГ, из которых ~187 тыс. участников отслеживали свой ритм в течение 7 мес. Предположительный диагноз ФП была заподозрен у 0,23% участников (что немного ниже, чем в исследовании Apple Heart Study, возможно, из-за более молодой и здоровой когорты исследуемых). Диагноз подтвердился в дальнейшем в 87% случаев (положительная прогностическая ценность >90%) по сравнению с результатом в 34% в проекте Apple Heart Study. На основании полученных данных можно считать предложенный фотоплетизмографический метод частого непрерывного мониторинга ритма эффективным для скрининга и раннего выявления ФП в большой популяции.
Важно, что на основании результатов мониторинга инструменты поддержки клинических решений обеспечивали возможность изменений в тактике ведения пациентов, например, почти у 80% пациентов с высоким риском были назначены антикоагулянты. В дальнейшей исследование mAFA II продемонстрировало значительное снижение риска повторных госпитализаций и клинических побочных эффектов терапии у пациентов с регулярным мониторингом ритма (Guo JACC 2020). Следовательно, возможно эффективное использование подобных технологий в лечении ФП на нескольких уровнях, например, для скрининга и раннего выявления аритмии, а также для контроля своевременного старта терапии, направленной на снижение вероятности инсульта и других ассоциированных осложнений.
- Исследование Fitbit Heart Study
Еще одно крупномасштабное виртуальное исследование для выявления эпизодов нерегулярного сердечного ритма, позволяющих предположить наличие ФП, было инициировано компанией Fitbit в мае 2020г (https://www.mobihealthnews.com/news/fitbitlaunches-large-scale-consumer-health-study-detect-fibheart-rate-sensors-algorithm и Varma 2020).
Действия при выявлении аритмии
Следующим шагом после выявления аритмии и определения ее параметров и степени опасности является формирование алгоритма действий на этапе оказания помощи (рис. 6). Например, если пациент при развитии пароксизма ФП принимает препарат для купирования аритмии (прием флекаинида в рамках тактики “таблетка в кармане”), регистрация ритма важна до и после назначения антиаритмической терапии для того, чтобы зафиксировать ФП на ЭКГ, оценить параметры, влияющие на безопасность (убедиться в отсутствии уширения комплекса QRS), и подтвердить восстановление синусового ритма. Аналогичный подход был предложен для контролируемого использования прямых ОАК у пациентов низкого риска с редкими эпизодами ФП, которые либо исходно имеют редкие пароксизмы аритмии, либо хорошо удерживают синусовый ритм на фоне лекарственной терапии или после проведения катетерной аблации; данное РКИ находится в настоящее время в стадии разработки (Passman 2016). Также планируется тестирование стратегии контроля ЧСС с помощью смарт-часов в ходе лечения ФП, поскольку данный метод может обеспечить более персонализированный подход по сравнению с предыдущими алгоритмами, разработанными на основании исследований мягкого и строгого контроля ЧСС (когда использовались нормы для общей популяции, а не персонализированные границы сердечного ритма) (Van Gelder 2010).

Рис. 6. Цифровые приложения могут интегрировать ретранслируемую пациентом информацию датчиков и клиническую информацию с автоматическим удаленным анализом, а также позволяют пациентам получать консультации и коррективы лечения непосредственно от врачей.
Нерешенные вопросы
- Возможность экстраполирования результатов на общую популяцию
Ключевое значение имеет тот факт, что технологии мобильного здравоохранения доступны для широкого использования, тогда как большинство из них просты и удобны для применения пользователями.
А) Тем не менее, пожилые люди либо пользователи с недостаточной медицинской грамотностью могут столкнуться с трудностями в использовании цифровых технологий (См. Раздел 5.4.2 Цифровое неравенство), что может усугубляться на фоне различных патологических состояний, например, после перенесенного инсульта.
Б) Стоимость электронных устройств и тарифных планов по их обслуживанию может быть определенным ограничением для использования смартфонов и умных часов среди населения с низким уровнем дохода: такие социальные группы уже недостаточно представлены в клинических исследованиях, что также зависит от географического региона проживания.
Таким образом, те пациенты, которые добровольно участвуют в исследованиях мобильного здравоохранения в США, с большей вероятностью будут иметь более высокий уровень образования и социальноэкономический статус, этнически будут относиться не к латиноамериканцам и, по предварительной оценке, будут иметь меньший риск выявления ФП.
- Приверженность к терапии
Достоверная оценка результатов на основании анализа клинических конечных точек при использовании технологий мобильного здравоохранения может быть затруднена в случае низкой приверженности пациентов, особенно при отсутствии альтернативных средств оценки конечных точек (Guo X 2017). Как правило, в исследованиях с виртуальным дизайном, не предполагающих очных визитов, риск исключения пациентов из исследования в ходе периода наблюдения более высокий. Соответственно, если мониторинг полностью зависит от мобильных технологий и отсутствуют традиционные способы наблюдения для оценки аритмии, то анализ полученных данных может быть затруднен вследствие недостаточной приверженности участников исследования, что ставит под угрозу достоверность данных и возможность обобщения результатов. К примеру, среди 2161 из 419297 участников, получивших уведомление о нерегулярном ритме в проекте Apple Heart Study, в дальнейшем только 945 человек завершили до конца первый визит в рамках протокола исследования. И среди этой группы, в которой было выдано 658 беспроводных ЭКГ регистраторов, обратная связь была получена только у 450 участников, где были получены пригодные к анализу данные (Perez 2019).
Таким образом, разработка и внедрение эффективных стратегий повышения приверженности к терапии при использовании мобильных приложений остаются чрезвычайно актуальным вопросом, требующим проведения дополнительных исследований.
- Клинические исходы
Данный вопрос является ключевым. До настоящего времени клиническая и прогностическая роль результатов, полученных при использовании мобильных приложений и портативных электронных устройств, остается не полностью ясной.
Особенно важно оценивать исходы у пациентов с ФП. Например, меняется ли время до дебюта устойчивой симптомной ФП в зависимости от степени выявленной аритмической нагрузки (бремени ФП), и как соотносятся между собой данные показатели? Следует ли считать ФП, выявленную при длительном мониторинге с помощью умных часов, эквивалентом ФП, диагностированной при госпитализации или на очном визите в клинике? Появляется все больше литературы о том, что увеличение бремени ФП имеет значение для ряда важных клинических конечных точек, включая инсульт, СН и смертность (см. Раздел 3.1.3) (Chen 2018, Glotzer 2009, Kaplan 2019, Piccini 2019, Wong 2018). Является ли достаточным прерывистый прием новых ОАК по требованию на фоне редких пароксизмов ФП (на основании данных контроля ритма) в плане адекватного снижения риска инсульта? Некоторые вопросы еще менее изучены: например, достоверность диагностики нарушений ритма с помощью беспроводного мониторинга пульса, особенно при отсутствии ЭКГ подтверждения.
Поскольку подобные технологии мобильного скрининга и диагностики нарушений ритма играют важное значение для принятия решения о старте, изменении или прекращении терапии, потребуется тщательная оценка их клинической безопасности и эффективности, а в некоторых случаях — одобрение регулирующих органов здравоохранения.
Несмотря на данные ограничения, у пациентов есть огромный потенциал для использования мобильных технологий для самоконтроля симптомов и лечения аритмий, а также других сопутствующих заболеваний (см. Раздел 4). В период пандемии SARS-CoV-2 введенные ограничения посещения клиники способствовали более ускоренному внедрению решений мобильного здравоохранения в клиническую практику (Varma JACC 2020). В сложившихся условиях ЭКГ в рамках клинических исследований регистрировалась с помощью портативных смарт-устройств и оценивалась дистанционно в ходе виртуальных визитов, а не при обычном очном обследовании, причем в ряде случаев весь мониторинг исследований осуществлялся в онлайн-режиме.
Литература/References
6.
Andrade JG, Champagne J, Dubuc M, et al.; CIRCA-DOSE Study Investigators. Cryoballoon or Radi frequency Ablation for Atrial Fibrillation Assessed by Continuous Monitoring: A Randomized Clinical Trial. Circulation. 2019;140:1779-88.
Chen LY, Chung MK, Allen LA, et al.; American Heart Association Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Quality of Care and Outcomes Research; and Stroke Council. Atrial Fibrillation Burden: Moving Beyond Atrial Fibrillation as a Binary Entity: A Scientific Statement From the American Heart Association. Circulation. 2018;137:e623-e644.
Glotzer TV, Daoud EG, Wyse DG, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circulation: Arrhythmia and Electrophysiology. 2009;2:474-80.
Guo X, Vittinghoff E, Olgin JE, et al. Volunteer Participation in the Health eHeart Study: A Comparison with the US Population. Science Reports. 2017(7):1956. doi:10.1038/s41598-017-02232-y.
Guo Y, Wang H, Zhang H, et al.; MAFA II Investigators. Mobile Photoplethysmographic Technology to Detect Atrial Fibrillation. Journal of the American College of Cardiology. 2019(74):2365-75. doi:10.1016/j.jacc.2019.08.019.
Guo Y, Lane DA, Wang L, et al.; mAF-App II Trial Investigators. Mobile Health Technology to Improve Care for Patients With Atrial Fibrillation. Journal of the American College of Cardiology. 2020;75:1523-34.
Kaplan RM, Koehler J, Ziegler PD, et al. Stroke Risk as a Function of Atrial Fibrillation Duration and CHA2DS2-VASc Score. Circulation. 2019;140:1639-46. doi:10.1161/ CIRCULATIONAHA.119.041303.
Nguyen KT, Olgin JE, Pletcher MJ, et al. Smartphone-Based Geofencing to Ascertain Hospitalizations. Circulation Cardiovascular Quality & Outcomes. 2017;10:e003326. doi:10.1161/CIRCOUTCOMES.116.003326.
Passman R, Leong-Sit P, Andrei AC, et al. Targeted Anticoagulation for Atrial Fibrillation Guided by Continuous Rhythm Assessment With an Insertable Cardiac Monitor: The Rhythm Evaluation for Anticoagulation With Continuous Monitoring (REACT.COM) Pilot Study. Journal of Cardiovascular Electrophysiology. 2016;27:264-70. doi:10.1111/jce.12864.
Perez MV, Mahaffey KW, Hedlin H, et al.; Apple Heart Study Investigators. Large-Scale Assessment of a Smartwatch to Identify Atrial Fibrillation. New England Journal of Medicine. 2019;381:1909-17. doi:10.1056/NEJMoa1901183.
Piccini JP, Clark RL, Kowey PR, et al. Long-term electrocardiographic safety monitoring in clinical drug development: A report from the Cardiac Safety Research Consortium. American Heart Journal. 2017;187:156-69.
Piccini JP, Passman R, Turakhia M, et al. Atrial fibrillation burden, progression, and the risk of death: a case-crossover analysis in patients with cardiac implantable electronic devices. Europace. 2019;21:404-13.
Turakhia MP, Desai M, Hedlin H, et al. Rationale and design of a large-scale, app-based study to identify cardiac arrhythmias using a smartwatch: The Apple Heart Study. American Heart Journal. 2019;207:66-75.
Van Gelder IC, Groenveld HF, Crijns HJ, et al.; RACE II Investigators. Lenient versus strict rate control in patients with atrial fibrillation. New England Journal of Medicine. 2010;362:1363-73. doi:10.1056/NEJMoa1001337.
Varma N, Stambler B, Chun S. Detection of atrial fibrillation by implanted devices with wireless data transmission capability. Pacing and Clinical Electrophysiology. 2005;28(Suppl 1):S133-6.
Varma, N, Marrouche N, Aguinaga L, et al. HRS/EHRA/APHRS/LAHRS/ACC/AHA Worldwide Practical Guidance for Telehealth and Arrhythmia Monitoring During and After a Pandemic. J Am Coll Cardiol. 2020;76:1363-74.
Wong JA, Conen D, Van Gelder IC, et al. Progression of Device-Detected Subclinical Atrial Fibrillation and the Risk of Heart Failure. Journal of the American College of Cardiology. 2018;71:2603-11.
7. Эксплуатационные задачи (операционные задачи)
7.1. Система здравоохранения — мониторинг электронного здравоохранения и госпитальная экосистема
Трансляция данных
Фундаментальная, но пока не решенная проблема внедрения мобильного здравоохранения в клиническую практику — это способы передачи данных между пациентом и поставщиком медицинских услуг. Формат связи может различаться в зависимости от того, адресованы ли данные врачу (например, для ИЭУ) или самому пациенту (потребительские цифровые товары для здоровья, например, Apple Watch (Apple Inc., Купертино, Калифорния).
ИЭУ в кардиологии: передача и анализ данных основаны на опыте работы с традиционными ИЭУ, которые способны генерировать огромные объемы информации в цифровом здравоохранении. Зачастую у одного пациента клинические данные можно получить из разных источников, например, как по результатам УМ, так и в ходе очного осмотра. В клинической практике трансляция информации при дистанционном наблюдении хорошо отработана: происходит передача сигнала от ИЭУ на удаленную станцию приёма и передачи данных, а затем на сервер производителя, где осуществляется доступ к данным в индивидуальном порядке. К сожалению, обычно выполняется конвертирование информации в формат изображения, что делает невозможным интерпретацию ЭМК. Затем файл отправляется пациенту и публикуется на портале ЭМК в виде изображения, что неудобно для интерпретации медицинскими специалистами и практически недоступно для обычных пользователей. Следовательно, для того чтобы привлечь к подобным программам наблюдения пациентов и специалистов здравоохранения, данные должны быть представлены в доступном формате, который позволит рядовому пользователю получать информативную сводку ключевых параметров (таких как состояние батареи и результаты УМ) с пояснениями и возможностью детализации данных по запросу.
Доступные для пользователей устройства цифрового здравоохранения. В настоящее время пользователи быстро осваивают всевозможные цифровые продукты для мониторинга состояния своего здоровья и скрининга возможной патологии, а также для контроля лечения хронических заболеваний. Подобные инструменты повышают приверженность пациентов к терапии и способствуют поддержанию здорового образа жизни, но, тем не менее, самая основная задача электронного здравоохранения — возможность быстрого обмена данными с поставщиками медицинских услуг и клиническими специалистами — остается нерешенной. С технической точки зрения многие порталы регистрации ЭМК неудобны для пользования и не позволяют пациентам отправлять вложенные файлы. Таким образом, пациенту и поставщику услуг остается использовать электронную почту, которая не считается безопасной и не соответствует требованиям по защите персональной информации HIPPA или GDPR. Даже если портал регистрации ЭМК имеет возможность принимать прикрепленные вложения, остается много вопросов по регистрации цифровых данных ЭМК, полученных с помощью мобильных устройств, на выделенном сервере для пациентов. Есть опасения, что подобные логистические и практические проблемы могут быть причиной отказа от использования технологий мобильного здравоохранения многими пациентами и медицинскими работниками. Со стороны компаний-поставщиков медицинских услуг также имеется беспокойство по поводу возможной перегрузки сайта необоснованными передачами данных для проверки, а также путаницы в отправке информации пациентами (например, неверная адресация результатов мониторинга АД или глюкозы своему электрофизиологу). Возможным выходом представляется использование облачного хранилища данных для работы и анализа информации с мобильных устройств.
Проблемы взаимодействия — отсутствие организованной инфраструктуры для приема входящих данных
Проблема восприятия и обработки данных, полученных с помощью цифровых инструментов здравоохранения, имплантируемых или носимых, представляет собой одно из наиболее серьезных клинических препятствий при использовании мобильных технологий. Клиницисты чувствуют себя все более перегруженными по мере увеличения объема анализируемых данных, а также расширения возможных источников информации за счет постоянного роста числа используемых технологий мобильного здравоохранения. Следовательно, необходимо формирование единой номенклатуры данных и моделей их систематизации, которые позволят интегрировать поступающую информацию в формате ЭМК. Представленный вопрос является сложным не столько технически, сколько с политической стороны, т.к. требует от медицинского сообщества принять единое мнение в отношении системы условных обозначений и терминологии, а также формы оцениваемых данных. Например, для кардиостимуляторов должны быть разработаны определенные правила оценки срока службы батареи, порогов стимуляции, переключения режимов и т.д. Для ИЭУ подобные стандарты уже созданы (https://www.iso.org/standard/63904.html, Slotwiner 2019).
Следующим шагом для разработчиков ЭМК является следование принципам принятой номенклатуры и поддержание определенного стандарта данных, в котором они передаются. С помощью этих подходов цифровая информация о здоровье пользователей может быть ассимилирована в клинический рабочий процесс, что позволяет поставщикам медицинских услуг просматривать и документировать клинические симптомы, а также управлять дальнейшими рекомендациями с помощью базы данных ЭМК. Работа в данном направлении уже ведется для используемых в кардиологической практике ИЭУ, но еще пока не коснулась направления беспроводных носимых цифровых регистраторов и мобильных приложений. Для реализации подобного проекта необходимо сотрудничество профессиональных медицинских организаций, врачей, инженеров, регулирующих органов, а также согласование нормативных принципов и финансовой составляющей вопроса для поставщиков оборудования и цифровых услуг. В качестве платформы для хранения и обработки огромных массивов данных можно эффективно использовать интеллектуальные компьютерные системы с прогнозноаналитическим программным обеспечением.
Проблемы взаимодействия — отсутствие организованной инфраструктуры для приема передачи данных и поддержки пациентов
Технологии мобильного здравоохранения позволяют контролировать процесс лечения пациентов, обеспечивая клиническую поддержку при помощи отправки текстовых сообщений пользователям (Chow 2015) или через мобильные приложения, предназначенные для напоминания пациентам о дозах и времени приема лекарств или о назначениях врача. Для повышения эффективности курации пациентов необходима ее синхронизация с провайдерами цифровых технологий, в идеале путем интеграции информации в ЭМК на интернет-портале, что позволяет своевременно корректировать прием лекарств и дозировки препаратов, а также обеспечить двустороннюю связь между врачом и пациентом (Spaulding 2019). Однако на данный момент системному программному обеспечению сервисов ЭМК не хватает подобной функциональности (Ratwani 2018).
7.2. Рекомендации по кибербезопасности для устройств мобильного здравоохранения
Применение мобильных устройств для обмена клиническими данными значительно расширяет возможности медицинского наблюдения за пациентами, но также потенциально представляет угрозу для безопасности данных пользователей, особенно в плане возможности доступа сторонних лиц к частной медицинской информации (Jalali 2019, Kruse 2017). В качестве основных причин беспокойства за сохранность электронной медицинской информации выделяют, прежде всего, финансовую составляющую, поскольку компании, производящие дорогостоящее электронное медицинское оборудование, представляют собой привлекательные цели для компьютерных атак, взлома программных систем и кражи данных. Виды возможных хакерских атак включают:
1) Вредоносные вирусные программы с требованием выкупа. Госпитальные электронные системы и базы данных больницы могут быть заблокированы (например, данные могут быть зашифрованы) до тех пор, пока злоумышленник не получит деньги (Mansfield 2016, Mansfield-Devine 2016).
2) Кража и продажа частной информации пациента (например, продажа медицинской информации).
3) Атаки, направленные на медицинские компании-производители. Взломщики могут тщательно изучить работу системы с целенаправленным выявлением недостатков в определенном электронном устройстве или мобильном приложении, сократить или способствовать продаже акций, а затем обнародовать недостатки, что будет причиной падения доходов и стоимости акций компании. Другая схема может быть реализована, когда представители криминальных компаний будут искать возможные подходы для получения инсайдерской информации из сети взломанной компании. Наконец, злоумышленники могут иметь компрометирующие данные на определенную медицинскую компанию, но не предпринять ни одного из перечисленных выше действий. Вместо этого они могут продавать свои методы или учетные данные другим участникам рынка электронных технологий, которые уже будут использовать полученную информацию (Perakslis 2014). К счастью, сценарии, когда кибератака приводит к непоправимым последствиям (например, из-за повреждения программного обеспечения кардиостимулятора или инсулиновой помпы), на сегодняшний день в реальном мире неизвестны, и их вероятность изучается только в исследовательских целях, чтобы предотвратить их возможную реализацию (Klonoff 2015). Возможно, это связано с тем, что атаки на крупные электронные корпорации и организации представляются для правонарушителей в киберпространстве более финансово прибыльными, чем взлом данных отдельных пользователей.
Поэтому чрезвычайно важно разрабатывать и вне — дрять современные эффективные технологии защиты информации и конфиденциальности пациентов в условиях этой новой электронной реальности удаленно управляемых устройств и массового сбора данных.
7.2.1. Стратегии взлома данных в технологиях мобильного здравоохранения
Часто злоумышленники не могут напрямую поставить под угрозу компьютерную систему, которая является целью их кибератаки. Вместо этого они начинают реализовывать схему компрометации более слабого звена системы. Например, если целью является получение частной медицинской информации о конкретном пациенте (например, персональные данные о состоянии здоровья), они могут попытаться заставить пользователя (или сотрудника компании) установить вредоносное мобильное или интернет-приложение, подвергая опасности все остальные данные, которые хранятся на телефоне или компьютере, включая электронную почту, пароли и другие учетные данные. С момента установки подобной вредоносной программы злоумышленник может иметь технологически несложный доступ к информации, которая представляет собой истинную цель кибератаки. В информационных технологиях процесс объединения компьютерных кодов для взлома работы системы носит название “программы разворота”. В дальнейшем каждый подобный “разворот” или “разрыв” способствует переходу на новый уровень доступа к зашифрованной информации, которые приближают хакера к желаемым целям.
Наиболее простым ходом для взломщиков является использование электронных фишинговых ссылок. После того, как пользователь откроет на устройстве компьютерный код взлома, скомпрометированная учетная запись электронной почты может использоваться для сброса паролей для других служб и для распространения более реалистичных фишинговых сообщений. Более технически сложные способы кибератаки используются для компрометации компонентов систем УМ в здравоохранении, например, беспроводных каналов (Bluetooth, Wi-Fi и т.д.), Интернет- и локальных сетевых коммуникаций или серверов (баз данных, веб-интерфейсов, файловых серверов и т.д.).
7.2.2. Рекомендации по защите информации для медицинских компаний-производителей
Невозможно создать электронную систему, которая не будет иметь недостатков и которую нельзя взломать. Однако цифровые системы/мобильные устройства должны быть спроектированы таким образом, чтобы в случае кибератаки существовал план корректного завершения работы без потери данных. Подобный подход позволит быстро исправить ситуацию в случае непредвиденных обстоятельств и попыток взлома системы.
Деловые обстоятельства (например, бюджет проекта, сроки) не должны преобладать над безопасностью работы системы, которая должна быть приоритетом. Кроме того, попытки закрыть общий доступ к информации мобильного здравоохранения или использовать скрытые устройства/защищенные протоколы не являются лучшим решением, и не доказали своей эффективности (Shanon 1949). Необходимо тщательно соблюдать баланс между удобством использования устройства и правилами кибербезопасности. Защита мобильных устройств от злоумышленников и одновременно сохранение их доступности для врачей и пользователей является сложной задачей. В мобильном здравоохранении эти трудности могут потенциально усугубляться на фоне зависимости пациентов от цифровых технологий (например, смартфонов, когда нельзя ожидать их использования только в медицинских целях) или при реализации практических подходов, которые находятся вне контроля IT-систем. Примером инженерного компромисса в ИЭУ может служить решение, когда беспроводная связь для обмена ключевой информацией работает только на очень малых расстояниях. Подобные технологии могут быть более безопасными, но менее комфортными для использования (например, требуя применения проводов и электродов) или менее безопасными, но более удобными (например, с использованием Bluetooth).
7.2.3. Рекомендации по защите информации для клиницистов и администраторов
Организация работы всегда должна включать многоуровневую схему безопасности (также называемую глубокой защитой), где каждая система защищена более чем одним уровнем безопасности. В подобных случаях, если какой-то один из блоков выйдет из строя, это не обязательно приведет к полному нарушению системы безопасности. К примеру, работу электронной базы данных можно формировать таким образом, что при входе в сеть: 1) требуется пароль; 2) предоставляется только минимальный уровень доступа каждому пользователю; 3) для связи используется только локальное соединение. Таким образом, если пароль пользователя скомпрометирован (ошибка № 1), злоумышленник все равно не сможет использовать его удаленно. Если сервер случайно открывается для удаленного доступа (ошибка № 3), взломщик может получить ключ только к данным одного пользователя. Другие инновационные решения включают повышение безопасности с помощью персональной базовой станции, использующей новую конструкцию радиосвязи, которая может действовать как средство радиоэлектронного подавления с помощью активных дезинформирующих помех (Gollakotta 2015).
В целом, рекомендуя пациентам то или иное электронное устройство, важно учитывать потенциально более слабую степень конфиденциальности/ безопасности данных (по сравнению с альтернативными методами наблюдения), убедиться, что пациент проинформирован об этих возможных негативных последствиях, и проанализировать статистику, как производитель реагировал на случаи нарушения безопасности мобильных данных в прошлом, если подобные инциденты имели место (Saxon 2018). Тем не менее, отсутствие данных по реальным случаям фактических нарушений кибербезопасности при использовании мобильных устройств или внешнего оборудования (программаторы, домашние коммуникаторы, электронные базы данных, протоколы связи и т.д.) серьезно затрудняет оценку реального соотношения риск/польза как для клиницистов, так и для пациентов.
Нормативно-правовая база в области кибербезопасности быстро меняется (Voelker 2018). Ассоциация FDA (как и другие надзорные организации) в настоящее время регламентирует оценку безопасности электронных мобильных технологий как необходимый этап их сертификации и клинического внедрения, поэтому пользователям и медицинским специалистам следует сообщать о всех выявленных проблемах безопасности производителям и регулирующим организациям (например, через портал FDA Medwatch) (Shuren 2018).
7.2.4. Рекомендации в отношении пациентов
При получении официального информированного согласия со стороны пациента на использование цифровых мобильных устройств для контроля здоровья всегда следует предоставлять полную информацию относительно кибербезопасности и потенциальных рисков в отношении защиты персональных данных.
7.3. Возмещение расходов
Компенсация затрат играет важную роль при внедрении новых клинических методов и обычно реализуется на том этапе, когда вмешательство признается эффективным, научно обоснованным и рентабельным (Treskes 2016). Так как мобильное здравоохранение развивается сравнительно недавно, процесс возмещения расходов только начинает формироваться, и, следовательно, его сложнее оценить, учитывая широкий спектр телемедицинских технологий.
- Снижение затрат на фоне применения мобильного здравоохранения
Мобильные технологии рассматриваются как эффективный инструмент ранней диагностики и контроля лечения аритмий и связанных с ними сопутствующих заболеваний, позволяя достичь всех преимуществ своевременного скрининга, профилактики и инициации терапии, тем самым уменьшая побочные эффекты, связанные с отсроченным назначением лечения и использованием дорогостоящих ресурсов здравоохранения (например, вызовы скорой помощи или госпитализации). Методы цифрового здравоохранения имеют важное значение для поддержания здорового образа жизни среди населения, изменения профиля риска ССЗ и увеличения приверженности к медикаментозной терапии (Feldman 2018). Наряду с традиционными подходами применение мобильных устройств может способствовать снижению бремени хронических заболеваний и связанной с ними длительной инвалидизации населения, особенно трудоспособного возраста. Тем не менее, оценка этих преимуществ в долгосрочной перспективе является сложной задачей, и стоимость затрат будет варьироваться в зависимости от географического региона и особенностей системы здравоохранения.
- Повышение расходов в мобильном здравоохранении
Существуют ряд факторов, которые могут повышать расходы на цифровое здравоохранение, связанные, прежде всего, с администрированием мобильных программ и приложений. Широкое распространение смартфонов и других коммерчески доступных мобильных устройств, к примеру, для контроля ЭКГ, с течением времени приводит к регистрации значительного количества сомнительных или ложноположительных результатов, что обусловливает, в свою очередь, дополнительные тестирования оборудования с целью его валидации, тем самым увеличивая использование ресурсов здравоохранения. Широкое внедрение программ мобильного скрининга потребует дополнительного распределения затрат, связанных с наблюдением новых пациентов, у которых обнаружат аритмию, но которые раньше не входили в целевые группы для скрининга нарушений ритма. Компании-провайдеры медицинских услуг также должны будут тратить время на анализ и интерпретацию потенциально больших массивов данных (и, соответственно, большого количества телефонных звонков и сообщений пользователей) перед тем, как станет возможным принятие дополнительных решений по оценке состояния пациента и дальнейшему ведению. Поэтому данные этапы будут сопровождаться финансовыми расходами для поддержания жизнеспособности мобильных проектов и их реализации.
- УМ имплантированных устройств
Клиническая информация, полученная посредством УМ ИЭУ, имеет ценное значение и может быть использована на дальнейших этапах ведения пациента. Крупные РКИ на протяжении многих лет демонстрируют безопасность и эффективность подобных дистанционных технологий, которые можно рассматривать как замену традиционных очных врачебных осмотров, и которые имеют особенно важную роль в выявлении бессимптомных клинических событий (Varma 2010). Исследования в области экономики здравоохранения, такие как EuroEco (включающие пациентов с ИКД), показали, что время, необходимое в клинике для проверки онлайн-информации в сети, проведения телефонных контактов и, при необходимости, очных осмотров, уравновешивалось меньшим количеством запланированных визитов по сравнению с традиционным амбулаторным подходом, в результате чего стоимость обеих программ наблюдения для медицинского учреждения была одинаковой (Heidbuchel 2014). С точки зрения оплаты финансовых расходов, наблюдалась тенденция к экономии средств при меньшем количестве
госпитализаций и сокращении продолжительности госпитализации, что также прослеживалось в других исследованиях (Crossley 2011, Guedon-Moreau 2014, Hindricks 2014, Mabo 2012). Однако, если на практике
работает программа только прямого возмещения затрат, то меньшее количество амбулаторных посещений врача (и госпитализаций) вследствие УМ приведет к снижению доходов клинических специалистов и медицинских учреждений, если не проводить своевременную адаптацию действующей экономической системы к условиям цифрового здравоохранения.
В настоящее время возмещение расходов при использовании технологий удаленного наблюдения (например, в США, Германии, Франции, Великобритании) осуществляется дискретным образом в соответствии с протоколами РКИ, таких как TRUST или IN-TIME (Hindricks 2014, Varma 2010), с выставлением счетов после получения результатов дистанционного мониторинга, исходя из максимального количества пациентов в год. Учитывая сложившуюся технологическую тенденцию к более длительным периодам передачи информации с использованием серверных систем поддержки принятия решений, которые предупреждают медицинского провайдера о регистрации потенциально важной информации, возможно, регулярно обновляемые компьютерные приложения могут быть более экономически эффективны. Распределение бюджета должно быть оптимальным как для страховых компаний, так и для поставщиков медицинских услуг, а выделяемые средства должны покрывать расходы на оборудование, программное обеспечение и другие услуги (например, возможное использование сторонних центров мониторинга данных). Эта схема является наиболее подходящей для реализации мобильных технологий в здравоохранении.
Ожидается, что мобильные медицинские технологии могут обеспечить более эффективный и экономически оправданный подход к оказанию медицинской помощи, который способствует оптимизации лечебного процесса и улучшению контроля состояния пациентов при интеграции в клиническую практику (Jiang 2019). Поэтому улучшение результатов терапии будет важным фактором для оценки возмещения расходов, например, для данных, ведущих к смене стратегии лечении аритмии (но не при скрининге большой бессимптомной популяции без ФР). Текущие исследования, оценивающие роль мобильных технологий для регистрации ЭКГ с помощью смартфона в целях скрининга ФП, к примеру исследование AF SMART II (Скрининг ФП, терапия и рекомендованная терапия), на современном этапе включают развернутый анализ экономической эффективности метода (Orchard 2018). Иногда финансовые обязанности по возмещению расходов могут выходить за рамки традиционных соглашений сторон в сфере здравоохранения с поиском новых возможных путей решения, например, взаимодействия со страховыми компаниями и другими потенциальными инвесторами (Bruining 2014). Действующие финансовые инициативы, реализованные в настоящее время в США, описаны в Приложении 1.
7.4. Нормативно-правовая база в электронном здравоохранении
В настоящее время наблюдается бурный прогресс цифровых технологий, которые постоянно совершенствуются. Прогнозируется, что с распространением сотовой технологии 5G удастся преодолеть новые границы в области потоковой передачи данных и связанной с ней аналитики. К сожалению, в области мобильного здравоохранения темп роста пока более медленный, чем хотелось бы. В США причины могут быть связаны с особенностями системы здравоохранения, когда цифровыми технологиями в первую очередь руководят частные организации, работающие в условиях финансовых ограничений (рекомендации по возмещению расходов CMS), а также с вопросами конфиденциальности данных пациентов (Закон об ответственности и переносе данных о страховании здоровья граждан) и правилами безопасности (Управление по санитарному надзору за качеством пищевых
продуктов и медикаментов, FDA). Эти ограничения устарели на фоне прогресса цифровых технологий и устройств мобильного здравоохранения, поэтому формируются новые принципы регулирования электронного оборота данных.
Недавно организацией FDA был основан совершенно новый раздел в категории “Медицинские устройства” под названием “Цифровое здравоохранение”, который находится под контролем Центра медицинских устройств и радиологического здоровья (Shuren 2018, FDA. Gov). Проект был инициирован и поддерживается Законом о методах лечения (21st Century Cures Act), который вступил в силу 13 декабря 2016г. Данный документ регламентирует разработку новых медицинских продуктов и технологий, что позволит пациентам получить доступ к современным достижениям и инновациям в области мобильного здравоохранения. Политика FDA в области цифрового здравоохранения в настоящее время включает три основных направления: общие принципы поддержания здорового образа жизни, мобильные медицинские приложения и электронные системы поддержки принятия клинических решений. Устройства mHealth входят в эти три категории, которые определены следующим образом:
Мобильные устройства для поддержания здорового образа жизни разработаны “для контроля общего состояния здоровья и не имеют задач диагностики, лечения, облегчения симптомов, профилактики или терапии патологических состояний” (21 CCA Section 3060 (a)(o)(1)(B)). С другой стороны, мобильные медицинские приложения, ранжированные организацией FDA как программное обеспечение, ориентированное на традиционно регулируемые функции здравоохранения, относятся к категории программного обеспечения, являющегося медицинским устройством. Подобное программное обеспечение разрабатывается по четко определенным принципам, включающим конкретные этапы создания программных систем (IEC-62304), оценку рисков, демонстрацию надежности и безопасности, включая вопросы кибербезопасности. Системы поддержки принятия клинических решений также могут быть основаны на технологиях цифрового здравоохранения либо быть интегрированы в мобильные устройства. Подробные определения и номенклатура приведены ниже (21 CCA Section 520 (о) (1)(Е)). Краткая информация включает представление о типах медицинских данных и рекомендации для клинических специалистов по методам профилактики, диагностики и лечения определенных патологических состояний или заболеваний. Это не означает, что медицинский работник в первую очередь полагается на предоставленную информацию для постановки клинического диагноза или решения о тактике лечения, а напротив, подход к выбору способов диагностики и терапии определяется индивидуально с учетом всех известных клинических факторов. Важно отметить, что обычные фитнесустройства для контроля здорового образа жизни не требуют обязательного одобрения FDA, в то время как мобильные приложения и системы поддержки клинических решений перед коммерческой реализацией во всех случаях должны получить подобное одобрение.
Принципы регуляции мобильного здравоохранения меняются и адаптируются со временем, чтобы соответствовать технологическому развитию современных цифровых устройств. Но сегодня время, которое требуется для одобрения и реализации новых технологий, может значительно запаздывать по сравнению с темпами прогресса в сфере электронного здравоохранения. Следовательно, важна оптимизация процесса подачи и обработки нормативных документов для ускорения процесса регистрации мобильных устройств. Одной из самых последних инициатив в США, направленных на решение этой проблемы, является программа FDA по предварительной сертификации программного обеспечения для цифрового здравоохранения (Pre-CERT) (Lee 2018). Проект Pre-CERT предлагает ускорить обзор нормативных документов для компаний, которые могут обеспечить быструю сертификацию разработанного программного продукта, предоставить данные постмаркетинговых исследований и продемонстрировать реальные доказательства эффективности внедряемых технологий. Ожидается, что компания, получившая одобрение FDA Pre-CERT, сможет в конечном итоге отменить или упростить процесс подачи заявки в регулирующие органы, в зависимости от степени рисков, связанных с использованием их программного обеспечения или мобильных технологий. Эта инициатива, получившая свое начало в 2019г, в настоящее время включает несколько международных компаний, которые продвигают свои мобильные технологические решения в области цифрового здравоохранения. Такой тип новой нормативно-правовой базы, безусловно, поможет крупным медицинским корпорациям ускорить коммерциализацию своих продуктов, но доступ к Pre-CERT может быть намного сложнее для небольших компаний, у которых нет ресурсов, чтобы продемонстрировать необходимые критерии, которые требует протокол Pre-CERT.
Литература/References
7.
7.1.
https://www.iso.org/standard/63904.html,
Chow CK, Redfern J, Hillis GS, et al. Effect of Lifestyle-Focused Text Messaging on Risk Factor Modification in Patients With Coronary Heart Disease: A Randomized Clinical Trial. Journal of the American Medical Association. 2015;314:1255-63.
Ratwani RM, Savage E, Will A, et al. A usability and safety analysis of electronic health records: a multi-center study. Journal of the American Medical Information Association. 2018;25:1197-201.
Slotwiner DJ, Abraham RL, Al-Khatib SM, et al. HRS White Paper on interoperability of data from cardiac implantable electronic devices (CIEDs). Heart Rhythm. 2019;16:e107-e127. doi:10.1016/j.hrthm.2019.05.002.
Spaulding EM, Marvel FA, Lee MA, et al. Corrie Health Digital Platform for Self-Management in Secondary Prevention After Acute Myocardial Infarction. Circulation. Cardiovascular Quality & Outcomes. 2019;12:e005509.
7.2.
Gollakota S, Hassanieh H, Ransford B, et al. They Can Hear Your Heartbeats: Non-Invasive Security for Implantable Medical Devices. doi:10.1145/2043164.2018438.
Jalali MS, Russell B, Razak S, Gordon WJ. EARS to cyber incidents in health care. Journal of the American Medical Information Association. 2019;26,81–90.
Klonoff DC. Cybersecurity for Connected Diabetes Devices. Journal of Diabetes Science and Technology. 2015;9:1143-7.
Kruse CS, Frederick B, Jacobson T, Monticone DK. Cybersecurity in healthcare: A systematic review of modern threats and trends. Technology Health Care. 2017;25:1-10.
Mansfield-Devine S. Ransomware: taking businesses hostage. Network Security, 8–17 Hospitals become major target for ransomware. Network Security 20162016;1–2. doi:10.1016/S1353-4858(16)30031-9.
Perakslis ED. Cybersecurity in health care. New England Journal of Medicine. 2014;371:395-7.
Saxon LA, Varma N, Epstein LM, et al. Factors Influencing the Decision to Proceed to Firmware Upgrades to Implanted Pacemakers for Cybersecurity Risk Mitigation. Circulation. 2018;138:1274-6.
Shanon CE. Communication theory of secrecy systems’. Bell System Technical Journal 1949;28.
Shuren J, Patel B, Gottlieb S. FDA Regulation of Mobile Medical Apps. Journal of the American Medical Association. 2018:320:337-8.
Voelker R. FDA Joins New Effort to Strengthen Medical Device Cybersecurity. Journal of the American Medical Association. 2018;320:1970.
7.3.
Bruining N, Caiani E, Chronaki C, et al., Task Force of the e-Cardiology W. Acquisition and analysis of cardiovascular signals on smartphones: potential, pitfalls and perspectives: by the Task Force of the e-Cardiology Working Group of European Society of Cardiology. European Journal of Preventive Cardiology. 2014;21(2 Suppl):4-13.
Crossley GH, Boyle A, Vitense H, et al., Investigators C. The CONNECT (Clinical Evaluation of Remote Notification to Reduce Time to Clinical Decision) trial: the value of wireless remote monitoring with automatic clinician alerts. Journal of the American College of Cardiology. 2011;57:1181-9.
Feldman DI, Theodore Robison W, Pacor JM, et al. Harnessing mHealth technologies to increase physical activity and prevent cardiovascular disease. Clinical Cardiology. 2018;41:985-91.
Guedon-Moreau L, Lacroix D, Sadoul N, et al.; ECOST trial Investigators. Costs of remote monitoring vs. ambulatory follow-ups of implanted cardioverter defibrillators in the randomized ECOST study. Europace. 2014;16:1181-8. doi:10.1093/europace/euu012.
Heidbuchel H, Hindricks G, Broadhurst P, et al. EuroEco (European Health Economic Trial on Home Monitoring in ICD Patients): a provider perspective in five European countries on costs and net financial impact of follow-up with or without remote monitoring. European Heart Journal. 2015;36:158-69. doi:10.1093/eurheartj/ehu339.
Hindricks G, Taborsky M, Glikson M, et al.; IN-TIME study group. Implant-based multiparameter telemonitoring of patients with heart failure (IN-TIME): a randomised controlled trial. Lancet. 2014;384:583-90.
Jiang X, Ming WK, You JH. The Cost-Effectiveness of Digital Health Interventions on the Management of Cardiovascular Diseases: Systematic Review. Journal of Medical Internet Research. 2019;21:e13166. doi:10.2196/13166.
Mabo P, Victor F, Bazin P, et al.; COMPAS Trial Investigators. A randomized trial of long-term remote monitoring of pacemaker recipients (the COMPAS trial). European Heart Journal. 2012;33:1105-11.
Orchard JJ, Neubeck L, Freedman B, et al. Atrial Fibrillation Screen, Management and Guideline Recommended Therapy (AF SMART II) in the rural primary care setting: an implementation study protocol. British Medical Journal Open. 2018;8:e023130.
Treskes RW, van der Velde ET, Barendse R, Bruining N. Mobile health in cardiology: a review of currently available medical apps and equipment for remote monitoring. Expert Review of Medical Devices. 2016;13:823-30.
Varma N, Epstein AE, Irimpen A, et al.; TRUST Investigators. Efficacy and safety of automatic remote monitoring for implantable cardioverter-defibrillator follow-up: the Lumos-T Safely Reduces Routine Office Device Follow-up (TRUST) trial. Circulation. 2010(122):325-32. doi: 10.1161/CIRCULATIONAHA.110.937409.
Varma N, Michalski J, Epstein AE, Schweikert R. Automatic remote monitoring of implantable cardioverter-defibrillator lead and generator performance: the Lumos-T Safely RedUceS RouTine Office Device Follow-Up (TRUST) trial. Circulation: Arrhythmia and Electrophysiology. 2010;3:428-36. doi:10.1161/CIRCEP.110.951962.
7.4.
Lee TT, Kesselheim AS. U.S. Food and Drug Administration Precertification Pilot Program for Digital Health Software: Weighing the Benefits and Risks. Annals of Internal Medicine. 2018;168:730-2.
Shuren J, Patel B, Gottlieb S. FDA Regulation of Mobile Medical Apps. Journal of the American Medical Association. 2018;320:337-8.
Center for Devices, Radiological Health. Digital Health. In: U.S. Food and Drug Administration [Internet]. https://www.fda.gov/medical-devices/digital-health.
8. Прогностический анализ данных
ИИ — это термин, имеющий широкое значение, который описывает любые вычислительные программы, которые обычно требуют человеческого интеллекта, такие как восприятие изображений, распознавание образов, построение логических выводов или прогнозирование исходов (Oxford English Dictionary; Kagiyama 2019). Чаще всего ИИ реализуется с использованием аналитических методов машинного обучения или технологий глубоких нейронных сетей. Эти методы хорошо подходят для классификации определенных диагностических паттернов, таких как изображения, включая ЭКГ.
Потенциальная возможность взаимодействия между технологиями ИИ и мобильным здравоохранением серьезно взволновала медицинское сообщество, поскольку это может позволить решить одну из основных задач — улучшить результаты лечения пациентов за счет повышения его эффективности при снижении затрат на оказание медицинской помощи (Davenport 2019, Marcolino 2018). Очевидно, что приложения для смартфонов и носимые устройства могут генерировать огромные массивы данных, которые превышают человеческие возможности интеграции и интерпретации (Steinhubl 2015). На основании мобильных технологий могут быть составлены биометрические наборы данных астрономических размеров. В клиническом аспекте подобные знания могут быть направлены как на разработку индивидуальных подходов к лечению, так и на понимание популяционных законов для отдельных процессов. Примером может служить анализ данных 6 млрд записей ночного сна, накопленных в течение длительной глобальной депривации сна, которые потенциально могут быть полезны для обоснования инициатив общественного здравоохранения (https://aasm.org/fitbit-scientists-reveal-results-analysis6-billion-nights-sleep-data). В свою очередь, технологии мобильного здравоохранения, основанные на интернет-подключении, позволяют осуществлять прогнозирование определенных процессов и исходов на основе индивидуальной информации в облачном хранилище данных (Bumgarner 2018, Nascimento 2018, Ribeiro 2019).
Исторически кардиология была одной из первых научных сфер, где проводились исследования ИИ из-за обилия данных, хорошо подходящих для классификации и прогнозирования (Seetharam 2019). С помощью нейронных сетей удалось решить задачи по распознаванию образов, и прежде всего изображений, когда после проведения тестирования, обучения и валидации программного комплекса результат был сравним с показателями расшифровки и анализа ЭКГ клиническими специалистами в отношении диагностики наличия аритмий при однократной записи ритма по данным портативных устройств или при амбулаторной регистрации ЭКГ (Hannun 2019, Ribeiro 2019, Smith 2019). Также было показано, что после обучения нейросетей возможно достичь автоматического анализа фракции выброса, выявления дисфункции левого желудочка и даже диагностики таких заболеваний, как гипертрофическая кардиомиопатия, на основе эхокардиографии (Zhang 2018). Совсем недавно нейронные сети также получили возможность интерпретировать новый вид информации, например, проводить оценку геометрии левого желудочка с диагностикой степени его дисфункции (Attia 2019a). Подобные технологии потенциально могут использоваться для быстрого диагностического анализа данных беспроводных носимых регистраторов, хотя может потребоваться строгая оценка безопасности их рутинного применения. В последнее время также рассматривается прогностическая ценность методов ИИ, например, для прогнозирования риска ФП на основании анализа отдельных ЭКГ записей в 12 отведениях с тщательной предварительной оценкой электрокардиологических параметров на ЭКГ с синусовым ритмом (Attia 2019b).
Принципы ИИ уже используются в работе приложений мобильного здравоохранения, таких как умные часы, или при полуавтоматической диагностике аритмий по записям ЭКГ с подключением к смартфону (Bumgarner 2018, Halcox 2017). Надо обратить внимание, что полученные диагнозы отражают результаты предварительного скрининга и должны сопровождаться дальнейшим дообследованием, а не заменяют консультации врача и профессиональной интерпретации данных. В ультразвуковой диагностике и эхокардиографии методы ИИ могут также оптимизировать процесс получения и интерпретации большого объема изображений и повысить точность диагностики с помощью разработки систем машинного обучения (Chamsi-Pasha 2017). Построение прогностических моделей на основе технологий ИИ впервые применялось у пациентов с ХСН и ФП, хотя иногда точность моделей не превосходила те значения, которые были получены с помощью традиционных методов (Awan 2019, Clifton 2015, Frizzel 2017, Goto 2019, Safavi 2019, Tripoliti 2019). Специальных исследований ИИ в сфере мобильного здравоохранения было немного. Результаты исследования LINK-HF представлялись обнадеживающими. В исследовании рассматривался анализ данных облачного хранилища с применением машинного обучения и моделирования по методу подобия, когда моделируется поведение сложных систем (например, авиационныхдвигателей) для создания алгоритма прогнозирования декомпенсации ХСН с использованием данных, передаваемых с портативного беспроводного нагрудного регистратора.
Пока существуют определенные ограничения, которые нужно преодолеть, прежде чем стратегии мобильного здравоохранения на основе ИИ станут более широко использоваться в клинической практике (Kagiyama 2019, Powell 2019, Ribeiro 2019, Steinhubl 2015). Доказательная база в области ИИ по-прежнему немногочисленна и основывается на наблюдательных исследованиях и вторичном анализе наборов данных. Кроме того, валидация методов ИИ в реальных клинических условиях, как правило, не проводится, и большинство алгоритмов могут работать по принципу “черного ящика”, т.е. быть не до конца изученными, что особенно важно если алгоритмы исходно были разработаны для среды, отличной от той, в которой находится реальный пациент (Ribeiro 2019, Weng 2017). Вопросы относительно рентабельности, принципов реализации, этики, конфиденциальности и безопасности использования алгоритмов ИИ до сих пор не решены.
Литература/References
8.
“Artificial Intelligence”. Oxford English Dictionary. www.oed.com
Attia ZI, Kapa S, Lopez-Jimenez F, et al. Screening for cardiac contractile dysfunction using an artificial intelligence-enabled electrocardiogram. Nature Medicine. 2019a;25:70-4.
Attia ZI, Noseworthy PA, Lopez-Jimenez F, et al. An artificial intelligence-enabled ECG algorithm for the identification of patients with atrial fibrillation during sinus rhythm: a retrospective analysis of outcome prediction. Lancet. 2019b;394:861-7.
Awan SE, Bennamoun M, Sohel F, et al. Machine learning-based prediction of heart failure readmission or death: implications of choosing the right model and the right metrics. European Society of Cardiology Heart Failure Journal. 2019;6:428-35.
Bumgarner JM, Lambert CT, Hussein AA, et al. Smartwatch Algorithm for Automated Detection of Atrial Fibrillation. Journal of the American College of Cardiology. 2018;71:2381-8.
Chamsi-Pasha MA, Sengupta PP, Zoghbi WA. Handheld Echocardiography: Current State and Future Perspectives. Circulation. 2017;136:2178-88.
Clifton DA, Niehaus KE, Charlton P, Colopy GW. Health Informatics via Machine Learning for the Clinical Management of Patients. Yearbook of Medical Informatics. 2015;10:38-43.
Davenport T, Kalakota R. The potential for artificial intelligence in healthcare. Future Healthcare Journal. 2019;94-8.
Frizzell JD, Liang L, Schulte PJ, et al. Prediction of 30-Day All-Cause Readmissions in Patients Hospitalized for Heart Failure: Comparison of Machine Learning and Other Statistical Approaches. Journal of the American Medical Association Cardiology. 2017;2:204-9.
Goto S, Goto S, Pieper KS, et al.; GARFIELD-AF Investigators. New AI Prediction Model Using Serial PT-INR Measurements in AF Patients on VKAs: GARFIELD-AF. European Heart Journal Cardiovasc Pharmacother. 2020;6(5):301-9.doi:10.1093/ehjcvp/pvz076.
Halcox JPJ, Wareham K, Cardew A, et al. Assessment of Remote Heart Rhythm Sampling Using the AliveCor Heart Monitor to Screen for Atrial Fibrillation: The REHEARSE-AF Study. Circulation. 2017;136:1784-94.
Hannun AY, Rajpurkar P, Haghpanahi M, et al. Cardiologist-level arrhythmia detection and classification in ambulatory electrocardiograms using a deep neural network. Nature Medicine. 2019;25:65-9.
Kagiyama N, Shrestha S, Farjo PD, Sengupta PP. Artificial Intelligence: Practical Primer for Clinical Research in Cardiovascular Disease. Journal of the American Heart Association. 2019;8:e012788.
Marcolino MS, Oliveira JAQ, D’Agostino M, et al. The Impact of mHealth Interventions: Systematic Review of Systematic Reviews. Journal of Medical Internet Research Mhealth Uhealth. 2018;6:e23.
Nascimento BR, Beaton AZ, Nunes MCP, et al. Integration of echocardiographic screening by non-physicians with remote reading in primary care. Heart. 2018;105:283-90. doi:10.1136/heartjnl-2018-313593.
Powell J. Trust Me, I’m a Chatbot: How Artificial Intelligence in Health Care Fails the Turing Test. J Med Internet Res. 2019 Oct 28;21(10):e16222.
Ribeiro ALP, Paix?o GMM, Gomes PR, et al. Tele-electrocardiography and bigdata: The CODE (Clinical Outcomes in Digital Electrocardiography) study. Journal of Electrocardiology. 2019;57S:S75-S78. doi:10.1016/j.jelectrocard.2019.09.008.
Ribeiro AH, Ribeiro MH, Paix?o GMM, et al. Automatic Diagnosis of the Short-Duration 12-Lead ECG using a Deep Neural Network. Nat Commun. 2020 Apr 9;11(1):1760. doi:10.1038/s41467-020-15432-4.
Ribeiro AL, de Oliveira GMM. Toward a Patient-Centered, Data-Driven Cardiology. Arq Bras Cardiol. 2019;112(4):371-3.
Safavi KC, Khaniyev T, Copenhaver M, et al. Development and Validation of a Machine Learning Model to Aid Discharge Processes for Inpatient Surgical Care. Journal of the American Medical Association Network Open. 2019;2:e1917221.
Seetharam K, Kagiyama N, Sengupta PP. Application of mobile health, telemedicine and artificial intelligence to echocardiography. Echo Research and Practice. 2019;6:R41-52.
Smith SW, Walsh B, Grauer K, et al. A deep neural network learning algorithm outperforms a conventional algorithm for emergency department electrocardiogram interpretation. Journal of Electrocardiology. 2019;52:88-95.
Steinhubl SR, Muse ED, Topol EJ. The emerging field of mobile health. Science Translational Medicine. 2015(7).283rv3.
Tripoliti EE, Karanasiou GS, Kalatzis FG, et al. A knowledge management system targeting the management of patients with heart failure. Journal of Biomedical Informatics. 2019;94:103203.
Weng SF, Reps J, Kai J, et al. Can machine-learning improve cardiovascular risk prediction using routine clinical data? PLoS One. 2017;12:e0174944.
Zhang J, Gajjala S, Agrawal P, et al. Fully Automated Echocardiogram Interpretation in Clinical Practice. Circulation. 2018;138:1623-35.
https://aasm.org/fitbit-scientists-reveal-results-analysis-6-billion-nights-sleep-data
9. Возможные перспективы развития
Использование современных цифровых технологий позволяет совершить прорыв в практическом здравоохранении, но требует значительных инвестиций на этапах валидации данных и демонстрации клинической ценности исследуемых методов. В процессе взаимодействия между пользователями, медицинскими компаниями-провайдерами и клиническими специалистами всегда имеются независимые ограничения (табл. 5), не хватает консенсуса или согласованности действий с четко определенным дизайном, вариантами принятия решений и их реализацией (рис. 7). Таким образом, формальные рекомендации по интеграции мобильного здравоохранения в клиническую практику в настоящее время не могут быть осуществлены в полной мере. Это подтверждается заявлением Рабочей группы по профилактике в США о том, что “при наличии ФП, обнаруженной с помощью мобильных устройств, недостаточно клинических доказательств для начала терапии” — несмотря на тот факт, что скрининг ФП был одним из первых показаний для использования цифровых регистраторов, вызывающих большой интерес у пациентов и клиницистов (Curry 2018). Таким образом, технологии мобильного здравоохранения в настоящее время представляют собой скорее всего устройства, отпускаемые без рецепта врача, которые продаются напрямую потребителям для отслеживания данных о состоянии здоровья без возможности клинического вмешательства.
Таблица 5
Принципы мобильного здравоохранения, возможные участники и перспективы


Рис. 7. Нерешенные вопросы при использовании мобильных технологий.
Примечание: чтобы полностью использовать огромный потенциал мобильного здравоохранения, необходимо продуктивное многоэтапное сотрудничество специалистов и представителей различных заинтересованных сторон, но многие вопросы до сих пор остаются без ответа. Среди потребителей цифровых продуктов увеличивается доля здоровых лиц, которые в итоге преобладают в структуре пользователей мобильного здравоохранения. В то же время пациентам подобные цифровые инструменты контроля здоровья рекомендуют достаточно редко. Потенциальные преимущества мобильных технологий для улучшения здоровья пациентов могут быть реализованы, когда производитель совместно с медицинскими учреждениями проводит тестирование и валидацию программного обеспечения при определенных заболеваниях. Необходимо определить участников, ответственных за контроль сбора и анализа данных и, следовательно, за прогнозирование клинических исходов. В конечном счете, пользователи и медицинские специалисты должны быть уверены в потенциальной клинической пользе используемых цифровых технологий, прежде чем рекомендовать их рутинное применение на практике.
Ниже представлены возможные варианты этапов стандартизации приложений мобильного здравоохранения.
1. Валидация данных
- Необходимо разрабатывать клинические стандарты для сравнительной оценки функциональности цифровых устройств медицинского
назначения.
При этом нужно помнить, что могут быть различия в применяемых мобильных методах диагностики при одной и той же патологии — к примеру, принцип регистрации ФП на основании ЭКГ или ФПГ отличается, что нужно учитывать при дальнейшем принятии клинических решений.
2. Определение оптимальной клинической тактики
- Скрининг
А. Оценить диагностическую ценность методики в зависимости от характеристик исследуемой популяции.
Б. Установить единый набор критериев клинической значимости (Slotwiner 2019).
Скрининг должен быть оправдан с медицинской точки зрения, а не зависеть от финансовых аспектов исследования. Следует проявлять осторожность при экстраполировании данных, полученных в когортах пациентов с клинически диагностированной ФП (обычно на основе клинических или госпитальных регистров), на тактику ведения ФП, выявленной с помощью технологий мобильного здравоохранения (“здоровые потребители”). Результаты, позволяющие предположить ФП в группах с низким исходным уровнем риска, могут с высокой долей вероятности оказаться ложноположительными, что может стать причиной дополнительных тестов, которые могут привести к клиническому риску для пациента (даже вызвать тревогу, а не успокоить), риску чрезмерного лечения и необоснованным финансовым расходам. Существует опасность, что скрининг ФП с использованием цифровых мобильных технологий, если он не направлен на группу повышенного риска, может быть в определенной степени дискредитирован и повторить судьбу многих программ медицинского скрининга в истории здравоохранения.
- Вопросы, требующие дальнейшего изучения
Определение основных клинических характеристик (продолжительность, количество эпизодов/ плотность аритмии) и ФР, которые оправдывают антикоагулянтную терапию при ФП, обнаруженной с помощью мобильных технологий.
- Контроль заболевания
А. Определить показания, периодичность и условия реализации терапевтических стратегий, которые могут уменьшить потребность в очных клинических визитах (по аналогии
с ИЭУ).
Б. Выявить предикторы, которые могут указывать на вероятную декомпенсацию заболевания, и предложить возможные профилактические вмешательства.
В. Оценить эффективность лечения.
- Влияние на клинические исходы
Преимущества использования технологий мобильного здравоохранения включают:
А. Повышение эффективности контроля заболевания.
Б. Модификация ассоциированных ФР (например, сопутствующие заболевания, изменение образа жизни).
3. Практическая реализация
- Анализ стоимость/эффективность. Например, анализ эффективности оптимизации рабочего процесса и улучшения качества лечения на индивидуальном уровне (Jiang 2019), оценка возмещения затрат в условиях действующей системы здравоохранения, возможность снижения затрат пациента или потребителя.
- Инициативы общественного здравоохранения и профессиональных сообществ. Обучение пациентов и повышение информированности о своем заболевании, комплексное взаимодействие заинтересованных сторон-участников процесса лечения, подготовка клинических рекомендаций.
4. Методы самоконтроля для пациентов
Пациенты контролируют интенсивность мониторинга и действуют в соответствии с полученной персональной информацией о состоянии здоровья. Частота сбора данных носит спорадический характер и определяется, например, удобством, периодичностью и обстоятельствами возникновения симптомов или временем активного отдыха и спортивных нагрузок. Данная стратегия, вероятно, недостаточно эффективна в плане обнаружения редких симптомов и не всегда способна обеспечить быстрое изменение клинической тактики при угрожающих жизни состояниях.
Возможные способы коррекции ограничений:
- Обучение пациентов и информирование их о своем заболевании, после чего анализируемые данные могут рассматриваться в индивидуальном клиническом контексте.
- Составление индивидуального графика мониторинга.
- Демонстрация безопасности используемых методов.
В одном недавнем исследовании показан пример использования мобильных технологий в режиме по требованию. Приложение Fibricheck использовалось пациентами для мониторинга ЧСС и ритма в течение недели до запланированной телеконсультации во время пандемии COVID-19, чтобы обеспечить возможность удаленной оценки клинического состояния и принятия решений о дальнейшей тактике. Периодичность мониторинга регулировалась согласно заранее определенному расписанию, что позволяло избежать ненужной загрузки данных и дополнительных контрольных визитов пациентов (Pluymaekers 2020).
- Пациенты имеют законное право на предоставление персональных данных о состоянии здоровья, полученных с помощью немедицинских (т.е. потребительских) мобильных технологий, которые могут быть включены в их медицинские карты.
5. Правила для компаний-провайдеров медицинских услуг
В сфере цифрового здравоохранения производитель медицинских технологий имеет определенные обязательства перед пользователями. Инструменты мобильного здравоохранения разрабатывались, в основном, как ориентированные на обычного пользователя технологии, доступные для более широкого рынка через розничные каналы, а не для специальных медицинских поставок. Этот факт могут использовать провайдеры мобильных медицинских технологий, учитывая высокую распространенность портативных смарт-устройств в современном обществе (каждый десятый житель США имеет соответствующее мобильное приложение или смарт-часы, что составляет ~30 млн человек). Однако прямая доступность медицинских услуг для рядового пользователя (в обход клинических специалистов, системы здравоохранения и страховых компаний) имеет определенные недостатки, т.к. ответственность за принятие клинических решений на основе полученных данных должны нести все-таки квалифицированные медицинские работники. Оптимизация работы медицинских мобильных приложений (помимо того, что их рассматривают как средство мониторинга состояния здоровья у обеспеченных пользователей/обеспокоенных собственным здоровьем пациентов) потребует выполнения ряда условий:
- Обеспечение доступности цифровых технологий для широкого круга пользователей.
- Взаимодействие с медицинскими специалистами для адаптации мобильных устройств в соответствии с клиническими потребностями и совместная оценка их эффективности. Это очень важно, т.к. врач несет полную ответственность за медицинские решения и контролирует стратегии лечения.
- Регламентирование операций с персональными данными пользователей (например, Генеральный регламент ЕС о защите персональных данных в Европе).
6. Распределение обязанностей
- Распределение обязанностей среди участников мобильного наблюдения (компании-производителя, госпиталя, других представителей), ответственных за кибербезопасность и защиту данных, которые могут нести ответственность в случае неправильной диагностики или пропуска патологии.
- Определение стандартных сроков ответа клиники в зависимости от состояния пациента и полученной диагностической информации. Этот вопрос является важным, поскольку с использованием облачных интернет-ресурсов и повышенных скоростей передачи данных (формат 5G) и технологии Internet of Things (IoT) клинические решения становятся доступными в режиме реального времени.
- При повторных исследованиях и многократном скрининге населения следует учитывать этические и социальные аспекты (Yan 2019, Turakhia 2020).
7. Оказание медицинской помощи
Варианты интегрирования индивидуальных мобильных приложений в действующую структуру здравоохранения.
- “Амбулаторное лечение, основанное на исключительных обстоятельствах”, т.е. проведение амбулаторных визитов пациентов только по показаниям.
- Централизованная обработка информации в облачном хранилище с последующей отправкой медицинскому специалисту/в клинику только клинически значимых данных.
- Раннее выявление пациентов из группы риска (даже до появления симптомов) с последующим решением о профилактической терапии (Boehmer 2017, Rosier 2016).
- Объединенный скрининг населения — изменение парадигмы индивидуального скрининга (Yan 2019, Turakhia 2020).
- Расширение роли беспроводных портативных устройств от амбулаторного лечения до стационарного этапа, например, возможно заменить традиционный проводной мониторинг отдельных индивидуальных параметров на беспроводной мониторинг нескольких параметров.
Например, технология наблюдения с применением специального водонепроницаемого кольца (Bodimetrics) использовалась для многопараметрического мониторинга (ЧСС, сон, индекс десатурации содержания кислорода, счетчик шагов и калорий) в отделении интенсивной терапии для пациентов с COVID-19. Кольцо подключается к смартфону или централизованному узловому распределителю данных в структуре госпиталя и позволяет совершать обмен информацией и принимать решения по коррекции терапии (https://bodimetrics.com/product/circul-sleep-and-fitness-ring/).
- Расширение функции мобильного мониторинга до проведения клинического вмешательства.
- Обеспечение удаленного программирования терапевтических ИЭУ в кардиологии.
Например, ИЭУ, применение новых носимых кардиовертеров-дефибрилляторов, которые включают возможность подключения смартфона на основе технологии Bluetooth® Low Energy (BLE) для передачи и отображения данных пациентов и их интерпретации клиническими специалистами. Это позволяет дистанционно внести изменения при программировании в такие параметры, как диагностические данные, зоны детекции, произвести сброс счетчиков; регулировка AV задержки/PVARP интервала, настройка минимальной частоты стимуляции и верхней частоты отслеживания, коррекция амплитуды стимуляции; перевод в МРТ режим, а также активация экстренной терапии или отключение необоснованной терапии, наносимой вследствие перелома электрода/непрерывной суправентрикулярной тахикардии/нарушения сенсинга.
А. Организация удаленных интервенционных вмешательств, например, дистанционной роботизированной аблации, которая может быть доступна пациентам, живущим в отдаленных районах, под удаленным контролем высококвалифицированных профессионалов, имеющих большой опыт работы в экспертных центрах (Choi 2018, Haidegger 2011, Shinoda 2020).
Б. Обеспечение персонализации медицинского подхода за счет беспрепятственной интеграции более широкого диапазона данных, полученных с помощью мобильных технологий, в генетический и клинический профиль пациента, включая информацию о факторах внешней среды и образе жизни (“big data”). (https://ghr.nlm.nih.gov/primer/precisionmedicine/initiative).
Заключение
Внедрение мобильных технологий в работу цифрового здравоохранения происходит неодинаковыми темпами в различных регионах и странах. Некоторые из описанных выше технологий одобрены повсеместно и могут быть доступны во всех странах. Поэтому, несмотря на то, что данный документ отражает, главным образом, точку зрения США, описанный опыт применения и регулирования мобильных устройств может служить ориентиром и для других международных профессиональных организаций, одобряющих принципы изложенного консенсуса экспертов. Всемирная Организация Здравоохранения предполагает, что повышение потенциала для внедрения и расширения рентабельных инновационных технологий цифрового здравоохранения может сыграть важную роль в обеспечении доступа к качественным медицинским услугам для всего населения, в то же время учитывая возможные ограничения, подобные тем, которые обсуждались в данном документе. Некоторые из проблем могут быть решены быстро, как видно из реакции на недавнюю глобальную пандемию SARS-CoV-2, которая вызвала необходимость в бесконтактном мониторинге пациентов и, как следствие, способствовала внедрению цифровых инструментов наблюдения (DHSS, FDA, Varma 2020). Регулирующие органы отреагировали также своевременно, смягчая правила регистрации телемедицинских технологий и формируя временную систему возмещения расходов, демонстрирующую, что при необходимости могут быть приняты соответствующие решения.
В будущем потенциальная клиническая польза на фоне применения мобильных решений в здравоохранении может иметь революционное значение и способствовать улучшению терапии многих заболеваний за счет своевременного и эффективного регулирования взаимодействия пациентов, клиницистов и системы здравоохранения во всем мире.
Литература/References
9.
Boehmer JP, Hariharan R, Devecchi FG, et al. A Multisensor Algorithm Predicts Heart Failure Events in Patients With Implanted Devices: Results From the MultiSENSE Study. JACC Heart Fail. 2017;5:216-25. doi:10.1016/j.jchf.2016.12.011.
Choi PJ, Oskouian RJ, Tubbs RS. Telesurgery: Past, Present, and Future. Cureus Journal of Medical Science. 2018;10:e2716. doi:10.7759/cureus.2716.
Curry SJ, Krist AH, Owens DK, et al. US Preventive Services Task Force, Screening for Atrial Fibrillation With Electrocardiography: US Preventive Services Task Force Recommendation Statement. Journal of the American Medical Association. 2018;320:478-84. doi:10.1001/jama.2018.10321.
Haidegger T, S?ndor J, Beny? Z. Surgery in space: the future of robotic telesurgery. Surgical Endoscopy. 2011;25:681?90. doi:10.1007/s00464-010-1243-3.
Jiang X, Ming WK, You JH. The Cost-Effectiveness of Digital Health Interventions on the Management of Cardiovascular Diseases: Systematic Review. Journal of Medical Internet Research. 2019;21:e13166. doi:10.2196/13166.
Pluymaekers NAHA, Hermans ANL, van der Velden RMJ, et al. On-demand app-based rate and rhythm monitoring to manage atrial fibrillation through tele-consultations during COVID-19. International Journal of Cardiology Heart & Vascular. 2020;28:100533. doi:10.1016/j.ijcha.2020.100533
Rosier A, Mabo P, Temal L, et al. Personalized and automated remote monitoring of atrial fibrillation. Europace. 2016;18:347-52. doi:10.1093/europace/euv234.
Shinoda Y, Sato A, Adach T, et al. Early clinical experience of radiofrequency catheter ablation using an audiovisual telesupport system. Heart Rhythm. 2020;17(5):870-5. doi:10.1016/j.hrthm.2020.01.018.
Turakhia MP. Diagnosing With a Camera From a Distance — Proceed Cautiously and Responsibly. Journal of the American Medical Association Cardiol. 2020:5:107.
Varma N, Marrouche NF, Aguinaga L, et al. HRS/EHRA/APHRS/LAHRS/ACC/AHA Worldwide Practical Guidance for Telehealth and Arrhythmia Monitoring During and After a Pandemic. Journal of the American College of Cardiology. 2020;76:1363-74. doi:10.1016/j.jacc.2020.06.019.
Yan BP, Lai WHS, Chan CKY, et al. High-Throughput, Contact-Free Detection of Atrial Fibrillation From Video With Deep Learning. JAMA Cardiol. 2020. Jan 12020;5(1):105-7. doi:10.1001/-jamacardio.2019.4004.
U.S. Department of Health & Human Services. Notification of enforcement discretion for telehealth remote communications during the COVID-19 nationwide public health emergency. 2020; https://www.hhs.gov/hipaa/for-professionals/special-topics/emergency-preparedness/notification-enforcement-discretion-telehealth/index.html
U.S. Food & Drug Administration. Enforcement policy for non-invasive remote monitoring devices used to support patient monitoring during the coronavirus disease-2019 (COVID-19) public health emergency. 2020; https://www.fda.gov/regulatory-information/search-fda-guidance-documents/enforcement-policy-non-invasive-remote-monitoringdevices-used-support-patient-monitoring-during.
https://bodimetrics.com/product/circul-sleep-and-fitness-ring/.
https://ghr.nlm.nih.gov/primer/precisionmedicine/initiative.
Приложение 1
В США возмещение медицинских услуг регулируется в первую очередь центрами услуг Medicare и Medicaid (CMS). Комитет по текущей процедурной терминологии (CPT) Американской медицинской ассоциации разрабатывает описательные коды для каждой медицинской услуги и присваивает код CPT. Затем каждый код CPT передается в Комитет ассоциации по обновлению относительной стоимости для разработки рекомендуемой единицы относительной стоимости, которая определяет размер компенсации расходов. Центры Medicare и Medicaid обычно следуют рекомендациям, разработанным Американской медицинской ассоциацией. В настоящее время идет работа по разрабатыванию кодов, отражающих внедрение технологий мобильного здравоохранения в клиническую практику. Затем после анализа кодов им будут присвоены значения единицы относительной стоимости. Если Центры Medicare и Medicaid их одобрят, они будут включены в Таблицу выплат Medicare и будут использоваться в клинической практике. Обычно этот процесс занимает около 2-х лет. После того, как коды и услуги будут утверждены и опубликованы в официальном прейскуранте, другие страховщики также обычно принимают их без ограничений (на момент написания данного документа CPT 99091 и CPT 99457 получили одобрение).
В 2015г Центры страховых услуг Medicare и Medicaid в США инициировали новый код, регламентирующий медицинскую помощь при хронических заболеваниях, который возмещает расходы по первичной медико-санитарной помощи при использовании дистанционных технологий для консультации и лечения пациентов. Далее в ноябре 2018г были завершены планы по возмещению расходов медицинским провайдерам за определенные услуги УМ пациентов и телемедицинские консультации. Эти изменения касались трех новых кодов CPT, которые отделяют услуги удаленного наблюдения пациентов от услуг телездравоохранения (A.) Новые коды CPT включают #99453, 99454 и 99457. Первые два кода описывают УМ физиологических параметров, но не включают конкретно мониторинг ЭКГ. Третий код характеризует услуги наблюдения и лечения, продолжительностью >20 мин времени, затрачиваемого медицинским персоналом/врачом/ другими квалифицированными медицинскими работниками в календарном месяце, требующего интерактивного общения с пациентом/его представителями в течение каждого прошедшего месяца; однако неясно, можно ли использовать этот код для служб мониторинга ЭКГ с помощью мобильных устройств. Существующий ранее код CPT 93040 (используемый для отчета по записи ЭКГ в 1-3 отведениях, без интерпретации и анализа) не подходит для регистрации событий мобильного устройства, инициированных пациентом, поскольку для этого потребуется другой порядок, который запускается событием, за которым следует отдельный сформированный отчет. Также было предложено создать новый виртуальный сервисный код HCPCS, GRAS1, для “Удаленной оценки предварительно записанной информации о пациенте”, который возместит поставщику расходы на асинхронный просмотр “записанного видео и/ или изображений, снятых пользователем для оценки состояния здоровья” и определить, необходимо ли очное посещение врача в клинике (веб-сайт Telemedicine and Health B.) Счет за этот код может быть выставлен отдельно, если в течение предыдущих семи дней не было посещения врача для регистрации ЭКГ. CMS завершают отдельные выплаты по коду CPT 99091 (сбор и интерпретация физиологических данных, например, ЭКГ, АД, мониторинг глюкозы), хранящиеся в цифровом виде и/или переданные пациентом и/или лицом, осуществляющим уход, врачу или другому квалифицированному специалисту в области здравоохранения (А.). Однако в этом случае должна быть клинически значимая причина, по которой врач будет проводить просмотр и анализ данных регулярно через определенные периоды времени.
A. Department of Health and Human Services Centers for Medicare & Medicaid Services. https://s3.amazonaws.com/public-inspection.federalregister.gov/2018-24170.pdf. Published 11/23/18. Accessed 26 Jan 21.
B. Telemedicine and Digital Health. Medicare’s New Virtual Care Codes: A Monumental Change and Validation of Asynchronous Telemedicine. https://www.healthcarelawtoday.com/2018/07/18/medicaresnew-virtual-care-codes-a-monumental-changeand-validation-of-asynchronous-telemedicine/. Published 7/18/18. Accessed 1/23/19.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Varma N., Cygankiewicz I., Turakhia M. Контроль аритмий с помощью технологий мобильного здравоохранения: цифровые медицинские технологии для специалистов по сердечному ритму. Консенсус экспертов 2021. Российский кардиологический журнал. 2021;26(1S):4420. https://doi.org/10.15829/1560-4071-2021-4420
Скопировать