Детерминанты прогноза и тактика ведения пациентов с легочной гипертензией, ассоциированной с патологией левых камер сердца: систематический обзор
Аннотация
Пациенты с легочной гипертензией (ЛГ), ассоциированной с заболеваниями левых отделов сердца, обычно характеризуются сложным коморбидным статусом и посткапиллярным компонентом ЛГ. Присутствие и идентификация комбинированного пост-/прекапиллярного компонента ЛГ у когорты пациентов с заболеванием левых отделов сердца отражается в виде более выраженных структурно-функциональных нарушений правого желудочка, обусловленных более высоким легочным сосудистым сопротивлением, что, в свою очередь, отражается в виде нарушения толерантности к физическим нагрузкам и наличием фенотипа ЛГ, схожего с легочной артериальной гипертензией (ЛАГ). Обнаружение комбинированного компонента ЛГ имеет решающее значение, поскольку это может влиять на прогноз и принципы лечения пациентов. В обзоре представлены современные маркеры прогноза больных ЛГ, ассоциированной с патологией левых отделов сердца, которые могут быть использованы в клинической практике. Проанализированы результаты рандомизированных клинических исследований и пилотных работ, посвященных расширению терапевтических возможностей лечения пациентов ЛГ группы 2 с использованием в т.ч. препаратов ЛАГ-специфической терапии. Обсуждены перспективы лечения данной когорты пациентов.
Более частой причиной повышения давления в малом круге кровообращения является развитие посткапиллярной легочной гипертензии (ЛГ) на фоне патологии левых отделов сердца в основном приобретенного характера, что составляет >80% от всех этиологических факторов возникновения ЛГ [1-3].
Согласно национальным рекомендациям и рекомендациям Евразийской ассоциации кардиологов гемодинамически ЛГ на фоне патологии левых отделов сердца представлена следующими характеристиками: значением среднего давления в легочной артерии (ЛА) ?25 мм рт.ст. и давления заклинивания ЛА (ДЗЛА) ?15 мм рт.ст. согласно данным катетеризации правых отделов сердца (КПОС) [1][2]. При этом в обновленных рекомендациях Европейского общества кардиологов (ЕОК) и Европейского респираторного общества (ЕРО), вышедших в августе 2022г, снижено пороговое значение среднего давления в ЛА (срДЛА), как одного из гемодинамических критериев ЛГ, с 25 мм рт.ст. до уровня срДЛА >20 мм рт.ст. [3].
Точно определить распространенность ЛГ в популяции не представляется возможным. По некоторым данным частота встречаемости ЛГ в мире составляет 1% населения и среди лиц старше 65 лет возрастает до 10% [4].
По данным трансторакальной эхокардиографии (ЭхоКГ) у 60% пациентов с систолической и у 83% пациентов с диастолической дисфункцией левого желудочка (ЛЖ) наблюдаются признаки ЛГ с уровнем расчетного систолического давления в ЛА (РСДЛА) >35 мм рт.ст. [5]. Распространенность ЛГ среди пациентов с сердечной недостаточностью (СН) и сниженной фракцией выброса (ФВ) ЛЖ (СНнФВ) варьирует в пределах 40-75%, в то время как среди пациентов с СН и сохраненной ФВ ЛЖ (СНсФВ) в пределах 36-83% пациентов [6].
Существует два гемодинамических варианта ЛГ на фоне патологии левых отделов сердца, которые представлены в виде изолированной посткапиллярной ЛГ (легочное сосудистое сопротивление (ЛСС) ?3 единиц Вуда (Ед Вуда) и диастолический градиент давления (ДГД) <7 мм рт.ст. [1][2], согласно обновленным рекомендациям ЕОК/ЕРО — ЛСС ?2 Ед Вуда [3]) и смешанной пост-/прекапиллярной ЛГ (ЛСС >3 Ед Вуда и ДГД ?7 мм рт.ст. [1][2], согласно обновленным рекомендациям ЕОК/ЕРО — ЛСС >2 Ед Вуда).
Идентификация смешанного варианта ЛГ при учете критерия ДГД ?7 мм рт.ст. наблюдается у 22,6% пациентов с СНсФВ и у 18,8% лиц с СНнФВ [7].
При смешанной пост-/прекапиллярной ЛГ хроническое повышение давления в левом предсердии у пациентов с патологией левых отделов сердца индуцирует более выраженное ремоделирование легочного сосудистого русла с повышением ЛСС и последующим развитием дисфункции правого желудочка (ПЖ), что практически не характерно для изолированной посткапиллярной ЛГ [8][9]. Именно поэтому для пациентов с комбинированным пост-/прекапиллярным компонентом ЛГ свойственно более выраженное нарушение толерантности к физическим нагрузкам и наличие фенотипа ЛГ, схожего с легочной артериальной гипертензией (ЛАГ) [10][11].
Присутствие и идентификация прекапиллярного компонента дополнительно к посткапиллярной ЛГ имеет решающее значение, поскольку это может влиять на прогноз и принципы лечения пациентов [9][12-14].
Целью данного обзора является изучение основных маркеров прогноза летальности, ухудшения течения СН и повторных госпитализаций у пациентов с ЛГ на фоне заболеваний левых отделов сердца, а также роли специфической терапии в лечении данной когорты пациентов.
Методологические подходы
Алгоритм поиска информации был разработан в соответствии с требованиями и положениями отчетности для систематических обзоров (PRISMA) в базе данных PubMed (132 статьи) и включал поиск исследований с использованием поисковых запросов, ключевых слов (в т.ч. используя медицинские предметные заголовки — MeSH) и логических операторов. Согласно поставленной цели поиска, тезисы докладов, протоколы заседаний, книги, клинические случаи и серии случаев не использовались. Английский язык был установлен в качестве языкового ограничения. Два автора независимо друг от друга изучили заголовки и аннотации публикаций на соответствие критериям включения, возникшие разногласия решали путем переговоров или с привлечением третьего автора. Первостепенно фильтр исследований проводился с помощью проверки заголовков и/или аннотаций, исключения обзоров, дублирующихся публикаций, описанных клинических случаев. Вторым этапом проводился отбор исследований после прочтения полнотекстовой рукописи. Исследования считались приемлемыми, если в них были представлены: 1) выборки взрослых пациентов с ЛГ на фоне патологии левых отделов сердца (с посткапиллярной ЛГ или смешанной пост-/прекапиллярной ЛГ) с описанием клинико-инструментальных характеристик пациентов, данных о прогнозе и исходах заболевания; 2) исследования, демонстрирующие динамику состояния пациентов с ЛГ группы 2 на фоне применяемых методов интервенционного или ЛАГ-специфического лечения (неоднократный прием препарата).
Ключевые слова в базе данных PubMed: ((pulmonary hypertension) and (left heart disease)) or (pulmonary hypertension, associated with left heart disease) or (postcapillary pulmonary hypertension) or (combined precapillary and postcapillary pulmonary hypertension) or ((heart failure preserved/reduced ejection fraction) and (pulmonary hypertension)).
Последний поиск осуществлялся 28 сентября 2022г.
Критерии включения/исключения. В систематический обзор включены только те исследования, в которых присутствовало полноценное описание результатов клинико-инструментальных методов исследования, динамики и исходов течения заболевания; в обзор не включались исследования, посвященные изучению эффекта ЛАГ-специфической терапии изолированно у пациентов с приобретенным пороком сердца до/после его хирургической коррекции. Также были исключены исследования на животных, обзоры, клинические случаи и серии случаев. Следует подчеркнуть, что количество включенных в исследования пациентов и установленный диагноз ЛГ неинвазивным методом исследования (т.е. с помощью ЭхоКГ) не являлись определяющими факторами отбора.
При первичном отборе с использованием вышеописанных поисковых запросов было получено 132 публикации (PubMed) (рис. 1).

Рис. 1. Алгоритм отбора публикаций для систематического обзора.
Сокращение: ЛГ — легочная гипертензия.
Для каждого исследования, посвященного изучению безопасности и эффективности применения интервенционных методов/ЛАГ-специфической терапии, для лечения пациентов с ЛГ на фоне патологии левых отделов сердца, регистрировались следующие данные: первый автор и/или название исследования, исследуемая популяция, количество включенных пациентов, возраст, пол, тип патологии левых камер сердца и величина ФВ ЛЖ, характеристики ЛГ и метод ее определения, интервенционный метод/препарат и длительность терапии, конечные точки, достижение конечных точек исследования. Любые разногласия разрешались путем обсуждения.
Всего после удаления повторяющихся статей, обзоров, клинических случаев, осталось 31 исследование, посвященное интервенционному и/или медикаментозному лечению пациентов с ЛГ на фоне патологии левых отделов сердца. Два независимых исследователя просмотрели полнотекстовые варианты оставшихся публикаций, после коллегиального обсуждения и привлечения третьего эксперта проведен анализ 16 статей, вошедших в данный систематический обзор. После отбора также проведен анализ 12 оригинальных исследований, посвященных изучению маркеров прогноза пациентов с патологией левых отделов сердца и ЛГ (рис. 1).
Детерминанты прогноза пациентов при ЛГ на фоне заболеваний левых отделов сердца
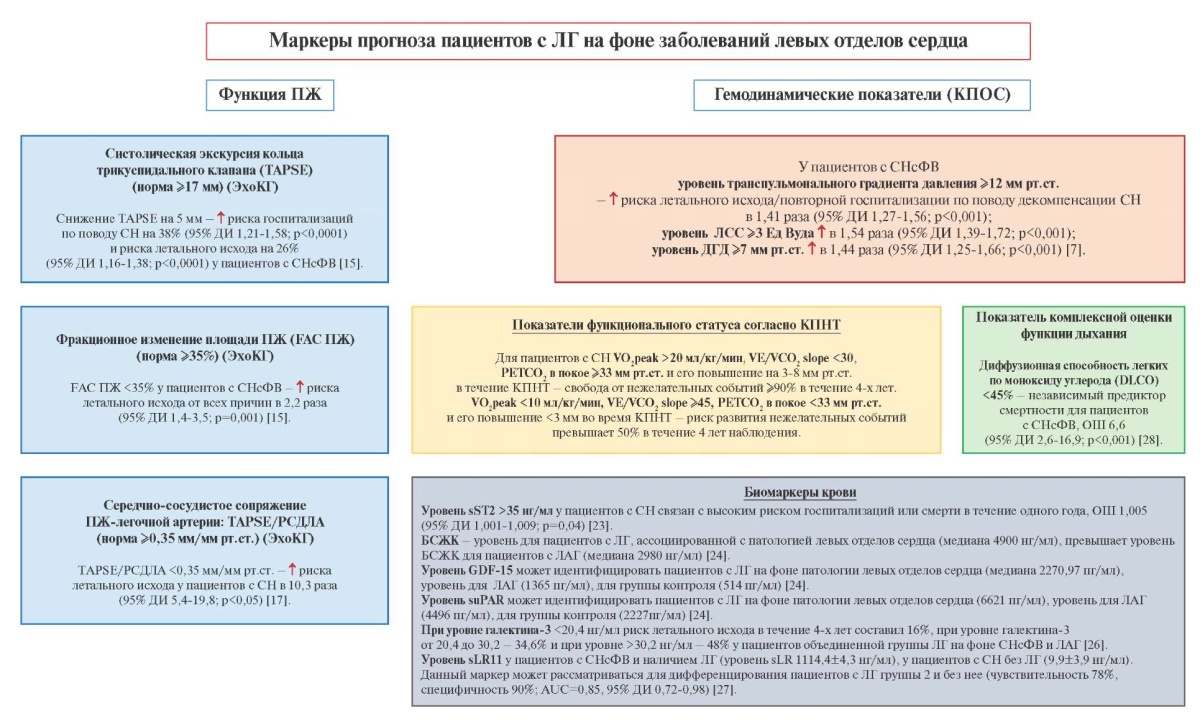
Основные маркеры прогноза пациентов с ЛГ на фоне патологии левых отделов сердца представлены на рисунке 2.

Рис. 2. Маркеры прогноза пациентов с ЛГ на фоне заболеваний левых отделов сердца.
Сокращения: БСЖК — белок, связывающий жирные кислоты, ДГД — диастолический градиент давления, ДИ — доверительный интервал, Ед Вуда — единицы Вуда, КПНТ — кардиопульмональное нагрузочное тестирование, КПОС — катетеризация правых отделов сердца, ЛАГ — легочная артериальная гипертензия, ЛГ — легочная гипертензия, ЛСС — легочное сосудистое сопротивление, ОШ — отношение шансов, ПЖ — правый желудочек, РСДЛА — расчетное давление в легочной артерии, СН — сердечная недостаточность, СНсФВ — сердечная недостаточность с сохранной фракцией выброса левого желудочка, ЭхоКГ — эхокардиография, DLCO — диффузионная способность легких по моноксиду углерода, FAC ПЖ — фракционное изменение площади правого желудочка, GDF-15 — фактор дифференцировки роста-15, sLR11 — растворимый рецептор липопротеина низкой плотности с 11 лиганд-связывающими повторами, sST2 — стимулирующий фактор роста, экспрессируемый геном 2, suPAR — растворимый рецептор активатора плазминогена урокиназы, PETCO2 — парциальное давление углекислого газа в конце выдоха, TAPSE — систолическая экскурсия кольца трикуспидального клапана, VE/VCO2 slope — вентиляционный эквивалент по углекислому газу, VO2peak — пиковое потребление кислорода.
Функция ПЖ как предиктор прогноза (по данным трансторакальной ЭхоКГ)
Функция ПЖ — одна из основных детерминант статуса и прогноза пациентов с ЛГ.
В течение медианы (Me) 2 лет уровень выживаемости пациентов с СНсФВ и наличием дисфункции ПЖ составляет 56% при сравнении с пациентами без нарушений функции ПЖ (93%) [15]. Продемонстрировано, что наличие дисфункции ПЖ при СНсФВ более характерно для пациентов мужского пола, с сопутствующей фибрилляцией предсердий, почечной дисфункцией и наличием коронарной патологии [15].
В ряде работ описан вклад динамики систолической функции ПЖ в прогноз пациентов с СНсФВ [15][16]. Результаты метаанализа автора Gorter TM, et al. продемонстрировали, что снижение значения показателя систолической функции ПЖ по данным трансторакальной ЭхоКГ — систолической экскурсии кольца трикуспидального клапана (TAPSE) на 5 мм ассоциируется с увеличением риска госпитализаций по повод СН на 38% (95% доверительный интервал (ДИ) 1,21-1,58; p<0,0001) (n=919) и риска летального исхода на 26% (95% ДИ 1,16-1,38; p<0,0001) (n=1156) у пациентов c СНсФВ. Величина TAPSE, свидетельствующая о дисфункции ПЖ, составляет <17 мм [16].
В исследовании Melenovsky V, et al. наличие дисфункции ПЖ в виде уменьшения показателя фракционного изменения площади ПЖ (FAC ПЖ) <35% у пациентов с СНсФВ ассоциировалось с увеличением риска летального исхода от всех причин в 2,2 раза после поправки на уровень РСДЛА по данным трансторакальной ЭхоКГ (95% ДИ 1,4-3,5; p=0,001). Нижняя граница нормы для показателя FAC ПЖ составляет 35% [15].
Данные метаанализа Gorter TM, et al. свидетельствуют о повышении риска госпитализации по поводу СН на 9% (95% ДИ 1,00-1,19; p=0,07) (n=869) и повышении риска летального исхода на 16% при снижении значения FAC ПЖ на 5% у пациентов с СНсФВ (95% ДИ 1,08-1,24; p<0,0001) (n=965) [16].
Такой показатель, как сердечно-сосудистое сопряжение ПЖ-ЛА, оцененное как отношение TAPSE к РСДЛА по данным ЭхоКГ, было изучено в ряде исследований у пациентов с СН [17][18]. Данный показатель представлен как мощный предиктор выживаемости у пациентов с СН. Значение TAPSE/РСДЛА <0,35 мм/мм рт.ст. ассоциируется с десятикратным увеличением риска летального исхода у пациентов с СН, отношение шансов (ОШ) 10,3 (95% ДИ 5,4-19,8; p<0,05) [17]. Спустя 4 года наблюдения у пациентов с СНсФВ при величине TAPSE/РСДЛА <0,35 мм/мм рт.ст. уровень выживаемости составляет 62%, тогда как при уровне от 0,35 до 0,50 мм/мм рт.ст. — 88,4%, а при уровне >0,65 мм/мм рт.ст. — 100% [18].
Параметры магнитно-резонансной томографии сердца как предикторы прогноза
Проведение магнитно-резонансной томографии (МРТ) сердца позволяет детально оценить структурные изменения сердца, верифицируя имеющуюся патологию левых камер сердца, как причину ЛГ, так и выраженность структурных и функциональных изменений ПЖ. МРТ сердца может быть также полезно в верификации фенотипа смешанной пост-/прекапиллярной ЛГ. Так, по данным МРТ сердца значение конечно-систолического угла межжелудочковой перегородки (угол, формирующийся между желудочками и средней частью перегородки) коррелирует с уровнем ДГД (r=0,74; p<0,001) и ЛСС (r=0,63; p<0,001). Угол межжелудочковой перегородки по данным МРТ сердца, равный 160°, является диагностическим порогом для идентификации пациентов со смешанной пост-/прекапиллярной ЛГ (c уровнем ДГД 7 мм рт.ст. и выше) с чувствительностью 67% и специфичностью 93%. Согласно данным однофакторного анализа c использованием регрессии пропорциональных рисков по Коксу значение систолического угла межжелудочковой перегородки 160° и выше может предсказать смертность от всех причин в течение 2 лет ОШ 1,615 (95% ДИ 1,253-2,082; p<0,001) [19].
Гемодинамические предикторы по данным КПОС
ДЗЛА является основным гемодинамическим показателем у пациентов с ЛГ на фоне патологии левых отделов сердца, отражающим задействование венозного легочного сосудистого русла и наличием изолированно посткапиллярного компонента ЛГ (ДЗЛА ?15 мм рт.ст.; ЛСС ?3 Ед Вуда) или присоединением комбинированного ремоделирования как венозного, так и артериального легочного сосудистого русла с формированием смешанной пост-/прекапиллярной ЛГ (ДЗЛА ?15 мм рт.ст.; ЛСС >3 Ед Вуда).
Ретроспективный анализ данных 2587 пациентов с ЛГ и СНсФВ при Me наблюдения пациентов 1383 дня показал, что величина транспульмонального градиента давления ?12 мм рт.ст., ЛСС ?3 Ед Вуда и ДГД ?7 мм рт.ст. были предикторами смертности и повторных госпитализаций по поводу декомпенсации СН. Так, риск летального исхода/повторной госпитализации по поводу декомпенсации СН увеличивался в 1,41 раза при уровне транспульмонального градиента давления ?12 мм рт.ст. (95% ДИ 1,27-1,56; p<0,001), в 1,54 раза при уровне ЛСС ?3 Ед Вуда (95% ДИ 1,39-1,72; p<0,001) и в 1,44 раза при уровне ДГД ?7 мм рт.ст. (95% ДИ 1,25-1,66; p<0,001), соответственно [7].
Значение давления в правом предсердии является компонентом, отражающим волюмический статус пациентов с СНсФВ, повышение которого напрямую связано с присоединением и правожелудочковой СН.
Измерение сердечного индекса ПЖ для пациентов с патологией левых отделов сердца ЛГ при инвазивном исследовании также является важным для понимания выраженности дисфункции ПЖ, напрямую являющейся зеркалом функционального статуса и прогноза пациентов с ЛГ.
Параметры функционального статуса как детерминанты прогноза
Патофизиологические механизмы непереносимости физической нагрузки при СН многофакторны и включают как нарушения сердечного и легочного резервов, так и снижение перфузии и/или функции периферических и дыхательных скелетных мышц.
Продемонстрировано, что дистанция в тесте 6-минутной ходьбы (ДТ6МХ) <300 м является независимым прогностическим маркером смерти от сердечно-сосудистых заболеваний у пациентов с СНнФВ II-III функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA), однако акцентируется внимание на важности учета именно динамики величины ДТ6МХ [20].
Общепризнанным золотым стандартом определения физического состояния пациентов с СН является метод кардиопульмонального нагрузочного тестирования (КПНТ), с помощью которого неинвазивно проводится оценка механизмов, ограничивающих физическую работоспособность. Для пациентов как с СНсФВ, так и с СНнФВ при проведении КПНТ значение пикового потребления кислорода (VO2peak) >20 мл/кг/мин, вентиляционного эквивалента по углекислому газу (VE/VCO2 slope) <30, парциального давления углекислого газа в конце выдоха (PETCO2) в покое ?33 мм рт.ст. и его повышение на 3-8 мм рт.ст. в течение КПНТ ассоциируются с наилучшим прогнозом пациентов с СН на протяжении 4 лет со свободой от нежелательных событий ?90%. При значении VO2peak =16-20 мл/кг/мин, VE/VCO2 slope 30-35,9, PETCO2 в покое ?33 мм рт.ст. и его повышении на 3-8 мм рт.ст. по данным КПНТ, в течение 1-4 лет свобода от нежелательных событий пациентов с СН составляет ?75%. Величина VO2peak =10-15,9 мл/кг/мин, VE/VCO2 slope 36-44,9, PETCO2 в покое ?33 мм рт.ст. и его повышение на 3-8 мм рт.ст. во время КПНТ у пациентов с СН ассоциируется со свободой от нежелательных событий ?50% в период 1-4 года наблюдения. Более неблагоприятный прогноз имеют пациенты с СН и величиной VO2peak <10 мл/кг/мин, VE/VCO2 slope ?45, PETCO2 в покое <33 мм рт.ст. и его повышении менее, чем на 3 мм во время КПНТ, риск развития нежелательных событий у данных пациентов превышает 50% в течение 1-4 лет наблюдения [21].
Биомаркеры крови как детерминанты прогноза
Биомаркеры СН, ремоделирования сердца и миокардиального напряжения
Мозговой натрийуретический пептид (BNP) и N-терминальный фрагмент предшественника BNP (NT-proBNP) являются универсальными маркерами для диагностики и прогнозирования исходов ряда сердечно-сосудистых патологий. Известно, что повышение уровня NT-proBNP напрямую коррелирует с проявлениями правожелудочковой СН и риском летального исхода у пациентов с ЛГ.
Например, для пациентов с ЛАГ существуют три страты, разделяющие данных пациентов на наличие низкого/среднего/высокого риска летальности в течение года с учетом комплексной оценки критериев, также включающих и уровень BNP/NT-proBNP. Уровни BNP <50 нг/л и/или NT-proBNP <300 нг/л соответствуют низкому риску летального исхода в течение года. BNP в пределах 50-300 нг/л и/или NT-proBNP в пределах 300-1400 нг/л, согласно национальным рекомендациям, соответствуют промежуточному риску летального исхода [1]. В обновленных рекомендациях ЕОК и ЕРО изменен диапазон данных маркеров для промежуточного риска: BNP в пределах 50-800 нг/л и/или NT-proBNP в пределах 300-1100 нг/л [3]. Уровни BNP >300 нг/л и/или NT-proBNP >1400 нг/л, согласно национальным рекомендациям [1], и BNP >800 нг/л и/или NT-proBNP >1100 нг/л, согласно европейским рекомендациям по диагностике и лечению ЛГ, соответствуют высокому риску.
При этом уровень данных маркеров разграничивает наличие хронической (BNP ?35 пг/мл и NT-proBNP ?125 пг/мл) (с поправкой при наличии фибрилляции предсердий)) или острой СН (BNP ?100 пг/мл и NT-proBNP ?300 пг/мл) [22]. Однако установленного диапазона уровня BNP и NT-proBNP в рамках стратификации риска прогрессирования заболевания и летальности именно для пациентов с ЛГ группы 2 пока не существует. Интерпретация уровня NT-proBNP при любом сердечно-сосудистом заболевании должна проводиться в совокупности с клиническим статусом, учетом коморбидной патологии.
Помимо семейства натрийуретических пептидов еще одним многообещающим биомаркером у пациентов с ЛГ является стимулирующий фактор роста, экспрессируемый геном 2 (sST2). sST2 представляет собой биомаркер, который экспрессируется в сердечных фибробластах и кардиомиоцитах, подвергнутых механической деформации, и играет роль в ремоделировании и фиброзе при СН. Повышение sST2 и NT-proBNP у пациентов с ЛГ вызвано дисфункцией и повышением давления наполнения ПЖ, более выраженным миокардиальным напряжением с последующей дилатацией ПЖ, что определяет тяжесть и прогноз пациентов с ЛГ. Уровень sST2 >35 нг/мл у пациентов с СН связан с более высоким риском нежелательных явлений, определяемых как госпитализация или смерть в течение одного года, по сравнению с субъектами с уровнем sST2 ниже этого значения [23].
Еще одним перспективным маркером для верификации типа ЛГ и ее тяжести является белок, связывающий жирные кислоты сердечного типа, который экспрессируется в цитозоле кардиомиоцитов, являясь маркером повреждения кардиомиоцитов. У пациентов с ЛГ белок, связывающий жирные кислоты, был изучен в работе Mirna M, et al. Более высокий уровень которого (как индикатора ранней ишемии миокарда среди всех форм ЛГ) был выявлен именно у пациентов с ЛГ, ассоциированной с патологией левых отделов сердца (группа 2) и в группе ЛГ (Me 4900 нг/мл), ассоциированной с патологией легких (группа 3), в то время как у пациентов с ЛАГ его уровень был в 1,6 раз ниже (Me 2980 нг/мл) [24].
Маркеры воспаления
Появляется все больше доказательств того, что воспалительные процессы занимают важную роль в ремоделировании легочного сосудистого русла у пациентов с ЛГ. Однако воспалительный компонент может также отражать ответ, вызванный определенной степенью ишемии и повышенного симпатического возбуждения вследствие ограниченного сердечного выброса у пациентов с ЛГ.
Ниже представлены относительно новые и нешироко известные маркеры для пациентов с ЛГ группы 2.
Фактор дифференцировки роста-15 (GDF-15) является членом суперсемейства трансформирующих факторов роста бета. GDF-15 экспонируется в различных типах клеток в ответ на повреждение ткани, ишемию или стресс. GDF-15 представляет собой маркер воспаления, но также участвует в регуляции клеточного восстановления и клеточного роста [25]. Выявление более высокого уровня GDF-15 для пациентов с ЛГ на фоне патологии левых отделов сердца (группа 2 ЛГ) (Me 2270,97 пг/мл для группы 2 ЛГ vs 1365 пг/мл для пациентов с ЛАГ vs 514 пг/мл для группы контроля) может быть обусловлено выраженным ремоделированием миокарда и гибелью кардиомиоцитов, т.к. в исследование были включены и пациенты с СНнФВ на фоне ишемической кардиомиопатии как причины ЛГ группы 2 [24].
В исследовании Mirna M, et al. для пациентов с ЛГ группы 2 также было характерно более выраженное повышение уровня растворимого рецептора активатора плазминогена урокиназы (suPAR) (6621 пг/мл для группы 2 ЛГ vs 4496 пг/мл для пациентов с ЛАГ vs 2227 пг/мл для группы контроля). Он представляет собой маркер воспаления и повреждения органов, вовлекаемый также и в процесс ремоделирования миокарда [24].
Еще одним перспективным к изучению маркером для пациентов с ЛГ является галектин-3, который представляет собой бета-галактозид-связывающий лектин, экспрессируемый в воспалительных клетках (макрофаги, нейтрофилы, эозинофилы и тучные клетки) и эндотелиальных клетках в ответ на повреждение тканей. Галектин-3 считается медиатором воспалительных процессов и фиброза, и его активность приводит к усилению неблагоприятного ремоделирования сердца. В исследовании Mazurek JA, et al. продемонстрирована взаимосвязь уровня данного маркера со смертностью пациентов с ЛГ различного генеза. В данную работу были включены пациенты (n=37) с ЛАГ и с ЛГ группы 2 на фоне СНсФВ. Me уровня галектина-3 для пациентов c ЛАГ составила 22,33 нг/мл и 28,94 нг/мл для пациентов с ЛГ группы 2 (p=0,07). Результаты данного исследования продемонстрировали взаимосвязь уровня галектина-3 со смертностью в течение 4-х лет пациентов объединенной группы ЛАГ и ЛГ группы 2, которая составила 16% при уровне галектина-3 <20,4 нг/мл, 34,6% от 20,4 до 30,2 и 48% при уровне >30,2 нг/мл [26]. Однако изолированно для пациентов с ЛГ на фоне патологии левых отделов сердца данный маркер не изучался.
Свою роль в тяжести пациентов с ЛГ группы 2 продемонстрировал растворимый рецептор липопротеина низкой плотности с 11 лиганд-связывающими повторами (sLR11) — маркер пролиферации гладкомышечных клеток и эндотелиальной дисфункции. В одноцентровое пилотное исследование было включено 34 пациента с СНсФВ и наличием митральной регургитации. Из них у 10 пациентов с ЛГ уровень sLR11 был значимо выше (14,4±4,3 нг/мл), чем у пациентов без ЛГ (9,9±3,9 нг/мл), p=0,002. Нежелательные явления спустя 5 лет у пациентов с повышенным уровнем данного маркера были представлены 5-ю госпитализациями (25%) и 2-мя летальными исходами (10%), тогда как нежелательных событий не наблюдалось у пациентов с нормальным уровнем sLR11. Авторами предложено, что данный маркер может рассматриваться для дифференцирования пациентов с ЛГ и без нее (чувствительность 78%, специфичность 90%; AUC=0,85, 95% ДИ 0,72-0,98), для определения тяжести митральной регургитации и ЛГ [27]. Основными ограничениями использования данного маркера могут быть наличие сопутствующей ишемической болезни сердца/нестабильной стенокардии, т.к. sLR11 также используется для прогнозирования течения ишемической болезни сердца.
Показатель комплексной оценки функции дыхания
Маркером прогноза для пациентов с ЛГ на фоне патологии левых отделов сердца является и показатель диффузионной способности легких по моноксиду углерода (DLCO), демонстрирующий способность легких транспортировать газ через альвеолярно-капиллярный барьер. Изменения в легочных капиллярах и посткапиллярных венулах могут вызывать функциональные изменения легких, в частности нарушение DLCO. Наличие сопутствующей хронической обструктивной болезни легких, сочетание эмфиземы и фиброза легких может также являться дополнительными причинами снижения DLCO у пациентов и с патологией левых камер сердца, однако нарушения механики дыхания и легочных объемов могут и отсутствовать, как и зависимость нарушений диффузионной способности легких от тяжести ЛГ [28].
В исследовании Hooper MM, et al. было включено 52 пациента с СНсФВ со снижением DLCO <45% от прогнозируемого значения и 56 пациентов с СНсФВ с уровнем DLCO ?45% от прогнозируемого значения. Наличие выраженного снижения DLCO <45% наиболее часто характеризовало пациентов мужского пола ОШ 2,71 (95% ДИ 1,05-6,88; p=0,039) с курением в анамнезе ОШ 5,01 (95% ДИ 1,91-13,1; p<0,001). Значение DLCO <45% является независимым предиктором смертности для пациентов с СНсФВ, ОШ 6,6 (95% ДИ 2,6-16,9; p<0,001). Уровень 3-х летней выживаемости пациентов с СНсФВ и DLCO <45% в 3 раза уступает выживаемости пациентов с DLCO ?45% (36,5% vs 87,8%, соответственно; p<0,001) [28]. Поэтому выполнение исследования функции внешнего дыхания, диффузионной способности легких при ЛГ группы 2 помогает диагностировать патологию легких и оценить степень ее тяжести, что необходимо для понимания ее вклада в тяжесть и характер имеющейся ЛГ.
Перспективы лечения
В соответствии с действующими европейскими рекомендациями по диагностике и лечению ЛГ 2022г, а также рекомендациями Минздрава Росси 2020г, лечение пациентов с ЛГ, ассоциированной с патологией левых отделов сердца, направлено на устранение структурно-функциональных нарушений левых камер сердца как основной причины развития ЛГ группы 2 (клапанная патология, диастолическая/систолическая дисфункция ЛЖ, обструкция выходного отдела ЛЖ и т.д.), а также прием медикаментозной терапии, одобренной для пациентов с СНнФВ и СНсФВ [1][3][22][29].
За последнее десятилетие продолжаются поиски новых путей лечения пациентов с СН и ЛГ с испытанием как новых медикаментозных препаратов, так и интервенционных вмешательств (табл. 1).
Таблица 1
Результаты исследований, посвященных изучению эффекта и безопасности интервенционных и медикаментозных методов лечения (ЛАГ-специфические препараты), для пациентов с ЛГ, ассоциированной с патологией левых отделов сердца
|
Исследование |
Популяция исследования |
Исследуемое устройство/препарат |
Конечные точки |
Результат |
|
Интервенционные методы лечения |
||||
|
СHAMPION [30] |
550 пациентов с СН: из них 119 с ФВ ЛЖ ?40% (среднее значение 50,6%) (из них 66 пациентов с ФВ ЛЖ ?50%); 430 пациентов с ФВ ЛЖ <40% (среднее значение 23,3%). У пациентов с ФВ ЛЖ ?40% в группе лечения (n=62) Me срДЛА 26 мм рт.ст., ДЗЛА 14 мм рт.ст.; в группе контроля срДЛА 24 мм рт.ст. ДЗЛА 13,5 мм рт.ст. (n=57) по данным КПОС. Для пациентов с ФВ ЛЖ <40% Me срДЛА составила 29 мм рт.ст., ДЗЛА 19 мм рт.ст. по данным КПОС. |
Имплантация во время КПОС системы с микроэлектромеханическим датчиком контроля ДЛА выполнена всем 550 пациентам: в «группу лечения» с ежедневным контролем кривых давления включены пациенты: n=62 с СН с ФВ ЛЖ ?40% (из них n=35 c ФВ ЛЖ ?50%) и 208 пациентов с ФВ ЛЖ<40%. В «группу контроля» с отсутствием контроля кривых давления включены пациенты: n=57 ФВ ЛЖ ?40% (из них n=31 c ФВ ЛЖ ?50%) и 222 пациента с ФВ ЛЖ <40%. |
Первичная конечная точка — госпитализация по поводу СН. |
Через 6 мес. пациенты с СН с ФВ ЛЖ ?40% из «группы лечения» (n=62) на 46% реже госпитализировались по поводу СН по сравнению с пациентами группы контроля (n=57), ОШ 0,54 (95% ДИ 0,38-0,70; p<0,0001) (11 госпитализаций в группе лечения/19 госпитализаций в группе контроля). Через 6 мес. пациенты с ФВ ЛЖ <40% в «группе лечения» (n=208) на 24% реже госпитализировались по поводу СН (n=222), ОШ 0,76 (95% ДИ 0,61-0,91; p=0,008) (73 госпитализации в группе лечения/101 госпитализация в группе контроля). Через 17,6 мес. у пациентов с СН с ФВ ЛЖ ?40% частота госпитализаций в группе лечения была на 50% реже по сравнению с группой контроля, ОШ 0,50 (95% ДИ 0,35-0,70; p<0,0001) (29 госпитализаций в группе лечения/59 в группе контроля). Через 17,6 мес. у пациентов с СН с ФВ ЛЖ <40% частота госпитализаций в группе лечения была на 26% реже по сравнению с группой контроля, ОШ 0,74 (95% ДИ 0,63-0,89; p=0,001) (153 госпитализации в группе лечения/220 в группе контроля). |
|
REDUCE-LAP-HF[31] |
Пациенты (n=64) с СН с ФВ ЛЖ >40% II-IVФК (NYHA) со средним возрастом 69 летcо средним ДЗЛА 17 мм рт.ст. и срДЛА 25 мм рт.ст. по данным КПОС и отсутствием явлений тяжелой правожелудочковой СН (центральное венозное давление <14 мм рт.ст. и TAPSE >1,4 см). |
Через венозный доступ имплантация устройства, создающего межпредсердный шунт (n=64). |
Первичные конечные точки: перипроцедурная безопасность вмешательства и безопасность в виде оценки цереброваскулярных и сердечно-сосудистых событий через 6 и 12 мес. после имплантации. Вторичные конечные точки: госпитализации по поводу СН в течение 1 года, а также изменения ЭхоКГ и гемодинамических параметров, функционального статуса, качества жизни. |
В течение 6 мес. наблюдения ни у одного пациента не было периоперационных или серьезных неблагоприятных сердечных или цереброваскулярных событий, включая смерть, инсульт, инфаркт миокарда, легочную или системную эмболию, или необходимость в кардиохирургическом вмешательстве по поводу осложнений, связанных с устройством. 17 госпитализаций по причине СН в течение года. 1-летняя выживаемость =95% (в течение одного года 3 смерти: пневмония и почечная недостаточность; инсульт; причина неизвестна). Динамика функционального статуса: ДТ6МХ спустя год увеличилась с 331±90 м до 363±93 м; (p=0,001). Значимое улучшение качества жизни. Улучшение TAPSEс 2,0±0,4 см до 2,2±0,4 см спустя год (p<0,05). Увеличение СВ ПЖ с 5,2 до 6,7 л/мин спустя год (p<0,05) и снижение градиента ДЗЛА/срДПП с 10 до 7 мм рт.ст. |
|
PADN-5 [35] |
Пациенты со смешанной пост-/прекапиллярной ЛГ (n=98) без приема ЛАГ-специфической терапии, 61,2% пациенты с СНнФВ и 38,8% пациенты с СНсФВ со срДЛА ?25 мм рт.ст., ДЗЛА >15 мм рт.ст. и ЛСС >3,0 Ед Вуда. |
Группа денервации ЛА (n=48) и группа приема силденафила + имитация денервации ЛА (n=50). |
Первичной конечной точкой было увеличение ДТ6МХ при 6-мес. наблюдении. Вторичной конечной точкой было изменение ЛСС. Основной конечной точкой безопасности было возникновение тромбоэмболии легочной артерии. |
Через 6 мес. среднее увеличение ДТ6МХ составило 83 м в группе денервации и 15 м в группе силденафила 66 м (95% ДИ: 38,2-98,8 м; р<0,001). На фоне денервации уровень ЛСС был значимо ниже 4,2±1,5 Ед Вуда, чем в группе силденафила (6,1±2,9 Ед Вуда; р=0,001). В группе денервации реже наблюдалось клиническое ухудшение (16,7%) по сравнению с группой силденафила (40%), р=0,014. В конце исследования было зарегистрировано 7 смертей от всех причин и 2 случая тромбоэмболии легочной артерии. |
|
Медикаментозные методы лечения |
||||
|
FIRST [36] |
Пациенты с СНнФВ (n=471) с Me возраста 65 лет c ФВ ЛЖ <25% и III-IV ФК (NYHA), уровень ДЗЛА ?15 мм рт.ст., сердечный индекс ?2,2 л/мин, Me системного сосудистого сопротивления 20,76 Ед Вуда, Me срДЛА в группе эпопростенола 38 мм рт.ст./в группе плацебо 40 мм рт.ст. по данным КПОС. |
Эпопростенол (n=237) или стандартная медикаментозная терапия СН (n=234). |
Первичные: смерть; серьезное событие как потребность в искусственной вентиляции легких, инотропных препаратах или механической поддержки кровообращения. Вторичные: ДТ6МХ, качество жизни, динамика клинического статуса спустя 3 мес. |
Выявлено значимое увеличение сердечного индекса, снижение ДЗЛА и ЛСС в группе терапии эпопростенолом в дозе Me 4,0 нг/кг/мин. Досрочное прекращение исследования из-за повышенной смертности от острой СН в группе лечения эпопростенолом. |
|
Lewis GD, et al.[37] |
СНнФВ (n=34) с Me возраста 54 года для группы силденафила и 62 года для группы плацебо. ФВ ЛЖ <40% и ФК II-IV (NYHA), уровень срДЛА >25 мм рт.ст. со средней величиной ЛСС >4 Ед Вуда по данным КПОС. |
Силденафил 25-75 мг 3 раза/сут. (n=17) или плацебо (n=17) в течение 12 нед. |
Первичная: VO2peak Вторичная: ДТ6МХ, ЛСС. |
В группе лечения силденафилом увеличился уровеньVO2peak, ДТ6МХ, снизилось ЛСС. |
|
Guazzi M, et al.[38] |
СНнФВ (n=32) со средним возрастом для группы силденафила 66 лет/для группы плацебо 68 лет, с ФВ ЛЖ <45%, срДЛА 25-35 мм рт.ст. по данным КПОС, Me ЛСС 4,5 Ед Вуда. |
Силденафил 50 мг 3 раза/сут.(n=16) или плацебо (n=16) в течение 1-го года. |
Параметры кардиопульмонального теста через 6 и 12 мес. Гемодинамика малого круга кровообращения через 6 и 12 мес. |
В группе лечения значимое увеличение VO2peak и уменьшением величины вентиляционного эквивалента по углекислому газу. Значимое снижение ДЛА и ЛСС, повышение СВ в группе лечения. |
|
SilHF [39] |
СНнФВ (n=69) с Me возраста 68 лет, Me ФВ ЛЖ 29%, РСДЛА ?40 мм рт.ст. по данным ЭхоКГ (Me 45 мм рт.ст.). Без оценки параметров катетеризации правых отделов сердца. |
Силденафил до 40 мг 3 раза/сут. (n=45) или плацебо (n=24) в течение 24 нед. |
Первичные конечные точки: улучшение клинического статуса пациента и динамика ДТ6МХ через 24 нед. |
На фоне силденафила не выявлено значимой динамики клинической картины, качества жизни и ДТ6МХ. |
|
Guazzi M, et al.[40] |
СНсФВ со смешанной пост-/прекапиллярной ЛГ (n=44) со средним возрастом 72,5 года и ФВ ЛЖ >50% ФК II-IV(NYHA) c СДЛА >40 мм рт.ст., среднее ДЗЛА 22 мм рт.ст., среднее ЛСС 3,88 Ед Вуда для группы силденафила и 3,27 Ед Вуда для группы плацебо по данным трансторакальной ЭхоКГ. |
Силденафил 50 мг 3 раза/сут. (n=22) или плацебо (n=22) в течение 52 нед. |
Первичные: гемодинамика малого круга кровообращения, функция ПЖ (TAPSE). Вторичная: качество жизни. |
Значимое снижение срДПП, срДЛА, ДЗЛА и ЛСС; улучшение функции ПЖ, СВ и качества жизни. |
|
Hoendermis ES, et al. [41] |
СНсФВ с изолированной посткапиллярной ЛГ (n=52), возраст 74±10 лет. ФВ ЛЖ ?45%, срДЛА >25 мм рт.ст., ДЗЛА >15 мм рт.ст., Me ЛСС 4 Ед Вуда (ЛСС >3Ед Вуда у 45% включенных пациентов) по данным КПОС. |
Силденафил 20 мг 3 раза/сут. (n=26) или плацебо (n=26) в течение 12 нед. |
Динамика срДЛА, ДЗЛА, СВ, VO2peak. |
Значимой динамики не выявлено. |
|
RELAX trial [42] |
СНсФВ (n=216) с Me возраста 69 лет, MeФВ ЛЖ 60% и уровнем РCДЛА 41 мм рт.ст. по данным ЭхоКГ (без оценки параметров катетеризации правых отделов сердца). |
Силденафил (n=113) 20 мг 3 раза/сут. в течение 12 нед.с увеличением дозы до 60 мг 3 раза/сут. в течение 12 нед. или плацебо (n=103). |
Первичная конечная точка: ИзменениеVO2peak через 24 нед.лечения. Вторичные конечные точки: ДТ6МХ и комплексная оценка клинического статуса (время до смерти/до сердечно-сосудистой или кардиоренальной госпитализации/изменения качества жизни участников без сердечно-сосудистой или кардиоренальной госпитализации спустя 24 нед). |
Значимой динамики клинического статуса и качества жизни не выявлено. Ухудшение почечной функции в группе силденафила. |
|
Kramer T, et al. [43] |
Хроническая СНсФВ и смешанная пост-/прекапиллярная ЛГ (n=40). Средний возраст пациентов 73 года. MeсрДЛА 46,2 мм рт.ст., Me ДЗЛА 21,2 мм рт.ст., Me ДГД 5,5±7,2 мм рт.ст., ЛСС Me6,2±3,0 Ед Вуда. |
Силденафил 20 мг 3 раза/сут. >1 года |
Динамика ДТ6МХ, уровня NT-proBNP, функция ПЖ по данным двумерной ЭхоКГ, частота госпитализаций по поводу СН. |
Повышение ДТ6МХ, снижение уровня NT-proBNP, улучшение функции ПЖ в виде увеличения TAPSE; снижение частоты госпитализаций по поводу СН. |
|
Belyavskiy E, et al. [44] |
СНсФВ, превалируют пациенты со смешанной пост-/прекапиллярной ЛГ (n=50) с РСДЛА 40 мм рт.ст. по данным ЭхоКГ (без оценки параметров катетеризации правых отделов сердца). |
Силденафил (n=30) 25 мг 3 раза/сут. в течение 3 мес. с дальнейшим увеличением дозы до 50 мг 3 раза/сут. в течение 3 мес. или плацебо (n=20). |
Динамика функционального статуса и функции ПЖ. |
Увеличение ДТ6МХ, снижение СДЛА, давления наполнения ПЖ и ЛЖ, гипертрофии ЛЖ; улучшение функции ПЖ, диастолической функции ЛЖ, и ФК СН (NYHA). |
|
LEPHT [45] |
СНнФВ (n=201) Me возраста 58,1 год. ФВ ЛЖ <40% c ФК II-IV (NYHA) и срДЛА ?25 мм рт.ст. по данным КПОС. Среднее значение ЛСС для группы плацебо, групп приема риоцигуата по 0,5 мг, 1 мг и 2 мг 3 раза/сут. составило 3,81 Ед Вуда, 3,43 Ед Вуда, 2,78 и 3,64 Ед Вуда, соответственно. |
Риоцигуат в 4-х параллельных группах в дозе 0,5, 1 или 2 мг 3 раза/сут. (n=132) или плацебо (n=69) в течение 16 нед. |
Первичные конечные точки: динамика срДЛА. Вторичные конечные точки: параметры гемодинамики. |
Первичная конечная точка не была достигнута: в группе приема риоцигуата 2,0 мг значимых различий в динамике уровня срДЛА по сравнению с группой плацебо не выявлено. Однако в группе лечения риоцигуатом 2 мг наблюдался значимый прирост сердечного индекса и снижение ЛСС по сравнению с плацебо. |
|
BADDHY [48] |
СНсФВ (n=20); средний возраст 68,1 для группы бозентана/67,4 года для группы плацебо. ФВ ЛЖ ?50%, срДЛА >25 мм рт.ст., ДЗЛА >15 мм рт.ст. по данным КПОС; дисфункция ПЖ по данным ЭхоКГ. Значение ЛСС не указано. |
Бозентан 125 мг в сут. в течение первого месяца с увеличением дозы после до 250 мг в сут. (n=9) или плацебо (n=11) в течение 12 нед. |
Динамика ДТ6МХ, СДЛА и давление в правом предсердии по данным ЭхоКГ. |
Острая СН у 3 пациентов в группе бозентана, в группе плацебо у 1 пациента. В группе плацебо незначительная тенденция к увеличению ДТ6МХ. |
|
ENABLE [49] |
СНнФВ (n=1613) средний возраст для группы бозентана 67,5/средний возраст в группе плацебо 66,9 лет; ФВ ЛЖ <35%, ФК III-IV (NYHA) с Me ДТ6МХ <375 м. Оценка катетеризации правых отделов сердца не проводилась. Два пациента исключены из анализа в связи с нежеланием дальнейшего участия в исследовании (итого 1611 пациентов). |
Бозентан (n=804) 125 мг в сут. в течение первого месяца с увеличением дозы после до 250 мг в сут. или плацебо (n=807) в течение Me 1,5 года. |
Первичная конечная точка: динамика клинического статуса через 9 мес.; смерть от любой причины или госпитализация по поводу СН. |
Бозентан не влиял на клинический статус пациентов спустя 9 мес. В группе бозентана наблюдалась задержка жидкости в течение первых 2-4 нед. лечения. 321 пациент в группе плацебо и 312 пациентов в группе бозентана умерли или были госпитализированы по поводу СН. |
|
MELODY-1 [50] |
СНсФВ и СНнФВ (n=63) ФВ ЛЖ ?35% c ФКII-IV (NYHA) со смешанной пост-/прекапиллярной ЛГ (срДЛА ?25 мм рт.ст.,ДЗЛА >15 мм рт.ст., ДГД ?7 мм рт.ст., ЛСС>3 Ед Вуда по данным КПОС). |
Мацитентан 10 мг (n=31) или плацебо (n=32) в течение 12 нед. |
Первичные точки: безопасность и переносимость (задержка жидкости, ухудшение класса NYHA). Изменение гемодинамики, NT-proBNP, ДТ6МХ. |
У 7 пациентов группы мацитентана наблюдалась задержка жидкости/у 4 в группе плацебо. Существенных различий между группами ни в одной из конечных точек исследования выявлено не было. |
Сокращения: ДГД — диастолический градиент давления, ДИ — доверительный интервал, ДЗЛА — давление заклинивания легочной артерии, ДЛА — давление в легочной артерии, ДТ6МХ — дистанция в тесте 6-минутной ходьбы, Ед Вуда — единицы Вуда, КПОС — катетеризация правых отделов сердца, ЛА — легочная артерия, ЛАГ — легочная артериальная гипертензия, ЛГ — легочная гипертензия, ЛЖ — левый желудочек, ЛСС — легочное сосудистое сопротивление, ОШ — отношение шансов, ПЖ — правый желудочек, РСДЛА — расчетное систолическое давление в легочной артерии, СВ — сердечный выброс, СН — сердечная недостаточность, СНнФВ — сердечная недостаточность с низкой фракцией выброса левого желудочка, СНсФВ — сердечная недостаточность с сохранной фракцией выброса левого желудочка, срДЛА — среднее давление в легочной артерии, срДПП — среднее давление в правом предсердии, ФВ — фракция выброса, ФК — функциональный класс, ЭхоКГ — эхокардиография, Me — медиана, NT-proBNP — N-терминальный фрагмент промозгового натрийуретического пептида, NYHA — Нью-Йоркская ассоциация сердца, TAPSE — систолическая экскурсия кольца трикуспидального клапана, VO2peak — пиковое потребление кислорода.
Интервенционное лечение
В исследовании СHAMPION (The Long-Term Safety and Clinical Efficacy of a Wireless Pulmonary Artery Pressure Monitoring System — CardioMEMS Heart Sensor) при имплантации во время КПОС системы с микроэлектромеханическим датчиком для динамического контроля давления в легочной артерии у пациентов с СН и ФВ ЛЖ ?40% (n=550) в течение периода наблюдения 17,6 мес. была достигнута стабильность клинического статуса со снижением частоты госпитализаций на 50% по поводу СН. Именно ежедневная оценка гемодинамики малого круга кровообращения с динамическим контролем давления в легочной артерии и подбор необходимых доз диуретической терапии, применение в ряде случаев вазодилататоров позволило стабилизировать волюмический статус пациентов [30].
В многоцентровом нерандомизированном исследовании REDUCE-LAP-HF имплантация устройства, создающего межпредсердный шунт, у пациентов с СН и ФВ ЛЖ >40% (n=64), имеющих срДЛА 25 мм рт.ст., явилась безопасной и повлияла на уменьшение индексированного конечно-диастолического объема ЛЖ, ДЗЛА, улучшение систолической функции ПЖ, как следствие функционального статуса и качества жизни пациентов [31].
Денервация легочный артерий при ЛГ до сих пор остается не до конца изученным направлением, применяющимся в единичных Федеральных центрах страны в основном в рамках научных направлений для пациентов с хронической тромбоэмболической ЛГ в дополнении к хирургическому лечению [32], а также у кардиохирургических пациентов с приобретенными пороками сердца и ЛГ [33]. Российскими авторами был проведен анализ 8 исследований, посвященных денервации легочной артерии при ЛГ различного генеза, в т.ч. ЛГ группы 2 в мировой практике. Продемонстрировано, что метод денервации ЛА способствовал снижению срДЛА, динамика которого составила -8,59 (95% ДИ -10,96 — -6,23) мм рт.ст., и увеличению дистанции ДТ6МХ, прирост которой составил 60,0 (95% ДИ 35,74-84,27) метров у обобщенной группы пациентов с ЛГ [34].
Эффект денервации ЛА был изучен на отдельной группе пациентов с СН II-IV ФК (NYHA) и смешанной пост-/прекапиллярной ЛГ (n=98) в исследовании PADN-5. В данном исследовании проводилось сравнение эффективности двух подходов: в первой группе проводилась денервация ЛА, во второй — терапия силденафилом 60 мг в сут. и имитация проведения денервации ЛА у пациентов со смешанной пост-/прекапиллярной ЛГ на фоне стандартной медикаментозной терапии СН. Спустя 6 мес. в группе денервации ЛА наблюдалась значимая и более выраженная динамика ДТ6МХ, как и выраженное снижение ЛСС, в данной группе клиническое ухудшение на протяжении 6 мес. наблюдалось в 2,4 раза реже по сравнению с пациентами в группе силденафила и имитации денервации [35].
Необходимо проведение крупных многоцентровых исследований, посвященных изучению как краткосрочного, так и пролонгированного эффекта денервации ЛА у пациентов различной этиологии и тяжести ЛГ.
Медикаментозное лечение
Возможность применения специфической терапии, доказавшей свое лечение у пациентов с ЛАГ, таких как антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы-5, стимуляторы растворимой гуанилатциклазы или простациклины, является спорным и не до конца решенным вопросом. Однако результаты уже проведенных исследований говорят о риске со стороны безопасности, как и об отсутствии ожидаемой эффективности от ЛАГ-специфической терапии для пациентов с ЛГ при патологии левых отделов сердца. До сих пор нет многоцентрового исследования, которое доказывало бы безопасность и пользу лечения ЛАГ-специфическими препаратами пациентов данной группы.
Еще в 1997г первой попыткой применения легочных вазодилататоров для пациентов с ЛГ на фоне патологии левых отделов сердца явилось рандомизированное исследование FIRST (The Flolan International Randomized Survival Trial). В рамках данного исследования оценивался эффект инфузионной терапии эпопростенолом у пациентов с застойной СНнФВ III-IV ФК (NYHA). Продемонстрировано влияние эпопростенола на улучшение сердечного индекса и снижение ДЗЛА, однако исследование было досрочно прекращено ввиду увеличения летальных исходов при использовании эпопростенола у пациентов с ЛГ группы 2 [36].
Эффект терапии силденафилом у пациентов как с СНсФВ, так и СНнФВ весьма спорный ввиду полученных разносторонних результатов в проведенных исследованиях [37-44] (табл. 1).
В работе Lewis GD, et al. у пациентов с ЛГ и СНнФВ с ФВ ЛЖ <40% спустя 12 нед. приема силденафила в дозе от 25 до 75 мг 3 раза/сут. было продемонстрировано значимое улучшение функционального статуса и снижение ЛСС у 17 пациентов с СН [37].
Пролонгированный эффект силденафила в дозе 50 мг 3 раза изучался в работе Guazzi M, et al. у 16 пациентов с ЛГ и СН с ФВ ЛЖ <45%. Было продемонстрировано значимое улучшение пикового потребления кислорода по данным КПНТ с 9,6 до 13,2 мл/мин/кг и уменьшение величины вентиляционного эквивалента по углекислому газу с 41,1 до 31,5 в дополнении к улучшению гемодинамических характеристик, представленных в динамике срДЛА с 34,8 до 24 мм рт.ст. и уровня ЛСС с 360 до 255 дин/с/см-5 спустя год лечения силденафилом по сравнению с группой плацебо (p<0,01) [38].
Впервые проведенное многоцентровое рандомизированное плацебо-контролируемое исследование SilHF продемонстрировало отсутствие эффекта силденафила в дозе до 40 мг 3 раза/сут. на клинический и функциональный статус, качество жизни пациентов с СНнФВ (n=45) по сравнению с плацебо (n=24) спустя 24 нед. лечения [39].
В свою очередь, у 22 пациентов с СНсФВ и смешанной пост-/прекапиллярной ЛГ терапия дженерическим силденафилом в дозе 50 мг 3 раза/сут. в течение 6 мес. продемонстрировала значимый эффект на функциональный статус, улучшение систолической функции ПЖ, снижение ДЗЛА и давления в правом предсердии [40].
В работе Hoendermis ES, et al. было отмечено отсутствие эффекта терапии силденафилом на динамику функционального статуса и гемодинамических параметров малого круга у пациентов с СНсФВ. На фоне лечения силденафилом в течение 12 нед. в дозе 20 мг 3 раза/сут. (n=26) по сравнению с плацебо (n=26) у пациентов с СНсФВ (ФВ ЛЖ ?45%) не выявлено значимой динамики уровня срДЛА, величины сердечного выброса, уровня ДЗЛА и VO2peak [41]. В рандомизированном исследовании RELAX на большей когорте пациентов с СНсФВ с Me ФВ ЛЖ 60% (при недоказанном инвазивным методом наличии ЛГ) также было показано отсутствие эффекта терапии силденафилом в дозе до 60 мг 3 раза (n=113) по сравнению с плацебо (n=103) на динамику клинико-функционального статуса и качества жизни пациентов спустя 12 нед. лечения [42]. Однако в данных исследованиях не были выделены отдельно пациенты со смешанной пост-/прекапиллярной ЛГ.
Позже проведенные исследования, преимущественно включающие пациентов со смешанной пост-/прекапиллярной ЛГ и СНсФВ, показали достоверное улучшение функционального статуса и функции ПЖ как на фоне краткосрочного приема (3 мес.), так и через год после терапии силденафилом в разных дозовых режимах [43][44] (табл. 1).
В рандомизированном исследовании LEPHT изучался эффект терапии стимулятором растворимой гуанилатциклазы — риоцигуатом у 201 пациента с ЛГ и систолической дисфункцией ЛЖ. В течение 16 нед. терапия риоцигуатом в разных дозовых режимах не оказала эффект на динамику гемодинамических параметров малого круга кровообращения [45].
Представитель группы стимуляторов растворимой гуанилатциклазы — верицигуат также изучался у пациентов с СНнФВ, так и СНсФВ, однако критерий наличия ЛГ не являлся ключевым при включении пациентов с СН в исследования. Так, в исследовании SOCRATES-REDUCED [46] у включенных в исследование пациентов с СН с ФВ ЛЖ <45% (n=351) оценивалась безопасность и эффект терапии верицигуатом в разных дозовых режимах (от 1,25 до 10 мг в сут.) в течение 12 нед. На фоне терапии верицигуатом в максимальной дозе 10 мг у 4,4% пациентов наблюдались синкопальные состояния, у 15,4% имела место значимая гипотония. Значимой динамики уровня NT-proBNP на фоне 12 нед. терапии верицигуатом выявлено не было, однако авторы это связывают с наличием включенных пациентов с фибрилляцией предсердий, дополнительно вносящей свой вклад в отсутствие положительной динамики биомаркера миокардиального напряжения. При этом выявлено, что прием более высоких доз риоцигуата отражался на более выраженном снижении уровня NT-proBNP.
В 2021г в европейских рекомендациях по лечению СН для снижения риска сердечно-сосудистой смерти и госпитализаций по причине СН терапия верицигуатом может быть рассмотрена для лечения пациентов с II-IV ФК по NYHA с ухудшением течения СНнФВ (II B) [22]. В исследовании SOCRATES-PRESERVED [47] 12-недельная терапия верицигуатом в дозе 10 мг у пациентов с СНсФВ имела хороший профиль переносимости, значимо не влияя на динамику артериального давления, однако не оказывала эффекта ни на динамику уровня NT-proBNP, ни на уменьшение объема ЛП. При этом у пациентов с СНсФВ терапия верицигуатом значимо улучшила качество жизни пациентов, что воодушевило исследователей к дальнейшему изучению более длительной терапии верицигуатом у данной когорты пациентов с СН [47].
Переходя к другому классу препаратов специфической терапии, доказавшей свой эффект на пациентах с ЛАГ, важно осветить результаты исследований, посвященные изучению безопасности и эффективности терапии препаратами группы антагонистов эндотелиновых рецепторов у пациентов с ЛГ на фоне патологии левых отделов сердца.
Эффект терапии бозентаном в дозе 250 мг в сут. на протяжении 12 нед. изучался в пилотном одноцентровом исследовании BADDHY у 9 пациентов с СНсФВ. Терапия бозентаном не повлияла на улучшение функционального статуса пациентов и динамику уровня РСДЛА по данным ЭхоКГ, вызывая явления острой СН у 3-х пациентов в группе лечения [48].
Длительный прием терапии бозентана в дозе 250 мг в сут. в исследовании ENABLE спустя 9 мес. лечения не оказал положительного влияния на исход пациентов с СНнФВ (ФВ ЛЖ <35%) III-IV ФК (NYHA), при этом вызывая выраженную декомпенсацию СН несмотря на интенсификацию диуретической терапии. Данное исследование было прекращено досрочно [49].
Проспективное многоцентровое исследование MELODY-1 (Macitentan in Subjects With Combined Pre- and Postcapillary Pulmonary Hypertension (CpcPH) Due to Left Ventricular Dysfunction) было единственным исследованием, имеющим критерии включения пациентов именно со смешанной пост-/прекапиллярной ЛГ при наличии заболевания левых отделов сердца [50]. За первый месяц наблюдения в данном исследовании терапия мацитентаном в дозе 10 мг привела к повышению риска задержки жидкости на 10,1% у пациентов со смешанной пост-/прекапиллярной ЛГ при сравнении с плацебо. Задержку жидкости, вероятнее всего, можно объяснить недостаточным медикаментозным нивелированием и компенсацией посткапиллярного компонента, и его превалированием над прекапиллярным компонентом ЛГ на момент инициации терапии мацитентаном. Спустя 3 мес. приема мацитентана отсутствовали достоверные изменения значения ЛСС, среднего давления в правом предсердии и ДЗЛА по сравнению с плацебо.
До сих пор научный мир находится в ожидании результатов многоцентровых исследований SERENADE (Macitentan is an Effective and Safe Treatment for Patients With Heart Failure With Preserved Ejection Fraction and Pulmonary Vascular Disease) и SOPRANO (Macitentan in Patients With Pulmonary Hypertension After Left Ventricular Assist Device Implantation), посвященных изучению эффективности и переносимости терапии мацитентаном 10 мг у пациентов со смешанной пост-/прекапиллярной ЛГ на фоне ХСН с сохранной ФВ ЛЖ1 и у пациентов со смешанной пост-/прекапиллярной ЛГ, после имплантации вспомогательного устройства для поддержки ЛЖ (Left Ventricular Assist Device)2.
Учитывая отсутствие явных доказательств положительного эффекта ЛАГ-специфической терапии для пациентов с ЛГ группы 2 согласно данным проведенных пилотных работ и единичных многоцентровых исследований, при этом продемонстрированного высокого риска развития отека легких, в современных национальных клинических рекомендациях назначение патогенетической терапии ЛАГ пациентам с ЛГ вследствие патологии левых отделов сердца противопоказано [1]. Однако рекомендации ЕОК и ЕРО по диагностике и лечению ЛГ рекомендуют предпринимать индивидуальный подход к выбору терапии пациентов с патологией левых камер сердца, имеющих смешанную пост-/прекапиллярную ЛГ с выраженным прекапиллярным компонентом в виде повышения ЛСС ?5 Ед Вуда. В этом случае препаратом выбора для таких пациентов является ингибитор фосфодиэстеразы типа 5 — тадалафил или силденафил (зарегистрированной на территории Российской Федерации). Данным пациентам принятие решения о назначении силденафила должно осуществляться только на фоне подобранной максимальной многокомпонентной медикаментозной терапии СН в стенах экспертного центра по проблеме ЛГ, где будет осуществлено комплексное обследование с КПОС [3].
Таким образом, возможность применения в клинической практике легочных вазодилататоров из группы ЛАГ-специфической терапии для пациентов с патологией левых отделов остается спорным. Однако в ряде случаев проводятся попытки назначения off-label ЛАГ-специфической терапии данной когорте пациентов. Ключевыми факторами, обосновывающими возможность попыток назначения легочных вазодилататоров являются: доказанный инвазивным методом диагностики комбинированный пост-/прекапиллярный компонент ЛГ при устраненном/компенсированном посткапиллярном компоненте ЛГ у пациента, получающего максимальную медикаментозную терапию по поводу заболевания левых отделов сердца, находящегося в оптимальном волюмическом статусе; персонализированный подход к назначению и выбору лечения, принятие решения о назначении специфического препарата только мультидисциплинарной командой высококвалифицированных специалистов.
Заключение
Сложный фенотип пациентов с ЛГ на фоне патологии левых отделов сердца подразумевает необходимость применения комплексного подхода к оценке прогноза данной когорты пациентов с учетом их коморбидного статуса, использованием как инвазивных, так и неинвазивных параметров, отражающих гемодинамический вариант ЛГ и характер структурно-функционального состояния сердца. Это позволит своевременно провести коррекцию имеющейся патологии левых отделов сердца и/или достичь медикаментозной компенсации. Попытки использования препаратов ЛАГ-специфической терапии для пациентов ЛГ группы 2 в большинстве исследований не увенчались успехом, однако продолжаются исследования, посвященные более детальному изучению безопасности и эффективности современных препаратов у такого гемодинамического варианта группы 2, как смешанная пост-/прекапиллярная ЛГ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. ClinicalTrials.gov. A multi-center, double-blind, placebo-controlled phase 2b study to evaluate the efficacy and safety of macitentan in subjects with heart failure with preserved ejection fraction and pulmonary vascular disease (SERENADE). https://clinicaltrials.gov/ct2/show/NCT03153111. Date last updated: July, 2018.
2. ClinicalTrials.gov. A prospective, multicenter, double blind, randomized, placebo-controlled, parallel group study to assess the efficacy and safety of macitentan in patients with pulmonary hypertension after left ventricular assist device implantation (SOPRANO). https://clinicaltrials.gov/ct2/show/NCT02554903. Date last verified: February, 2018.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Ляпина И.Н., Теплова Ю.Е., Мартынюк Т.В. Детерминанты прогноза и тактика ведения пациентов с легочной гипертензией, ассоциированной с патологией левых камер сердца: систематический обзор. Российский кардиологический журнал. 2023;28(1S):5115. https://doi.org/10.15829/1560-4071-2023-5115
Скопировать