Тромбоз правых отделов сердца у пациентов с тромбоэмболией легочной артерии: серия клинических случаев
Аннотация
В настоящее время разработаны рекомендации по лечению больных с тромбоэмболией легочной артерии, однако оптимальная тактика ведения таких пациентов при наличии тромбоза правых камер сердца остается предметом дискуссий. Своевременное выявление тромбоза правых камер сердца может повлиять на выбор тактики лечения, что поможет снизить риск неблагоприятных исходов. В статье приведены три клинических случая с различными вариантами клинического течения и стратегиями ведения, учитывающими факторы риска и прогноз.
Тромбоз правых отделов (ТПО) сердца может быть следствием венозной эмболии, распространения тромбоза глубоких вен, или развиваться в связи со снижением скорости кровотока на фоне фибрилляции предсердий, тяжелой дисфункции правого желудочка (ПЖ) или легочной гипертензии (ЛГ), а также вследствие развития гиперкоагуляционного синдрома при первичных опухолях сердца или его метастатическом поражении [1][2]. Повышенный риск тромбообразования имеют также пациенты с механическими клапанами, кардиостимуляторами, центральными венозными катетерами и эндокардитом [3][4]. Частота встречаемости ТПО сердца среди пациентов с тромбоэмболией легочной артерии (ТЭЛА) составляет ~4% всех случаев, возможно выше у пациентов с массивной ТЭЛА [5].
По локализации различают тромбоз в правом предсердии (ПП), ПЖ, пролабирующие тромбы легочной артерии (ЛА) или проксимальной части нижней полой вены (НПВ) [2].
Диагностика ТПО сердца осуществляется с помощью трансторакальной или чреспищеводной эхокардиографии (ЭхоКГ) и компьютерной томографической ангиопульмонографии (КТ‐АПГ), при этом основным диагностическим критерием является обнаружение тромботических масс в правых камерах сердца. Особое значение имеет выявление тромбов с признаками флотации, что ассоциировано с высокой ранней смертностью, особенно у пациентов с дисфункцией ПЖ [5][6]. Хотя, по мнению некоторых зарубежных авторов, худший прогноз у пациентов с сочетанием ТЭЛА и ТПО прежде всего связан с гемодинамическими нарушениями, а не с характеристиками тромба, такими как размер, подвижность и форма [6-9].
Ведение пациентов с ТПО и ТЭЛА является сложной задачей из-за повышенного риска неблагоприятных исходов, более высоких показателей смертности и отсутствия установленных рекомендаций и стандартизированных данных по лечению [5][7-9].
Представляем вам три клинических наблюдения, демонстрирующих возможную тактику ведения пациентов с ТПО и ТЭЛА с различными факторами риска.
Клинический случай 1
Пациентка 32 лет, курильщица, с избыточной массой тела (индекс массы тела (ИМТ) 28,7 кг/м²), из анамнеза известно, что состоит на диспансерном учете у психиатра по поводу биполярного расстройства, ведет малоподвижный образ жизни ввиду постоянного чувства беспокойства, перенесла коронавирусную инфекцию 1,5 года назад в легкой форме. Госпитализирована экстренно в стационар в связи с жалобами на выраженную одышку в течение трех дней. Была заподозрена ТЭЛА, доставлена напрямую в отделение реанимации и интенсивной терапии (ОРИТ), на догоспитальном этапе вводился гепарин внутривенно 80 ЕД/кг.
При осмотре общее состояние тяжелое. Сознание ясное, очаговой неврологической симптоматики нет. Кожные покровы обычной окраски, цианоза нет, периферических отеков нет. Видимые слизистые розовые, влажные. Дыхание самостоятельное, частота дыхательных движений (ЧДД) — 30/мин. SpO2 — 89% (fiO2 =21%). Аускультативно в легких дыхание жесткое, ослаблено в нижних отделах, хрипов нет. Тоны сердца — приглушены, ритмичны, артериальное давление (АД) — 87/57 мм рт.ст., частота сердечных сокращений (ЧСС) — 112 уд./мин. Язык влажный, чистый. Живот — симметричный, мягкий, не вздут, при пальпации безболезненный во всех отделах, выслушивается активная перистальтика.
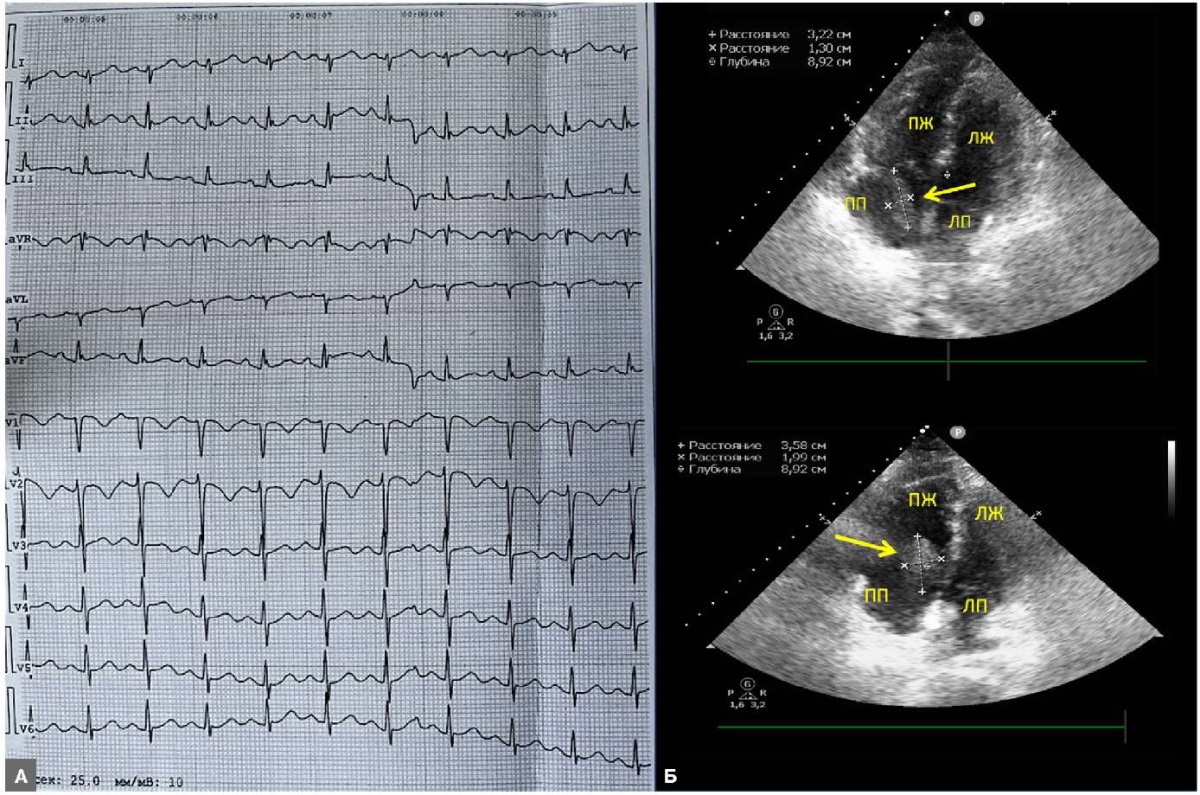
По данным электрокардиографии (ЭКГ): синусовая тахикардия, отклонение электрической оси вправо, отрицательный зубец Т в отведениях V1-V2 (рис. 1 А). При трансторакальной ЭхоКГ выявлены признаки перегрузки ПЖ: D-образный левый желудочек (ЛЖ), систолическое давление в ЛА (СДЛА) 55 мм рт.ст., расширение ПП 4,0*4,6 см, расширение ПЖ и нормальные показатели систолической экскурсии кольца трикуспидального клапана (TAPSE) — 17 мм, TAPSE/СДЛА 0,3, НПВ 1,5 см с коллабированием >50%, в ПП выявлено гиперэхогенное образование 3,2*2,0 см, пролабирующее в полость ПЖ — тромб (рис. 1 Б). При проведении ультразвукового ангиосканирования (УЗАС) вен нижних конечностей признаков тромбоза не выявлено.

Рис. 1. Пациент 1.
Примечание: А — ЭКГ при поступлении в отделение: синусовая тахикардия, отклонение электрической оси вправо, отрицательный зубец Т V1-V2. Б — трансторакальная ЭхоКГ, четырехкамерная позиция: тромб в полости ПП (желтая стрелка). Цветное изображение доступно в электронной версии журнала.
Сокращения: ПЖ — правый желудочек, ПП — правое предсердие, ЛЖ — левый желудочек, ЛП — левое предсердие, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
По результатам КТ-АПГ (рис. 2), выполненной при поступлении: в левой ЛА видны тромботические массы с субокклюзией ее просвета, частичным переходом на ствол ЛА, распространяющиеся на нижнедолевую артерию, практически все сегментарные и субсегментарные артерии с полной окклюзией их просвета, за исключением сегментарных артерий А1,3; справа тромботические массы в верхне- и нижнедолевых артериях, большинстве сегментарных и субсегментарных артерий с различной степенью окклюзии их просвета; на фоне выраженных артефактов от контрастного вещества в полости ПП нельзя исключить наличие тромба; косвенных признаков ЛГ и признаков перегрузки правых отделов сердца не выявлено (ствол ЛА 27 мм, правая ЛА 23 мм, левая ЛА 24 мм, соотношение ПЖ/ЛЖ <1); в паренхиме обоих легких признаки «мозаичной перфузии», а также единичные мелкие участки по типу «матового стекла», расположенные в субплевральных отделах, вероятно, формирующиеся зоны инфаркт-пневмонии (рис. 3).

Рис. 2. Пациент 1. КТ-АПГ в динамике — при поступлении (А, В) и после тромболизиса (Б, Г), MIP-реконструкции в аксиальной (А, Б) и сагиттальной (В, Г) плоскостях.
Примечание: А — в левой ЛА видны тромботические массы с субокклюзией ее просвета и частичным переходом на ствол, распространяющиеся на левую нижнедолевую артерию и ее ветви (желтая стрелка); сохранено контрастирование сегментарных артерий верхней доли правого легкого (зеленый круг). Б — в правой ЛА появился тромб (красная стрелка); отсутствует контрастирование сегментарных артерий верхней доли правого легкого (красный круг); уменьшились размеры тромба в левой ЛА (желтая стрелка). В — полная окклюзия левой нижнедолевой артерии и ее ветвей (красный круг). Г — уменьшение степени тромбоза нижнедолевой артерии, появление контрастирования сегментарной артерии А6 и ее ветвей с появлением в прилежащей паренхиме инфильтрации — кровоизлияние/реперфузионный отек (зеленый круг). Цветное изображение доступно в электронной версии журнала.
Сокращения: КТ‐АПГ — компьютерная томографическая ангиопульмонография, ЛА — легочная артерия.

Рис. 3. Пациент 1. КТ грудной клетки в динамике — при поступлении (А) и после тромболизиса на 2 сут. (Б, В), аксиальная плоскость.
Примечание: в субплевральных отделах обоих легких видны единичные мелкие участки по типу «матового стекла», вероятно, формирующиеся зоны инфаркт-пневмонии (А, стрелки); уплотнение и некоторое увеличение размеров участка по типу «матового стекла», характерного для инфаркт-пневмонии в S8 правого легкого (Б, стрелка); появление зоны инфильтрации преимущественно по типу консолидации (В, стрелка).
В общем анализе крови: гемоглобин 184 г/л (120-160 г/л), эритроциты 5,4*1012/л (3,9-5*1012/л), лейкоциты 6,6*109/л (4-9*109/л), тромбоциты 123*109/л (150-400*109/л). В биохимическом анализе крови: креатинин 83 мкмоль/л (72-127 мкмоль/л), скорость клубочковой фильтрации (СКФ) 92,5 мл/мин/1,73 м², калий 4,4 ммоль/л (3,5-5,1 ммоль/л), глюкоза 5,4 ммоль/л (4,1-6,1 ммоль/л), С-реактивный белок 101,9 мг/л (0-5 мг/л), Д-димер 803 нг/мл (0-500 нг/мл), тропонин I <0,006 нг/мл (0,00001-0,04 нг/мл), N-концевой промозговой натрийуретический пептид (NT-proBNP) 1098 пг/мл (0-200 пг/мл).
Диагностирована массивная ТЭЛА с высоким риском смерти по шкале PESI (класс IV, 122 балла). Учитывая нестабильную гемодинамику (стойкое снижение систолического АД <90 мм рт.ст.), высокий риск смерти по критериям ESC, было принято решение о проведении системного тромболизиса рекомбинантным человеческим тканевым активатором плазминогена по стандартной схеме (альтеплаза, 100 мг), начата инфузия гепарина. Риск кровотечений по шкале VTE-BLEED низкий (0 баллов).
На фоне проведенной терапии через сутки гемодинамические показатели нормализовались, одышка в покое уменьшилась, были достигнуты и сохранялись целевые значения активированного частичного тромбопластинового времени (АЧТВ).
При повторном ЭхоКГ (через 24 ч) признаков тромбоза в полости ПП не выявлено, однако сохранялись признаки дисфункции ПЖ: D-образный ЛЖ, парадоксальное движение межжелудочковой перегородки, TAPSE 13 мм, TAPSE/СДЛА 0,3, и признаки ЛГ — СДЛА 43 мм рт.ст., при этом НПВ 1,5 см с коллабированием >50%, расчетное давление в ПП в норме (5 мм рт.ст.).
При повторной КТ-АПГ на вторые сутки наблюдения (рис. 2) отмечалась разнонаправленная динамика: появление тромба в правой ветви ЛА с частичной окклюзией ее просвета и распространением тромботических масс на верхнедолевую артерию и сегментарные артерии А1-3 с полной окклюзией их просвета; уменьшение степени тромбоза левой ветви ЛА и появление контрастирования сегментарной и некоторых субсегментарных артерий А6; степень тромбоза в остальных ветвях ЛА прежняя; отмечается некоторое расширение просвета ствола ЛА до 29 мм, соотношение ЛА/восх. отд. >1, что может указывать на косвенные признаки ЛГ; появился следовой плевральный выпот слева; ранее описанные участки характерные для инфаркт-пневмонии по типу «матового стекла» в левом легком практически регрессировали, участок «матового стекла» в S8 правого легкого стал плотнее, несколько увеличился в размерах; в S6 левого легкого (в зоне, где улучшилось кровоснабжение) появилась обширная зона инфильтрации преимущественно по типу консолидации — следует дифференцировать между кровоизлиянием и реперфузионным отеком (рис. 3).
Учитывая наличие пневмонии, пациентке назначена антибактериальная терапия цефотаксимом 2 г/сут. с положительным эффектом (в динамике С-реактивный белок снизился до 8,3 мг/л, положительная рентгенологическая картина). На 4 сут. пациентка была переведена в отделение сосудистой хирургии, назначен ривароксабан 30 мг/сут. Проводилось дообследование, данных за наличие онкологического заболевания не получено.
На 13 сут. (перед выпиской) выполнено повторное ЭхоКГ: тромбов в полостях сердца не выявлено, СДЛА 45 мм рт.ст., других признаков дисфункции ПЖ не выявлено. Уровень NT-proBNP на момент выписки составил 1000 пг/мл. Учитывая молодой возраст пациентки и отсутствие провоцирующих факторов, было рекомендовано амбулаторное дообследование с целью исключения тромбофилии, даны рекомендации по дальнейшему образу жизни и профилактике тромбоэмболических осложнений.
При повторном телефонном визите через 6 мес. пациентка сообщила, что спустя 2 мес. после выписки повторно была госпитализирована с рецидивом ТЭЛА, а также была направлена в центр наблюдения пациентов с хронической тромбоэмболической ЛГ (ХТЭЛГ), отмечает одышку при умеренной физической нагрузке. В связи с рецидивом ТЭЛА на фоне приема ривароксабана с хорошим комплаенсом была проведена смена терапии на апиксабан.
Клинический случай 2
Пациент 77 лет с ожирением (ИМТ 30,4 кг/м²), длительным анамнезом гипертонической болезни, хронической сердечной недостаточности (ХСН) с сохраненной фракцией выброса ЛЖ на уровне II функционального класса по NYHA, доставлен экстренно в приемное отделение стационара с жалобами на одышку в покое и при незначительной физической нагрузке в течение трех дней, выраженную слабость и дискомфорт за грудиной.
При осмотре общее состояние тяжелое. Сознание ясное, очаговой неврологической симптоматики нет. Кожные покровы: бледной окраски, акроцианоз, периферических отеков нет. Видимые слизистые розовые, влажные. Дыхание самостоятельное, ЧДД — 26 дых. дв./мин. SpO2 — 92% (fiO2 =21%). Аускультативно в легких дыхание жесткое, проводится во все отделы, хрипов нет. Тоны сердца — приглушены, ритмичны, АД — 122/75 мм рт.ст., ЧСС — 116 уд./мин. Язык влажный, чистый. Живот — симметричный, мягкий, не вздут, при пальпации безболезненный во всех отделах, выслушивается активная перистальтика.
По данным ЭКГ: синусовая тахикардия, ЧСС 140 уд./мин, признак SI QIII.
Госпитализирован в кардиологическое отделение с декомпенсацией ХСН. В ходе обследования не выявлено признаков застоя по данным рентгенографии грудной клетки и ультразвукового исследования легких, отмечено повышение уровня Д-димера до 9420 нг/мл (норма 0-500 нг/мл), в связи с чем заподозрена ТЭЛА (промежуточная клиническая вероятность по шкале Geneva — 6 баллов и Wells — 1,5 балла). Подкожно введен эноксапарин 1,0 мг/кг.
Выполнена КТ-АПГ (рис. 4): в области бифуркации ствола ЛА с переходом на ее правую и левую ветви определяется седловидный тромб, распространяющийся на все долевые, сегментарные и большинство субсегментарных ветвей с обеих сторон с различной степенью окклюзии их просвета; признаков тромбоза правых камер сердца достоверно не выявлено; выявлены косвенные признаки ЛГ и признаки перегрузки правых отделов сердца (ствол ЛА 33 мм, правая ЛА 26 мм, левая ЛА 32 мм, соотношение ПЖ/ЛЖ >1).

Рис. 4. Пациент 2. КТ-АПГ, MPR-реконструкции в аксиальной плоскости.
Примечание: седловидный тромб в бифуркации ствола ЛА с переходом на ее главные ветви (А, стрелка); признаки высокой ЛГ с перегрузкой правых отделов сердца: расширение ствола ЛА, ПП и ПЖ, соотношение ПЖ/ЛЖ >1 (А, Б). Цветное изображение доступно в электронной версии журнала.
Сокращения: ЛА — легочная артерия, ПЖ — правый желудочек, ПП — правое предсердие.
При проведении УЗАС вен нижних конечностей выявлены признаки тромбоза глубоких вен слева до уровня нижней трети бедра без флотации, сегментарного тромбоза большой подкожной вены слева.
Диагностирована массивная ТЭЛА, с высоким риском смерти по шкале PESI (класс IV, 117 баллов).
После проведения компьютерной томографии в отделении кардиологии состояние пациента ухудшилось, отмечалась дезориентация, выраженное беспокойство, тахипноэ до 28 в мин, снижение SpO2 до 86%, ЧСС 135 уд./мин, при этом сохранялась стабильная гемодинамика (АД 118/76 мм рт.ст.). В связи с ухудшением состояния был переведен в ОРИТ, где была начата неинвазивная вентиляция легких через лицевую маску в режиме CPAP. С учетом стабильной гемодинамики принято решение воздержаться от проведения тромболитической терапии (ТЛТ), начата инфузия гепарина.
В отделении ОРИТ выполнена трансторакальная ЭхоКГ: фракция выброса ЛЖ 55%, D-образный ЛЖ, парадоксальное движение межжелудочковой перегородки, расширение ПЖ (переднезадний размер — 3,8 см, базальный размер — 5,4 см, средний размер 4,3 см) и ПП 5,4*5,7 см, TAPSE 24 мм, S’ 0,10 см/с, TAPSE/СДЛА 0,3, расширение НПВ — 2,6 см с коллабированием <50%, СДЛА 64 мм рт.ст. В полости ПЖ выявлено гиперэхогенное образование (тромб) лентовидной формы, прикрепляющийся к хордам трикуспидального клапана, максимальный размер ~2,6 см (рис. 5 Б).

Рис. 5. Пациент 2.
Примечание: А — ЭКГ на вторые сутки: ритм синусовый, ЧСС 108 в мин, SI QIII, единичная ЖЭС. Б — трансторакальная ЭхоКГ, субкостальная позиция: тромб в полости ПЖ (желтая стрелка). Цветное изображение доступно в электронной версии журнала.
Сокращения: ЖЭС — желудочковая экстрасистолия, ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек, ПП — правое предсердие, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
В общем анализе крови: гемоглобин 159 г/л (120-160 г/л), эритроциты 4,9*1012/л (3,9-5*1012/л), лейкоциты 9,3*109/л (4-9*109/л), тромбоциты 256*109/л (150-400*109/л). В биохимическом анализе крови: креатинин 99 мкмоль/л (72-127 мкмоль/л), СКФ 63,1 мл/мин/1,73 м², калий 4,2 ммоль/л (3,5-5,1 ммоль/л), глюкоза 6,8 ммоль/л (4,1-6,1 ммоль/л), С-реактивный белок 9,8 мг/л (0-5 мг/л), тропонин I 0,16 нг/мл (0,00001-0,04 нг/мл).
На фоне проводимой терапии на 2 сут. отмечалась положительная динамика в виде нормализации психического статуса, отсутствии дезориентации, уменьшения одышки в покое, сохранялась стабильная гемодинамика, АД 112/74 мм рт.ст., ЧСС 108 в мин, ЭКГ представлена на рисунке 5 А. Пациент переведен на инсуффляцию увлажненного кислорода, продолжена инфузия гепарина с достижением целевых значений АЧТВ. На 3 сут. по стабилизации состояния пациент был переведен в отделение сосудистой хирургии, назначен ривароксабан в дозировке 30 мг/сут.
На 11 сут. госпитализации (перед выпиской) проведено ЭхоКГ, отмечалась положительная динамика в виде регресса признаков перегрузки правых отделов сердца: уменьшились размеры ПЖ (переднезадний размер — 3,2 см базальный размер — 5,1 см, средний размер — 3,9 см) и ПП 4,7*5,5 см, TAPSE 23 мм, S’ 0,19 см/с, TAPSE/СДЛА 0,4, НПВ 1,8 см с коллабированием >50%; сохранялись признаки ЛГ — СДЛА 55 мм рт.ст., тромб выявленный ранее в полости ПЖ не обнаружен.
Через 2 мес. после выписки пациент пришел на консультацию: жалоб на одышку не предъявляет, увеличилась толерантность к физической нагрузке, постоянно принимает ривароксабан 20 мг/сут. При осмотре кожные покровы обычной окраски, отмечается варикозное расширение вен левой нижней конечности, ассиметричная отечность 1+, цианоза нет, АД 110/72 мм рт.ст., ЧДД 16 в мин, SpO2 97%. При проведении УЗАС вен нижних конечностей определяется тромбоз подколенной, задней большеберцовой вены без признаков реканализации и флотации. При ЭхоКГ: переднезадний размер ПЖ 3,4 см базальный 5,1 см, средний размер 4,3 см, ПП 4,1*5,1 см, TAPSE 25 мм, S’ 0,14 см/с, TAPSE/СДЛА 0,7, НПВ 2,0 см с коллабированием >50%, СДЛА 34 мм рт.ст., тромбоза в ПЖ/ПП нет.
Клинический случай 3
Пациентка 84 лет, с ожирением 2 степени (ИМТ 37,3 кг/м²), длительным анамнезом гипертонической болезни, маломобильная в связи с артритом коленных суставов (последние 6 дней иммобилизирована), перенесла коронавирусную инфекция 1,5 года назад в легкой форме. Госпитализирована экстренно в приемное отделение с жалобами на выраженную одышку до степени удушья, нарастающую в течение 2 нед.
При осмотре общее состояние тяжелое. Сознание ясное, очаговой неврологической симптоматики нет. Кожные покровы: нормальной окраски, периферических отеков нет. Видимые слизистые розовые, влажные. Дыхание самостоятельное, ЧДД — 22 дых. дв./мин. SpO2 — 87% (fiO2 =21%). Аускультативно в легких дыхание жесткое, проводится во все отделы, хрипов нет. Тоны сердца — приглушены, ритмичны, АД — 140/92 мм рт.ст., ЧСС — 110 уд./мин. Язык влажный, чистый. Живот — симметричный, мягкий, не вздут, при пальпации безболезненный во всех отделах, выслушивается активная перистальтика.
По данным ЭКГ: синусовый ритм с ЧСС 106 уд./мин, инверсия зубца Т в отведениях V1-V5 (рис. 6 А). При трансторакальной ЭхоКГ определялись признаки перегрузки ПЖ: TAPSE 10 мм, S’ 0,10 см/с, TAPSE/СДЛА 0,16, переднезадний размер ПЖ 3,4 см, базальный 3,5 см, средний 3,4 см, ПП 3,1 см*4,1 см, НПВ не расширена 2,1 см с коллабированием >50%, СДЛА 63 мм рт.ст. Выявлен тромб в полости ПЖ округлой формы размером 2,8*1,8 см. При УЗАС вен нижних конечностей признаки окклюзирующего тромбоза передней большеберцовой вены, подколенной вены и медиальной группы суральных вен справа без признаков флотации, стадия начальной реканализации.

Рис. 6. Пациент 3.
Примечание: А — ЭКГ при поступлении: синусовый ритм с ЧСС 106 в мин, инверсия зубца Т в отведениях V1-V5, единичные ЖЭС. Б — трансторакальная ЭхоКГ, четырехкамерная позиция: тромб в полости ПЖ (желтая стрелка). Цветное изображение доступно в электронной версии журнала.
Сокращения: ЖЭС — желудочковая экстрасистолия, ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек, ПП — правое предсердие, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
По результатам КТ-АПГ, выполненной при поступлении (рис. 7): в правой ЛА определяются тромботические массы с частичной окклюзией ее просвета, распространяющиеся на ее долевые, сегментарные и субсегментарные ветви с различной степенью окклюзии их просвета; тромботические массы в нижнедолевой ветви левой ЛА, большинстве сегментарных и субсегментарных ветвей слева с различной степенью окклюзии их просвета; признаков тромбоза правых камер сердца достоверно не выявлено; косвенные признаки ЛГ и признаки перегрузки правых отделов сердца (ствол ЛА 34 мм, правая ЛА 27 мм, левая ЛА 31 мм, соотношение ПЖ/ЛЖ >1).

Рис. 7. Пациент 3. КТ-АПГ, MPR-реконструкции в аксиальной плоскости.
Примечание: тромбы в правой ЛА, левой нижнедолевой артерии и в отходящих от нее сегментарных ветвях (А, стрелки); признаки ЛГ, начальные признаки перегрузки правых отделов сердца: небольшое расширение ствола ЛА, ПП и ПЖ, соотношение ПЖ/ЛЖ >1 (Б, В). Цветное изображение доступно в электронной версии журнала.
Сокращения: ЛА — легочная артерия, ЛГ — легочная гипертензия, ЛЖ — левый желудочек, ПЖ — правый желудочек, ПП — правое предсердие.
В общем анализе крови: гемоглобин 156 г/л (120-160 г/л), эритроциты 5,3*1012/л (3,9-5*1012/л), лейкоциты 10,5*109/л (4-9*109/л), тромбоциты 203*109/л (150-400*109/л). В биохимическом анализе крови: креатинин 83,9 мкмоль/л (72-127 мкмоль/л), СКФ 55,3 мл/мин/1,73 м², калий 4,4 ммоль/л (3,5-5,1 ммоль/л), глюкоза 6,8 ммоль/л (4,1-6,1 ммоль/л), С-реактивный белок 11,2 мг/л (0-5 мг/л), Д-димер 2873 нг/мл (0-500 нг/мл), тропонин I 0,28 нг/мл (0,00001-0,04 нг/мл), NT-proBNP 741 пг/мл (0-200 пг/мл).
Диагностирована массивная ТЭЛА с высоким риском смерти по шкале PESI (IV класс, 124 балла), промежуточно-высоким риском смерти по критериям ESC и стабильной гемодинамикой. Пациентка госпитализирована в ОРИТ, проводилась оксигенотерапия 5 л/мин, в качестве антикоагулянтной терапии начата инфузия гепарина под контролем АЧТВ.
На фоне проводимой терапии отмечалась положительная динамика в виде уменьшения одышки в покое, сохранялась стабильная гемодинамика, АД 135/79 мм рт.ст., ЧСС 79 уд./мин, ЧДД 19 в мин, SpO2 на воздухе 95%, на 4 сут. переведена в отделение сосудистой хирургии, назначен ривароксабан 30 мг/сут.
На 8 сут. проведена ЭхоКГ в динамике, сохранялись признаки дисфункции ПЖ: TAPSE 11 мм, TAPSE/СДЛА 0,17; признаки ЛГ: расширение НПВ 2,4 см с коллабированием <50%, повышение СДЛА 67 мм рт.ст.; сохранялся тромб в полости ПЖ размером 2,5*1,2 см. Пациентка была выписана по собственному желанию и настоянию родственников.
При повторном телефонном контакте через месяц пациентка отказалась от повторного визита в связи с маломобильностью, принимает ривароксабан 20 мг/сут., одышка при незначительной физической нагрузке сохраняется.
Обсуждение
В настоящее время разработаны рекомендации по выбору стратегии лечения больных ТЭЛА, однако оптимальная тактика ведения таких пациентов в сочетании с ТПО сердца остается предметом дискуссий и в ряде случаев требует незамедлительного принятия решения и командной работы. Своевременное выявление у этих больных факторов риска внутрисердечного тромбоза и непосредственно тромбоза правых камер сердца может повлиять на тактику лечения, что позволит снизить вероятность неблагоприятных исходов и улучшить прогноз.
Согласно данным регистров ICOPER, RIETE и крупного метаанализа, у пациентов с ТПО сердца и ТЭЛА среди предрасполагающих факторов чаще встречались: ХСН, активные онкологические заболевания, иммобилизация, а также чаще регистрировалась артериальная гипотония и гипоксемия [8-10]. У двух из представленных пациентов встречались предрасполагающие факторы к ТПО сердца: в 3-м случае — иммобилизация, во 2-м случае — ХСН (табл. 1); у 1-ой пациентки при поступлении была зарегистрирована артериальная гипотония и гипоксемия, у двух других пациентов были признаки гипоксемии при нормальном уровне АД.
Таблица 1
Характеристика пациентов
|
Пациент 1 |
Пациент 2 |
Пациент 3 |
|
|
Характеристика |
женщина 32 лет |
мужчина 77 лет |
женщина 84 лет |
|
Факторы риска |
— |
ХСН |
иммобилизация |
|
Гемодинамическая нестабильность |
+ |
— |
— |
|
PESI класс |
IV |
V |
IV |
|
Дисфункция ПЖ по данным ЭхоКГ/признаки перегрузки правых отделов сердца по КТ-АПГ |
+/- |
+/+ |
+/+ |
|
Повышение уровня кардиомаркеров |
— |
+ |
+ |
|
Риск смерти по критериям ESC |
высокий |
промежуточно-высокий |
промежуточно-высокий |
|
Тромболитическая терапия |
+ |
— |
— |
|
Антикоагулянтная терапия |
инфузия гепарина → ривароксабан |
инфузия гепарина → ривароксабан |
инфузия гепарина → ривароксабан |
|
Изменение тромба при ЭхоКГ на момент выписки из стационара |
полное растворение тромба |
полное растворение тромба |
сохранение тромба в полости ПЖ |
|
Динамика состояния |
рецидив ТЭЛА с формированием ХТЭЛГ |
положительная динамика |
положительная динамика |
Сокращения: КТ‐АПГ — компьютерная томографическая ангиопульмонография, ПЖ — правый желудочек, ТЭЛА — тромбоэмболия легочной артерии, ХТЭЛГ — хроническая тромбоэмболическая легочная гипертензия, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография.
Имеется ряд зарубежных публикаций, посвященных вопросам повышенного риска тромбообразования и ТЭЛА у пациентов с новой коронавирусной инфекцией (COVID-19) в остром и отдаленном (постковидном) периоде [11]. Однако по последним данным перенесенная COVID-19 в легкой форме не ассоциирована с высоким риском ТЭЛА, в т. ч. в отдаленном периоде [11][12]. В первом и третьем представленном случае пациенты перенесли COVID-19 в легкой форме более чем за год до возникновения ТЭЛА, вероятно, COVID-19 не является причиной возникновения ТПО и ТЭЛА в представленных случаях.
По данным регистров ICOPER и RIETE, у пациентов с ТЭЛА и ТПО чаще выявляются признаки дисфункции ПЖ и повышение уровня сердечных биомаркеров [8][10]. У представленных нами пациентов были выявлены признаки дисфункции ПЖ по данным ЭхоКГ, а во 2-м и 3-м случаях признаки дисфункции также выявлялись при КТ-АПГ и сочетались с повышением уровня тропонина (табл. 1).
В настоящее время нет достоверных данных о связи морфологии тромба и прогноза пациентов, в Европейском регистре RiHTER с участием 138 пациентов было продемонстрировано отсутствие влияния размера, локализации и формы тромба на 30-дневную летальность [6]. Другие авторы подчеркивают важность определения типа тромбов [2][14]: тип А — крупные и подвижные, с высокой склонностью к дистальной эмболизации, и тип В — небольшие и неподвижные тромбы ПП, отмечая различия в тактике ведения пациентов с двумя различными типами [2]. При этом исследователи едины во мнение, что важно выявить наличие ТПО сердца, т. к. это связано с худшим прогнозом и различием в терапевтических подходах [5][7][9][13]. У первой пациентки в ПП был выявлен крупный, подвижный тромб с пролабированием в полость ПЖ, у второго и третьего пациентов тромб был меньшего размера и с фиксацией к стенке ПЖ.
Стратификация риска на основании гемодинамической стабильности, шкалы PESI, признаков дисфункции ПЖ и повышения уровня кардиомаркеров является обязательным для решения вопроса о тактике ведения пациентов с ТЭЛА согласно действующим рекомендациям [5]. Первая пациентка с учетом нестабильной гемодинамики относилась к высокому риску по критериям ESC, в связи с чем ей была проведена ТЛТ, второй и третий пациенты относились к промежуточно-высокому риску и получали только антикоагулянты, всем пациентам проводилась терапия гепарином с последующим переводом на прямые пероральные антикоагулянты.
Оптимальное лечение ТПО сердца с сопутствующей ТЭЛА в настоящее время не определено и варьируется от монотерапии антикоагулянтами и системного тромболизиса до современных методов, которые включают эндоваскулярные методы лечения, такие как механическая тромбэктомия и хирургическая эмболэктомия. В ретроспективном анализе ICOPER среди включенных 2454 пациентов с ТЭЛА смерть от всех причин была выше у пациентов с ТПО, чем без ТПО через 14 дней (21 и 11%, р=0,032) и через 3 мес. (29 и 16%, р=0,036). Не было получено достоверных различий в отношении частоты смерти от всех причин через 3 мес. наблюдения в группе пациентов с ТПО, получавших только гепарин (23,5%), и у пациентов с ТПО, которым был проведен тромболизис (20,8%) [8]. В другом крупном проспективном регистре RIETE смертность от ТЭЛА в течение 30 дней была выше у пациентов с ТПО, чем без ТПО (5,2 и 0,9%; р<0,001). У пациентов с ТПО (n=325) не было выявлено статистических различий в частоте смерти от всех причин (6,2% vs 14%; р=0,15) или частоте смерти, связанной с ТЭЛА (4,7% vs 7,8%; р=0,47) при проведении реперфузионной терапии (ТЛТ — 58 пациентов, тромбэктомия — 12 пациентов) по сравнению с применением только антикоагулянтов [10]. Однако следует отметить, что эти данные получены из регистров, поэтому диагностическое обследование, оценка риска и назначенная терапия не были заслеплены и не были контролируемыми.
В то же время несколько ретроспективных исследований показали, что пациенты, получавшие только антикоагулянты, имеют более высокий уровень смертности по сравнению с пациентами, получавшими системный тромболизис или хирургическую эмболэктомию [14][15]. Athappan G, et al. ретроспективно проанализировали данные 328 пациентов с ТПО и ТЭЛА, общая краткосрочная смертность для всей когорты составила 23,2%. Смертность, связанная с применением только антикоагулянтов, была значительно выше, чем при выборе хирургической эмболэктомии или ТЛТ (37,1, 18,3 и 13,7%, соответственно), при этом значительного увеличения риска осложнений при ТЛТ не наблюдалось [14].
В настоящее время продолжается изучение эффективности и безопасности различных эндоваскулярных методик (катетерный тромболизис, фармакомеханический тромболизис, катетерная фрагментация тромбов, аспирационная и ротационная тромбэктомия) у пациентов высоко и промежуточно-высоко риска смерти, однако количество пациентов с сочетанием ТПО и ТЭЛА в этих исследованиях крайне мало [2][16].
Khosla A, et al. предлагают следующую тактику лечения для пациентов с ТЭЛА и выявленным ТПО сердца, основанную на действующих рекомендаций ESC и данных клинических исследований и регистров: вне зависимости от гемодинамической стабильности пациента немедленную активацию междисциплинарной команды, состоящей из реаниматолога, эндоваскулярного хирурга, кардиоторакального хирурга и кардиолога (Pulmonary Embolism Response Team — PERT). Пациентам с нестабильной гемодинамикой рекомендована реперфузионная терапия: проведение системного тромболизиса (при отсутствии противопоказаний), катетерная или хирургическая эмболэктомия. Авторы подчеркивают недостаток данных рандомизированных клинических исследований у гемодинамически стабильных пациентов с тяжелой дисфункцией ПЖ и подвижными или пролабирующими тромбами, однако, учитывая высокий риск дестабилизации гемодинамики в этой когорте пациентов, рекомендуют в дополнение к антикоагулянтной терапии рассмотреть возможность проведение катетерной эмболэктомии, учитывая благоприятный профиль безопасности, минимально инвазивную технику и меньшее количество противопоказаний по сравнению с системными тромболитиками или хирургическими подходами. У пациентов с открытым овальным окном, тромбозом открытого овального окна, подозрением на первичную опухоль сердца, очень крупным тромбом или ранее неудачными попытками эндоваскулярного вмешательства авторами рекомендуется отдать предпочтение хирургическому подходу, если пациент является подходящим кандидатом на хирургическое вмешательство. Остальным пациентам низкого риска, без дисфункции ПЖ, с неподвижными тромбами, тромбами небольшого размера или хроническим ТПО сердца авторы рекомендуют антикоагулянтную терапию и мониторинг гемодинамических параметров [2].
Во всех представленных нами случаях в междисциплинарную команду по принятию решений и определения тактики ведения пациента были включены реаниматолог, кардиолог, специалист ультразвуковой диагностики и рентгенолог. У первой представленной пациентки с нестабильной гемодинамикой, дисфункцией ПЖ по данным ЭхоКГ и крупным тромбом ПП (3,2*2,0 см), пролабирующим в полость ПЖ, была выбранная тактика проведения реперфузионной терапии с использованием системного тромболизиса. Терапия оказала положительное влияние с лизированием тромба в полости ПП и регрессом признаков дисфункции ПЖ на момент выписки. Несмотря на это, в последующем у пациентки был рецидив ТЭЛА с формированием ХТЭЛГ при правильном приеме антикоагулянтной терапии. Второй и третий пациенты были гемодинамически стабильны, оба с дисфункцией ПЖ, определенной по ЭхоКГ и КТ, неподвижным тромбом ПЖ (2,6 и 2,8 см, соответственно). Согласно рекомендациям Khosla A, et al., таким пациентам в дополнение к антикоагулянтной терапии можно рассмотреть возможность проведения катетерной эмболэктомии [2]. Однако это потребовало бы перевода пациентов в другой стационар, что могло быть сопряжено с высоким риском дестабилизации гемодинамики. Выбранная тактика антикоагулянтной терапии гепарином у второго пациента оказала положительное влияние с лизированием тромба и восстановлением функции ПЖ на момент выписки. Однако у третьей пациентки сохранялись признаки тромбоза и дисфункция ПЖ на момент выписки. Следует отметить различие в сроках наблюдения пациентов, во втором случае пациент выписан на 11 сут., в третьем случае пациентка отказалась от дальнейшего нахождения в стационаре и была выписана на 8 сут.
В ретроспективном исследовании с участием 97 пациентов с ТПО было показано, что разрешение тромбов было связано с большей выживаемостью [17]. У третьей представленной пациентки на момент выписки сохранялся тромб в полости ПЖ, несмотря на проведенную антикоагулянтную терапию. Возможно, проведение катетерной эмболэктомии могло бы привести к снижению степени дисфункции ПЖ в динамике, однако пациентка отказалась от дальнейшего стационарного лечения и обследования.
По данным регистра RIETE пациенты с ТЭЛА и ТПО имеют риск повторной ТЭЛА в 2,5 раза выше, чем пациенты без ТПО [10]. У первой представленной пациентки через 2 мес. был зарегистрирован рецидив ТЭЛА, подтвержденный данными КТ-АПГ, при этом ТЭЛА была не массивная, ее источник не был определен, пациентке была рекомендована пожизненная антикоагулянтная терапия.
Заключение
Лечение пациентов с ТЭЛА и ТПО требует учета многих факторов, в первую очередь важна оценка гемодинамики для решения вопроса об экстренном проведении реперфузии, так же как у пациентов без ТПО. Степень дисфункции ПЖ, характеристики тромба, так же как наличие открытого овального окна или опухоли сердца могут повлиять на выбор тактики лечения в пользу эндоваскулярных или хирургических методов лечения. Представленные случаи демонстрируют различные варианты клинического течения и необходимость комплексного и мультидисциплинарного подхода, совместно со смежными специалистами.
Необходимы последующие исследования с целью оптимизации стратегии лечения пациентов с ТПО и ТЭЛА, особенно с учетом потенциальной пользы новых эндоваскулярных методов лечения.
Заявление о получении информированного добровольного согласия у пациентов. Согласие на использование информации в научных целях получено.
Благодарности. Выражаем благодарность Демченко Анне Юрьевне за помощь в интерпретации и описании результатов компьютерной томографической ангиопульмонографии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Тетерина М.А., Убайдуллаева Д.А., Фарзалиева Н.А., Назырова А.Р., Джаясингхе Хавпаге М.Г., Лапшин А.А., Мерай И., Кобалава Ж.Д. Тромбоз правых отделов сердца у пациентов с тромбоэмболией легочной артерии: серия клинических случаев. Российский кардиологический журнал. 2024;29(2S):5797. https://doi.org/10.15829/1560-4071-2024-5797. EDN: LSODEA
Скопировать