Особенности длительного ведения пациентки репродуктивного возраста после хирургической коррекции митрального клапана на фоне инфекционного эндокардита
Аннотация
В рамках клинического случая представлен «портрет» пациентки с приобретенным пороком митрального клапана (МК) на фоне инфекционного эндокардита, диагностированного впервые на третьем триместре беременности. Выполнено протезирование МК биологическим протезом «КемКор», после чего последовало два успешных родоразрешения. Через 18 лет после коррекции порока, в результате развития дисфункции протеза, пациентке проведена эндоваскулярная транскатетерная имплантации биопротеза «протез в протез» в митральную позицию.
Данный клинический случай уникален с позиции обоснования выбора биологического протеза для коррекции приобретенного порока МК у пациентки репродуктивного возраста, длительного периода функционирования биопротеза и коррекции возникшей в последующем клапанной дисфункции с использованием транскатетерных технологий.
Распространенность приобретенных пороков сердца в общей популяции составляет от 2 до 5%, с закономерным увеличением частоты их выявления с возрастом [1]. Поражение митрального клапана (МК) сердца встречающееся как в виде изолированного, так и сочетанного порока, является одной из основных причин оперативных вмешательств в кардиохирургии. Традиционными методами лечения пороков МК являются протезирование или пластика клапана в условиях искусственного кровообращения [2].
По данным российских исследователей доля больных с инфекционным поражением МК, требующего хирургической коррекции, увеличилась в 2 раза в период с 2015г по 2020г [3][4].
Инфекционный эндокардит (ИЭ) у беременных встречается довольно редко (0,006% случаев) [5], в основном имеет вторичный характер и подострое течение, развивается на клапанах, пораженных исходно ревматическим процессом, или при врожденных пороках сердца, и обычно выявляется в III триместре беременности [6].
В случае наличия порока МК, требующего хирургической коррекции, у женщин репродуктивного возраста в связи с отсутствием необходимости пожизненного приема антикоагулянтной терапии (АКТ) наиболее предпочтительной является имплантация биологических протезов (БП) клапанов сердца, обладающих низкой тромбогенностью. Это позволяет не увеличивать риск развития маточных кровотечений во время беременности и родов, а также выносить здорового ребенка [7]. Однако низкая прочность ксеногенной ткани БП в дальнейшем приводит к выраженной дисфункции клапана. Происходит кальцификация ксеногенной ткани протезов, которая сопровождается инфильтрацией клеток реципиента с последующей репопуляцией и ремоделированием структур клапанов [8][9].
В настоящее время продолжается поиск причин дисфункции БП. Это важно с позиции модификации факторов риска развития дисфункции БП, что позволит продлить время функционирования протеза. Существует несколько теорий формирования дисфункций — естественное старение (износ) БП, протез-обусловленные дисфункции (усталостная прочность, биоинертность, резистентность к минерализации), реципиент-ассоциированные факторы (модифицируемые/немодифицируемые), протезный эндокардит. Однако в последнее время активно обсуждается роль традиционных для атеросклероза факторов риска дисфункции БП — дислипидемии, ожирения. Известно, что жировая ткань является источником провоспалительных медиаторов (интерлейкин-16, фактор некроза опухоли-альфа), в связи с этим и ожирение может вносить свой вклад в ограничение сроков функционирования клапанов [10].
Периоперационные риски при выполнении повторных вмешательств по коррекции дисфункции протеза значительно выше, чем при проведении первичной коррекции порока. Поэтому активно обсуждается применение малоинвазивных подходов с целью устранения дисфункции протезов клапанов сердца. У пациентов с высоким хирургическим риском проведение эндоваскулярного протезирования МК является альтернативным методом лечения, в т.ч. у больных с ранее выполненным протезированием МК в условиях искусственного кровообращения [11].
Данный клинический случай демонстрирует длительный период функционирования БП у молодой пациентки репродуктивного возраста, а также использование транскатетерных технологий для коррекции возникшей дисфункции протеза.
Описание клинического случая
Пациентка Л., впервые консультирована кардиологом в 1998г в возрасте 21 год на 7-ом мес. беременности после перенесенной респираторной вирусной инфекции. В тот период у пациентки впервые возникла клиника сердечной недостаточности (СН) (жалобы на одышку при физической нагрузке (ФН) (NYHA III), повышенную утомляемость). Из анамнеза известно, что ранее у пациентки не выявлялись заболевания сердечно-сосудистой системы. Из сопутствующих заболеваний имел место аутоиммунный тиреоидит (компенсированный), хроническая железодефицитная анемия легкой степени тяжести.
Диагностирован ИЭ с поражением МК — разрыв передней створки МК с формированием выраженной регургитации (IV степени), наличие подвижной вегетации на задней створке клапана. Пациентка наблюдалась у кардиолога, кардиохирурга и гинеколога весь период беременности, на 39-й нед. беременности через кесарево сечение произошло родоразрешение, родился здоровый ребенок, в дальнейшем в условиях кардиохирургического отделения активно проводилось лечение СН, подавление септического процесса. Пациентка продолжала наблюдение у кардиохирурга после выписки из стационара с динамическим проведением эхокардиографии (ЭхоКГ). В 2000г спустя 2 года после родоразрешения пациентке выполнено протезирование МК БП «КемКор-30» (эпоксиобработанный). Выбор типа клапанного протеза был обсужден с пациенткой и обусловлен ее желанием иметь в последующем детей. После операции наблюдался регресс явлений СН и восстановление толерантности к ФН (ТФН) на высоком уровне. Стоит отметить, что на момент выполнения оперативного вмешательства вес пациентки при росте 168 см составлял 46 кг (индекс массы тела (ИМТ) =16,3 кг/м2).
Через 6 мес. после оперативного вмешательства, на фоне удовлетворительной функции протеза, отсутствия нарушений ритма сердца, симптомов СН и других показаний к использованию АКТ, был отменен непрямой антикоагулянт — фенилин.
С 2001г по 2002г у пациентки имелись незапланированные беременности, хотя пациентка применяла барьерные методы контрацепции. Беременности были прерваны медицинским абортом. В 2002г (спустя 2 года после операции) у пациентки возникла 4 беременность. Противопоказаний для вынашивания беременности на тот момент по результатам обследований обнаружено не было. В течение всей беременности пациентку курировала команда, состоящая из кардиохирургов, кардиологов и акушеров-гинекологов. В 2003г с применением кесарева сечения родился здоровый ребенок.
После родоразрешения пациентка каждый год проходила контрольное обследование, в т.ч. для исключения нарушения функции БП. Состояние сохранялось стабильным, ТФН высокая, одышка, сердцебиение при ФН не беспокоили.
В 2010г, спустя 10 лет после протезирования МК, по данным трансторакальной ЭхоКГ отмечены умеренные дегенеративные изменения в виде уплотнения створок протеза. Это естественный и прогнозируемый для БП клапанов сердца процесс. Показатели ЭхоКГ при динамическом наблюдении за пациенткой соответствовали критериям нормальной функции протезированного клапана, однако все же отмечалось умеренное уменьшение эффективной площади открытия, повышение среднего диастолического градиента, скорости кровотока на БП (табл. 1).
В 34 года (2011г) у пациентки случается пятая беременность, несмотря на обсуждаемые риски возникновения протез-обусловленных осложнений с учетом функционирования протеза >10 лет, пациентка была настроена на вынашивание беременности. В период всей беременности за пациенткой наблюдали, нарушений ритма сердца и проявлений СН не было выявлено. Необходимости в дополнительном назначении АКТ у пациентки не было, показатели коагулограммы находились в пределах нормативных значений.
В процессе развития беременности, вследствие увеличения объема циркулирующей крови и преднагрузки, отмечалось увеличением размеров и объемов левых камер сердца. На 8-й нед. беременности возникла центральная регургитация на БП МК в результате вышеописанного механизма. Транспротезная регургитация к моменту родоразрешения увеличилась до II степени. Существенные изменения показателей скорости кровотока и диастолического градиента на протезированном клапане за период беременности отсутствовали, что указывало на функциональную состоятельность протеза (табл. 1). Таким образом, за период течения беременности морфологические и функциональные параметры ремоделирования сердца претерпевали физиологические изменения.
За беременность пациентка прибавила в весе 7 кг. Беременность протекала на фоне анемии беременной легкой степени, с курсовым приемом препаратов железа. Через кесарево сечение родился живой доношенный мальчик. По данным контрольной ЭхоКГ перед выпиской внутрисердечная гемодинамика нормализовалась с уменьшением регургитации на БП МК до I степени.
В динамике с 2011г по 2013г по ЭхоКГ определялась транспротезная регургитация II степени, имели место участки уплотнения створок протеза МК (табл. 1). ТФН сохранялась удовлетворительной. С 2014г выявлялась умеренная дисфункция БП МК, регургитация на протезе ближе к II степени (косонаправленная), в динамике отмечалось нарастание градиента давления на МК. В мае 2019г по ЭхоКГ, выполненной в плановом порядке, выявлена умеренная дисфункция БП; увеличилась транспротезная регургитация на МК до средне-выраженной (II-III степени) (табл. 1).
Важно отметить, что с 2013г пациентка начала прибавлять в весе, и к 2019г вес пациентки составлял 78 кг (прибавка в весе с момента оперативного вмешательства составила 32 кг), ИМТ составил 27,6 кг/м2.
С сентября 2019г пациентка стала отмечать жалобы на учащенное сердцебиение как в покое, так и при ФН, перебои в работе сердца, появление одышки инспираторного характера при ходьбе с ускорением, подъеме на 2 этаж. По данным ЭхоКГ увеличилась площадь открытия МК, на БП визуализировались неоднородные створки с участками уплотнения, выраженная транспротезная регургитация — до III-IV степени, повысилась скорость трансмитрального потока и давление в легочной артерии в динамике от мая 2019г (табл. 1). При объективном осмотре — частота сердечных сокращений 90 уд./мин, систоло-диастолический шум в проекции выслушивания МК, ИМТ =28,9 кг/м2. По электрокардиографии — ритм синусовый, единичная желудочковая экстрасистола; по мультиспиральной компьютерной томографии с ангиопульмонографией — данных за тромбоэмболию легочной артерии нет. По данным лабораторных исследований выявлена железодефицитная анемия легкой степени тяжести (гемоглобин 111 г/л; гематокрит 34,6%; эритроциты 4,27*1012, ферритин 80 мкг/л, уровень железа 5,8 мкмоль/л), гипербилирубинемия 27,1 мкмоль/л (прямой билирубин 12,2 мкмоль/л; непрямой билирубин 14,9 мкмоль/л).
Учитывая нарастающую дисфункцию БП, прогрессирование СН, коллегиально с кардиохирургом и рентгенэндоваскулярным хирургом принято решение о необходимости коррекции дисфункции протеза. При высоком хирургическом риске эндоваскулярное протезирование МК является альтернативным «открытой хирургии» методом лечения и применяется в т.ч. у пациентов с ранее выполненным протезированием МК в условиях искусственного кровообращения (технология «протез в протез»). Открытое репротезирование биологического МК, особенно у лиц с наличием тяжелой сопутствующей патологии, ассоциируется с высокой летальностью [11]. Для оценки морфометрии БП, межпредсердной перегородки (МПП), выявления дополнительных факторов (кальциноза и т.д.), с целью рассмотрения эндоваскулярной реимплантации МК пациентке выполнена мультиспиральная компьютерная томография сердца с контрастированием и электрокардиографической синхронизацией в ноябре 2019г — выявлены кальцинаты по периферии БП МК [11, 12]. С учетом высокого хирургического риска повторного открытого вмешательства — EuroScore II — 5,6% (на момент осмотра возраст пациентки составлял 43 года, имелась легочная гипертензия (систолическое давление в легочной артерии составляло 55 мм рт.ст.), III функциональный класс по NYHA, в анамнезе кардиохирургическое вмешательство), в связи с отказом пациентки от повторного вмешательства на открытом сердце в условиях искусственного кровообращения и от пожизненного приема АКТ, на данный момент было принято решение о плановом проведении транскатетерного эндоваскулярного протезирования МК (протез в протез) с применением эндоваскулярных конструкций, используемых для протезирования аортального клапана.
В качестве медикаментозного лечения рекомендован прием: ацетилсалициловой кислоты 75 мг, пантопразола 20 мг 1 раз/сут., торасемида 5 мг утром, метопролола сукцината 12,5 мг утром, ивабрадина 5 мг 2 раза/сут., спиронолактона 25 мг обед, пероральных препаратов железа.
В марте 2020г пациентка госпитализирована в стационар в плановом порядке с целью хирургического лечения.
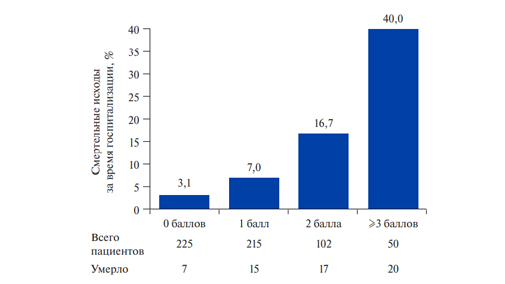
В условиях рентгеноперационной 12 марта 2020г выполнена эндоваскулярная имплантация транскатетерного клапана Edwards SAPIEN XT 26 мм в митральную позицию (протез в протез) трансфеморальным доступом справа. Ход операции: правым яремным доступом установлен электрод временного электрокардиостимулятора в правый желудочек. В условиях искусственной вентиляции легких с применением внутривенной анестезии обеспечен пункционный доступ (общая бедренная вена). Выполнена транссептальная пункция, через левое предсердие и протез митральной позиции установлен первый сверхжесткий проводник, в левом предсердии установлен второй проводник, по проводнику установлен баллонный катетер диаметром 10 мм, затем 16 мм, выполнена предилатация МПП. С техническими сложностями выполнялись попытки прохождения провод-
ником через МПП (по причине регидности МПП) и БП в митральной позиции, установлен интродьюсер в общую бедренную вену 18F, в условиях сверхчастой стимуляции (180 в мин) проведено позиционирование баллон-расширяемого транскатетерного клапана Edwards SAPIEN XT размером 26 мм в позицию БП в митральной позиции объемом жидкости в шприце высокого давления 24 мл (рис. 1, 2).
При контрольной ЭхоКГ 12.03.2020г после операции — положение клапана правильное, нарушения атриовентрикулярной проводимости и компрометации параклапанных структур нет; уменьшился пиковый и средний градиент, степень регургитации и скорость потока на МК (табл. 1). Перед выпиской по данным мультиспиральной компьютерной томографии от 17 марта 2020г: состояние после транскатеторной имплантации МК (протез в протез), в проекции МК установлен протез, диаметр до 24 мм, высота ~19,5 мм. Определяется дефект МПП шириной до 4,5 мм.
Пациентка была выписана в стабильном состоянии, жалоб не предъявляла, рекомендован прием препаратов: торасемид 10 мг, варфарин 2,5 таблетки (6,25 мг) под контролем международного нормализованного отношения (целевые значения 2,5-3,5) в течение 3 мес., спиронолактон 25 мг утро, обед, ивабрадин 5 мг 2 раза/сут. Регулярно наблюдалась в поликлинике кардиодиспансера.
Обратилась вновь к специалистам кардиоцентра через 29 мес. после вмешательства (в августе 2022г) с жалобами на снижение ТФН, возникновение тяжести в прекардиальной области, одышки при ФН (NYHA III).
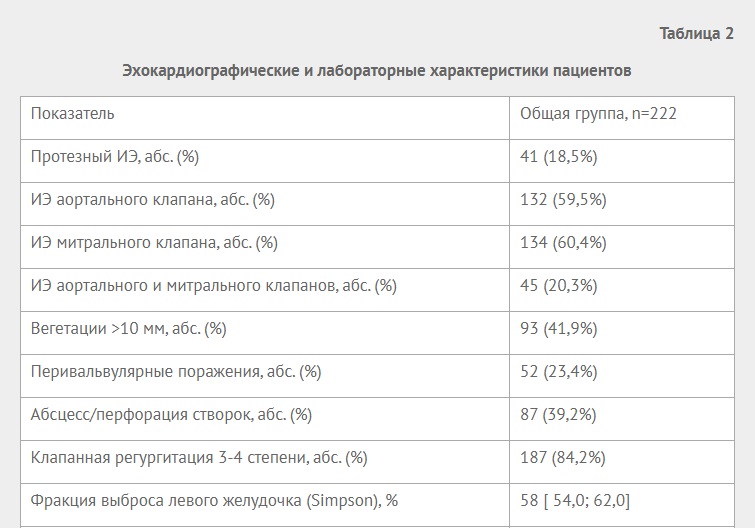
При дообследовании в общем анализе крови уровень гемоглобина составил 92 г/л, ферритина — 78 мкг/л, уровень железа в крови — 7,8 мкмоль/л. По данным ЭхоКГ — функция протеза удовлетворительная, транспротезная регургитация 0-I степени, Vmax 214 см/сек, Vср 163 см/сек, Рmax 18 мм рт.ст., Рср 11 мм рт.ст. на МК, ударный объем левого желудочка (ЛЖ) 44 мл, фракция выброса ЛЖ 67%, конечно-диастолический объем ЛЖ 66 мл, конечно-систолический объем ЛЖ 22 мл, сброс в правое предсердие через дефект МПП 0,15 см (рис. 3). Выполнена чреспищеводная ЭхоКГ от 01 ноября 2022г — данных за дегенеративные изменения протеза нет. Таким образом, по данным ЭхоКГ можно предполагать развитие у пациентки протезно-пациентного несоответствия без структурных изменений на биопротезе.
Выполнена биоимпедансометрия: вес 79 кг, рост 168 см, содержание жира в организме выше нормы — 36% (N<32%), процент содержания воды в организме 41% — ниже нормы (N 45-60%), мышечная масса 43,9% — норма, физическое развитие 2 — свидетельствует об ожирении; костная масса 2,3 кг — норма, уровень содержания висцерального жира в организме 8 — норма.
Известно, что пациентка с декабря 2021г начала прием комбинированных оральных контрацептивов по рекомендации гинеколога в связи с обильными mensis, что сопровождалось снижением гемоглобина до 87 г/л. Сама пациентка связывает ухудшение состояния с приемом гормональных препаратов, поскольку при их отмене отметила положительную динамику (самостоятельно отменила прием комбинированных оральных контрацептивов в апреле 2022г).
После проведенного консилиума, учитывая удовлетворительную функцию протеза, рекомендовано снижение веса пациентки, компенсацию имеющейся анемии и последующее динамическое наблюдение. При выписке из стационара гемоглобин в динамике повысился и сохранялся на уровне 115 г/л на фоне приема препаратов железа (железа (III) гидроксид полимальтозат 100 мг 2 раза/сут.) в течение 10 дней.
Выписалась из стационара с клиническим диагнозом:
Приобретенный порок сердца. Протезирование МК БП «Кемкор» от 2000г. Дисфункция протеза МК, недостаточность (выраженная транспротезная регургитация III-IV степени). Транскатетераная эндоваскулярная имплантация «Edwards SAPIEN XT 26 мм» в митральную позицию (протез в протез) от 2020г. Дефект МПП. Недостаточность трикуспидального клапана I степени. Желудочковая экстрасистолия III градации по Лауну. Хроническая СН IIА стадии. Легочная гипертензия. Функциональный класс II.
Сопутствующие заболевания: аутоиммунный тиреоидит, эутиреоз. Хронический гастрит, ремиссия. Хроническая железодефицитная анемия легкой степени тяжести.
Даны рекомендации по приему лекарственных средств: ацетилсалициловая кислота 75 мг утром, бисопролол 5 мг утром, рамиприл 2,5 мг вечером, спиронолактон 25 мг утром, торасемид 2,5 мг утром. Рекомендована компенсация железодефицитной анемии курсовым приемом препаратов железа (железа (III) гидроксид полимальтозат 100 мг 2 раза/сут.) в течение 2-3 мес., контроль общего анализа крови, уровня железа и ферритина в динамике через 1 мес., консультация гинеколога, снижение веса, проведение ежегодного контроля трансторакальной ЭхоКГ, наблюдение кардиолога по месту жительства.
Таблица 1
Показатели трансторакальной ЭхоКГ в динамике с 2013 по 2022гг
|
Параметры по данным ЭхоКГ |
06.2013 |
07.2014 |
09.2015 |
12.2016 |
2017 |
2018 |
05.2019 |
09.2019 |
03.2020 |
03.2020 после операции |
03.2020 перед выпиской |
10.2021 |
08.2022 |
11.2022 |
|
Транспро-тезная регургитация (степень) |
II |
II |
II |
II |
II |
I-II |
II-III |
III-IV |
III (по ЧП ЭхоКГ III-IV) |
0-I |
I |
0-I |
I |
I |
|
So МК (см2) |
2,3 |
3 |
– |
2,7 |
2,5 |
2,3 |
2,6 |
2,7 |
1,8 |
1,6 |
1,75 |
1,65 |
1,7 |
1,5 |
|
Vср (см/сек) |
114 |
120 |
128 |
131 |
136 |
146 |
134 |
165 |
124 |
108 |
152 |
122 |
176 |
163 |
|
Vmax |
165 |
180 |
– |
210 |
– |
229 |
192 |
– |
244 |
161 |
194 |
207 |
222 |
214 |
|
Pmax |
11 |
13 |
– |
18 |
– |
21 |
15 |
– |
24 |
10,4 |
15 |
17 |
20 |
18 |
|
Pср |
6 |
6,2 |
7 |
8 |
8 |
9 |
8 |
12 |
8 |
5,2 |
10 |
7 |
13 |
11 |
|
ФВ ЛЖ (?) |
70 |
72 |
72 |
78 |
75 |
72 |
74 |
79 |
85 |
64 |
66 |
69 |
71 |
67 |
|
ЛП (см) |
3,6 |
3,6 |
3,8 |
3,6 |
3,9 |
3,7 |
3,8 |
4,3 |
4,5 |
– |
4 |
4,2 |
4,1 |
4,1 |
|
КДО ЛЖ (мл) |
108 |
88 |
97 |
135 |
108 |
113 |
102 |
130 |
124 |
88 |
88 |
124 |
102 |
66 |
|
КСО ЛЖ (мл) |
32 |
25 |
27 |
30 |
27 |
35 |
27 |
27 |
18 |
32 |
30 |
38 |
30 |
22 |
|
УО ЛЖ (мл) |
76 |
63 |
70 |
105 |
81 |
81 |
75 |
103 |
106 |
56 |
58 |
86 |
72 |
44 |
|
ВОПЖ прокс. (см) |
2,2 |
2,4 |
2 |
2,2 |
2,1 |
1,9 |
1,6 |
2,2 |
2 |
– |
– |
1,5 |
2,5 |
2,9 |
|
ПП (4АС) см?см |
4,2?4,2 |
3,6?4,1 |
4,2?4,9 |
4,1?4,5 |
4,4?4,5 |
3,7?4,4 |
4,2?4,3 |
4,1?4,3 |
3,9?5 |
– |
4,3?4,6 |
4,7?4,8 |
4,2?5,0 |
4,3?5,3 |
|
ДЛАсист |
25 |
28 |
22 |
30 |
28 |
28 |
55 |
60 |
20 |
45 |
34 |
38 |
41 |
|
|
ДЛАср |
12 |
15 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
23 |
26 |
26 |
|
Степень регургитации на ТК |
– |
– |
– |
– |
– |
I |
– |
II-III |
I |
0-I |
– |
I |
I |
I |
Сокращения: ВОПЖ прокс. — проксимальный размер выходного отдела правого желудочка, ДЛАсист/ср — систолическое/среднее давление в легочной артерии, КДО — конечно-диастолический объем, КСО — конечно-систолический объем, ЛЖ — левый желудочек, ЛП — левое предсердие, МК — митральный клапан, ПП — размер правого предсердия, ТК — трикуспидальный клапан, УО — ударный объем, ЧП ЭхоКГ — чреспищеводная эхокардиография, ФВ — фракция выброса, ЭхоКГ — эхокардиография, So — площадь открытия, Vcр — средняя скорость кровотока на митральном клапане, Vmax — максимальная скорость кровотока на митральном клапане, Pmax — максимальный трансмитральный градиент, Pср — средний трансмитральный градиент.

Рис. 1. Транскатетераная эндоваскулярная имплантация «Edwards SAPIEN XT 26 мм» в митральную позицию (протез в протез) 2020г. Полное раздувание баллоном имплантированного протеза в позиции МК.
Примечание: 1 — расправленный каркас протеза, 2 — электрод электрокардиостимулятора в правом желудочке, 3 — доставочная система.

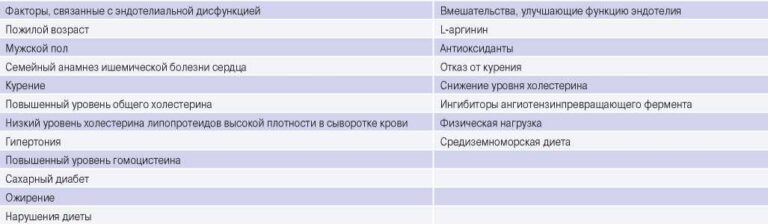
Рис. 2. Компетентная работа имплантированного транскатетерного клапана Edwards SAPIEN XT 26 мм в позицию МК по методике протез в протез.

Рис. 3. Скоростные показатели и градиент давления на МК (ноябрь 2022г).
Обсуждение
Существуют данные о том, что риск дисфункций БП коррелирует с возрастом и чаще развивается у молодых пациентов. В исследовании Астапова Д. А. и др. [13] установлено, что имплантация БП в более раннем возрасте ассоциируется с большей вероятностью неблагоприятного исхода пациента при динамическом наблюдении. По-видимому, репродуктивный возраст женщин является одним из небольшого количества исключений, используемых как аргумент для имплантации БП у лиц молодого возраста. Период нормального функционирования БП клапанов сердца в пределах 8-15 лет, однако существуют наблюдения и более длительного периода отсутствия дисфункции БП [14-16].
Описан случай репротезирования МК с использованием БП мужчине молодого возраста по данным публикации Кондюковой Н. В. и др. от 2015г [17], где в возрасте 33 лет на фоне ИЭ у пациента развилась гемодинамически значимая митральная регургитация (IV степени), был имплантирован ксеноаортальный БП «КемКор-32». На тот момент выбор протеза был обусловлен наличием синусового ритма, имеющейся возможностью отказа от пожизненного применения антикоагулянтов, предполагаемой резистентностью протеза к кальциевой дегенерации. Однако после проведенного оперативного вмешательства в связи с удовлетворительным самочувствием и низкой комплаентностью, со слов пациента, он в течение 11 лет не обращался в кардиохирургическую клинику для проверки функции БП. Спустя 11 лет в связи с нарастанием клиники СН пациент обратился в клинику, выявлена дисфункция БП, выполнено репротезирование МК с имплантацией БП «Юнилайн-28» с использованием методики имплантации valve-in-valve. В данном случае протезообусловленных осложнений не произошло благодаря принятому решению о выборе типа имплантируемого клапана, поскольку БП не требует пожизненного применения антикоагулянтов и контроля эффективности медикаментозной гипокоагуляции. Необходим персонифицированный подход к выбору имплантируемого протеза, учитывая и комплаентность пациента, поскольку это влияет на отдаленный прогноз, качество жизни больных и на сокращение риска протезообусловленных осложнений.
В случае нашей пациентки при выявлении дисфункции БП в 2019г с целью определения дальнейшей тактики была рассчитана шкала EuroScore II, учитывая наличие на момент осмотра легочной гипертензии (систолическое давление в легочной артерии 55 мм рт.ст.), кардиохирургическое вмешательство в анамнезе, III функциональный класс по NYHA, и возраст пациентки — 43 года, риск по EuroScore II составил 5,6%, а также в связи с отказом пациентки от «открытой» хирургии и от пожизненного приема варфарина при постановке механического клапана, было принято решение о плановом проведении транскатетерного эндоваскулярного протезирования МК (протез в протез) с применением эндоваскулярных конструкций, используемых для протезирования аортального клапана.
Малотравматичная техника репротезирования имеет ряд преимуществ перед традиционным повторным хирургическим вмешательством за счет сохранения целостности фиброзных колец. В пользу предпочтительного использования БП явился длительный период функционирования предыдущего клапана (19 лет). При выборе типа протеза также необходимо учитывать мнение потенциального реципиента при условии полной его информированности о возможных рисках использования того или иного клапанного заменителя.
Говоря о частоте повторных операций на протезированных клапанах по результату исследования Chiang YP, et al. [18], пациенты с БП чаще подвергаются реимплантации в связи с дисфункцией протеза по сравнению с механическими клапанами. Продемонстрировано, что 15-летняя совокупная частота повторных операций в группе больных с БП значимо превышает количество реопераций в группе механических протезов (12,1% vs 6,9%, соответственно). Однако для пациентов с БП характерна более низкая вероятность развития кровотечений (6,6%) по сравнению с пациентами с механическими протезами (13%) [19].
В настоящее время изучается влияние дислипидемии на темпы прогрессирования кальцификации, дегенеративных изменений БП клапанов [20-23]. Так, в работе Farivar RS, et al. [20] пациенты, у которых развивалась кальций-ассоциированная дисфункция ксеноклапанов, характеризовались повышенным уровнем холестерина в сыворотке крови. Работа Mahjoub H, et al. [22] установила в качестве независимого фактора риска дегенеративных изменений БП увеличение соотношения АпоВ/АпоA-I, который отражает качественный состав проантиатерогенных частиц липопротеинов. Таким образом, наблюдаются сложные, взаимо-опосредуемые, многофакторные механизмы взаимодействия между протезом и реципиентом, которые оказывают влияние на функцию БП. Изменение конституциональных особенностей пациента также может сказываться на структурных изменениях протеза и способствовать прогрессированию дисфункции протеза.
В случае молодого репродуктивного возраста пациентки с приобретенным пороком МК, требующего хирургической коррекции, предпочтение отдается БП клапанов сердца в связи с их низкой тромбогенностью и отсутствием необходимости длительного приема АКТ. В свою очередь, риски, связанные с необходимостью приема АКТ, отражаются в виде геморрагических осложнений и возможного возникновения эмбриопатии во время беременности [24]. В связи с этим, несмотря на ограниченность сроков функционирования и необходимость проведения повторных операций в будущем, многие специалисты склоняются к имплантации клапанных БП женщинам детородного возраста [24]. Выбор БП для нашей пациентки позволил ей выносить и родить двух здоровых детей. Кроме того, обращает на себя внимание уникальный по времени период благополучного функционирования БП — 19 лет.
Причины дисфункции протезов включают анатомические и функциональные, в настоящее время активно обсуждается роль ожирения и дислипидемии в формировании дисфункции. В исследовании Kim S, et al. было показано, что увеличение ИМТ на одну единицу сопровождается увеличением риска развития хронической СН у мужчин и женщин на 5% и 7%, соответственно [25]. Само ожирение, и, как следствие, увеличение площади тела, может вызвать появления протезно-пациентного несоответствия, что ассоциируется со снижением выживаемости после замены МК и легочной гипертензией. Также известно, что жировая ткань продуцирует адипокины с провоспалительным (лептин, интерлейкины и фактор некроза опухолей-?) эффектами, и по мере увеличения ИМТ жировая ткань начинает переходить в метаболически дисфункциональный фенотип. В этом состоянии адипоциты вынуждены производить более высокие концентрации провоспалительных адипокинов, которые способствуют воспалению и повреждению открытых тканей [26]. Метаболические нарушения приводят к таким процессам, как хроническое неспецифическое воспаление и перекисное окисление липидов, в свою очередь и вызывающим кальциевую дегенерацию БП [9].
У нашей пациентки избыточная масса тела возникла еще до имплантации протеза в протез, с увеличением веса в динамике практически в 2 раза с момента первичной коррекции порока. Дополнительное развитие кальцификации протеза и двухкратное увеличение массы тела пациентки создали в совокупности условия, приведшие к структурным изменениям БП и развитию протезно-пациентного несоответствия (тяжелое несоответствие пациент-протез: площадь открытия протеза 1,5/площадь поверхности тела (1,9) =0,78).
Имеющийся длительный анамнез железодефицитной анемии также вносил свой вклад в более низкую ТФН и гемодинамические нарушения. Анемия является еще одной из наиболее распространенных причин, осложняющих течение и приводящих к обострению хронической СН. Есть данные о том, что анемия является независимым фактором, ухудшающим качество жизни, увеличивающим риск повторной госпитализации и смертности при хронической СН [27-29]. Известно, что при помощи гемодинамических механизмов происходит компенсация гипоксии тканей, развивающейся в результате анемии. Вследствие низкого гематокрита снижается вязкость крови и уменьшается постнагрузка, при анемии увеличивается венозный возврат (преднагрузка), что приводит к перегрузке сердца объемом, а под действием повышенного тонуса симпатической нервной системы возрастает сократимость миокарда и частота сокращений сердца. В результате возрастания сократимости миокарда и частоты сокращения происходит перегрузка работой. Эти механизмы ведут к формированию гипертрофии миокарда, нарастающей дилатации камер сердца и развитию относительной недостаточности клапанов сердца [30]. Соответственно коррекция дополнительного фактора как анемия у данной пациентки также является ключевым в рамках компенсации явлений хронической СН и улучшения качества жизни.
В настоящее время существуют альтернативные открытой хирургии подходы к коррекции дисфункции БП [12][31]. Транскатетерное эндоваскулярное протезирование применяется у пациентов с высоким хирургическим риском, уже ранее перенесших протезирование МК в условиях искусственного кровообращения и имеющих нарушение функции БП. При таком методе хирургической коррекции применяются транскатетерные клапаны, разработанные для аортальной позиции или специально разработанные клапаны [11][12]. Существующие регистровые наблюдения в большинстве случаев основаны на off-label применении клапанов SAPIEN. Использование серии конструкций SAPIEN, исходно предназначенных для аортальных клапанов, демонстрирует хорошие результаты при их установке по методике протез в протез при вмешательствах на дегенеративно измененном БП в митральной позиции [31].
Ключевым аспектом в успехе транскатетерного вмешательства по методике протез в протез является комплексная оценка морфометрических особенностей клапана, сопутствующей патологии пациента, периоперационного риска при использовании открытого или эндоваскулярного вмешательства, и конечно же, детально спланированный ход транскатетерной процедуры. Таким образом, транскатетерные технологии могут быть серьезной альтернативной открытой хирургии в процессе выполнения повторных вмешательств при дисфункции ранее установленных протезов клапанов в т.ч. митральной локализации.
Уникальность представленного клинического случая заключается в длительном периоде функционирования БП МК у молодой женщины, что улучшило качество жизни пациентки и позволило дважды вынашиванию беременности и успешным родоразрешениям. Очередные роды, в свою очередь, способствовали прогрессированию транспротезной регургитации, что потребовало проведения эндоваскулярной реимплантации клапана «протез-в-протез» спустя 20 лет от первичного протезирования клапана. Сохранение жалоб на одышку при ФН, незначимой регургитации и после проведенного вмешательства с имплантацией протеза в протез не является критерием для повторных вмешательств, однако требует изменения образа жизни, коррекции сопутствующей анемии и снижения массы тела пациентки в связи с развитием «протез-пациент» несоответствия.
Заключение
Таким образом, представленный клинический случай является уникальным и актуальным с точки зрения изучения течения заболевания у пациенток репродуктивного возраста, подвергнутых хирургической коррекции приобретенного порока МК, у которых своевременная диагностика, коррекция терапии и хирургическое вмешательство способствуют улучшению качества жизни. Использование БП клапанов сердца у данной когорты пациенток обусловлено в основном отсутствием необходимости приема АКТ, что улучшает прогноз вынашивания ребенка и родов. В результате выполненной хирургической коррекции митрального порока инфекционного генеза с установкой БП у пациентки в возрасте 23 года только спустя 19 лет от первичного вмешательства произошла значимая дисфункция протеза, требующая реимплантации клапана «протез-в-протез», что позволило за это время пациентке на фоне удовлетворительного состояния перенести двое родов. Сохранение незначимой регургитации и после проведенного эндоваскулярного вмешательства с имплантацией протеза в протез обусловлено протезно-пациентным несоответствием на фоне увеличения массы тела пациентки практически в 2 раза в динамике с момента первичной имплантации БП и наличием железодефицитной анемии, что требует изменения образа жизни, снижения массы тела пациентки и тщательного динамического наблюдения с коррекцией анемии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Дрень Е.В., Ляпина И.Н., Ганюков В.И., Иванова А.В., Стасев А.Н., Барбараш О.Л., Барбараш Л.С. Особенности длительного ведения пациентки репродуктивного возраста после хирургической коррекции митрального клапана на фоне инфекционного эндокардита. Российский кардиологический журнал. 2023;28(2S):5376. https://doi.org/10.15829/1560-4071-2023-5376
Скопировать