Место электрокардиографии в диагностике кардиомиопатий и спортивного сердца
Электрокардиография (ЭКГ) остается самым доступным и хорошо воспроизводимым методом исследования сердца. Длительное время при заболеваниях миокарда неишемического генеза изменения на ЭКГ определяли как неспецифические. Исследования последних лет с применением современных технологий, таких как магнитно-резонансная томография (МРТ) и генетический анализ, позволили значительно продвинуться в понимании патологических процессов в миокарде и выделить специфические изменения на ЭКГ для некоторых из них. Привычные для ишемической болезни сердца или артериальной гипертензии (АГ) “рубцовые” и “ишемические” изменения на ЭКГ при кардиомиопатиях имеют другое происхождение и появляются вследствие нарушений микроциркуляции, интерстициального фиброза, беспорядочного расположения кардиомиоци- тов или их фиброзно-жирового замещения, а также асимметричной гипертрофии, меняющей направленность оси QRS. Правильная интерпретация изменений на ЭКГ зачастую позволяет своевременно предположить истинный генез заболевания в рамках конкретного структурного фенотипа и задать правильный вектор для его подтверждения. В ряде случаев изменения на ЭКГ являются единственным фенотипическим проявлением наследственной болезни сердца [1], что делает метод незаменимым при семейном скрининге.
У атлетов, чаще динамических видов спорта (велоспорт, футбол, бег), длительные интенсивные физические нагрузки приводят к структурным и электрическим адаптационным изменениям, которые принято называть “спортивным сердцем” [2]. Эти изменения в большинстве случаев доброкачественные, но иногда могут совпадать с признаками кардио- миопатий, являющихся ведущей причиной внезапной сердечной смерти (ВСС) молодых спортсменов [3]. Правильная интерпретация ЭКГ у лиц, активно занимающихся спортом, с одной стороны, может помочь “не пропустить” фатальное заболевание, а с другой — избежать неоправданной дисквалификации [3][4].
Аритмогенная кардиомиопатия
Аритмогенная кардиомиопатия (АКМ), ранее определявшаяся как аритмогенная дисплазия только правого желудочка (ПЖ), является генетическим заболеванием миокарда ПЖ и/или левого (ЛЖ) желудочков, отличительный фенотипический признак которого — образование миокардиальных рубцов в виде фиброзного или фиброзно-жирового замещения кардиомиоцитов, которые служат субстратом для глобальной и/или локальной дисфункции миокарда и предрасполагают к фатальным желудочковым аритмиям [5]. Диагноз АКМ — собирательный и ставится по совокупности морфофункциональных и структурных изменений миокарда, выявленных при эхокардиографии (ЭхоКГ), МРТ, биопсии, ЭКГ покоя и суточного мониторирования ЭКГ, а также с учетом семейного и генетического анализа.
На ЭКГ при АКМ выделяют критерии, специфичные для преимущественного вовлечения ПЖ или ЛЖ, которые подразделяют на большие и малые [5]. Так, инверсии зубца Т в правых грудных отведениях (V1-V3) у взрослых людей при отсутствии полной блокады правой ножки пучка Гиса (ПНПГ) являются большим критерием ПЖ-варианта АКМ. Распространение инверсий зубца Т до V4-V6 свидетельствует о значительной дилатации и дисфункции ПЖ (рис. 1). В случае наличия полной блокады ПНПГ такие инверсии становятся менее специфичными и относятся к малым критериям ПЖ-варианта АКМ. Также всегда следует исключать заболевания, которые могут быть похожи на АКМ, такие как смещение сердца вследствие перикардиотомии или деформации грудной клетки, перегрузка ПЖ объемом или давлением, саркоидоз сердца и миокардит [6].

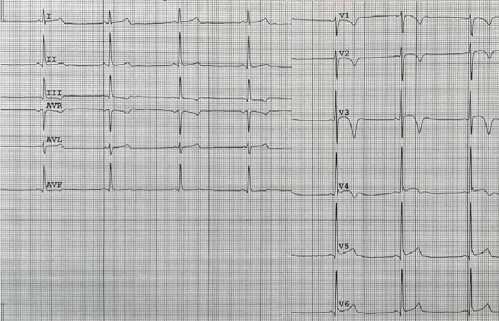
Рис. 1. Больная 42 лет с бивентрикулярной АКМ, с преимущественным вовлечением ЛЖ. А. ЭКГ: низкий вольтаж QRS в стандартных и инверсии зубца Т в V1-V6 отведениях; частая желудочковая экстрасистолия с конфигурацией полной блокады ЛНПГ и верхней осью. Б. МРТ: расширение обоих желудочков, НМ ЛЖ.
Эпсилон-волна, ранее относившаяся к большим критериям АКМ, представляет собой воспроизводимый низкоамплитудный сигнал между окончанием комплекса QRS и началом зубца Т. За последние десять лет диагностическая ценность этого критерия была поставлена под сомнение из-за высокой вариабельности в его идентификации и интерпретации [7], и в обновленных критериях Падуа 2020г [5] эпсилон- волна отнесена к малому критерию ПЖ-варианта АКМ, так же как удлинение времени активации выводного отдела ПЖ (TAD, terminal activation delay) >55 мсек, представляющее собой интервал от пика зубца S до окончания QRS, включая R’ в V1-V3 при отсутствии полной блокады ПНПГ.
Низкий вольтаж QRS в стандартных отведениях (<5 мм) может свидетельствовать о вовлеченности ЛЖ при АКМ (рис. 1). Чувствительность этого критерия низкая (не более 30%), поэтому он считается малым для ЛЖ-варианта АКМ при отсутствии ожирения, эмфиземы или перикардиального выпота [5]. Также к малым критериям ЛЖ-варианта АКМ отнесены инверсии зубца Т изолированно в боковых отведениях при отсутствии полной блокады левой ножки пучка Гиса (ЛНПГ) [5]. Изолированный ЛЖ- вариант АКМ фенотипически не отличим от дилатационной кардиомиопатии (ДКМП) и зачастую подтверждается только генетическим анализом, выявляющим мутации в типичных для АКМ генах межклеточных контактов (десмосом).
Регистрация поздних потенциалов с помощью сигнал-усредненной ЭКГ не нашла широкого применения в практике и более не используется для диагностики АКМ.
Желудочковая аритмия с конфигурацией полной блокады ЛНПГ и нижней осью, что указывает на ее происхождение из выводного отдела ПЖ, является малым критерием, а без нижней оси (из других отделов ПЖ) — большим критерием ПЖ-варианта АКМ [5] (рис. 1). Желудочковая аритмия с конфигурацией полной блокады ПНПГ является малым критерием ЛЖ-варианта АКМ [5].
Сходные с АКМ изменения миокарда, такие как значительное расширение ПЖ, пограничное снижение фракции выброса (ФВ) ПЖ и желудочковые аритмии, могут быть индуцированы регулярными физическими нагрузками у здоровых лиц [8][9]. К физиологическим изменениям ПЖ на ЭКГ относят вольтажные критерии гипертрофии ПЖ, изолированную полную блокаду ПНПГ и отклонение электрической оси вправо. Высокочувствительная в отношении АКМ инверсия зубца Т в правых грудных отведениях теряет свою специфичность в популяции спортсменов динамических видов спорта из-за достаточно большой распространенности (до 4% в отведениях V1-V3 и до 10% только в V1-V2) [2]. По нашим неопубликованным данным на основании анализа 619 ЭКГ спортсменов динамических видов спорта, инверсии зубца Т в V1-V3 без каких-либо значимых структурных изменений сердца встречаются в 1,9% случаев (рис. 2). Тем не менее, на сегодняшний день у белых спортсменов любые инверсии зубца Т в двух смежных отведениях, в т.ч. в V1-V3, расцениваются как патологические и требуют углубленного обследования и последующего наблюдения. У чернокожих спортсменов такие инверсии, в особенности, с элевацией сегмента ST с точкой J >1 мм, переведены в ранг доброкачественных [10]. Помимо инверсий зубца Т, заподозрить АКМ у спортсменов можно при регистрации желудочковых нарушений ритма и эпсилон- волн.

Рис. 2. А. Спортсмен 24 лет, пятиборье, бессимптомный, ЭхоКГ, МРТ сердца, суточное мониторирование ЭКГ патологии не выявили. ЭКГ: инверсии зубца Т в V1-V3 с предшествующей >1 мм элевацией ST в точке J. Б. Спортсменка 35 лет, велоспорт, бессимптомная, без структурной патологии сердца. ЭКГ: инверсии зубца Т в V1-V3, изолированное увеличение вольтажа QRS.
Гипертрофия ЛЖ
Гипертрофическая кардиомиопатия (ГКМП) — самая частая наследственная патология сердца. У 60% больных ГКМП обусловлена мутациями в генах саркомера, комплексе сократительных белков кардиомиоцитов. У 5-10% под маской (фенокопии) ГКМП скрываются более редкие болезни накопления (Фабри, Данон, РККЛ02-кардиомиопатия), инфильтративные (амилоидоз, саркоидоз), митохондриальные, нейромышечные заболевания (атаксия Фридрейха), мальформации (синдром Нунан), эндокринные кардиомиопатии. У оставшихся 30% больных причину ГКМП выяснить пока не удается [11]. В отличие от АКМ, критерии диагноза ГКМП только морфологические: утолщение миокарда ЛЖ у взрослых >15 мм (>13 мм при наличии родственника с ГКМП), которое не может быть объяснено другими состояниями, приводящими к перегрузке ЛЖ (АГ, аортальный стеноз) [12].
Изменения на ЭКГ, в основном, инверсии зубца Т или глубокие узкие (“кинжальные”) зубцы Q с положительным зубцом Т в нижних и боковых отведениях, регистрируются более чем у 90% больных с саркомерной ГКМП [13]. “Гигантские” (>10 мм) симметричные зубцы Т, присутствующие обычно диффузно во всех грудных отведениях, указывают на выраженную гипертрофию верхушечных сегментов ЛЖ [14] (рис. 3). Псевдоинфарктные комплексы QS в грудных отведениях и полные блокады НПГ встречаются при ГКМП нечасто и в основном после хирургической редукции межжелудочковой перегородки или при выраженном трансмуральном фиброзе на поздних стадиях заболевания [13]. Такие изменения более характерны для инфильтративных заболеваний [15][16] (рис. 4).

Рис. 3. Больной 34 лет с верхушечной формой семейной ГКМП. А. ЭКГ: “гигантские” инверсии зубца Т в V2-V6, вольтажные признаки гипертрофии ЛЖ. Б. ЭхоКГ: гипертрофия верхушечных сегментов ЛЖ с формой полости ЛЖ в виде “туз пик”.

Рис. 4. Больная 64 лет с семейным транстиретиновым амилоидозом сердца. А. ЭКГ: вольтаж QRS низкий в стандартных и “нормальный”, не соответствующий выраженности гипертрофии на ЭхоКГ, в грудных отведениях; регресс R в V1-V4. Б. ЭхоКГ: выраженная гипертрофия миокарда ЛЖ, расширение предсердий. В. Допплер-ЭхоКГ: рестриктивный тип диастолической дисфункции ЛЖ.
Сочетание выраженной гипертрофии ЛЖ по данным визуальных методов исследования с нарушениями проводимости на ЭКГ всегда подозрительно в отношении фенокопий ГКМП. Так, укороченный интервал PQ должен наводить на мысль о болезнях накопления [17] или митохондриальные заболевания [1], а замедление AV-проведения позволяет думать об амилоидозе [15], саркоидозе [16] или более поздних стадиях болезней накопления и митохондриальных заболеваний [1][13][17].
У многих больных с ГКМП на ЭКГ регистрируются вольтажные критерии гипертрофии ЛЖ и только у 2% они не сопровождаются нарушениями реполяризации [18]. Если вольтаж выражен чрезмерно, то стоит заподозрить болезнь накопления [13]. Если же, напротив, вольтаж QRS снижен или “нормальный” при выраженной гипертрофии на ЭхоКГ (электромеханическое несоответствие), то следует заподозрить амилоидоз [15] (рис. 4).
У каждого 8-го больного с ГКМП регистрируется удлинение интервала QTс >480 мсек, а у каждого 2-го >450 мсек, что ассоциируется с риском ВСС и служит дополнительным аргументом для имплантации кардиовертера-дефибриллятора [13][19].
Около 5-10% больных с фенотипом ГКМП имеют либо нормальную ЭКГ, либо изолированное увеличение вольтажа QRS. У таких больных болезнь дебютирует позже, симптомы выражены меньше и прогноз лучше [13][20].
У спортсменов физиологическая гипертрофия не превышает 14 мм у мужчин [21] и 12 мм у женщин [22], тем не менее она всегда подозрительна в отношении дебюта ГКМП. Одним из самых характерных ЭКГ-признаков “спортивного сердца” является выраженное увеличение вольтажа QRS, которое часто ошибочно описывают как “гипертрофию ЛЖ”. В отличие от патологической гипертрофии на ЭКГ спортсменов нет сопутствующих нарушений реполяризации, поэтому умеренное утолщение стенок ЛЖ на ЭхоКГ в сочетании с изолированным увеличением вольтажа QRS свидетельствуют о физиологическом ремоделировании миокарда, а нарушения реполяризации в виде инверсий зубца Т >1 мм более чем в 2 смежных нижних (II и aVF) и, особенно, боковых (I, aVL, V5 или V6) отведениях указывают на возможную ГКМП [4].
Инверсии зубца Т в нижних и боковых отведениях регистрируются на ЭКГ спортсменов и в отсутствии структурных изменений сердца. Изолированные инверсии зубца Т в нижних отведениях встречаются у 2% белых и у 6% чернокожих здоровых спортсменов [13], что по частоте встречаемости значительно превышает наследственные заболевания сердца. По нашим неопубликованным данным на основании анализа 1435 ЭКГ спортсменов различных видов спорта, изолированные инверсии зубца Т в нижних отведениях встречаются в 1% случаев. Инверсии зубца Т в боковых отведениях считаются наиболее неблагоприятными, т.к. могут быть первым признаком кардиомиопатии [23]. К изменениям, подозрительным в отношении ГКМП у спортсменов, также относят: патологические зубцы Q (>0,25 от последующего зубца R или >40 мсек по ширине), депрессии сегмента ST >0,5 мм в >2 смежных отведениях, полную блокаду ЛНПГ, неспецифическое расширение QRS >140 мсек и частую желудочковую экстрасистолию [4].
Систолическая дисфункция ЛЖ
ДКМП — синдром, характеризующийся систолической дисфункцией и дилатацией ЛЖ, которые не могут быть объяснены ишемической болезнью сердца или состояниями, приводящими к перегрузке ЛЖ (АГ, клапанная и врожденная патология сердца). Систолическая дисфункция ЛЖ (ФВ <45%) без расширения его полости с 2016г классифицируется как “гипокинетическая недилатационная кардиомиопатия” [24].
ДКМП является самой этиологически гетерогенной кардиомиопатией. Около 40% случаев ДКМП относятся к наследственным вариантам [25], которые могут проявляться изолированным поражением сердца, в сочетании с нарушениями проводимости и некомпактным миокардом (НМ) или в рамках системных мышечных заболеваний. Среди последних наиболее часто фенотип ДКМП встречается при дистрофинопатиях (Дюшена и Бекера), поясно-конечностных мышечных дистрофиях (ПКМД) и прогрессирующей мышечной дистрофии Эмери-Дрейфуса (МДЭД) [26]. Наследственные ДКМП возникают по причине мутаций в генах саркомера (титин), цитоскелета (дистрофин, десмин), клеточных мембран (ламин, ионные каналы) и органелл [25]. Приобретенные формы ДКМП развиваются вследствие инфекций, аутоиммунных заболеваний, токсического (алкоголь, кокаин) или лекарственного (химиотерапия) поражения миокарда, дефицита микроэлементов, эндокринно-метаболических заболеваний и беременности [24]. Отдельно выделяют тахи-индуцированную кардиомиопатию — потенциально обратимое снижение систолической функции ЛЖ, развивающееся на фоне постоянной предсердной или желудочковой тахиаритмии [27]. Имеются данные, что больные с ненаследственными формами ДКМП имеют также генетический субстрат болезни [25][28][29][30].
Изменения на ЭКГ выявляются более чем у 80% больных с ДКМП [31]. Самым частым, но неспецифичным отклонением является полная блокада ЛНПГ, которая иногда предшествует структурным изменениям сердца. Следует отличать истинную полную блокаду ЛНПГ от сочетания гипертрофии ЛЖ с блокадой передней ветви ЛНПГ. При полной блокаде ЛНПГ QRS >140 мсек (130 мсек для женщин), имеется зазубрина в средней части QRS как минимум в двух из следующих отведений: V1, V2, V5, V6, I, aVL. Такая морфология ассоциирована с лучшими результатами ресинхронизирующей терапии [32]. Полная блокада ПНПГ при ДКМП встречается нечасто и, как правило, ассоциируется с мутациями в гене дистрофина [31].
Некоторые формы ДКМП имеют специфические отклонения на ЭКГ. Так, снижение вольтажа зубца Р или синдром слабости синусового узла с “выключенным” предсердием (atrial standstill) характерны для МДЭД [24], а синусовая брадикардия с эпизодами остановки синусового узла — для ламинопатий [31]. AV-блокады ассоциированы с мутациями в генах ламина и Na-канала, МДЭД, десминопатиями и миотонической дистрофией [24][26][31], а из приобретенных форм ДКМП характерны для саркоидоза, болезни Чагаса, клещевого боррелиоза (болезни Лайма) и дифтерии [24][31][33]. Также при болезни Чагаса часто регистрируется полная блокада ПНПГ с блокадой передней ветви ЛНПГ [34].
“Рубцовые” изменения в нижних, задних и боковых отведениях характерны для дистрофинопатий, ПКМД и саркоидоза [1][24]. У носителей мутаций в гене дистрофина также может регистрироваться высокий вольтаж зубца R в V1-V2 вследствие трансмуральных рубцов в заднебоковой стенке ЛЖ [31].
Вольтажные признаки гипертрофии ЛЖ при фенотипе ДКМП подозрительны в отношении декомпенсированного гипертонического сердца или конечной стадии ГКМП [35]. У значительной доли больных с ДКМП регистрируются инверсии зубца Т, которые, в отличие от ГКМП, менее глубокие, не связаны с вольтажными критериями гипертрофии ЛЖ и не являются специфичными [31]. Тем не менее, сочетание инверсий зубца Т изолированно в левых или во всех грудных отведениях с низким вольтажом QRS в стандартных отведениях подозрительно в отношении изолированного ЛЖ-варианта или бивентрикулярной АКМ [24][31][35]. Интервал QT при ДКМП, как правило, не изменяется, за исключением его укорочения при первичном дефиците карнитина [36] или удлинения при токсическом действии антрациклина [31]. Как и при ГКМП, ~10% больных с фенотипом ДКМП имеют нормальную ЭКГ [35].
У каждого 10-го спортсмена динамических видов спорта развивается значительное расширение ЛЖ со снижением ФВ (<52%), что создает “серую зону” по ДКМП [21]. Такое ремоделирование ЛЖ в сочетании с выраженной брадикардией и/или значительным удлинением интервала PQ (до 400 мсек), которые характерны для “спортивного сердца”, затрудняет дифференциальный диагноз с ДКМП. Наличие у спортсменов нарушений AV-проводимости высоких степеней, полной блокады ЛНПГ, нарушений реполяризации в боковых отведениях, патологических зубцов Q или желудочковых нарушений ритма в сочетании со сниженной ФВ ЛЖ всегда подозрительны в отношении патологической кардиомиопатии [4].
Гипертрабекулярность/НМ ЛЖ
Синдром НМ характеризуется выраженной трабекулярностью ЛЖ с глубокими сообщающимися с полостью ЛЖ межтрабекулярными пространствами, и клинически ассоциирован с сердечной недостаточностью, желудочковыми аритмиями и системными тромбоэмболиями [37]. Благодаря широкому распространению МРТ, морфологические критерии НМ стали выявляться достаточно часто (до 15%) в общей популяции [38], что сделало очевидным необходимость дифференцировать истинный синдром НМ, вызываемый мутациями в генах саркомера, цитоскелета, митохондрий, клеточных мембран и других [39], от доброкачественной гипертрабекулярности ЛЖ. ЭКГ может помочь в этом дифференциальном диагнозе. Так, появление на ЭКГ синдрома ранней реполяризации желудочков переводит гипертрабекулярность ЛЖ в “серую зону” по НМ, а регистрация полной блокады ЛНПГ, патологических зубцов Q или инверсий зубца Т указывает на высокий риск патологического НМ [37].
В популяции спортсменов избыточная трабекулярность достаточно распространена вследствие повышенной преднагрузки на ЛЖ во время физической активности, которая демаскирует трабекулы и делает их более выраженными [40]. Этим же механизмом объясняют значимо большую распространенность НМ среди больных с хронической анемией и беременных [41][42]. Большинство спортсменов с гипертрабекулярностью ЛЖ имеют доброкачественное изолированное увеличение вольтажа QRS или синдром ранней реполяризации желудочков. Тем не менее, у небольшой части (0,9%) регистрируются инверсии зубца Т и снижение систолической функции ЛЖ, что следует трактовать как патологию [43].
Заключение
Высокая вариабельность клинического течения кардиомиопатий затрудняет постановку точного диагноза и стратификацию риска ВСС. Отклонения от нормы на ЭКГ могут помочь предположить происхождение структурных изменений миокарда неишемического генеза и тем самым сократить время до постановки диагноза, выделить больных с особо агрессивными генетическими формами, которым требуется установка имплантируемого кардиовертера-дефи- бриллятора, или своевременно начать специфическую терапию. Среди большого количества бессимптомных здоровых спортсменов ЭКГ позволяет выделять тех, кто требует более тщательного наблюдения в связи с риском развития кардиомиопатии и ВСС. Повышение уровня знаний в области интерпретации ЭКГ при кардиомиопатиях позволит улучшить выявляемость, лечение и прогноз таких больных. Сводные данные по специфическим изменениям на ЭКГ при кардиомиопатиях представлены в таблице 1.
Таблица 1
Специфические признаки кардиомиопатий на ЭКГ покоя
| Фенотип | ЭКГ-изменения | Предположительный диагноз |
|---|---|---|
| Расширение/нарушение сократимости ПЖ | инверсии Т в V1-V3 | большой критерий ПЖ-АКМ |
| инверсии Т в V1-V4(V6) | значительное вовлечение ПЖ | |
| ?-волна в V1-V2 | малый критерий ПЖ-АКМ | |
| TAD >55 мсек в V1-V3 | малый критерий ПЖ-АКМ | |
| ? QRS в стандартных отведениях | бивентрикулярная АКМ | |
| инверсии Т в V4-V6/I, aVL | бивентрикулярная АКМ | |
| Гипертрофия ЛЖ | укорочение PQ | Фабри, Данон, Помпе, PRKAG2, митохондриальные заболевания |
| AV-блокады | амилоидоз, поздняя стадия Фабри, Данон, острый миокардит | |
| ?? вольтажа QRS | Данон, Помпе | |
| ? или “нормальный” вольтаж QRS | амилоидоз | |
| резкое отклонение оси QRS вправо | синдром Нунан | |
| Систолическая дисфункция ЛЖ | ? Р/atrial standstill | МДЭД 1 и 2 тип |
| синусовая брадикардия | ламинопатия | |
| укорочение PQ | DMD | |
| AV-блокады | саркоидоз, ламинопатия, МДЭД, миотоническая дистрофия, десминопатия, болезнь Чагаса, дифтерия, клещевой боррелиоз | |
| Q/QS в нижне-боковых отведениях | DMD, BMD, саркоидоз, ПКМД | |
| ? QRS | ЛЖ-АКМ | |
| полная блокада ПНПГ | DMD, болезнь Чагаса (+ блокада передней ветви ЛНПГ) | |
| инверсии Т в V1-V6 | ЛЖ- или бивентрикулярная АКМ | |
| Гипертрабекулярность ЛЖ | полная блокада ЛНПГ | синдром НМ |
| патологические Q | ||
| инверсии Т |
Сокращения: АКМ — аритмогенная кардиомиопатия, ЛЖ — левый желудочек, ЛНПГ — левая ножка пучка Гиса, МДЭД — мышечная дистрофия Эмери-Дрейфуса, НМ — некомпактный миокард, ПЖ — правый желудочек, ПКМД — поясно-конечностная мышечная дистрофия, ПНПГ — правая ножка пучка Гиса, atrial standstill — “выключенное” предсердие, BMD (Becker muscular dystrophy) — мышечная дистрофия Бекера, DMD (Duchenne muscular dystrophy) — мышечная дистрофия Дюшена, TAD (terminal activation delay) — удлинение времени активации.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Чумакова О.С., Исаева М.Ю., Королева О.С., Затейщиков Д.А. Место электрокардиографии в диагностике кардиомиопатий и спортивного сердца. Российский кардиологический журнал. 2020;25(3S):4023. https://doi.org/10.15829/1560-4071-2020-4023
Скопировать