Влияние представителя пиримидинов — 5-оксиметилурацила на динамику ангиогенных факторов роста в периоперационном периоде хирургической реваскуляризации миокарда (результаты рандомизированного исследования)
Аннотация
Цель. Оценить влияние препарата 5-оксиметилурацил на динамику ангиогенных факторов роста в периоперационном периоде хирургической реваскуляризации миокарда.
Материал и методы. В проспектовое рандомизированное одноцентровое исследование включены две группы пациентов: 25 пациентов основной группы в периоперационном периоде аортокоронарного шунтирования (за 5 дней до и в течение 14 дней после операции) в дополнение к стандартной терапии получали препарат 5-оксиметилурацил (в дозе 500 мг 3 раза/сут.), 25 пациентов контрольной группы — стандартную терапию. Группы были сопоставимые по полу, возрасту, основным клинико-функциональным характеристикам и особенностям хирургического вмешательства. У пациентов методом иммуноферментного анализа исследовали количественные показатели факторов роста ангиогенеза в периферической крови, забранной за 5 дней до и через 14 дней после операции: человеческий васкулоэндотелиальный фактор роста А (VEGF-A), фактор роста гепатоцитов человека (hHGF), инсулин-подобный фактор роста 1 (IGF-1) и человеческий фактор роста фибробластов, основная форма (FGF basic, FGFb).
Результаты. В основной группе пациентов на фоне приема 5-оксиметилурацила наблюдалось статистически значимое увеличение концентрации в периферической крови следующих факторов роста по сравнению с контрольной группой: VEGF-A на 26,90% (р=0,0246), IGF-1 на 44,89% (р=0,0011), FGFb на 60,0% (р=0,0006). Концентрация hHGF также оказалась выше на 19,90%, однако не достигла уровня статистической значимости (р=0,2836).
Заключение. Применение представителя пиримидинов 5-оксиметилурацила в периоперационном периоде хирургической реваскуляризации миокарда приводит к достоверному увеличению в периферической крови таких ангиогенных факторов роста, как сосудистый эндотелиальный фактор роста А, инсулиноподобный фактор роста 1 и основной фактор роста фибробластов.
Аортокоронарное шунтирование (АКШ) является методом хирургической реваскуляризации миокарда, позволяющим существенно повысить выживаемость пациентов с многососудистым поражением коронарного русла при ишемической болезни сердца (ИБС) [1]. Согласно данным современных исследований этот результат достигается не только благодаря улучшению кровоснабжения миокарда вследствие создания обходного анастомоза, но и за счет развития коллатерального кровообращения, способного обеспечить кровоток в случае разрыва атеросклеротической бляшки и тромбоза шунтированной артерии [2]. Биологической основой развития коллатерального кровообращения являются артерио- и ангиогенез, а основным пусковым фактором для роста и развития новых кровеносных сосудов — ишемия миокарда. Таким образом, артериогенез и ангиогенез можно считать фундаментальными механизмами выживаемости при ИБС [3][4]. Вместе с тем в ряде исследований было показано, что реваскуляризация миокарда с помощью АКШ может вызывать самостоятельный ангиогенетический ответ [5]. Исходя из этого, Gutterman DD, et al. [6] недавно выдвинули гипотезу, в соответствие с которой АКШ улучшает ишемическую среду миокарда, устанавливая «атеростаз» за счет эндогенного высвобождения факторов, обладающих сосудорасширяющими, противовоспалительными, антитромботическими и ангиогенетическими способностями.
В этой связи значительный научно-практический интерес представляет раскрытие механизмов, влияющих на развитие микроциркуляторного русла при проведении операций хирургической реваскуляризации миокарда, а также поиск фармакологических субстанций, способных стимулировать процесс ангио- и артериогенеза при проведении указанных операций [7].
Цель исследования: оценить влияние препарата 5-оксиметилурацил (5-ОМУ) на динамику ангиогенных факторов роста в периоперационном периоде хирургической реваскуляризации миокарда.
Материал и методы
В проспективное рандомизированное одноцентровое исследование было включено 50 больных, которым в Республиканском кардиологическом центре (г. Уфа) проводилась хирургическая реваскуляризация миокарда. Критериями включения в исследование стали возраст от 40 лет и старше, запланированная операция АКШ, стенокардия напряжения 3-4 функционального класса по CCS. Основными критериями исключения — выраженная дисфункция клапанов на фоне ИБС, аневризма левого желудочка, острый период инфаркта миокарда (ИМ), тяжелая систолическая дисфункция левого желудочка (фракция выброса левого желудочка <30%), значимое атеросклеротическое поражение каротидного бассейна (стеноз >70%).
Стандартная терапия включала антиагрегантную терапию (ацетилсалициловая кислота, клопидогрел), ?-блокаторы (метопролол, бисопролол, карведилол), ингибиторы ангиотензинпревращающего фермента (эналаприл, лизиноприл, периндоприл), статины (симвастатин, аторвастатин, розувастатин) и, при необходимости, нитраты короткого и пролонгированного действия (изосорбид динитрат, изосорбид мононитрат). Пациенты с сопутствующим сахарным диабетом получали адекватную сахарснижающую терапию.
Рандомизация была осуществлена методом конвертов. Больные основной группы (25 человек) в дополнение к стандартной терапии за 5 дней до и в течение 14 дней после операции перорально получали препарат 5-ОМУ в дозе 500 мг 3 раза/сут. Контрольную группу составили также 25 больных, которым проводилась стандартная терапия. Дизайн исследования представлен на рисунке 1. Как исследователи, так и пациенты были проинформированы о назначенном лечении.

Рис. 1. Дизайн исследования.
Сокращения: АКШ — аортокоронарное шунтирование, ИС — информированное согласие, ИФА — иммуноферментный анализ, 5-ОМУ — 5-оксиметилурацил.
Группы были сопоставимы по полу, возрасту, давности заболевания, функциональному классу стенокардии и недостаточности кровообращения, количеству пораженных сосудов, клинико-функциональным показателям и особенностям хирургического вмешательства (при апостериорном сравнении с использованием критерия Манна-Уитни и углового преобразования Фишера различия статистически незначимы (p>0,05)) (табл. 1).
Таблица 1
Демографические и клинико-функциональные характеристики исследуемых групп, Me (25%-75%)
|
Показатель |
Основная группа |
Контрольная группа |
Статистическая значимость различий, р |
|
Основные клинико-демографические характеристики |
|||
|
Средний возраст, лет |
50,37 (42,93-66,41) |
55,51 (46,84-63,88) |
0,63 |
|
Мужской пол, % |
92 |
96 |
0,60 |
|
Функциональный класс стабильной стенокардии по CCS |
3,00 (2,51-3,74) |
3,34 (2,63-3,72) |
0,88 |
|
Функциональный класс недостаточности кровообращения по NYHA |
2,00 (1,54-2,40) |
2,03 (1,66-2,22) |
0,41 |
|
Давность заболевания, мес. |
65,36 (55,00-72,08) |
59,79 (48,84-69,82) |
0,67 |
|
Сопутствующие заболевания |
|||
|
Постинфарктный кардиосклероз, % |
72 |
68 |
0,30 |
|
Артериальная гипертензия, % |
60 |
64 |
0,29 |
|
Сахарный диабет, % |
16 |
20 |
0,36 |
|
Характеристики поражения коронарного бассейна |
|||
|
Среднее количество пораженных артерий |
2,62 (2,04-3,00) |
2,55 (2,00-2,90) |
0,44 |
|
Поражение передней межжелудочковой артерии, % |
100 |
100 |
1,0 |
|
Поражение огибающей артерии, % |
80 |
84 |
0,37 |
|
Поражение правой коронарной артерии, % |
84 |
80 |
0,37 |
|
Особенности хирургического вмешательства |
|||
|
Использование ИК, % |
64 |
64 |
1,0 |
|
Средняя продолжительность операции, мин |
235,86 (205,65-270,24) |
252,00 (210,00-291,24) |
0,68 |
|
Среднее время ИК, мин |
102,18 (81,65-136,00) |
111,40 (76,54-128,96) |
0,89 |
|
Среднее время пережатия аорты, мин |
60,76 (52,62-70,44) |
55,48 (49,53-68,82) |
0,39 |
Сокращения: ИК — искусственное кровообращение, CCS — Canadian Cardiovascular Society (Канадское кардиологическое общество), NYHA — New York Heart Association (Нью-Йоркская ассоциация сердца).
У всех пациентов исходно (до назначения препарата) и через 2 нед. после выполнения АКШ определяли количественные значения следующих факторов роста ангиогенеза методом иммуноферментного анализа:
- Человеческий васкулоэндотелиальный фактор роста А (VEGF-A) — набор Human VEGF-A BioLISA, производства компании Bender MedSystems, Австрия.
- Фактор роста гепатоцитов человека (hHGF) — тест-система Human HGF, производства компании Biosource, Бельгия.
- Инсулин-подобный фактор роста 1 (IGF-1) — набор OCTEIA IGF-1, производства Immunodiagnostic Systems Holdings Ltd, Великобритания.
- Человеческий фактор роста фибробластов, основная форма (FGF basic, FGFb) — набор Human FGF basic Quantikine ELISA, R&D Systems, Inc, производства США.
Выбор аналитов для исследования был продиктован результатами проведенных ранее нашей группой авторов экспериментальных исследований по изучению влияния препарата 5-ОМУ на экспрессию факторов роста на моделях хронической и острой ишемии миокарда у кроликов, в ходе которых была изучена динамика указанных факторов методом количественной полимеразной цепной реакции с обратной транскрипцией в реальном времени [8].
Взятие венозной крови объемом 10-12 мл у пациентов проводили за 5 сут. до операции АКШ и через 14 дней после в утренние часы натощак с использованием системы Vacutainer, заполненной стабилизирующим агентом. Никаких осложнений, связанных с процедурой, не возникло. Полученные образцы крови инкубировали 5-10 мин при комнатной температуре, затем центрифугировали в течение 20 мин при 1500 g и t +40°С. Полученная плазма помещалась в микропробирки Эппендорф по 1,5 мл, после этого образцы замораживались и хранились в медицинском морозильнике при температуре -18° С.
При выборе контрольных точек для оценки биомаркеров ангиогенеза принимали во внимание время максимального воздействия препарата на обмен нуклеиновых кислот и синтез белка, который находится в диапазоне между 3 и 7 днями [9] и соответствует сроку начала приема — за 5 дней до операции. Продолжительность приема (14 дней после операции АКШ) связана с тем, что созревание примитивных кровеносных сосудов вместе со стенками и сетчатыми структурами происходит в течение 2 нед. после ишемического воздействия, следовательно, данный временной период является перспективной мишенью для терапевтического воздействия [10].
Конечные точки исследования. Основным объектом наблюдения (первичной конечной точкой) было изменение концентрации анализируемых факторов роста в периферической крови пациентов через 2 нед. после операции.
5-ОМУ — производное пиримидинов, является «минорным» основанием, встречается в значительных количествах в транспортной РНК и ДНК, обладает выраженным иммуностимулирующим действием. В 2002г разрешено применение 5-ОМУ под торговым названием «Иммурег» (ФСП 42-0415-2777-02). Согласно инструкции по применению препарата зарегистрированными показаниями для применения являются инфекционно-воспалительные заболевания (в составе антибиотикотерапии): заболевания органов дыхания (пневмония, хроническая обструктивная болезнь легких, абсцесс легких), хронический пиелонефрит, а также профилактика инфекционных осложнений на фоне химиотерапии хронического лимфолейкоза.
До включения в исследование у каждого пациента было получено письменное информированное согласие. Исследование проводилось в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и Хельсинкской декларацией о правах человека и было одобрено локальным этическим комитетом при Башкирском государственном медицинском университете.
Статистическую обработку результатов проводили с использованием программы Statistica 8.0. Расчет размера выборки исходил из ожидаемой частоты возникновения первичной конечной точки (p) 10%, при надежности вывода 95%, t=1,96 и максимальной ошибке ?=5%. Принимая во внимание, что по результатам теста Колмогорова-Смирнова и Шапиро-Уилка распределение признаков в группах не отвечало нормальному, для выявления статистических различий между независимыми выборками использовали непараметрический критерий Манна-Уитни и угловое преобразование Фишера. Данные представляли в виде медианы Me и межквартильного интервала (25-75%). Различия считали статистически значимыми при р?0,05.
Результаты
Статистический анализ показал, что исходные значения исследуемых факторов роста периферической крови в анализируемых группах не имели значимых различий.
На следующем этапе исследования мы оценили динамику изучаемых факторов роста на фоне применения 5-ОМУ (основная группа) и без применения препарата (контрольная группа).
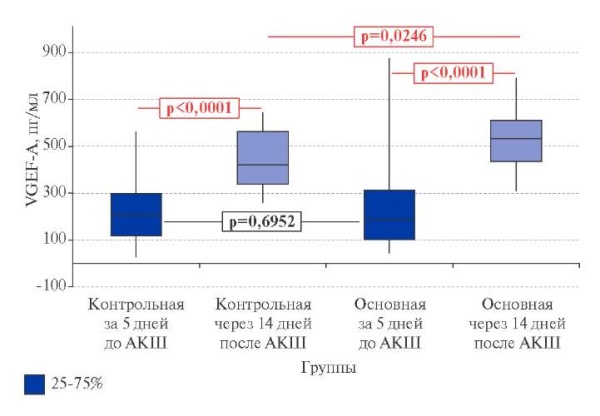
VEGF-A в контрольной группе пациентов продемонстрировал статистически значимый рост: медиана показателя выросла с 204,50 (117,50-297,50) до 420,63 (338,54-563,58) пг/мл — на 105,68% (р<0,0001) (рис. 2).

Рис. 2. Динамика концентрации васкуло-эндотелиального фактора роста А (VEGF-A) в крови пациентов Контрольной (n=25) и Основной (n=25) групп за 5 дней до и через 14 дней после проведения АКШ (Me (25%;75%), p — статистическая значимость различий, критерий Манна-Уитни).
Сокращения: АКШ — аортокоронарное шунтирование, VEGF-A — человеческий васкулоэндотелиальный фактор роста А.
Динамика VEGF-A в основной группе пациентов после хирургической реваскуляризации миокарда с одновременным назначением 5-ОМУ оказалась более впечатляющей: прирост составил 184,29% (с 187,50 (101,00-338,54) до 533,05 (435,26-612,03) пг/мл, p<0,0001) (рис. 2). При этом в основной группе итоговый уровень VEGF-A был статистически значимо выше, чем в контрольной на 26,90% (р=0,0246). Полученный результат, по нашему мнению, связан с совокупным благотворным влиянием на процессы ангиогенеза операции коронарного шунтирования и применения 5-ОМУ.
Концентрация фактора роста гепатоцитов человека HGF в контрольной группе характеризовалась тенденцией к снижению (с 1413,00 (817,50-1912,00) пг/мл в дооперационном периоде до 1402,00 (937,50-2174,50) пг/мл через 2 нед. после АКШ (р=0,4153)) (рис. 3).

Рис. 3. Динамика концентрации фактора роста гепатоцитов человека hHGF в крови пациентов Контрольной (n=25) и Основной (n=25) групп за 5 дней до и через 14 дней после проведения АКШ (Me (25%;75%), p — статистическая значимость различий, критерий Манна-Уитни).
Сокращения: АКШ — аортокоронарное шунтирование, hHGF — фактор роста гепатоцитов человека.
Динамика HGF у пациентов основной группы, напротив, была положительной, однако не достигла уровня статистической значимости: отмечался рост медианы показателя на 6,12% с 1584,00 (1062,00-1965,00) пг/мл в дооперационном периоде до 1681,00 (1244,50-2179,00) пг/мл (р=0,2481) через 2 нед. после АКШ. Вместе с тем различия между показателем концентрации HGF в контрольной и основной группах через 14 дней после хирургической реваскуляризации миокарда также оказались статистически незначимыми (р=0,2836), что говорит об ограниченном благоприятном влиянии 5-ОМУ на процессы ангиогенеза с участием пути, регулируемом каскадом HGF.
Обсуждая динамику содержания инсулин-подобного фактора роста IGF-1, в отличие от двух предыдущих анализируемых факторов, следует обратить внимание на его статистически значимое снижение в контрольной группе с 117,50 (88,00-193,00) пг/мл в предоперационном периоде до 98,00 (75,00-143,00) пг/мл через 2 нед. после операции (на 19,89%, р=0,0177) (рис. 4).

Рис. 4. Динамика концентрации инсулин-подобного фактора роста IGF-1 в крови пациентов Контрольной (n=25) и Основной (n=25) групп за 5 дней до и через 14 дней после проведения АКШ (Me (25%;75%), p — статистическая значимость различий, критерий Манна-Уитни).
Сокращения: АКШ — аортокоронарное шунтирование, IGF-1 — инсулин-подобный фактор роста 1.
В этой связи интересные данные получены у пациентов основной группы, у которых на фоне применения 5-ОМУ вместо снижения отмечалась тенденция к росту уровня инсулин-подобного фактора роста IGF-1: его медиана повысилась с 128,50 (75,00-198,00) пг/мл в предоперационном периоде до 142,00 (93,00-173,00) пг/мл на 14 сут. после АКШ, или на 10,5% (р=0,7649). И, что особенно важно, наличие статистической значимости различий в послеоперационных уровнях IGF-1 в основной и контрольной группах — на 44,89% (р=0,0011), свидетельствует о явных преимуществах 5-ОМУ в поддержании нормогликемии в периоперационном периоде.
Фактор роста фибробластов (FGFb) является одним из основных регуляторов процессов ангиогенеза. В наших исследованиях он демонстрирует статистически значимый рост на фоне операции АКШ в контрольной группе с 3,40 (2,15-6,95) пг/мл до 5,70 (4,65-7,65) пг/мл (р=0,0336), или на 67,64% (рис. 5).

Рис. 5. Динамика концентрации фактора роста фибробластов FGFb в крови пациентов Контрольной (n=25) и Основной (n=25) групп за 5 дней до и через 14 дней после проведения АКШ (Me (25%;75%), p — статистическая значимость различий, критерий Манна-Уитни).
Сокращения: АКШ — аортокоронарное шунтирование, FGFb — человеческий фактор роста фибробластов, основная форма.
Динамика FGFb в основной группе (на фоне применения 5-ОМУ) показала еще более впечатляющую динамику, чем в контрольной группе — с 4,70 (2,70-6,45) пг/мл в предоперационном периоде до 8,35 (5,30-10,70) пг/мл через 14 дней после АКШ, или на 77,65% (p=0,0006). При сравнении итоговых уровней FGFb (через 14 дней после АКШ) в контрольной и основной группах значения исследуемого фактора оказались существенно выше в основной группе (на 60%, р=0,0006).
Обсуждение
В связи со сформулированной в последние годы теорией хирургической коллатерализации при выполнении АКШ, вызывает научный и клинический интерес изучение производных пиримидинов в качестве проангиогенных лекарственных средств. Данный класс препаратов давно применяется в широкой врачебной практике в самых разных сферах из-за большого разнообразия клинических эффектов. Влияние производных пиримидина на ангиогенез также достаточно хорошо изучено в работах [11][12], причем влияние на ангиогенез препаратов данной группы сравнимо по эффективности с введением VEGF [13].
Для 5-ОМУ, как и для всех представителей пиримидинов, присущи сразу два доказанных на данный момент механизма ангиогенного действия — антиоксидантная активность [14] и способность накапливать аденозин [15].
Влияние активных форм кислорода на постишемический ангиогенез связано с локальным подавлением ангиогенных факторов роста в ишемизированной области. Достоверно установлено, что активные формы кислорода могут ингибировать NO непосредственно и через ингибирование эндотелиальной синтазы оксида азота, блокируя ее действие на сосудистую систему [16], таким образом, подавление оксидантного стресса в миокарде путем применения фармакологических субстанций с антиоксидантной активностью закономерным образом приводит к стимулированию процессов ангиогенеза.
Увеличение содержания аденозина (путем нарушения его обратного захвата) вследствие применения пиримидиновых нуклеотидов, а также способность к повышению концентрации циклического аденозинмонофосфата связана с ингибированием фермента фосфодиэстеразы [15]. По современным данным аденозин активирует 4 различных подтипа (А1, А2А, А2В и А3) рецепторов, стимулирует капиллярообразование в ишемизированном сердце и индуцирует выработку проангиогенных факторов [17][18].
Наиболее впечатляющая динамика концентрации в периферической крови среди анализируемых нами факторов роста на фоне применения 5-ОМУ зафиксирована у VEGF-A, как ключевого фактора ангиогенеза в миокарде на фоне гипоксии [10]. В ряде кинических исследований показано, что повышенный уровень VEGF-A способствует пролиферации эндотелиальных клеток сосудов, улучшает проницаемость сосудов и восстанавливает целостность эндотелия и функцию сосудов, что является компенсаторным механизмом при развитии ишемии миокарда [19][20]. Анализ баз научных источников показал, что воздействие на VEGF-A с помощью лекарственных препаратов является перспективной мишенью для лечения сердечно-сосудистых заболеваний. Например, гидроксисафлор желтый улучшал функцию эндотелиальных клеток-предшественников и увеличивал концентрацию VEGF-A у мышей с моделью ИМ посредством сигнального каскада HO-1/VEGF-A/SDF-1?, что значимо восстанавливало сердечную дисфункцию, вызванную ишемией, и улучшало выживаемость животных [21][22]. Экстракты Pueraria и Salvia miltiorrhiza стимулировали ангиогенез, активируя путь VEGF/VEGFR2, тем самым сохраняя миокард крыс с моделью ИМ [23], а салидрозид увеличивал экспрессию HIF-1?, а затем уровень VEGF для ингибирования некроза и апоптоза кардиомиоцитов, вызванных гипоксией [24].
Вместе с тем обращает на себя внимание выраженная динамика до- и послеоперационных значений фактора роста FGFb на фоне применения 5-ОМУ, которая по уровню прироста показателей была схожа с динамикой VEGF-A, что является закономерным следствием неразрывной связи FGF-2 и VEGF-A в процессах ангиогенеза [25]. Зафиксированное в нашем исследовании снижение концентрации в периферической крови пациентов контрольной группы инсулин-подобного фактора роста IGF-1 связано с активацией катаболических процессов после хирургической реваскуляризации миокарда, причем глубина этого снижения отражает тяжесть операционной травмы и, следовательно, степень катаболизма после операции [26]. И, напротив, стабилизация указанного фактора роста в основной группе пациентов на фоне применения 5-оксиметидурацила является крайне важным для поддержания гомеостаза глюкозы в периоперационном периоде хирургической реваскуляризации миокарда [27].
Ранее эффективность 5-ОМУ как стимулятора ангиогенеза, а также возможные механизмы действия, были экспериментально изучены В. В. Плечевым, Б. А. Олейником и Р. Ю. Рисбергом в 2012г на модели острого ИМ у кроликов. Так, в эксперименте на 112 кроликах-самцах породы шиншилла на фоне необратимой ишемии миокарда авторы продемонстрировали, что 5-ОМУ способствует достоверному увеличению уровня экспрессии гена FGF2 на 26%, гена HGF на 60% и гена VEGFa на 131% [8], а также приводит к увеличению плотности сосудистой сети в миокарде [28] на границе ишемизированной зоны, что в целом согласуется с результатами настоящего клинического исследования и, в известной степени, позволяет предполагать наличие подобной взаимосвязи и у пациентов с ИБС на фоне периоперационного применения препарата. Вместе с тем, понимая необходимость получения не косвенных, а прямых доказательств эффективности 5-ОМУ в части стимуляции процессов ангиогенеза в миокарде, и учитывая объективные сложности выполнения гистологических исследований, связанных с необходимостью прижизненной биопсии миокарда, перспективными задачами нашей научной группы будут проведение современных неинвазивных методов визуализации, таких как однофотонная эмиссионная компьютерная томография с Tc99 [29] и позитронно-эмиссионная томография с радиотрейсерами ангиогенеза [30] у пациентов данной группы.
Ограничения исследования. Ограничениями данного исследования является малый объем выборки и короткий период наблюдения.
Заключение
Применение представителя пиримидинов 5-ОМУ в периоперационном периоде хирургической реваскуляризации миокарда приводит к достоверному увеличению в периферической крови ангиогенных факторов роста — сосудистого эндотелиального фактора роста А, инсулиноподобного фактора роста 1 и основного фактора роста фибробластов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Олейник Б.А., Плечев В.В., Евдаков В.А., Ижбульдин Р.И., Загидуллин Н.Ш. Влияние представителя пиримидинов — 5-оксиметилурацила на динамику ангиогенных факторов роста в периоперационном периоде хирургической реваскуляризации миокарда (результаты рандомизированного исследования). Российский кардиологический журнал. 2023;28(1S):5140. https://doi.org/10.15829/1560-4071-2023-5140
Скопировать