Модифицированная операция Росса
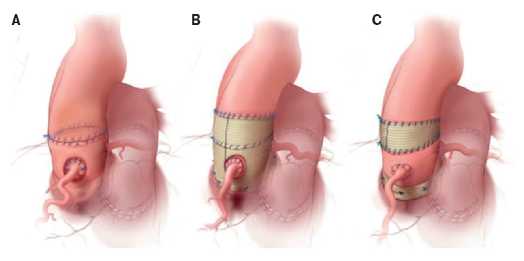
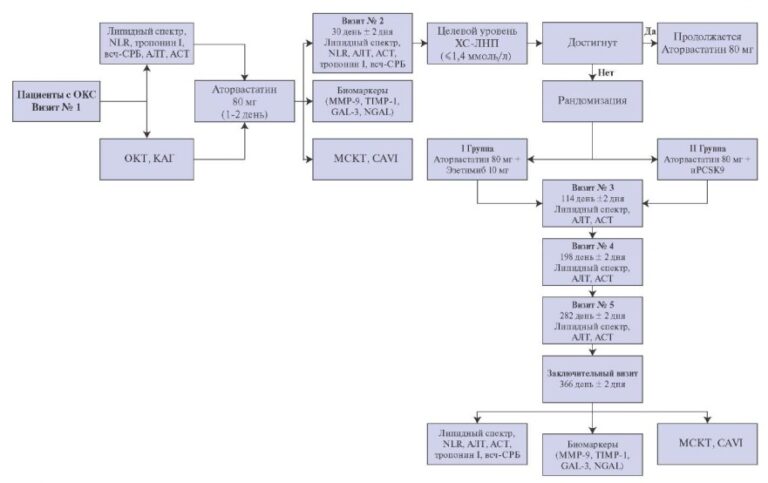
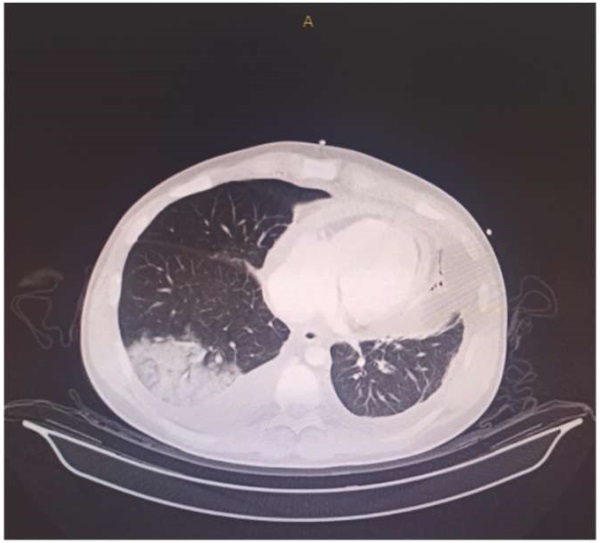
При дисфункции аортального клапана (АК) протезирование клапана является методом выбора лечения таких пациентов [1-3]. В последнее время увеличивается количество операций на АК в Российской Федерации, в 2017г было проведено 5992 вмешательства на АК, в 2018г — 6819, в 2019г — 7318 [4]. Одним из методов хирургического лечения является процедура Росса, которая была предложена британским кардиохирургом Д. Россом в 1967г [5]. Первую операцию Росса в России провел в центре Мешалкина израильский кардиохирург Бернардо Алекс Видне в 1998г, спустя 2 мес. после показательных операций Видне, Юрий Горбатых самостоятельно выполнил данную операцию [6]. Истинное количество операций Росса в Российской Федерации остается неизвестным. По последним Американским рекомендациям по приобретенным порокам сердца от 2020г операцию Росса можно выполнять пациентам моложе 50 лет (IIb класс показаний) [1]. Многочисленные исследования показали отличные отдаленные результаты операции Росса [7-10]. Однако у некоторых пациентов в отдаленном периоде может произойти поздняя дилатация легочного аутографта (рис. 1), что, в свою очередь, является причиной повторных операций [11-16]. Чтобы избежать этого осложнения, были предложены технические модификации, в т.ч. имплантация легочного аутографта внутри собственного корня аорты или перикарда пациента, окутывание легочного аутографта Дакроновым протезом, экстраанатомическое укрепление фиброзного кольца (ФК) АК и синотубулярного соединения (СТС) сосудистым протезом [17-20]. У каждого из этих подходов есть свои преимущества и ограничения. Модификации показаны на рисунке 2 A, B, C [21]. Данная работа преследует цель оценить состояние и выявить нерешенные проблемы внешней поддержки легочного аутографта для профилактики его дилатации при операции Росса на современном этапе.

Рис. 1. Компьютерная томография сердца и аорты с контрастированием.
Примечание: дилатация легочного аутографта после классической операции Росса.

Рис. 2. Технические модификации процедуры Росса, направленные на уменьшение поздней дилатации и недостаточности аутотрансплантата (адаптировано из [21]).
Примечание: A) внутриаортальная имплантация, B) имплантация внутри протеза из дакрона, C) экстраанатомическая аннулопластика и укрепление СТС.
Сокращение: СТС — синотубулярное соединение.
Стратегия поиска и отбора источников
Для поиска использовали базы данных PubMed, Web of Science, Google Scholar, Российский индекс научного цитирования. Анализировали статьи до 1 декабря 2021г, содержащие релевантные извлекаемые данные об операции, модифицированной Росса. Исключали: комментарии и тезисы конференций, исследования, в которых представлены неполные или неизвлекаемые данные.
Внутриаортальная имплантация легочного аутографта или окутывание перикардом
В попытке предотвратить расширение аутотрансплантата, избегая использования протезного материала, некоторые авторы предложили использовать аутологичную ткань для обеспечения внешней поддержки легочного аутографта. Для этой цели используются две ткани: перикард и аорта. Хотя они могут несколько ограничивать растяжимость корня неоаорты, считается, что эти ткани обладают лучшими механическими свойствами, чем дакрон. Самый большой опыт аутологической поддержки корня легочного аутотрансплантата с использованием собственной аорты пациента — метод включения (рис. 3) получен хирургами из Мельбурна, которые сообщили об отдаленных результатах этой техники у 322 оперированных пациентов с 1992 по 2013гг. Средний возраст включенных больных составил 39,5 лет, минимальный и максимальный возраст больных 15 и 63 года. Изолированная аортальная регургитация (АР) имелась у 103 (32%) пациентов. Перед имплантацией легочного аутотрансплантата нативная аорта и остатки корня аорты были адаптированы для достижения определенных измерений СТС и ФК АК для пациентов мужского и женского пола (24-26 и 22- 24 мм, соответственно). Хирургические этапы представлены на рисунке 3. Уменьшение ФК и СТС было выполнено — 201 (62,4%) и 159 (49,4%) пациентам. 30-ти дневная летальность составила 0,3%, один пациент умер после выписки из стационара от инфаркта миокарда. Отдаленные результаты этой стратегии впечатляют: неоаортальные размеры стабильны до 15 лет после операции. На данный момент только у 1,5% всех пациентов максимальный размер корня аорты превышает 40 мм в диаметре, и ни у одного из них не превышает 43 мм. В соответствии с предыдущими исследованиями, пациенты с предоперационной АР и пациенты с большим ФК АК имели более высокий риск развития дилатации корня неоаорты при последующем наблюдении. Эти пациенты также чаще подвергались повторной операции. Поэтому авторы рекомендуют укреплять ФК АК при его диаметре ?25 мм. Тем не менее общая свобода от повторной операции аутотрансплантата через 18 лет составила 96%, и ни одна из повторных операций не была вызвана дилатацией аутотрансплантата [17].

Рис. 3. Схематическое изображение операции (адаптировано из [17]).
В субанализе этой когорты, посвященном 129 пациентам, у которых имелись двухстворчатый АК и изолированная выраженная АР, Poh CL, et al. сообщили в общей сложности о 11 повторных операциях на аорте (9 по поводу рецидивирующей АР и 2 по поводу эндокардита), в результате чего общая свобода от повторных операций составила 89% через 10 лет и 85% через 20 лет. Следует отметить, что дисфункция аутотрансплантата в этой когорте, как правило, происходил рано (т.е. в течение первых 5 лет наблюдения). Также наблюдался большой эффект эпохи: 45% повторных операций приходилось на первые 25% пациентов, до того, как были разработаны хирургические стратегии авторов. В дополнение к превосходной прочности аутотрансплантата в этой когорте пациентов с высоким риском дилатации аутотрансплантата, поздняя выживаемость также была замечательной, с 96% отсутствием общей смертности через 20 лет [22].
В настоящее время эти выдающиеся результаты представляют собой наилучшие доступные отдаленные результаты процедуры Росса у пациентов с АР, предполагая, что, когда это возможно, подход Мельбурна представляет собой отличное решение проблемы дилатации легочного аутотрансплантата. Тем не менее при использовании этой хирургической стратегии следует учитывать несколько важных деталей. Примечательно, что этот метод не очень хорошо подходит для пациентов с одностворчатым клапаном или двустворчатым клапаном Сиверса типа 0 (комиссуры 180?), особенно при большом несоответствии между размером корня аорты и легочного аутотрансплантата. Кроме того, тот факт, что нативная аорта всегда реконструируется до одних и тех же размеров в зависимости от пола пациента, вызывает опасения по поводу потенциального искажения легочных аутотрансплантатов разного диаметра [23].
Опыт окутывания перикардом ограничен. Pacifico AD, et al. сообщили о своем опыте с 25 пациентами, у которых аутотрансплантат был обернут в перикард (аутоперикард у 12 пациентов, бычий перикард у 13). Но отдаленные результаты данной методики не были опубликованы [24].
Окутывание Дакроновым протезом легочного аутографта
Чтобы предотвратить дилатацию легочного аутотрансплантата, несколько групп авторов предложили заключить легочный аутотрансплантат в Дакроновую трубку перед имплантацией (рис. 4). Для этого использовались как прямые протезы, так и протезы с синусами Вальсальвы (Terumo Vascutek, Renfrewshire, Scotland, UK). Эта методика показала хорошие первые результаты со стабильным диаметром ФК аутотрансплантата и неосинуса до 5 лет [18][25-28]. Slater M, et al. в 2005г описали модифицированную методику Росса при помощи окутывания аутографта Дакроновым протезом [19].
Koul B, et al. предложили модифицированную методику Росса с окутыванием из Дакронового протеза (рис. 5) [27]. Весь легочный аутографт снаружи поддерживается Дакроновым протезом. Дакроновый протез берется из расчета на 4 мм больше внутренного диаметра кольца легочного аутографта, измеренного во время операции. Схематическое изображение операции представлено на рисунке 5. Данная методика была применена 13 пациентам. Средний возраст пациентов составлял 35 лет (от 22 до 50). Период наблюдения составил 16 мес. Авторы пришли к заключению, что данная методика не влияла на функцию АК и размер ФК АК, а также препятствовала дилатации неоаортального клапана (неоАК).
Al Rashidi F, et al. опубликовали среднесрочные результаты данной методики [29]. Проспективно были проанализированы 26 пациентов, которым была выполнена операция Росса, из них 13 по классической методике и 13 — модифицированная методика. Период наблюдения составил 4,5 года. Особый акцент уделялся геометрии неоАК и корня неоаорты. И было показано, что в среднесрочном периоде в динамике отсутствует дилатация ФК неоАК, синусов Вальсальвы, СТС и проксимальной части восходящей аорты по сравнению с классической методикой.
Gebauer R, et al. предоставили 10 случаев применения модифицированной методики путем окутывания сосудистым протезом (рис. 6). Средний возраст больных составил 34,2 года. В основном это были пациенты с широким ФК, т.е. пациенты с фактором риска поздней дилатации легочного аутографта. Средний диаметр ФК составил 28,5 мм (21-35 мм). Средний диаметр сосудистого протеза, применяемого для окутывания, составил — 27,5±2,3 мм. Средний период наблюдения составил 14,6 мес. За этот период ни у одного пациента не было изменения геометрии неоаортального корня. Juthier F, et al. проанализировали шестилетние результаты данной методики у 12 пациентов. В период наблюдения не было значимой регургитации на неоАК. А также отсутствовала статистически значимая дилатация диаметра ФК и синусов Вальсальвы. Средние диаметры ФК, неосинусов Вальсальвы и СТС составили 23,3±2,6 мм, 32,6±3,3 мм, 28,9±4,5 мм при выписке 24,0±1,9 мм, 33,6±3,3 мм и 29,5±3,6 мм, соответственно, на последнем контроле (р=0,32; р=0,08 и р=0,25, соответственно) [26].

Рис. 4. Основные этапы модификационной операции Росса при помощи окутывания Дакроновым протезом (адаптировано из [18]).

Рис. 5. Схематическое изображение операции (адаптировано из [27]).

Рис. 6. Интраоперационный вид данной методики (адаптировано из [26]).
Также ряд авторов описали методики окутывания легочного аутографта сосудистым протезом [28][30].
С точки зрения Mazine A и El-Hamamsy I, основным ограничением этого подхода является то, что он изменяет форму корня аутотрансплантата, особенно при использовании прямых Дакроновых протезов, и ухудшает его естественный динамизм. Это могло иметь негативные последствия для мгновенных движений створок аутотрансплантата, коронарного резерва кровотока и импеданса левого желудочка, тем самым потенциально сводя на нет некоторые из основных преимуществ операции Росса [23].
Кроме того, отсутствие механотрансдукции приводит к беспорядку внеклеточного матрикса и гладкомышечных клеток, что приводит к потере аутотрансплантатом своих эластичных свойств [31]. Эти соображения пока носят в основном теоретический характер, поскольку ни одно исследование не рассматривало этот вопрос в контексте обернутого аутотрансплантата. Однако гемодинамические исследования после использования методов ремоделирования и реимплантации клапанов подтверждают эти опасения [32][33]. Использование протезов с синусами Вальсальвы, которые позволяют расширить стенку синусов, потенциально может смягчить некоторые из этих явлений.
Помимо этих проблем, данный подход также имеет ряд технических опасностей. Окутывание легочного аутотрансплантата в Дакроновый протез может вызвать искажение его естественной геометрии, что потенциально может привести к ранней АР. Еще одна ловушка — это вероятность деформации или перегиба коронарных артерий Дакроновым трансплантатом. Очень важно убедиться, что коронарные анастомозы включают стенку аутотрансплантата и Дакроновый трансплантат во время коронарной реимплантации, чтобы избежать перегиба коронарной артерии. Еще одна проблема — это возможность скопления крови в свободном пространстве между стенкой аутотрансплантата и Дакроновым трансплантатом, с образованием гематомы, которая может сдавливать корень неоаорты или создавать очаг инфекции. Например, Чернов И.И. и др. наоборот рекомендуют не захватывать сосудистый протез, а только легочный аутографт при имплантации устьев коронарных артерий во избежание перегиба и накопления гематомы между протезом и неоаортой [34]. Сам дакрон, как синтетический материал, вызывает некоторые опасения, поскольку он связан с усилением воспалительной реакции вокруг легочного аутотрансплантата, что может привести к ранней дисфункции и ограничить долгосрочные преимущества операции Росса [35]. Черновым И.И. и др. были опубликованы отличные пятилетние результаты данной методики [36].
Другими авторами было предложено использовать альтернативные синтетические материалы, такие как GoreTex (W.L. Gore & Associates Inc., Flagstaff, AZ, USA), но отдаленные результаты на сегодняшний день отсутствуют [37].
Экстраанатомическая аннулопластика и укрепление СТС
Пациенты с АР и расширенным ФК АК имеют повышенный риск дилатации аутотрансплантата и отказа. Как описано ранее, несколько стратегий с использованием внешней поддержки доказали свою эффективность в снижении риска поздней дилатации аутотрансплантата. Однако эти стратегии могут ограничивать подвижность легочного аутотрансплантата и тем самым ограничивать некоторые ожидаемые преимущества процедуры Росса. Стремясь минимизировать риск дилатации аутотрансплантата, обеспечивая при этом отличную гемодинамику и неограниченную подвижность аутотрансплантата, некоторые авторы выступают за подход, при котором хирургическое и послеоперационное лечение индивидуально для каждого пациента. Этот подход фокусируется на известных факторах риска дилатации аутотрансплантата и нацелен на них в соответствии с индивидуальной анатомией и характеристиками пациента. Цель состоит в том, чтобы стабилизировать или поддержать различные компоненты корня неоаорты, чтобы предотвратить дилатацию на всех уровнях: ФК, синусы Вальсальвы и СТС. Другой целью этого подхода является минимизация неконтролируемой артериальной гипертензии, хорошо известного фактора риска ранней дилатации аутотрансплантата и дисфункции неоАК, что особенно выражено у пациентов с предоперационной АР. Этот адаптированный хирургический подход (рис. 2 C) подробно описан в других источниках [38][39].
Таким образом, корень аутотрансплантата ориентирован так, чтобы более тонкий, обращенный влево синус находился в левом коронарном синусе. Перед имплантацией обрезают аутотрансплантат так, чтобы осталось как можно меньше инфундибулярной мышцы. Аутотрансплантат помещается в выводной тракт левого желудочка (субаннулярная имплантация) так, что нативное кольцо аорты может обеспечивать кольцевую поддержку. У пациентов с АР выполняют внеаортальную аннулопластику с использованием полного кругового кольца из дакрона для дальнейшей стабилизации кольца аорты [40].
Mazine A и El-Hamamsy I считают, что этот подход более эффективен для предотвращения позднего увеличения диаметра кольца по сравнению с аннулопластичным швом или полукольцами. Чтобы обеспечить дополнительную поддержку, авторы используют собственный некоронарный синус и левоправую комиссуру в качестве свободной внешней оболочки. Кроме того, легочная артерия обрезается непосредственно над спайкой, чтобы минимизировать объем стенки легочной артерии, которая будет подвергаться системному давлению. У пациентов с диаметром восходящей аорты >36 мм или несоответствием размера >3-4 мм между восходящей аортой и СТС аутотрансплантата во время операции рекомендуют хирургическое лечение восходящей аорты, поскольку расширение СТС является известным механизмом несостоятельности аутотрансплантата. Чтобы снизить этот риск, устанавливается короткий Дакроновый трансплантат между аутотрансплантатом и восходящей аортой, который стабилизирует СТС [39]. При использовании этой стратегии жизненно важно, чтобы Дакроновый промежуточный трансплантат был настолько коротким, насколько это необходимо, поскольку авторы наблюдали, что замена восходящей аорты Дакроновым трансплантатом, стабилизируя СТС, приводит к значительному увеличению жесткости корня аутотрансплантата [41], что может ограничить некоторые преимущества операции и привести к снижению прочности аутотрансплантата [9]. В дополнение к вышеупомянутым техническим деталям, Mazine A и El-Hamamsy I внедрили строгий ориентированный на пациента протокол удаленного мониторинга артериального давления, нацеленный на систолическое артериальное давление ?110 мм рт.ст. в течение первых 12 мес. после операции. С 2011г данные авторы выполнили >500 процедур Росса с использованием этого подхода с отличными среднесрочными результатами и без признаков дилатации аутотрансплантата. В недавнем анализе не наблюдалось различий в размерах корня аутотрансплантата между пациентами с предоперационной АР и аортальным стенозом в течение 7 лет после операции [38]. Для подтверждения долгосрочной стабильности размеров аутотрансплантата и определения жизнеспособности этого подхода необходимо постоянное наблюдение. В частности, будет интересно определить влияние этого индивидуального хирургического подхода на частоту первичной недостаточности аутотрансплантата, как это наблюдалось в других исследованиях [42].
Brown JW, et al. проанализировали 31 пациента с двухстворчатым АК и дилатацией восходящего отдела аорты, которым в рамках операции Росса была выполнена аннулопластика в сочетании с протезированием восходящего отдела аорты (рис. 7) [20]. Средний возраст включенных больных составил 28,8±14,4 лет. Все пациенты имели от умеренной до выраженной АР. Средний размер сосудистого протеза, который использовали для протезирования восходящей аорты, составил 25±2,6 мм. Среднее время ишемии миокарда составило 94±24 мин, время искусственного кровообращения — 133±28 мин. У троих больных в послеоперационном периоде возникли осложнения: рестернотомия по поводу кровотечения была выполнена в данном случае 3,2%, проблемы с правой коронарной артерии — однократно (3,2%), компартмент-синдром правой нижней конечности также у 1 больного (3,2%). В госпитальном периоде не было летальных исходов. Средний период наблюдения составил 2,5±2,2 года. Диаметр корня аорты увеличился у 3 (10%) больных.

Рис. 7. Аннулопластика АК и протезирование восходящего отдела аорты (адаптировано из [20]).
Чернов И. И. и др. проанализировали непосредственные результаты модифицированной операции Росса (рис. 8) у 21 взрослого пациента [34]. Средний возраст включенных больных составил 41±10,1 лет. В 42,9% случаев выполнялись комбинированные вмешательства на сердце. Дилатированный АК имелся у 8 (38,1%) больных. Интрааортальная методика (рис. 6 А) была применена у 12 и окутывание сосудистым протезом (рис. 6 B) у 9 больных. В госпитальном периоде не было летальности. Имелся ряд нефатальных осложнений, таких как: периоперационный инфаркт миокарда — 1 (4,8%), инсульт — 1 (4,8%), рестернотомия по поводу кровотечения — 1 (4,8%), острое почечное повреждение — 3 (14,3%). При контрольной эхокардиографии были отмечены отличные гемодинамические показатели: максимальный градиент на легочном аутографте составил 9,1±5,3 мм рт.ст.

Рис. 8. Интраоперационная фотография модифицированных методик Росса (адаптировано из [34]).
Примечание: А) интрааортальное окутывание, B) окутывание Дакроновым сосудистым протезом.
Чуть позже Чернов И. И. и др. представили пятилетние результаты модифицированной операции Росса [36]. Ретроспективно были проанализированы 43 пациента, которым была выполнена модифицированная методика Росса, из них интрааортальную методику применяли в 22 (51,2%) случаях, окутывание Дакроновым протезом — 21 (48,8%) случае. Средний возраст больных составил 40,0±11,7 года. Двухстворчатый АК диагностировали у 29 (67,4%) больных. Пятилетняя общая выживаемость, свобода от реоперации и дилатации восходящей аорты или легочного аутографта не менее 5 см составили 97,4%, 100,0% и 100,0%, соответственно.
Несколько исследований последовательно идентифицировали предоперационную АР и дилатацию кольца аорты как предикторы дисфункции аутотрансплантата. Таким образом, пациенты с этими особенностями представляют собой неоптимальную анатомическую основу для операции Росса. Тем не менее при рассмотрении этих доказательств и выяснении роли процедуры Росса в этой группе пациентов следует иметь в виду несколько важных особенностей. А именно, что процедура Росса представляет собой “эволюционную сказку”, означающую, что, хотя операция была введена более полувека назад, она продолжала развиваться благодаря постепенному пониманию сложных анатомических и физиологических особенностей, связанных с ее выполнением [43]. Как подробно описано в предыдущем разделе, были предложены многочисленные технические модификации и дополнительные меры для снижения риска поздней дисфункции, особенно у пациентов с АР (рис. 2). С внедрением этих методов вполне вероятно, что результаты операции со временем будут улучшаться.
Будущее модифицированной операции Росса
В последние годы был достигнут значительный прогресс в понимании механизмов, которые приводят к дилатации аутотрансплантата и отказу от него у пациентов с предоперационной АР. Это позволило разработать хирургические стратегии, направленные на предотвращение этого позднего осложнения. Как резюмируется в этой статье, внешняя поддержка легочного аутотрансплантата является эффективной стратегией предотвращения дилатации. Однако этот подход вызывает теоретические опасения, связанные с ограничением подвижности аутотрансплантата, потенциально нарушающим гемодинамику корня аорты и сводящим на нет некоторые долгосрочные преимущества операции. Требуются дальнейшие исследования, чтобы определить, приводят ли эти теоретические опасения к клинически значимым результатам. Как упоминалось ранее, у пациентов, у которых развивается дилатация легочного аутотрансплантата после процедуры Росса, большая часть увеличения диаметра наблюдается вскоре после операции [44]. Таким образом, если бы можно было обеспечить временную внешнюю поддержку аутотрансплантату на ранней стадии ремоделирования, это позволило бы ему безопасно адаптироваться к системному давлению, а также обеспечило бы неограничительную гемодинамику в долгосрочной перспективе и снизило бы риски, связанные с использованием протезов. Разработка полностью рассасываемых биоинженерных каркасов открывает большие перспективы для реализации этого видения. Данная концепция не нова. Еще в 1993г Mortiz A, et al. предложили окутывание легочного аутотрансплантата рассасывающимся полиглактином 910 [45]. К сожалению, о долгосрочных результатах этого подхода не сообщалось. Совсем недавние достижения в области биоматериалов привели к возрождению этой концепции. Nappi F, et al. разработали биоинженерный полурезорбируемый каркас из композита полидиоксанона и вспененного политетрафторэтилена и имплантировали его в гетеротопную экспериментальную модель Росса [46]. Каркас был обернут вокруг легочного аутотрансплантата десяти ягнят и имплантирован в их нисходящую аорту. Через 6 мес. каркас эффективно предотвращал расширение по сравнению с контрольными ягнятами. Эксплантированные аутотрансплантаты не показали воспалительных изменений, а композит хорошо интегрировался в стенку сосуда. Эти результаты являются многообещающими, и продолжение исследований в этой области потенциально может обеспечить оптимальное решение для пациентов с риском дилатации аутотрансплантата.
Заключение
Модифицированные методики для внешней поддержки легочного аутографта являются эффективными мерами для предотвращения дилатации, однако этот подход вызывает теоретические опасения, связанные с ограничением подвижности аутографта, потенциально нарушающим гемодинамику корня аорты. Требуются дальнейшие исследования отдаленных результатов, чтобы определить, приводят ли эти теоретические опасения к клинически значимым результатам, также определить наиболее эффективный и безопасный метод модифицированной операции Росса.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Энгиноев С.Т., Магомедов Г.М., Рашидова Т.К., Кондратьев Д.А., Абдрахманов Э.Н., Чернов И.И., Тарасов Д.Г. Модифицированная операция Росса (литературный обзор). Российский кардиологический журнал. 2022;27(1S):4854. https://doi.org/10.15829/1560-4071-2022-4854
Скопировать