Взаимосвязь сортилина и пропротеиновой конвертазы субтилизин-кексинового типа 9 сыворотки крови с тяжестью каротидного и коронарного атеросклероза у пациентов с гипертонической болезнью
По данным Всемирной организации здравоохранения ежегодно >7 млн человек переносят инфаркт миокарда (ИМ), ассоциирующийся с высокими показателями смертности, инвалидизации, значимым социально-экономическим ущербом [1][2]. Снижения летальных исходов после ИМ удалось достичь за счет оптимизации лечебно-диагностических и реабилитационных мероприятий, расширения сети центров с круглосуточной доступностью эндоваскулярных и кардиохирургических вмешательств, улучшения фармакотерапии хронических форм ишемической болезни сердца (ИБС) и сопутствующих заболеваний [1]. У 20-35% пациентов, переживших ИМ, следующие 5 лет сохраняется высокий риск новых ишемических событий (ИМ, инсультов, нестабильной стенокардии), в связи с чем актуальна проблема совершенствования вторичной профилактики повторных коронарных катастроф [3].
В настоящее время после ИМ внимание акцентируется на оптимизации приверженности к прогнозулучшающей терапии (антитромботических, гипотензивных, липидснижающих препаратов), коррекции коморбидной патологии, менее востребованными остаются подходы к модификации образа жизни пациентов (изменения проатерогенных стереотипов питания; коррекция физической активности (ФА); нивелирование постинфарктных психологических расстройств; отказ от курения и избыточного употребления алкоголя; нормализация массы тела) [4]. Несмотря на высокую эффективность последних мероприятий после ИМ, врачи сталкиваются со сложностями реализации данного подхода, что связано с низкой информированностью пациентов о его положительном влиянии, недостаточностью доказательных данных по должной модификации жизни.
Первично в поведенческой коррекции постинфарктного периода следует рассматривать вопрос повышения ФА для борьбы с гиподинамией, ассоциированной с 6% кардиоваскулярных смертей [5][6]. Росту гиподинамии способствуют урбанизация, роботизация труда и цифровизация современной жизни, между тем доказано, что в постинфарктном периоде благоприятно наращивание ФА, минимизируя иммобилизацию. Косвенным подтверждением этому является факт высокой госпитальной летальности при ИМ в 1950-х годах, когда пребывание пациентов в постельном режиме продолжалось до 34 сут. и повышало риск тромбоэмболических осложнений [7].
Несомненным является протективное действие повышения ФА при первичной профилактике в общей популяции, однако данные по вторичной профилактике ИМ немногочисленны и противоречивы [8][9]. Регистр SWEDEHEART SEPHIA стал первым исследованием, оценившим влияние ФА на прогноз 22227 пациентов после ИМ [10]. Уровень ФA регистрировался пациентами на 6-10 нед. и 10-12 мес. после острого коронарного синдрома (ОКС).
Выявлено, что по сравнению с малоподвижными пациентами, в группе постоянно активных пациентов (отношение рисков (ОР): 0,29, 95% доверительный интервал (ДИ): 0,21-0,41), а также группах пациентов с повышенной ФА (ОР: 0,41, 95% ДИ: 0,31-0,55) и пониженной ФА (ОР: 0,56, 95% ДИ: 0,45-0,69) годовая смертность ниже. Пациенты с ИМ, повысившие за месяц ФА, имели показатели смертности ниже малоактивных больных, дальнейшее же амбулаторное увеличение ФА было благоприятно для выживаемости. Наибольший протективный эффект выявлен среди постоянно активных пациентов после ИМ, пациентов, увеличивших ФА за 6-10 нед. при снижении фракции выброса левого желудочка (<40%) [10].
Согласно российским рекомендациям по ведению пациентов с ИМ, необходимо до 2-6 нед. от ОКС начать умеренную дозированную контролируемую ФА с акцентом упражнений на выносливость [11]. В качестве целевой обозначается частота физических тренировок (ФТ) (по 2,5 ч каждая) не менее 3 раз в нед. (оптимально — ежедневно). Упражнения следует выполнять с постоянной интенсивностью или ее наращиванием при детренированности организма, а также при наличии сердечной недостаточности. Подбор ФА после ИМ необходимо проводить в медицинском учреждении с учетом результатов нагрузочных проб. Предпочтительным видом ФА при ИБС считается аэробная активность, однако это не исключает упражнений силовой направленности [12]. Формирование персонифицированного плана ФТ после ИМ возложено на мультидисциплинарные бригады (реабилитолог, врач лечебной физкультуры, физиотерапевт) [13].
Выполнение рекомендаций по ФА после ИМ сопряжено с рядом вопросов, требующих решения, в частности: врачи сомневаются в реальной эффективности ФА по прогностическому влиянию после ИМ; пациенты испытывают недоверие к физической реабилитации (ФР), что отражается в их низкой приверженности к этим методикам при самостоятельном выполнении; отсутствуют доступные стандартизированные способы контроля за режимом ФА пациента; нет утвержденных алгоритмов подбора режима ФА в постинфарктном периоде.
Цель настоящего обзора — представить актуальные научно-обоснованные взгляды на эффективный и безопасный режим ФА для оптимальной вторичной профилактики после ИМ, а также спорные и нерешенные вопросы ФР после ИМ.
Материал и методы
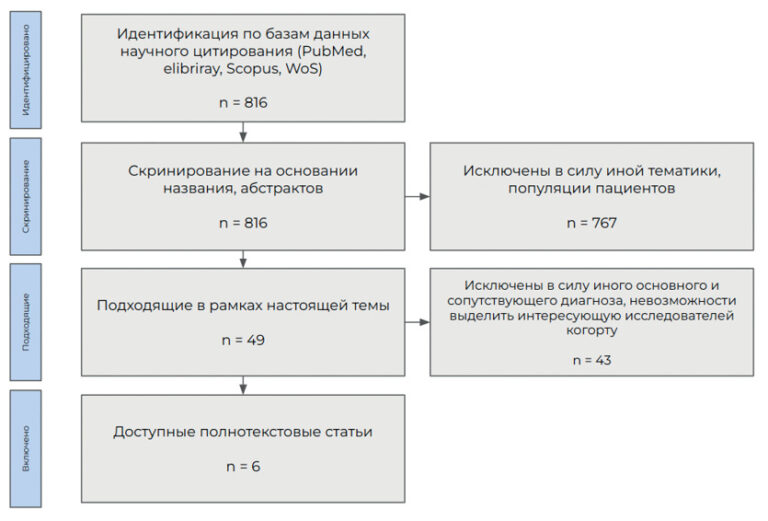
Поиск литературы по теме обзора осуществлен в базах данных Medline (https://pubmed.ncbi.nlm.nih.gov/), в полнотекстовой базе журналов издательства Wiley на платформе Wiley Online Library (https://onlinelibrary.wiley.com/) и издательства Elsevier (https://www.sciencedirect.com/), научной электронной библиотеке (elibrary.ru). В анализ включались источники с рисунка 1.

Рис. 1. Блок-схема CONSORT
Ключевыми словами на русском языке в поиске являлись: физическая активность, инфаркт миокарда, повторные сердечно-сосудистые катастрофы, вторичная профилактика; на английском — physical activity, myocardial infarction, recurrent cardiovascular events, secondary prevention. Для повышения специфичности и ограничения чувствительности поиска использовался оператор “AND”. Поиск проводился и по литературе анализируемых статей.
Результаты и обсуждение
Увеличение ФА после ИМ — эффективный подход в улучшении мышечного метаболизма, вазодилатации и наращивании пикового потребления кислорода мышцами, включая миокард, что сопровождается положительным действием на сердечнососудистую систему (адаптивное, антиатерогенное и антиаритмическое) и на основные факторы кардиоваскулярного риска (дислипидемию, ожирение, артериальную гипертензию, сахарный диабет, психологический дистресс) [14] (табл. 1).
Таблица 1
Основные результаты

Сокращения: ИМ — инфаркт миокарда, ФА — физическая активность, ФТ — физические тренировки.
В исследованиях на животных уникальной особенностью ФА в постинфарктном периоде показано ингибирование процессов системного воспаления, перекисного окисления липидов, ремоделирования и фиброзирования миокарда, профилактики систолической дисфункции за счет прекондиционирования на молекулярном уровне, выраженного антиоксидантного и антиапоптотического эффектов [15][16]. Kapusta J, et al. (2016) также определили наличие связи ФТ, выполняемых пациентами в постинфарктном периоде, с увеличением показателей сердечного выброса, ударного объема, сократимости миокарда, повышением толерантности к нагрузкам, снижением концентрации натрийуретического пептида, показав, что дезадаптивные изменения модифицируются по мере наращивания ФА после ИМ с дозозависимым эффектом (р<0,0001) [17].
Несмотря на эффективность повышения ФА после ИМ, приверженность пациентов к ФР лимитируется множеством факторов, среди которых доминируют деструктивные поведенческие привычки пациентов (курение, нерациональное питание, депрессия, тревожность, выраженные личностные характеристики), а также отсутствие информационной поддержки, понятной для пациента и его окружения [18-20].
Имеются данные о влиянии на постинфарктный комплаенс к ФА пола пациентов: женщины чаще мужчин характеризуются низкой ФА как до ИМ, так и после него [21]. В этом же исследовании показана связь недостаточной ФА с традиционными ИБС коморбидностями: сахарным диабетом, артериальной гипертонией, ожирением (p<0,05). Tripp C, et al. (2020) показали, что для приверженности к модификации ФА в течение первых 90 дней постинфарктного периода значимым выступает молодой возраст пациента [22]. В связи с этим понятно, что комплаенс к ФТ после ИМ нельзя рассматривать изолированно от тяжести перенесенного ИМ, резидуальной стенокардии, коморбидности и возраста пациента, а также своевременности, полноценности и эффективности реваскуляризации миокарда [23].
Влияние на формирование постинфарктной приверженности к увеличению ФА оказывают социально-экономические показатели среды обитания пациента. Согласно результатам проспективного наблюдения исследования PURE, исходно включавшего 163397 человек в возрасте 35-70 лет, проживающих в городских и сельских поселениях 17 стран с различными доходами, показано, что достижение целевой ФА (?150 мин в нед. или ?600 МЕТ?мин в нед.) связано с экономическим благополучием государства. В странах с высоким и выше среднего уровнем доходов риск кардиоваскулярной смерти и развития ишемических событий в течение 6-9 лет при наличии сердечно-сосудистых заболеваний в анамнезе был ниже при большей ФА за нед. [24]. Мощным фактором комплаенса к ФА пациентов с ИМ выступает наличие социальной поддержки (статус в браке; проживание с партнерами, детьми, внуками; владение домашними животными), что дополнительно мотивирует к ФТ после ОКС [25]. В регистре CLARIFY численностью 32954 пациента с ИБС, выявлено, что приверженность к ФА определяется географией проживания, где низкая ФА объяснялась сложностью климатических и экологических условий для ФТ (p<0,0001) [26].
Важным в преодолении недостаточной приверженности и мотивации пациентов после ИМ к модификации жизни и ФА является доступность консультирования медицинскими специалистами. Такая практика в 22 странах Европейского Союза показала ответ на коррекцию образа жизни в постинфарктном периоде в 36,5% случаев [27]. В России изолированно от программ комплексной реабилитации оценка приверженности к ФА не проводилась, однако ее можно оценить как низкую, исходя из недостаточного комплаенса к общей ФР после ИМ [28]. Европейский подход к вторичной профилактике ИМ характеризуется внедрением цифрового сопровождения пациентов, в т.ч. в рамках ФТ с оценкой эффективности/безопасности режима. Пациент в течение реализации дистанционной программы остается максимально информированным представителями мультидисциплинарной команды [29]. Перспективными методиками стимуляции комплаенса к постинфарктному повышению ФА является проведение контролируемых групповых и индивидуальных занятий ФР при медицинских учреждениях, а также выдача по рецепту врача субсидированных государством абонементов на посещение ФТ под контролем реабилитолога [29]. При этом снижение рисков повторных сердечно-сосудистых событий и смерти за счет повышения ФА позиционируется равнозначным при занятиях на дому и в медицинских организациях [30]. На сегодняшний день эпидемиологически безопасными (в контексте коронавирусной инфекции) являются дистанционные ФТ, показавшие лучший годовой комплаенс пациентов после ИМ [30][31].
В качестве методик контроля двигательной активности постинфарктных пациентов могут применяться интерактивные образовательные приложения для мобильных телефонов и компьютеров, включающие дневники питания, учет фармакотерапии, данные акселерометрии пациента [32]. В ходе рандомизированных испытаний таких продуктов после ИМ получены противоречивые данные о прогностическом влиянии, в связи с чем их использование рекомендовано как альтернатива контролируемой реабилитации, когда последняя территориально недоступна [30][33]. Опция удаленного контроля ФА после ИМ применима у пациентов с имплантированными устройствами, где мониторинг осуществляется с помощью встроенных акселерометров с обратным автоматическим оповещением [22][32]. Дальнейшие исследования в области совершенствования мониторинга ФА, улучшения приверженности к ФТ, демонстрирующие роль государственной и общественной поддержки модификации ФА, имеют высокий научный и практический интерес. Еще одним аспектом, актуализирующим необходимость исследований ФА пациентов в постинфарктном периоде, является отсутствие алгоритмов подбора режимов ФТ с позиции их безопасности. Неопределенной остается форма аэробной ФА (профессиональная, бытовая, транспортная, рекреационная), наиболее влияющая на прогноз ИМ [33]. В одном исследовании показано отсутствие связи коронарных рисков при ИМ с высокой профессиональной ФА [34]. В другой работе отмечены преимущества рекреационной формы ФА в снижении смертности [35].
Спорен вопрос оптимальных сроков начала ФА после ИМ. Ряд авторов аргументируют преимущества отсроченного начала тренировочных программ ввиду ограничений двигательного режима, существующих в первые дни пребывания в стационаре с ИМ [36][37]. Другие утверждают, что эффективным и безопасным является старт ФА в первую неделю ИМ в силу отсутствия у 81% пациентов соматических ограничений для ходьбы по коридору и упражнений на месте [38]. Более половины больных с ИМ находятся в гиподинамии из-за боязни расширять двигательную активность.
Неопределенной остается оптимальная интенсивность ФА после ИМ. Barons М, et al. (2015) определили протективный эффект в постинфарктном периоде для тренировок средней и высокой интенсивности [39]. В другой работе эффективными и безопасными после ИМ признаются 9-недельные тренировки умеренной интенсивности [40]. Иные авторы считают, что снижение риска повторных коронарных событий достигается с помощью дозированного наращивания интенсивности ФА от легкой к умеренной, от умеренной к высокой за год от ИМ. При этом гендерные и клинические ограничения результатов не указываются [41].
Нет сомнений, что аэробная ФА (продолжительные динамические и ритмичные нагрузки с вовлечением групп больших мышц) благоприятно влияет на течение ИБС и постинфарктного периода, улучшает качество жизни [42]. Определены положительные эффекты ходьбы и бега при проведении амбулаторной реабилитации ИМ в отношении увеличения толерантности к физической нагрузке [43]. В этом же исследовании показано улучшение прогноза после ИМ у пациентов, самостоятельно занимавшихся ФА в виде езды на велосипеде, работы по дому и в саду, скандинавской ходьбы, танцев, лыж, катания на коньках, гребли или плавания [43]. Определено, что ходьба свыше 30 мин в день независимо от темпа ассоциировалась со снижением смертности на 29% в течение 14 лет после ИМ [42][43]. В постинфарктном периоде благоприятно дополнение аэробных тренировок упражнениями с отягощением для конечностей, улучшающих потребление кислорода и результаты теста 6-мин ходьбы (p=0,003 и 0,003, соответственно), а также ФТ с подвесной системой [44][45].
При подборе постинфарктному пациенту программы модификации ФА немаловажно определить ее продолжительность. В исследовании Ekblom O, et al. (2015) снижение частоты неблагоприятных исходов в постинфарктном периоде может достигаться при проведении регулярных ФТ в режиме двух и более сеансов упражнений в нед. продолжительностью не менее 30 мин в течение года. Однако авторы отмечают субъективность результатов в силу использования опросников самооценки объема ФА, а не объективных измерений [46]. Экспериментальные исследования мышей с ИМ и систолической дисфункцией показали, что эффективной в восстановлении насосной функции миокарда является редуцированная до 15 мин ФА на протяжении 3 мес. Marschner R, et al. (2019) показали оптимальную с позиции приверженности постинфарктных больных продолжительность ФР равную 3 мес. [47]. При этом имеются другие результаты, оценивающие эффективность увеличения ФА после ИМ. В работе Hvas A, et al. (2018) обращается внимание на возможность негативного влияния на агрегационную функцию тромбоцитов продолжительной ФА, совершаемой в течение 20 нед. после ИМ [48].
Исследования Hansen D, et al. (2010) и Sakalaki M, et al. (2019) показали, что долгосрочные программы ФТ (свыше 2 лет) после ИМ дают менее оптимистичные результаты, чем программы первых 12 мес., за счет снижения комплаентности пациентов, что ассоциируется с повышением риска смерти и повторных госпитализаций [49][50]. В связи с этим планируя длительные курсы повышения ФА, необходимо учитывать готовность пациентов долгосрочно следовать рекомендациям реабилитационной команды.
Анализ вышеуказанных проблем позволил алгоритмизировать задачи в рамках амбулаторного постинфарктного повышения ФА. Первично лечащему врачу рекомендуется проводить оценку толерантности пациента к ФА после: опрос, осмотр, оценка гемодинамики, анализ результатов электрокардиографии, велоэргометрии или тредмил-теста, теста 6-мин ходьбы, кардиопульмонального тестирования. Далее мультидисциплинарно обсуждать пациента: определять показания и противопоказания к ФТ; подбирать программу повышения ФА с учетом суточных бытовых, досуговых, транспортных и профессиональных физических нагрузок, клинического статуса, коморбидности, проявлений “хрупкости”, полноты реваскуляризации миокарда. В последующем включать пациента в бесплатные программы индивидуальных и групповых ФТ длительностью не <12 мес. после ИМ (контролируемых очно или с цифровым сопровождением). Редуцирование сроков до 3-6 мес. производить только при высоком риске неблагоприятных исходов. Требуется осуществлять мониторинг ФА (личный контроль медицинским работником, опросы, дистанционная акселерометрия): оценка приверженности к ФТ; анализ регулярности (целевой уровень 3-5 дней в нед. или ежедневно продолжительностью не <30 мин), дозированности и этапности в расширении двигательного режима (подготовительный, основной, поддерживающий), ступенчатости в наращивании объема и интенсивности (от минимальной — к средней, от средней — к высокой) ФА в соответствии с функциональными возможностями организма, достигнутыми к выписке из стационара. Следует проводить консультативную и мотивационную работы по вопросам постинфарктного повышения ФА в рамках обучающих школ для пациентов, а профессиональным медицинским сообществом популяризировать положительные эффекты здорового образа жизни и ФТ. Одним из путей стимулирования использования ресурса ФТ после ИМ рассматривать включение программ повышения ФА в стандарт медицинской помощи при ОКС, ИБС и хронической сердечной недостаточности, с финансовым поощрением пациентов, успешно освоивших ФР, со стороны государства или фондов медицинского страхования.
Для повышения приверженности врачей к программам постинфарктной ФР необходимо транслировать результаты наблюдательных регистровых исследований оценки ФА у пациентов с ИМ, а также проводить рандомизированные сравнения стандартного амбулаторного ведения пациентов с контролируемыми методами ФТ.
Заключение
Несмотря на доказанную роль гиподинамии в развитии и прогрессировании сердечно-сосудистых заболеваний, в реальной клинической практике у пациентов после ИМ использование врачами методов повышения ФА для вторичной профилактики остается недостаточным и вследствие этого является малоэффективной методикой для улучшения качества жизни и прогноза после ОКС. Преодоление барьеров к увеличению ФА в постинфарктном периоде должно осуществляться при социально-экономической и информационной поддержке государства, системы здравоохранения путем разработки и внедрения доступных программ ФТ, с возможностями контроля достижения целевой ФА.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Вуколова Ю.Ю., Губарева И.В. Взаимосвязь сортилина и пропротеиновой конвертазы субтилизин-кексинового типа 9 сыворотки крови с тяжестью каротидного и коронарного атеросклероза у пациентов с гипертонической болезнью. Российский кардиологический журнал. 2022;27(2S):4903. https://doi.org/10.15829/1560-4071-2022-4903
Скопировать