Тромбоэмболия легочной артерии у пациента с вирусной пневмонией: если не COVID-19, то грипп H1N1: на примере двух клинических случаев
Аннотация
В статье представлены два клинических случая развития тромбоэмболии легочной артерии (ТЭЛА) у пациентов с вирусными пневмониями. В одном случае — у пациента после перенесенной новой коронавирусной инфекции, во втором случае — у пациента с гриппом. Сравнительный анализ особенностей развития ТЭЛА у двух пациентов согласуется с литературными данными и подтверждает различия в предикторах развития тромбоэмболии и разную клиническую картину. ТЭЛА становится все более актуальной нозологией для врачей кардиологов. Подчеркивается важность понимания факторов риска ТЭЛА, особенностей клинической картины у пациентов с вирусными пневмониями в текущей эпидемиологической обстановке присутствия как новой коронавирусной инфекции, так и сезонных возбудителей, в т.ч. вируса гриппа.
В 2023г официально завершилась пандемия новой коронавирусной инфекции (COVID-19). Наблюдается снижение заболеваемости и вытеснение вируса COVID-19 сезонными возбудителями вирусных инфекцией, гриппом. Вирусные пневмонии ассоциированы с повышенным риском развития венозных тромбоэмболий (ВТЭ), тромбоэмболии легочной артерии (ТЭЛА). Актуальным становится изучение отдаленных последствий перенесенной COVID-19 и ее осложнений.
Риск ВТЭ при пневмониях, связанных с COVID-19, другими сезонными вирусными пневмониями и гриппом H1N1 может значительно различаться. На риск влияет тяжесть инфекции и связанная с ней госпитализация. У пациентов с пневмониями необходима оценка факторов риска ВТЭ. Это было актуальным и в допандемийный период [1].
Частота ВТЭ при COVID-19 в период пандемии в среднем регистрировалась на уровне 20% у среднетяжелых больных [2][3]. При гриппе у пациентов в отделениях интенсивной терапии ВТЭ ранее наблюдались с частотой 9% [4]. При штамме H1N1, при респираторном дистресс синдроме риск выше, частота осложнений ВТЭ может достигать 29,2% [4][5].
Данные по частоте развития тромбоэмболий противоречивы у амбулаторных и стационарных больных. Выявление COVID-19 у амбулаторных пациентов может не сопровождаться повышением риска ВТЭ [6]. В большом сетевом анализе с участием 909463 пациентов с COVID-19 в период с сентября 2020г по июль 2021г было показано, что частота ВТЭ среди амбулаторных пациентов составляет 0,2-0,8%, а стационарных 4,5% [7].
В ранний период пандемии большая группа исследователей в Испании провела анализ особенностей ВТЭ при COVID-19 [8]. Результаты демонстрируют частоту выявления ТЭЛА среди пациентов неотложных отделений в 10,91 выше в сравнении с допандемийным периодом [9].
Тяжесть инфекции остается сильным независимым предиктором развития тромботических осложнений даже при новых штаммах COVID-19 [10].
Понимание различий в факторах риска, предикторах, особенностях клинической картины ТЭЛА, ассоциированной с COVID-19 и другими инфекциями и прежде всего гриппом является актуальным, требующим дополнительного внимания врачей.
Клинический случай 1
Клиническая характеристика пациента. Пациент, женщина, 48 лет, без анамнеза хронических заболеваний, аллергий, вредных привычек, от коронавирусной инфекции не вакцинирована. Заболела остро в конце августа 2020г — появился кашель, озноб, лихорадка до 37,5 С. Обратилась за медицинской помощью, по данным рентгенографии выявлена двусторонняя интерстициальная пневмония с высокой вероятностью COVID-19. Диагностирована COVID-19. Диагноз подтвержден иммунологически (мазок из зева и носа на SARS-COV-2 с проведением теста полимеразной цепной реакции (ПЦР), дополнительно проводилось определение в крови антител к SARS-COV-2). Пациентка госпитализирована в специализированное отделение для лечения пациентов с COVID-19. Получала терапию цефтриаксоном 2 г/сут., левофлоксацином 1000 мг/сут., дексаметазоном 8 мг/сут., умифеновиром 800 мг/сут., нефракционированным гепарином 10000 ЕД/сут. (данные по лабораторному контролю активированного частичного тромбопластинового времени (АЧТВ) недоступны).
На 9 сут. состояние пациентки тяжелое, сохранялся кашель, выраженная одышка в покое. Выполнена компьютерная томография (КТ) легких с контрастированием. Выявлена двусторонняя полисегментарная пневмония объемом поражения 75%, признаки ТЭЛА сегментарных ветвей правой легочной артерии. Продолжена терапия, в т. ч. лечебные дозы гепарина.
На 12 сут. мазок из зева и носа на SARS-COV-2 — «отрицательный». Принято решение о переводе в кардиологическое отделение.
При поступлении в кардиологическое отделением жалобы на одышку в покое, малопродуктивный кашель. Общее состояние тяжелое. Сознание ясное. Положение активное. Индекс массы тела 35,1 кг/м2. Кожные покровы бледные. При аускультации легких дыхание ослабленное везикулярное, хрипов нет, частота дыхания 16 в мин. Сатурация крови 96%. Тоны сердца приглушены, ритмичные, частота сердечных сокращений (ЧСС) 62 в мин. Артериальное давление 120/70 мм рт.ст. Печень по краю реберной дуги, периферических отеков нет. PESI 48 баллов (возраст 48 лет + 0 баллов за дополнительные критерии) — риск низкий, sPESI 0 баллов (риск низкий). На электрокардиограмме (ЭКГ) — синусный ритм с ЧСС 66 в мин, электрическая ось сердца горизонтальная. Минимальные реполяризационные изменения. Продолжена терапия цефтриаксоном 2 г/сут., нефракционированным гепарином до 1500 ЕД/ч внутривенно капельно, назначен варфарин 5 мг/сут. (назначение варфарина и нефракционированного гепарина отражает рутинную практику на момент заболевания пациента, данные по не витамин К-зависимым пероральным антикоагулянтам у пациентов с COVID-19 на тот момент были недостаточны). Также назначался ацетилцистеин 600 мг/сут., омепразол 20 мг/сут. Выполнена эхокардиография (ЭхоКГ). Данных за перегрузку правых отделов не выявлено (подробный протокол исследования недоступен). По данным ультразвукового исследования вен нижних конечностей нарушения проходимости в поверхностных и глубоких венах не выявлено.
На 20 сут. состояние пациентки с положительной динамикой — одышка, кашель уменьшились. По данным КТ легких положительная динамика — картина вирусной пневмонии в стадии обратного развития.
На 23 сут. пациентка выписана из стационара с диагнозом: Тромбоэмболия сегментарных ветвей низкого риска. Двусторонняя полисегментарная пневмония. Реконвалесцент COVID-19. Терапия при выписке варфарин 2,5 мг в сут. ежедневно под контролем международного нормализованного отношения (МНО).
Через 1 год у пациентки одышка только при значительной физической нагрузке. Дистанция 440 м по данным теста 6-минутной ходьбы. Нормальный уровень N-концевого промозгового натрийуретического пептида 21,2 пг/мл (N<125 пг/мл). По данным ЭхоКГ патологических изменений не выявлено (табл. 1). По данным КТ с контрастированием (проводилось планово при динамическом обследовании после перенесенной тромбоэмболии) — нарушений кровотока не выявлено. Пациентка консультирована гематологом, при обследовании выявлены мутации, предрасполагающие к тромбообразованию: ITGA2 гомозигота, PAI-1 гетерозигота. Пациентка продолжила прием антикоагулянта. В связи с трудностями контроля МНО варфарин отменен, назначена терапия апиксабаном 5 мг дважды в сут. В связи с отсутствием повторных тромбоэмболических событий в течение 12 мес. доза апиксабана снижена до 2,5 мг дважды в сут.
Через 3 года наблюдается незначительная одышка (1 балл по шкале Борга), Дистанция 438 м по данным теста 6-минутной ходьбы. По данным ЭхоКГ патологические изменения отсутствуют (табл. 1). С учетом недостаточных научных данных об отдаленном прогнозе, риске повторных событий у пациентов с перенесенной ТЭЛА и COVID-19, с пациенткой обсуждено и принято решение о продолжении терапии апиксабаном 2,5 мг 2 раза/сут. Рекомендовано наблюдение и повторное обсуждение вопроса о продолжении продленной антикоагулянтной терапии при отсутствии повторных тромбоэмболических событий.
Лабораторные данные. При переводе в кардиологический стационар — минимальные воспалительные изменения, лимфопения, тромбоцитопения: лейкоциты крови — 10,06×109/л (N: 4,37-9,68), нейтрофилы 71,6% (N: 42,5-73,2), лимфоциты 14,8% (N: 18,2-47,4), гемоглобин 129 г/л (N: 106-135), тромбоциты 142×109/л (N локальной лаборатории: 186-353; N (по Всемирной организации здравоохранения): 150-400), тропонин Т 0,008 нг/мл (N: 0-0,014), Д-димер 640 мкгFEU/мл (N<500), холестерин липопротеинов низкой плотности 4,92 ммоль/л (N: 0,01-2,59), билирубин общий 16 мкмоль/л (N: 5-21), АЧТВ 105,3 сек (N: 28,6-38,2), МНО 1,54 (N: 0,8-1,2), креатинин 77 мкмоль/л (N: 44-80), скорость клубочковой фильтрации (СКФ) (EPI) 82 мл/мин (N: 90-140), глюкоза 5,3 ммоль/л (N: 4,1-5,9).
При выписке — положительная динамика показателей: лейкоциты крови — 8,6×109/л (N: 4,37-9,68), нейтрофилы 70% (N: 42,5-73,2), лимфоциты 14% (N: 18,2-47,4), тромбоциты 162×109/л (N локальной лаборатории: 186-353; N (по Всемирной организации здравоохранения): 150-400), МНО при выписке 2,8.
Инструментальные данные. При переводе в кардиологическое отделение на ЭКГ синусный ритм с ЧСС 66 уд./мин, электрическая ось сердца горизонтальная, минимальные реполяризационные изменения (рис. 1).
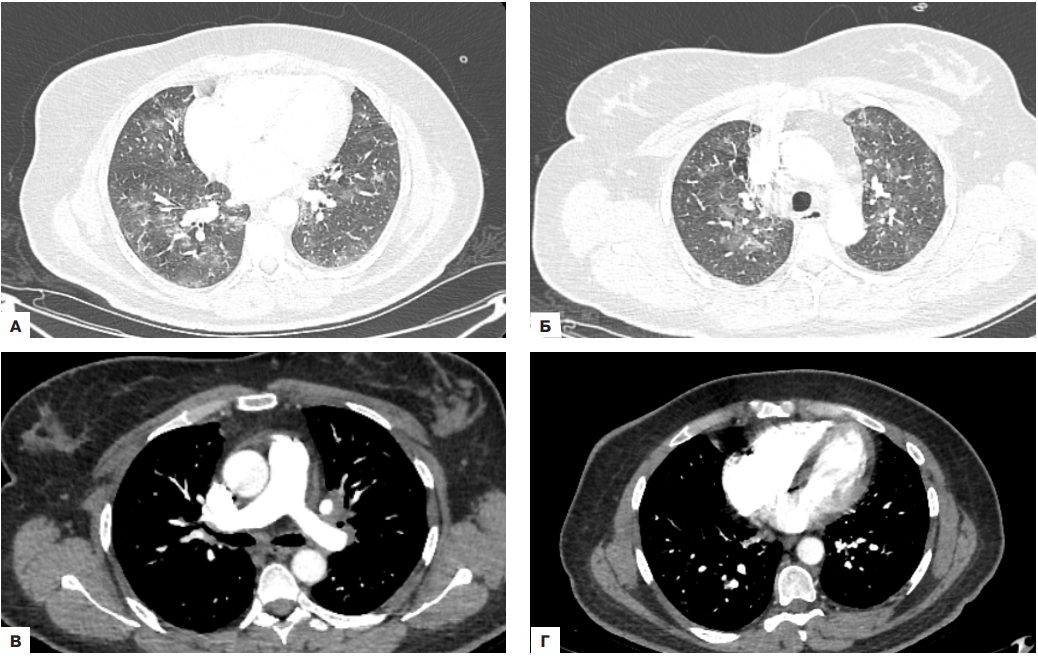
При проведении КТ-ангиографии легких выявлены признаки двусторонней полисегментарной пневмонии объемом поражения до 75%, признаки тромбоэмболии сегментарных ветвей правой нижнедолевой легочной артерии (рис. 2).
По данным ЭхоКГ в динамике через 1 год и 3 года отсутствуют признаки структурно-функциональных нарушений (табл. 1, рис. 3).
Таблица 1
Трансторакальная ЭхоКГ через 1 и 3 года
|
Показатель |
Значение через 1 год |
Значение через 3 года |
Норма |
|
Ствол легочной артерии |
19 |
23 |
≤25 мм |
|
Правый желудочек (4к) |
32 |
37 |
≤42 мм |
|
Площадь правого предсердия |
14 |
14 |
≤18 см2 |
|
Индекс объема левого предсердия |
15 |
23 |
≤34 мл/м2 |
|
Конечно-диастолический размер левого желудочка |
44 |
43 |
≤55 мм |
|
Индекс массы миокарда левого желудочка |
57,27 |
62,52 |
≤95 г/м2 |
|
Фракция выброса левого желудочка |
71 |
54 |
≥55% |
|
Скорость трикуспидальной регургитации |
1,4 |
2,1 |
≤2,8 м/сек |
|
Среднее давление в легочной артерии |
9,5 |
≤20 мм рт.ст. |
|
|
Систолическое давления в легочной артерии |
21 |
≤30 мм рт.ст. |
|
|
Экскурсия фиброзного кольца трикуспидального клапана |
21 |
23 |
>16 мм |
|
Время ускорения кровотока в правом желудочке |
108 |
115 |
>105 мсек |
|
Фракционное изменение площади правого желудочка |
37 |
42 |
32-60% |
|
Нижняя полая вена, колабирование |
>50% |
18, >50% |
≤25 мм, >50% |

Рис. 1. ЭКГ.
Примечание: демонстрируется отсутствие признаков перегрузки правых отделов сердца.

Рис. 2. КТ легких с контрастированием.
Примечание: демонстрируются признаки двусторонней интерстициальной пневмонии с объемом поражения до 75% (А, Б). Отсутствуют тромботические изменения в крупных ветвях легочной артерии (В). Присутствуют признаки сегментарного и субсегментарного тромботического поражения правой нижнедолевой легочной артерии (Г).

Рис. 3. Трансторакальная ЭхоКГ через 3 года.
Примечание: демонстрируется отсутствие увеличения размеров правого желудочка (А, Б), отсутствие значимых структурно-функциональных изменений, низкая вероятность легочной гипертензии (В, Г).
Клинический случай 2
Клиническая характеристика пациента. Пациент, мужчина, 36 лет, без анамнеза хронических заболеваний, аллергий, вредных привычек, от гриппа не вакцинирован. Заболел остро в конце декабря 2022г — появился озноб, головная боль, боль в мышцах, лихорадка до 38,7 С. Самостоятельно начал принимать ингавирин, нестероидные противовоспалительные препараты. На следующий день осмотрен терапевтом по месту жительства, продолжено амбулаторное лечение (данных по изменению терапии нет).
На 5 сут. состояние с отрицательной динамикой, появился приступообразный сухой кашель, одышка при небольшой физической нагрузке, сохранялась фебрильная лихорадка. Повторно осмотрен терапевтом, выполнена рентгенография органов грудной клетки, выявлена двусторонняя пневмония. Экспресс тест на SARS-COV-2 — «отрицательный», экспресс тест на грипп А — «положительный». Пациент госпитализирован в инфекционное отделение с диагнозом «Грипп А. Внебольничная вирусная двусторонняя нижнедолевая пневмония, средней степени тяжести». Проводилось лабораторное обследование, в т. ч. посев мокроты. Назначена терапия: осельтамивиром 75 мг 2 раза/сут., левофлоксацин 500 мг внутривенно 2 раза/сут., дезинтоксикационная терапия.
На 7 сут. общее состояние пациента средней степени тяжести. Сознание ясное. Положение активное. Индекс массы тела 22,2 кг/м2. Кожные покровы физиологической окраски, без экзантем. Температура тела 36,2 С. Сатурация крови пульсоксиметром 97%. Дыхание в легких жесткое, хрипы в нижних отделах легких. Частота дыхания 18 в минуту. Тоны сердца ясные, ритмичные, шумы не выслушивались. Левая нижняя конечность отечная, цианотичная, болезненная при пальпации. Пациент консультирован хирургом, заподозрен острый бедренный венозный тромбоз. Данных по антикоагулянтной терапии нет. Дополнительно выполнен ПЦР тест на РНК вируса гриппа А и B — результат в динамике «отрицательный». Принято решение о переводе пациента из инфекционного стационара для лечения тромбоза.
Во время транспортировки пациента бригадой скорой помощи резкое ухудшение состояния, появление акроцианоза верхней половины тела, снижение артериального давления, потеря сознания. Пациент доставлен в реанимационное отделение Центра кардиологии и неврологии.
При поступлении общее состояние крайне тяжелое. Сознание — кома. Искусственная вентиляция легких (ИВЛ). При аускультации легких дыхание ослабленное везикулярное, рассеянные сухие хрипы, частота дыхания 22 в мин. Сатурация крови 88%. Тоны сердца глухие, аритмичные, ЧСС 128 уд./мин. Артериальное давление на инотропной поддержке 80/60 мм рт.ст. Отек левой голени. На ЭКГ — фибрилляция предсердий, признаки перегрузки правых отделов сердца. Выполнена КТ легких с контрастированием, выявлена массивная ТЭЛА, двусторонняя полисегментарная пневмония. Принято решение о проведении системного тромболизиса алтеплазой 100 мг. Также проводилась терапия гепарином 1000 ЕД/ч внутривенно, левофлоксацин 500 мг внутривенно 2 раза/сут., цефтазидим 2 г 3 раза/сут. внутривенно, адреналин 2 мкг/кг/мин, омепразол 40 мг внутривенно.
На 8-9 сут. с момента начала заболевания состояние пациента тяжелое с некоторой положительной динамикой. Стабилизация гемодинамики, адреналин отменен, артериальное давление 110/70-135/75 мм рт.ст. Диурез достаточный. На ЭКГ синусовый ритм с ЧСС 110 уд./мин, признак Kosuge. Продолжена аппаратная ИВЛ, сатурация крови 94-99%. Сознание — заторможен, реагирует на раздражители, пытается выполнять простые команды. Сохранялась фебрильная лихорадка до 40 С. В анализах показатели гемоглобина без значимой динамики. Некоторая положительная динамика в уровне тромбоцитов. Признаков кровотечения нет. Принято решение о проведении антикоагулянтной терапии нефракционированным гепарином, назначен варфарин 2,5 мг в сут. (планировался перевод на продленную терапию варфарином). Изменение ранее назначенной эмпирически антибактериальной терапии не проведено. Планировался повторный посев мокроты, далее коррекция.
На 10 сут. у пациента геморрагический синдром сначала в виде появления подкожных гематом, далее кровотечение из глотки и вероятно верхних отделов желудочно-кишечного тракта. Принято решение о приостановке терапии антикоагулянтами, проведена заместительная терапия свежезамороженной плазмой и эритроцитной массой. Далее после стабилизации гемостаза проведена коррекция антикоагулянтной терапии, назначен фондапаринукс 7,5 мг в сут.
На 11 сут. состояние пациента тяжелое с отрицательной динамикой — прогрессирование дыхательной недостаточности, развитие полиорганной недостаточности.
На 12 сут. несмотря на проводимую терапию у пациента остановка дыхания, кровообращения, реанимационные мероприятия без эффекта.
Труп пациента направлен на патологоанатомическое исследование с диагнозом: Основное заболевание по типу конкурирующих: 1. Острый венозный бедренный тромбоз. 2. Внебольничная двусторонняя полисегментарная пневмония тяжелой степени. Реконвалесцент по гриппу А. Осложнения: ТЭЛА. Острая легочно-сердечная недостаточность. Тромбоцитопения. Желудочно-кишечное кровотечение вероятно из глотки и верхних отделов желудочно-кишечного тракта. Сопутствующий: Фибрилляция предсердий, впервые выявленная со спонтанным восстановлением синусного ритма. EHRA IV.
По результатам исследования выявлено совпадение диагноза, выдано медицинское свидетельство о смерти с диагнозом: I. а) Острая респираторная недостаточность; б) Абсцесс лёгкого с пневмонией (J85.1) II. Тромбоз и эмболия других уточненных вен (I82.8).
Лабораторные данные. 5 сут.: Экспресс тест на SARS-COV-2 — «отрицательный», Экспресс тест на грипп А — «положительный».
5 сут. (инфекционное отделение) — определялись воспалительные изменения в лабораторных показателях: лейкоциты крови — 13,9×109/л (N: 4-9), гемоглобин — 144 г/л (N: 126-172), тромбоциты 114×109/л (N: 180-320), С-реактивный протеин — 305 мг/л (N: 0-1), креатинин 106 мкмоль/л (N: 62-124), СКФ (EPI) 80 мл/мин (N: 90-140), глюкоза 8,25 ммоль/л (N: 3,9-6,1), фибриноген 7,26 г/л (N: 2-4). В общем анализе мокроты большое количество лейкоцитов, в остальном без особенностей. Бактериологическое исследование мокроты — не информативно.
6 сут. (инфекционное отделение): лейкоциты крови — 9,8×109/л (N: 4-9), гемоглобин — 137 г/л (N: 126-172), тромбоциты 95×109/л (N: 180-320), С-реактивный протеин — 217,2 мг/л (N: 0-1), креатинин 76,5 мкмоль/л (N: 62-124), СКФ (EPI) 115 мл/мин (N: 90-140), глюкоза 6,13 ммоль/л (N: 3,9-6,1), ферритин 840,7 нг/мл (N: 20-300), МНО 1,44 (N: 0,8-1,2), АЧТВ 37,7 сек (N: 28,6-38,2), Д-димер 4444 нг/мл DDU (N <243 нг/мл). ПЦР-анализ РНК вируса гриппа А и B, коронавируса 2019 — nCoV, РС-вируса, метапневмовируса, риновируса, коронавируса, ДНК бокавируса, РНК парагриппа 1, 2, 3, 4 типа — все типы вирусов «не обнаружено». Кислотно-щелочная среда (КЩС): pO2 72,9 мм рт.ст. (N: 34,5-45); pCO2 35,9 мм рт.ст. (N: 45-58); pH 7,379 (N: 7,26-7,36); tHb 13,97 г/дл (N: 11,5-17,4); натрий 138,9 ммоль/л (N: 135-148); хлориды 103 ммоль/л (N: 95-110); кальций 1,261 ммоль/л (N: 1,12-1,32); калий 4,04 ммоль/л (N: 3,5-5,5); BE -3,8 ммоль/л (N: -2,3-2,3); BE ecf -4,4 ммоль/л (N: -2,9-2,9); cHCO3st 20,7 ммоль/л (N: 22-27); ctO2 18,5 ммоль/л (N: 18,8-22,3); при FIO=0,21 (РаО2/FIO2 =243 мм рт.ст.).
7 сут. (кардиологический стационар, отделение реанимации) — воспалительные изменения, тромбоцитопения, признаки тромбоза, повреждения миокарда: лейкоциты крови — 12,24×109/л (N: 4,37-9,68), гемоглобин — 114 г/л (N: 119-154), тромбоциты 22×109/л (N: 186-353), тропонин Т 0,045 нг/мл (N: 0-0,014), Д-димер >20 мкгFEU/мл (N<500), холестерин липопротеинов низкой плотности 1 ммоль/л (N: 0,01-2,59), билирубин общий 4,2 мкмоль/л (N: 5-21), АЧТВ 89,6 сек (N: 28,6-38,2), МНО 2,34 (N: 0,8-1,2), креатинин 130 мкмоль/л (N: 44-80), СКФ (EPI) 63 мл/мин (N: 90-140), глюкоза 10,2 ммоль/л (N: 4,1-5,9).
8 сут. (кардиологический стационар, отделение реанимации) — сохранялись воспалительные изменения, анемия, тромбоцитопения: лейкоциты крови — 14,64×109/л (N: 4,37-9,68), гемоглобин — 111 г/л (N: 119-154), тромбоциты 52×109/л (N: 186-353), АЧТВ 61,9 сек (N: 28,6-38,2), МНО 1,47 (N: 0,8-1,2).
10 сут. — прогрессирующая анемия: лейкоциты крови — 14,8×109/л (N: 4,37-9,68), эритроциты 2,46×1012/л (N: 4,18-5,48), гемоглобин — 81 г/л (N: 119-154), гематокрит 23,1% (N: 36,2-46,3), тромбоциты 73×109/л (N: 186-353), АЧТВ 36,9 сек (N: 28,6-38,2), МНО 1,63 (N: 0,8-1,2), креатинин 300 мкмоль/л (N: 44-80), СКФ (EPI) 23 мл/мин (N: 90-140). КЩС: pO2 191 мм рт.ст. (N: 83-108); pCO2 28,1 мм рт.ст. (N: 35-45); pH 7,402 (N: 7,35-7,45): ctHb 8,2 г/дл (N: 13,5-17,5); натрий 164,4 ммоль/л (N: 136-146); хлориды 130,4 ммоль/л (N: 98-106); кальций 1,22 ммоль/л (N: 1,15-1,29); калий 4,24 ммоль/л (N: 3,5-5,4); BE -7,7 ммоль/л; (N: -2-3), BE ecf -6,8 ммоль/л (N: -1,5-3); cHCO3st 18,9 ммоль/л (N: 22,5-26,9); ctO2 11,8 ммоль/л (N: 8,4-9,9); при FIO=0,7 (РаО2/FIO2 =372 мм рт.ст.) PEEP 6 см.вод.ст.
11 сут.: лейкоциты крови — 12,89×109/л (N: 4,37-9,68), эритроциты 2,57×1012/л (N: 4,18-5,48), гемоглобин — 83 г/л (N: 119-154), гематокрит 25%% (N: 36,2-46,3), тромбоциты 96×109/л (N: 186-353), КЩС: pO2 173,8 мм рт.ст. (N: 83-108); pCO2 62,4 мм рт.ст. (N: 35-45); pH 7,123 (N: 7,35-7,45): ctHb 8,3 г/дл (N: 13,5-17,5); натрий 170,9 ммоль/л (N: 136-146); хлориды 133,8 ммоль/л (N: 98-106); кальций 1,275 ммоль/л (N: 1,15-1,29); калий 5,67 ммоль/л (N: 3,5-5,4); BE -9,3 ммоль/л (N: -2-3); BE ecf -9,1 ммоль/л (N: -1,5-3); cHCO3st 16,9 ммоль/л (N: 22,5-26,9); ctO2 11,8 ммоль/л (N: 8,4-9,9); при FIO=0,7 (РаО2/FIO2 =247,1 мм рт.ст.) PEEP 6 см.вод.ст.
Инструментальные данные. При регистрации ЭКГ на 7 сут. выявлена фибрилляция предсердий с частотой сокращения 115-188 в мин, неполная блокада правой ножки пучка Гиса, элевация сегмента ST в правых грудных отведениях. На 8 сут. синусный ритм с частотой 111 в мин, нормальное положение электрической оси, неполная блокада правой ножки пучка Гиса, признаки перегрузки правого желудочка в виде отрицательных зубцов Т в правых грудных отведениях (рис. 4).
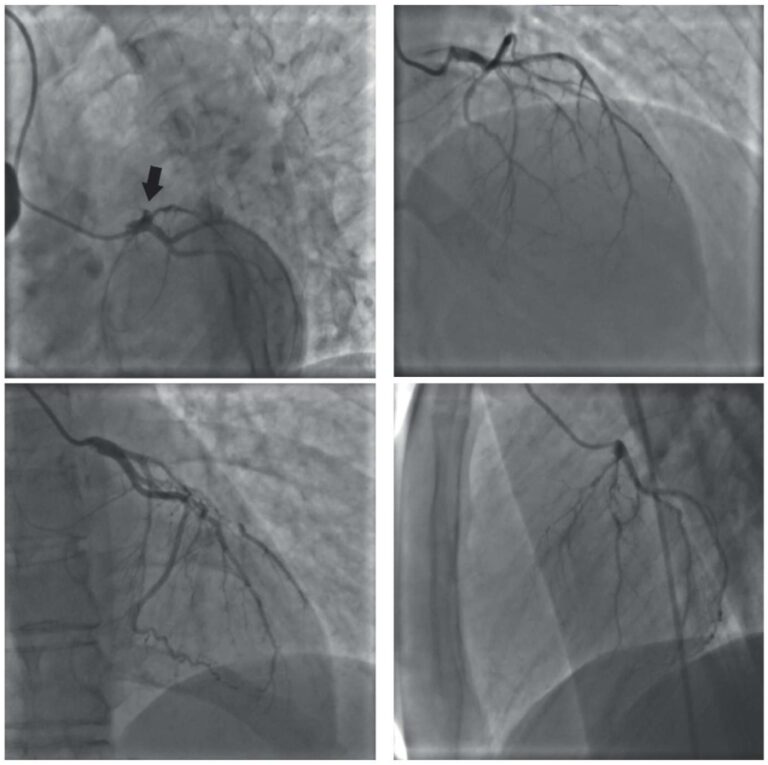
При проведении КТ-ангиографии легких выявлена двусторонняя массивная ТЭЛА (главных легочных артерий с распространением на долевые артерии с обеих сторон и среднедолевую артерию справа), двусторонняя полисегментарная пневмония (рис. 5).
ЭхоКГ на 10 сут. — визуализация резко снижена (пациенту проводилась ИВЛ, положение пациента на спине), исследование в полном объеме провести не удалось, информативность исследования неудовлетворительная: правый желудочек не расширен, правое предсердие 28 мм (N≤40 мм), объем левого предсердия 30 мл (N≤58 мл), конечно-диастолический размер левого желудочка 46 мм (N≤55 мм), масса миокарда левого желудочка 127,65 г, фракция выброса левого желудочка 74% (N≥55%), регургитация на трикуспидальном клапане I степени, среднее давление в легочной артерии 29 мм рт.ст. (N≤30 мм рт.ст.), нижняя полая вена 20 мм (N≤25 мм), коллабирует >50%.
По данным ультразвукового ангиосканирования вен нижних конечностей выявлен окклюзирующий бедренный тромбоз глубоких вен левой нижней конечности с флотацией (до 18 мм).
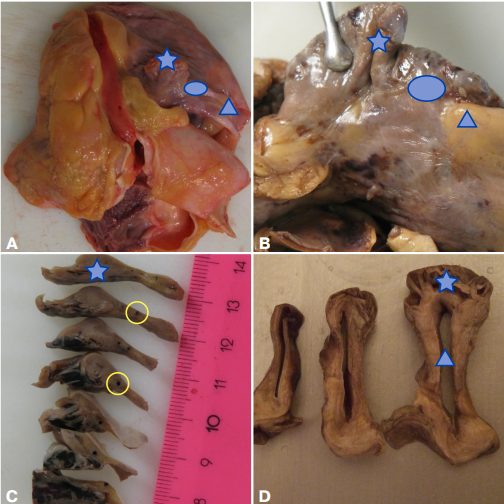
Протокол аутопсии (выборочно). Ткань обоих легких уплотнена, больше справа; на разрезах неоднородного серо-красного цвета с множественными очагами до 3 см, заполненных сливкообразным зеленоватым содержимым (рис. 6). В крупных сосудах посмертные сгустки крови. Сердце размерами 11,5×10,5×6,5 см, массой 300 г. Толщина миокарда левого желудочка 1,4 см, правого 0,3 см. Миокард на разрезе дрябловатой консистенции, красно-коричневого цвета, папиллярные мышцы не утолщены. Эндокард серый, тонкий, гладкий, блестящий. Клапаны без особенностей. Устья коронарных артерий зияют, просвет их сохранен, стенка их тонкая.

Рис. 4. ЭКГ.
Примечание: демонстрируется наличие фибрилляции предсердий (А) и далее синусной тахикардии (Б) с признаками перегрузки правых отделов сердца (инверсия зубцов Т в правых грудных отведениях).

Рис. 5. КТ легких с контрастированием.
Примечание: демонстрируются признаки двусторонней полисегментарной пневмонии, объемом поражения легочной ткани справа до 10%, слева до 60%. Справа в верхней доле единичные участки «матового стекла», в нижней доле тотальная зона конолидации с «воздушной бронхограммой» с частичным ателектазом S6 (А, Б). Двусторонняя массивная ТЭЛА (главных легочных артерий с распространением на долевые артерии с обеих сторон и среднедолевую артерию справа) (В, Г).

Рис. 6. Левое легкое при аутопсии.
Примечание: демонстрируется наличие признаков пневмонии — ткань легкого уплотнена, множественные очаги деструкции.
Таблица 2
Особенности ТЭЛА при COVID-19 и гриппе H1N1
|
COVID-19 |
Грипп |
|
|
Предикторы |
— тяжелое течение, в т. ч. при новых штаммах инфекции — ожирение — сахарный диабет 2 типа |
— штамм H1N1 — тяжелое течение, ОРДС — отсутствие вакцинации — мужской пол — бактериальная инфекция — отсутствие тромбопрофилактики |
|
Клиника |
— дистальное поражение легочной артерии — реже признаки перегрузки правых отделов по ЭКГ, эхокардиографии — дистальный тромбоз глубоких вен или тромбоз отсутствует — недостаточно данных при новых штаммах инфекции |
— классические симптомы и признаки |
|
Прогноз |
Определяется тяжестью COVID-19. Высокая летальность при сопутствующей сердечно-сосудистой патологии, сахарном диабете. Риск развития ХТЭЛГ недостаточно изучен. Данных о необходимости продленной антикоагулянтной терапии недостаточно |
Высокий риск летальности: до 30% при ОРДС |
Сокращения: ОРДС — острый респираторный дистресс-синдром, ХТЭЛГ — хроническая тромбоэмболическая легочная гипертензия, ЭКГ — электрокардиография, COVID-19 — новая коронавирусная инфекция.
Обсуждение
Повышение доступности современных диагностических методов, увеличение частоты встречаемости факторов риска ВТЭ в популяции, даже без учета COVID-19, приводит к повышению заболеваемости и частоты выявления ТЭЛА. Тенденция актуальна, в т. ч. среди госпитализированных пациентов с пневмониями вне зависимости от возбудителя.
По данным существующих публикаций, риск развития ТЭЛА при COVID-19 не укладывается в традиционные тромбоэмболические факторы риска (табл. 2). Многие характеристики связаны скорее с риском тяжелого течения COVID-19, чем ТЭЛА. У пациентов реже встречаются классические риски — предшествующие тромбоэмболии, прием эстрогенов, онкология [11]. У описываемой пациентки с COVID-19 отсутствовали значимые клинические факторы риска ВТЭ. Не совсем ясно, насколько существующие шкалы претестовой вероятности (Wells, Geneva), хорошо изученные при легочной эмболии (ЛЭ) в допандемийный период, применимы у больных с COVID-19 [12].
В описанном клиническом случае c COVID-19 тромботическое поражение легких носило дистальных характер, отсутствовал тромбоз глубоких вен нижних конечностей. Во многих исследованиях доказано, что у пациентов с COVID-19 реже встречаются классические симптомы и признаки. Для этих пациентов характерно поражение дистальных отделов легочной артерии, реже проксимальное массивное поражение, больше половины пациентов могут иметь ограниченное сегментарное поражение [13]. Поражение правых отделов по данным ЭКГ, ЭхоКГ, глубокий венозный тромбоз встречаются реже [9]. Особенности клинической картины сохраняются при развитии и выявлении ТЭЛА и в отделенном периоде [14][15]. При COVID-19 осложнения могут быть проявлениями первичного тромботического процесса на уровне мелких сосудов легких, не ассоциированным с глубоким венозным тромбозом in situ [16-18]. Иммунотромбоз с поражением мелких артерий может объяснять особенности ЛЭ при COVID-19. В пользу этой гипотезы — частота микротромбозов по данным исследований гистологии при COVID-19 достигает 57%, что выше, чем, например, при гриппе H1N1 (24%) [19].
Данные по прогностической роли ЛЭ при COVID-19 противоречивы. Пациенты с диагностированными тромбоэмболиями могут чаще лечиться в условиях отделений интенсивной терапии, иметь более длительные сроки лечения, чаще лечиться ИВЛ, но это не всегда ассоциировано с ухудшением прогноза [11]. В одном из исследований летальность была сопоставима в группах сравнения с COVID-19: 16% при ЛЭ в сочетании с COVID-19 против 16,6% у пациентов с COVID-19 без ЛЭ, но была значительно ниже в группе пациентов с ЛЭ без COVID-19 (6,5%) [9]. При попытке валидации шкалы PESI в одном из ретроспективных исследований демонстрируется недооценка с помощью шкалы риска смерти у больных с новой коронавирусной инфекцией [20]. В нашем случае наблюдалось относительно благоприятное течение заболевания. Пациентка выписана с улучшением.
Факторы риска заболеваемости и смертности при гриппе H1N1 сопоставимы с другими штаммами, включают: ожирение, иммуносупрессию, хронические заболевания легких, другая тяжелая коморбидность, низкий социально-экономический статус, недоступность медицинской помощи. Отличительной чертой может быть более молодой возраст [21]. Высокий риск сердечно-сосудистых осложнений и ВТЭ также являются отличительной чертой гриппа H1N1. Тяжесть течения инфекции определяет риск развития тромбозов [22].
Риск развития ВТЭ и прогноз при гриппе связан с развитием острого респираторного дистресс-синдрома (ОРДС). В одном из наблюдательных исследований демонстрируется, что штамм H1N1, присоединение бактериальной инфекции, мужской пол — являются факторами риска ВТЭ. Что особенно важно, у пациентов с ОРДС риск ТЭЛА выше в 23,3 раза [23]. Назначение гепарина может снижать риск тромбозов у пациентов с позитивным тестом на грипп H1N1 и не влияет на риск у других критических больных c ОРДС с негативным тестом на грипп H1N1. Пациенты без антикоагулянтов в данном исследовании имели в 33 раза чаще ВТЭ при гриппе Н1N1 [23]. Риск геморрагических событий может не зависеть от штамма вируса, связан в большей степени с сопутствующей тромбоцитопенией. Вакцинация снижает риск тяжелого течения гриппа, а вместе с этим риск всех осложнений, включая ВТЭ [24]. Протективный эффект вакцинации особенно высок у молодых пациентов. У нашего пациента — молодого невакцинированного мужчины с появлением тяжелой бактериальной инфекции — присутствовали все известные предикторы высокого риска развития ВТЭ. Назначение антитромботической терапии в соответствии с существующими рекомендациями, в т. ч. тромболитическая терапия, позволили стабилизировать пациента на короткое время. С учетом клиники в динамике, отсутствия массивного тромботического процесса по данным аутопсии, вероятно, можно предполагать эффективность тромболитической терапии. Сопутствующая тромбоцитопения, тяжесть состояния привели к тяжелым геморрагическим осложнениям. Тяжелая бактериальная инфекция с быстрым развитием полиорганной недостаточности в сочетании с другими осложнениями, к сожалению, не позволили спасти пациента.
В описанном случае с гриппом H1N1 нельзя исключить начальной фазы синдрома диссеминированного внутрисосудистого свертывания с гиперкоагуляцией на момент развития тромботических нарушений. Решение о поведении тромболитической терапии принято по жизненным показаниям исходя из клинической ситуации. Наблюдавшееся кровотечение — вероятно, сложное взаимоотношение как нарушений коагуляции, так и локальных факторов, связанных с интубацией трахеи, проведением ИВЛ. В пользу отсутствия возможного прогрессирования коагулопатии указывают лабораторные показатели на уровне терапевтической гипокоагуляции до кровотечения и незначительной гипокоагуляции после отмены антикоагулянтов при состоявшемся кровотечении. Тромбоцитопению нельзя однозначно объяснить развитием синдрома диссеминированного внутрисосудистого свертывания, ее причина не всегда может быть установлена у пациентов с вирусными инфекциями.
Важным вопросом является не только своевременное назначение, но и длительность антикоагулянтной терапии, необходимость продленной антикоагулянтной терапии [25, 26]. ТЭЛА может приводить к развитию хронической тромбоэмболической лёгочной гипертензии (ХТЭЛГ). Немногочисленные исследования показывают, что частота развития ХТЭЛГ у пациентов с ЛЭ и COVID-19, как минимум, не меньше, чем у пациентов без COVID-19. По данным разных авторов, составляет от 5 до 11% [27, 28]. Возможно, для развития ВТЭ недостаточно наличия COVID-19, она может рассматриваться как дополнительный триггер для реализации других факторов риска развития тромбоэмболии. У нашей пациентки при дальнейшем обследовании выявлены мутации, предрасполагающие к тромбообразованию. В связи с этим требуется дальнейшее изучение необходимости длительной антикоагулянтной терапии у пациентов с перенесенной COVID-19 и ВТЭ.
Заключение
ТЭЛА актуальная патология для врачей кардиологов и других специальностей. Риск развития ТЭЛА повышен при пневмониях, вызванных COVID-19, сезонным гриппом. В зависимости от возбудителя, заболевание может иметь разные предикторы и клиническую картину. С практической точки зрения важным является понимание существующих различий. Нами подчеркивается важность антикоагулянтной терапии у пациентов с тяжелым течением вирусных пневмоний. Дальнейшие исследования необходимы для оценки отдаленных исходов, обоснования целесообразности длительной антикоагулянтной терапии.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Кононов С.К., Соловьёв О.В., Метелев И.С., Назаров Д.Е., Пшеничникова А.В., Хомяков Д.А. Тромбоэмболия легочной артерии у пациента с вирусной пневмонией: если не COVID-19, то грипп H1N1: на примере двух клинических случаев. Российский кардиологический журнал. 2024;29(3S):5821. https://doi.org/10.15829/1560-4071-2024-5821. EDN: XJIBUV
Скопировать