Кардиомиопатия такоцубо. Обзор данных литературы: понятие, эпидемиология, патогенез. Часть I
Кардиомиопатия такоцубо (КТ) в клинической практике встречается все чаще, причем при самой разной патологии, что связано с улучшением диагностики заболевания. И вместе с тем до сих пор этот диагноз устанавливается не всегда, в первую очередь в связи с недостаточной осведомленностью врачей о данном заболевании.
Учитывая имеющийся большой объем информации в настоящее время по проблеме КТ и множество нерешенных вопросов, возникла необходимость проанализировать данные литературы и поделиться собственным опытом диагностики КТ.
КТ представляет собой форму острой и, как правило, обратимой сердечной недостаточности, провоцируемой у большинства пациентов различными стрессорными факторами, протекающей с транзиторной дисфункцией преимущественно левого желудочка (ЛЖ), клинически и электрокардиографически напоминающей острый коронарный синдром.
Целью обзора является анализ современных исследований, касающихся механизмов развития, клинических проявлений, диагностики и лечения КТ, выполненных в последние годы.
Материал и методы
Мы провели систематический поиск в базе данных PubMed по следующим ключевым словам: «stress cardiomyopathy», «cardiomyopathy takotsubo», «broken heart syndrome», «apical ballooning syndrome», «takotsubo syndrome», «transient apical ballooning syndrome» за период с 1 января 2010г по 1 января 2022г. По результатам поиска было проанализировано 170 источников литературы: согласительные документы, метаанализы, обзоры литературы, статьи, клинические случаи.
В первой части обзора будут изложены вопросы, касающиеся эпидемиологии, критериев диагностики и патогенетических механизмов заболевания. Во второй — клинические проявления, алгоритм обследования и подходы к лечению КТ.
Историческая справка
Впервые термин takotsubo (в переводе с японского «ловушка для ловли осьминога») был введен Sato H, et al. в 1990г, когда был опубликован отчет о пяти случаях КТ, спровоцированного стрессовой ситуацией, самый первый из которых был выявлен в 1983г в городской больнице в Хиросиме [1]. Термин takotsubo был использован в связи с тем, что при этом синдроме во время эхокардиографии (ЭхоКГ) и вентрикулографии у пациентов были выявлены изменения формы ЛЖ в виде горшка, напоминающего ловушку для осьминогов, применяемую в Японии. При этом наблюдалась акинезия верхушки ЛЖ при гиперкинезии базальных сегментов. Учитывая, что все случаи КТ первоначально встречались только в Японии, было высказано предположение о взаимосвязи КТ с азиатской расой. Однако уже в конце 1990-х гг французскими и американскими группами исследователей были опубликованы собственные клинические случаи КТ [1].
Вместе с тем анализ данных литературы показывает, что, по сути, впервые эта патология была представлена нашим соотечественником профессором Меерсоном Ф. З. в 1984г. Не хотелось бы обсуждать приоритеты, но тем не менее именно этот ученый обобщил имеющуюся к тому времени информацию о катехоламиновом повреждении миокарда у человека, а также результаты собственных экспериментов на животных, и эта болезнь была названа им стрессорной кардиомиопатией. Удивительно, но взгляды ученого на патогенез заболевания практически полностью соответствуют современным представлениям, о чем речь пойдет далее [1][2].
Эпидемиология
Точная распространенность КТ в настоящее время остается неизвестной. По данным различных регистров заболевание диагностируется у 1,0-2,5% пациентов, госпитализированных с подозрением на острый коронарный синдром [3]. В США на КТ приходится 0,02% госпитализаций [1]. Основную группу больных составляют женщины в период менопаузы, возраст которых, как правило, колеблется в диапазоне 60-70 лет, но в последнее время все чаще заболевание описывается у мужчин в возрасте 50-75 лет [1][4]. В научной литературе также были представлены случаи заболевания у детей, самый маленький из них — недоношенный ребенок, рожденный на 28-й нед. беременности. В последние годы в связи с появлением международных критериев и алгоритмов диагностики КТ стала диагностироваться чаще. Наиболее значимый рост заболеваемости (в 3-4 раза) был отмечен во время начала пандемии коронавирусной инфекции (COVID-19), что связывают с психологическим, социальным и экономическим стрессом у населения [5].
Критерии диагностики КТ
В экспертном документе по КТ в 2018г были представлены обновленные международные диагностические критерии заболевания InterTAK [1]:
- Преходящие признаки дисфункции ЛЖ чаще в области верхушки ЛЖ (апикальная форма) или его других областей. Возможно вовлечение правого желудочка. Региональное нарушение движения стенок обычно выходит за пределы кровоснабжения одной коронарной артерии, реже находится в пределах одной коронарной артерии (фокальный КТ).
- Предшествующий эмоциональный, физический или комбинированный триггер, однако это условие не обязательно.
- Неврологические нарушения (субарахноидальное кровоизлияние, ишемический инсульт и др.), а также феохромоцитома могут быть триггерами КТ.
- Вновь развившиеся изменения на электрокардиограмме: элевация сегмента ST, депрессия сегмента ST, инверсия зубца T и удлинение интервала QTc; в редких случаях (5%) изменения на электрокардиограмме отсутствуют.
- Уровни кардиоспецифических маркеров (тропонин и креатинкиназа МВ) умеренно повышены; типично существенное повышение значений N-концевого промозгового натрийуретического пептида.
- Обструктивное поражение коронарного русла не исключает КТ.
- Отсутствие признаков инфекционного миокардита (для исключения миокардита необходимо выполнить магнитно-резонансную томографию (МРТ) сердца).
- Заболевают преимущественно женщины в постменопаузе.
Как следует из приведенных рекомендаций, в отличие от предыдущих (клиника Мейо (2004, 2008гг), Европейского общества специалистов по сердечной недостаточности (2016г) [6]) и других, КТ может возникать не только вследствие эмоционального стресса, но и на фоне обострений соматической патологии (так называемые, физические триггеры), в т.ч. при феохромоцитоме; коронарный атеросклероз не исключает диагноз, а также помимо классического апикального варианта могут наблюдаться другие, о чем речь пойдет далее.
Триггеры КТ. Первичные и вторичные формы заболевания
Известно, что у большинства пациентов триггером для развития КТ является стресс, возникающий на фоне отрицательных эмоциональных реакций на различные жизненные ситуации: смерть близкого человека, ссоры и разводы, автомобильные и другие катастрофы, природные катаклизмы и т.д. Однако описаны случаи КТ, развивающейся при положительных переживаниях: юбилеи, свадьбы детей и внуков, денежные выигрыши — так называемое счастливое сердце «happy heart». Как уже упоминалось, КТ может возникнуть вследствие воздействия других причин: соматические заболевания, медицинские вмешательства, применение лекарственных препаратов. Эти триггеры в рекомендациях европейских экспертов названы физическими.
В зависимости от того, какой именно фактор привел к развитию заболевания, КТ разделяется на первичную, когда симптомы обратимой сердечной недостаточности являются причиной обращения за медицинской помощью и, как правило, возникают при воздействии эмоционального стресса, и — вторичную, развивающуюся на фоне воздействия физических триггеров [1][7]. По данным литературы, в 11-28% случаев не удается установить тот или иной пусковой фактор, вызвавший развитие КТ [1][4].
Ввиду того, что вторичная КТ наблюдается довольно часто, в 23% случаев среди всех причин [8], и с ней могут встретиться врачи разных специальностей, представляется целесообразным перечислить те основные заболевания и состояния, при которых описана КТ. Это такие медицинские вмешательства и ситуации, как анестезия, хирургические операции, прерывание беременности, выполнение радиочастотной аблации, проведение стресс-тестов, эндоскопические исследования и другие [1]. Следующие лекарственные средства описаны как спровоцировавшие развитие КТ: адреналин, добутамин, эргометрин, химиопрепараты и др. КТ описана при обострении бронхиальной астмы, при пневмониях, тромбоэмболии легочной артерии [1]. По данным литературы, КТ возникала на фоне сепсиса, при сотрясении мозга, желудочно-кишечном кровотечении, обострении воспалительных заболеваний кишечника, онкологических заболеваниях и др. На рисунках 1 и 2 представлена частота различных триггерных факторов при развитии КТ.

Рис. 1. Частота различных триггерных факторов при КТ (адаптировано из [4]).

Рис. 2. Встречаемость различных вторичных форм КТ (адаптировано из [4]).
С чем связано развитие КТ при соматических заболеваниях? По-видимому, в этих случаях к «катехоламиновой буре» приводит активация автономной нервной системы, имеющей представительство во всех органах и передающей в головной мозг (ГМ) сигналы о произошедшем патологическом событии (рис. 3), а также, безусловно, — психологическая реакция человека на случившееся заболевание, госпитализацию, медицинские вмешательства.

Рис. 3. Вероятные патогенетические механизмы вторичных форм КТ.
Важно отметить, что среди соматических заболеваний лидируют болезни легких. В нашей выборке больных с КТ (60 наблюдений) в 11,7% случаев при вторичной форме триггером являлись заболевания легких (обострения бронхиальной астмы, тромбоэмболия легочной артерии, ковидная пневмония [9][10]. Это обстоятельство, по-видимому, можно объяснить особенностями сложной иннервации и кровоснабжения легких и их связью с центрами мозга и автономной нервной системой.
Анатомические варианты КТ
По данным ЭхоКГ/вентрикулографии выделяют несколько анатомических вариантов КТ (рис. 4).

Рис. 4. Анатомические варианты КТ (адаптировано из [1]).
Наиболее часто встречается типичная апикальная форма, при которой отмечается циркулярная акинезия миокарда ЛЖ, нередко сопровождающаяся раздутием верхушки (так называемое баллонирование верхушечных сегментов ЛЖ) и гиперкинезия базальных отделов. Несколько реже наблюдается средне-желудочковая форма (гипокинезия средних сегментов ЛЖ, гиперкинезия базальных и апикальных сегментов), инвертированная или базальная форма (гипокинезия базальных сегментов и гиперкинезия верхушечных сегментов ЛЖ) и — фокальная (локальное нарушение сократимости в любых сегментах с признаками баллонирования). Помимо ЛЖ, у трети пациентов в патологический процесс вовлекается правый желудочек, при этом данная форма считается прогностически более неблагоприятной [1].
Патогенетические механизмы КТ
Патофизиология КТ сложна, механизмы, которые лежат в основе заболевания, до конца не изучены и продолжают исследоваться. Выдвигаются различные теории развития заболевания. Большое внимание уделяется прямому кардиотоксическому действию на миокард избытка катехоламинов (КХ), спазму коронарных микрососудов, вегетативному дисбалансу, оксидативному стрессу, воспалительным и метаболическим нарушениям в миокарде [1][7]. Остановимся на основных механизмах.
Роль центральной нервной системы в патогенезе заболевания
Роль стресса в развитии КТ очевидна, не случайно это заболевание называется стрессорной кардиомиопатией [1]. Поэтому исследования, касающиеся патогенетической связи «мозг-сердце», появились с момента первых описаний заболевания [11].
Как известно, стресс — это физиологическая реакция организма, опосредованная корковыми и подкорковыми механизмами в ГМ. Лимбическая система, неокортекс, спинной мозг, ретикулярная формация и ствол мозга являются главными анатомическими структурами, участвующими в ответной реакции на стресс [12]. При этом срабатывают две основные нейроэндокринные оси: «голубое пятноадреномедуллин» и ось «гипоталамус-гипофиз-надпочечники» (ГГН) [7][12].
Голубое пятно регулирует острую реакцию организма на стресс, поддерживая состояние «бдительности», которое, с одной стороны, способствует адаптации к изменениям окружающей среды, а с другой — может вызывать эмоциональные реакции, такие как напряжение и беспокойство. Активация голубого пятна вызывает секрецию норадреналина хромаффинными клетками мозгового вещества надпочечников, что, в свою очередь, стимулирует ось ГГН [12].
Синтез кортизола в коре надпочечников является результатом активности оси ГГН. Кортизол воздействует на многие ткани, включая ГМ, и совместно с повышенной адренергической активностью способствует синтезу и секреции адреналина и норадреналина в мозговом веществе надпочечников [12].
Однофотонная эмиссионная компьютерная томография ГМ показала, что активность гиппокампа и ствола мозга увеличиваются через 1-4 дня после дебюта КТ [11]. Эта аномальная активация ГМ снижается со временем, но остается, хоть и в меньшей степени, через 28-39 дней после полного восстановления нормального движения стенки ЛЖ [11]. Напротив, активность вентромедиальной префронтальной коры снижается как в острой, так и в хронической фазах КТ [11].
В последние годы с помощью современных методов исследования появилась новая информация об участии различных отделов мозга в патогенезе КТ. Так, в нескольких работах при выполнении МРТ ГМ выявили существенные структурные различия между пациентами с КТ и здоровой контрольной группой. Они касались лимбической системы, состоящей из островка, миндалины, поясной коры и гиппокампа — структур, активно участвующих в контроле эмоций и вегетативной регуляции сердечной деятельности. У пациентов с КТ обнаружено уменьшение толщины коры в островках, поясной коре, сниженный объем серого вещества миндалин [13][14].
Недавнее исследование показало нарушение взаимосвязей между структурами ГМ, отвечающими за контроль симпатической и парасимпатической систем у пациентов с КТ в состоянии покоя при выполнении функциональной МРТ [6][15], другими исследователями этим же методом выявлено уменьшение связей между лимбическими областями мозга у данных больных [13][14].
Обращает на себя внимание и частота развития КТ у неврологических пациентов. Известно, что заболевание возникает после инсульта, транзиторной ишемической атаки, эпилептических приступов, субарахноидальных аневризмах [1]. Согласно данным литературы, ~50% пациентов с КТ страдают острым или хроническим неврологическим или психиатрическим заболеванием, самым распространенным из которых является депрессия [6][16]. Как известно, у пациентов с депрессивными расстройствами наблюдается нарушение обратного захвата нейронами норэпинефрина из синаптической щели [14][17]. Это, в свою очередь, способствует длительной стимуляции симпатической нервной системы (СНС) и при возникновении стрессорной ситуации может приводить к сократительной дисфункции ЛЖ [18].
Роль КХ в развитии КТ
Поскольку роль стресса, как провоцирующего фактора, рассматривалась с первых описаний КТ, массивный выброс КХ изначально считался одним из главных патогенетических механизмов заболевания. В 2003г впервые описан повышенный уровень норадреналина в сыворотке крови у пациентов с КТ [19]. Похожие результаты опубликованы в 2005г, продемонстрировав более высокий уровень КХ и связанных со стрессом нейропептидов у пациентов с КТ по сравнению с больными с инфарктом миокарда (ИМ) [1]. На основании этих данных авторы сделали вывод, что КТ вызвана стресс-индуцированной «катехоламиновой бурей». Однако последующие работы дали противоречивые результаты [6], поэтому дискуссия об уровне циркулирующих КХ у больных КТ продолжается. Вместе с тем местные влияния КХ на миокард признаются практически всеми исследователями.
Как указывалось, патогенез КХ — повреждения миокарда в свое время был описан профессором Меерсоном Ф. З., который объяснял возникающие патологические изменения в миокарде при стрессовых ситуациях нарушениями метаболизма глюкозы и свободных жирных кислот (СЖК), активацией перекисного окисления липидов, повреждением мембран кардиомиоцита и саркоплазматического ретикулума, ответственных за транспорт Ca2+, избыток которого в сочетании с избытком СЖК приводит к разобщению процессов окисления и фосфорилирования в митохондриях и снижению содержания аденозинтрифосфата (АТФ), активации миофибриллярных протеаз и митохондриальных фосфолипаз. В результате данных метаболических изменений возникают контрактуры и некробиоз отдельных групп кардиомиоцитов, а также в целом выраженные нарушения сокращения и расслабления миокарда [2]. По сути, это — ключевые механизмы повреждения миокарда при КТ, которые с развитием современных методов диагностики только уточняются.
Так, в начале 2000-х гг был описан механизм десенситизации ?1,2-адренорецепторов (?1,2-АР), возникающий в ответ на избыточную продукцию КХ, заключающийся в переключении регуляторного G-белка со стимулирующего подтипа (Gs) на ингибирующий (Gi), что приводит к снижению сократимости миокарда, в то же время обеспечивая защиту кардиомиоцитов от токсического влияния КХ. При избытке КХ также образуется особый белок бета-аррестин-2 (?-arrestin-2), который связывается с активированными ?1,2-АР, предотвращая их стимуляцию и блокируя клеточную передачу сигналов, а также удаляет эти рецепторы с поверхности клетки (процесс интернализации рецепторов) (рис. 5) [21][22].
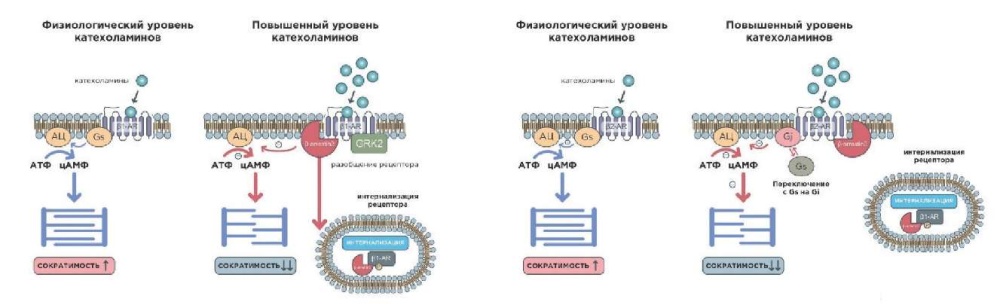
Рис. 5. Механизмы нарушения сократимости миокарда при КТ (адаптировано из [20]).
Сокращения: АЦ — аденилатциклаза, АТФ — аденозинтрифосфат, цАМФ — циклический аденозинмонофосфат.
В 2018г японскими исследователями была подтверждена связь нарушения сократимости ЛЖ при КТ с десенситизацией ?1,2-АР в ответ на повышенный уровень КХ. Ценность этой работы заключается в том, что выводы были подтверждены гистологическими методами с применением иммуногистохимического анализа у пациентов с КТ в сравнении с лицами без патологии миокарда и больными с другими формами кардиомиопатии. Причем было показано, что для ?1-АР в ответ на КХ-токсичность характерно взаимодействие с белками ?-аррестинами-2, а для ?2-АР — переключение связывающего G-белка с Gs на Gi [23]. В результате десенситизации ?1,2-АР, по мнению исследователей, возникает феномен «оглушенного (станнирующего) миокарда». Этот термин при КТ используют многие авторы. Однако следует заметить, что термин «станнирование миокарда», впервые предложенный Heyndrickx GR и в последующем использованный Braunwald E, подразумевает под собой обратимую дисфункцию миокарда, возникающую вследствие ишемии и реперфузии [24]. Поэтому, применительно к КХ-механизму, вероятно, лучше использовать термин — повреждение миокарда. Вместе с тем нарушения перфузии/реперфузия миокарда в качестве пусковых механизмов снижения его сократимости при КТ также широко обсуждаются, о чем речь пойдет далее.
Важным звеном внутриклеточных нарушений при КТ является перегрузка кардиомиоцитов Ca2+. В последние годы уточнены механизмы влияния КХ на кальций-регуляторную систему кардиомиоцитов. Согласно исследованиям 2020г было показано, что КХ при повышенном их уровне, стимулируя ?-АР, подавляют экспрессию генов, кодирующих кальций-регуляторный белок (SERCA2a), в результате чего снижается его сродство с Са2+ [16] и последний накапливается в цитозоле и саркоплазматическом ретикулуме. Возникающий избыток Ca2+ в кардиомиоците вызывает митохондриальную дисфункцию: отек, открытие мегапоры митохондрий и в конечном итоге — к истощению запасов энергии в кардиомиоцитах. В результате возникает апоптоз кардиомиоцитов, при нарастающих нарушениях — некроз с фиброзом, сократительная дисфункция миокарда [25][26].
Кроме того, перегрузка кардиомиоцитов Ca2+ также возникает вследствие повреждения сарколеммы митохондрий и саркоплазматического ретикулума продуктами окисления КХ — адренохромами, которые являются важным источником активных форм кислорода, вызывающих оксидативный стресс, при котором вследствие активации перекисного окисления липидов повышается концентрация СЖК, блокируются белки дыхательной цепи митохондрий и цикла Кребса, что приводит к снижению синтеза АТФ [26][27].
В последние годы описан еще один вариант оксидативного стресса при КТ — нитросативный стресс. Образующиеся при стрессовых воздействиях КХ стимулируют эндотелиальную NO-синтазу и тем самым продукцию свободного радикала оксида азота (NO—) — активного вазодилататора и регулятора ряда внутриклеточных процессов. Одновременно имеет место активация продукции еще одной активной формы кислорода — супероксид-анион радикала (О2—). Оба радикала очень быстро, практически с диффузионной скоростью, образуют пероксинитрит (ONOO—), очень сильный окислитель, который легко проникает через клеточные мембраны по анионным каналам в клеточные компартменты, активно окисляет липидные структуры, повреждает молекулы ДНК, модифицирует белки. При этом пероксинитрит не только запускает процессы окислительные повреждения белков, но, как активный нитрующий фактор, обусловливает введение нитрогрупп в тирозиновые фрагменты белков, что провоцирует так называемый нитросативный стресс [28]. Развитие последнего приводит к изменению гомеостаза кальция в митохондриях, нарушению функции митохондрий, истощению АТФ, приводит к развитию воспаления в миокарде [29]. Пероксинитрит в низких и средних концентрациях способен запускать апоптотическую программу клеточной смерти, в то время как высокие концентрации пероксинитрита вызывают гибель клеток по некротическому пути [30].
Ряд авторов считают, что нитросативный стресс имеет решающее значение в развитии КТ [31]. Для доказательства данной гипотезы Surikow SY, et al. провели эксперимент со стареющими самками крыс. Животным вводился изопротеренол, обладающий ?-адреностимулирующим эффектом и способствующий активации эндотелиальной NO-синтазы. После введения изопротеренола (5 мг/кг внутрибрюшинно) 11 из 28 крыс внезапно погибли в течение 2 ч, а у 17 выживших крыс изучены результаты ЭхоКГ, выполнен иммуногистохимический анализ миокарда. Было показано, что у крыс на фоне изопротеренола развивались КТ-подобные ЭхоКГ изменения, которые сопровождались избыточным миокардиальным накоплением пероксинитрита. Кроме этого, в миокарде крыс обнаруживались воспалительные макрофагальные инфильтраты, клетки которых экспрессировали CD68+ [31]. Таким образом, в экспериментальной модели была подтверждена роль нитросативного стресса в патогенезе КТ, заключающаяся в развитии метаболических нарушений и энергетического дефицита в миокарде, а также модуляции воспалительных изменений.
Наконец, КХ непосредственно влияют на метаболические пути, стимулируя аэробный гликолиз, гликогенолиз, кетогенез, повышают использование экзогенных энергетических субстратов, особенно СЖК, запуская вышеописанный каскад внутриклеточных процессов [27][32].
Таким образом, патологические эффекты избытка КХ при КТ многообразны и заключаются не только в их воздействии на ?-рецепторный аппарат кардиомиоцитов, но и в развитии оксидативного и нитросативного стресса, воспалительных изменений и нарушения внутриклеточных метаболических процессов, приводящих к дефициту энергии в кардиомиоците и в результате — снижению сократимости миокарда (рис. 6).

Рис. 6. Механизмы катехоламинового повреждения миокарда при КТ.
Эпикардиальный и микрососудистый спазм при КТ
Эпикардиальный спазм, возникающий вследствие гиперактивности СНС, и последующая реперфузия миокарда были предложены в качестве возможного механизма, лежащего в основе КТ на заре изучения патогенеза данного заболевания [1]. Несколько авторов описали и спонтанный, и спровоцированный ацетилхолином вазоспазм у пациентов с КТ [1][6][33]. Однако аномалии движения стенок ЛЖ при КТ обычно не соответствуют бассейну кровоснабжения одной коронарной артерии, и поэтому маловероятно, что спазм одной артерии является причиной КТ [1]. Можно предположить содружественный спазм нескольких коронарных артерий, но тогда непонятно, почему в одном бассейне возникает акинезия, а в другом — гиперкинезия, кроме того, вряд ли такие распространенные нарушения перфузии миокарда были бы обратимыми. Более того, не все исследователи в дальнейшем подтвердили наличие спазма коронарных артерий при КТ [1][7]. Поэтому данная причина заболевания в настоящее время, как правило, рассматривается в историческом аспекте.
А вот генерализованный спазм микрососудов, артериол и преартериол, рядом исследователей рассматривается как ключевой механизм развития КТ [6][7]. В ответ на стресс у пациентов с КТ возникает чрезмерная симпатическая активность, локальный выброс КХ в миокарде, стимуляция ?1,2-АР, повышается концентрация эндотелина-1 в плазме, что приводит к острой микрососудистой вазоконстрикции, ишемии, последующей реперфузии и «оглушению миокарда» [1][6][34].
Как известно, основным механизмом постишемической сократительной дисфункции является образование цитотоксичных свободных радикалов, которые выделяются при повторном поступлении кислорода в ранее ишемизированный миокард в момент реперфузии, перегрузка кардиомиоцитов кальцием, повреждение митохондрий и нарушение образования энергии в кардиомиоцитах [25][35].
Микроваскулярная дисфункция в остром периоде КТ была выявлена при помощи неинвазивных и инвазивных диагностических методик. По данным литературы, в острой фазе КТ у пациентов наблюдалось снижение резерва коронарного кровотока, измеренного с помощью трансторакальной допплерографии или позитронно-эмиссионной томографии-сканирования [7], при этом внутривенное введение аденозина временно улучшало перфузию миокарда, а на фоне выполнения холодовой пробы, либо при интракоронарном введении ацетилхолина перфузия ЛЖ ухудшалась [7][33]. Также нередко сообщается о феномене «замедленного кровотока» по данным коронарографии у больных с КТ, что характерно для микроваскулярной дисфункции, при этом наблюдается спонтанное восстановление кровотока при повторном исследовании через 1 мес. [36]. Подтверждают роль микроциркуляторных нарушений данные биопсии миокарда у пациентов с КТ, которые продемонстрировали индуцированный КХ апоптоз эндотелиальных клеток микрососудов [7].
Гипотеза об участии микрососудистых нарушений при КТ согласуется с данными о том, что патофизиология КТ имеет общие черты с микрососудистой стенокардией, в основе которой, как известно, также лежит микроваскулярная дисфункция и нарушения перфузии миокарда. Как и КТ, микроваскулярная стенокардия часто встречается у женщин в постменопаузе, нередко болевой синдром возникает на фоне отрицательных эмоций; пациентки при той и другой патологии характеризуются тревожными личностными особенностями, у них часто отсутствуют обструктивные изменения коронарных артерий. В литературе высказывается точка зрения, что КТ может являться острой формой микрососудистой стенокардии [7][36].
В нашей клинической практике был случай развития КТ у пациентки 73 лет с подтвержденной при помощи позитронно-эмиссионной томографии микрососудистой стенокардией в анамнезе [37].
КТ и воспаление
Процесс хронического субклинического воспаления при КТ вызывает растущий интерес в последние годы, т.к. уже имеющийся объем фактических данных свидетельствует об особой значимости системной воспалительной реакции (СВР) у пациентов с КТ как в краткосрочной, так и в долгосрочной перспективе [38]. СВР была обнаружена у значительной части пациентов с КТ и заключалась в повышении уровня лейкоцитов, С-реактивного белка, провоспалительных цитокинов [7][39][40]. При этом выраженность СВР ассоциировалась с более значительным повреждением миокарда и неблагоприятным исходом в острой фазе [39]. Длительное наблюдение за пациентами на протяжении 2 лет показало, что СВР оставалась независимым фактором смерти от сердечно-сосудистых заболеваний [39].
В недавнем многоцентровом исследовании выполнили проспективную оценку значения СВР у больных КТ, используя МРТ сердца с инфузией суперпарамагнитных частиц оксида железа (USPIO) в острой фазе заболевания и через 5 мес. [40]. Была выявлена опосредованная макрофагами клеточная воспалительная реакция в миокарде на фоне его отека. Кроме того, наблюдались повышенные уровни провоспалительных цитокинов-хемокин CXC лиганд 1 (CXC chemokine ligand 1) (является хемоаттрактантом для нейтрофилов, Т-лимфоцитов и моноцитов), IL-6 и IL-8 [40]. Через 5 мес. усиления захвата USPIO больше не находили, повышенные уровни IL-6 сохранялись, что указывало на присутствие хронического воспалительного процесса [40].
Для определения воспалительных изменений при КТ использовали хорошо зарекомендовавшую себя экспериментальную модель индуцированной стрессом КТ (инъекции изопреналина) у самок крыс Sprague Dawley, показав раннюю инфильтрацию миокарда нейтрофилами с последующим присоединением субпопуляции провоспалителных макрофагов [41]. Важно отметить, что и в этой работе было обнаружено повышение только провоспалительных макрофагов — M1 [41].
Эстрогены и КТ
Еще один ключ к пониманию патогенеза КТ — поразительное гендерное преобладание: 90% пациенток — женщины, из них 80% — в постменопаузе. Эти факты не оставляют сомнений в том, что снижение эстрогенов может предрасполагать к развитию КТ [1][6][7]. Действительно, женщины старше 55 лет имеют почти пятикратный риск развития КТ по сравнению с женщинами моложе 55 лет [1]. Эстрогены защищают кардиомиоциты от индуцированной изадрином продукции КХ [29]. Известно, что снижение уровня эстрогенов ослабляет вагусные влияния в вегетативном центре гипоталамуса, что увеличивает реактивность СНС при ее активации [30]. Эстрогены воздействуют на тонус сосудов, уменьшая вазоконстрикцию, в т.ч. на уровне артериол миокарда за счет образования эндотелиальной NO-синтазы [1][6][12]. Доказано, что эстрогены снижают болевую чувствительность, влияя на ноцицептивные центры ГМ [42]. Наконец, в менопаузе у женщин повышается плотность ?1-АР и меняется соотношение ?1- и ?2-АР в миокарде, а также повышается чувствительность ?1-АР к КХ [43][44].
В экспериментах на животных было показано, что заместительная гормональная терапия защищает от КТ [45]. Вместе с тем более поздние небольшие ретроспективные исследования не показали, что заместительная гормональная терапия предупреждала развитие КТ у женщин в постменопаузе [45]. Отсутствуют также данные, указывающие на корреляции между уровнем эстрогенов и развитием КТ [46]. В то же время вряд ли следует ожидать таких прямых корреляций, т.к. в период менопаузы количество и качественный состав эстрогенов закономерно изменяется у всех женщин, скорее, речь должна идти о недостаточности компенсаторных механизмов в ответ на стресс у женщин в период менопаузы и, возможно, о генетической предрасположенности к заболеванию.
Генетическая предрасположенность
Мысль о генетической предрасположенности к КТ также не оставляет исследователей в покое, т.к. несмотря на частоту развития данного заболевания у женщин в менопаузе, встречаемость КТ в этой популяции женщин в целом все-таки относительно невелика. Сообщалось, что КТ возникает у близких родственников, однако модель менделевского наследования у нескольких поколений для КТ не была описана [1][6]. Вероятно, генетическая предрасположенность имеет полигенную природу и реализуется путем разных механизмов. Так, описана связь между фенотипом КТ и полиморфизмом гена ?1-АР [1]. Были получены результаты, касающиеся функционального полиморфизма генов ?1-, ?1-, ?2-АР и эстрогеновых рецепторов [1][7]. Так, известно, что полиморфизм GRK5 41L усиливает десентизацию ?-АР, и на трансгенных мышах было продемонстрировано, что вариант GRK5 L41 вызывает отрицательный инотропный эффект в условиях КХ стимуляции [1][6].
Таким образом, вопросы генетической предрасположенности при данной патологии требуют дальнейшего изучения.
Другие факторы, ассоциированные с КТ
Нарушение функции щитовидной железы нередко наблюдается у пациентов с КТ. В нескольких работах описаны случаи заболевания, развившегося на фоне тиреотоксикоза [47][48]. Было выявлено, что при КТ у 37,5% пациентов встречается повышенный уровень тиреоидных гормонов [49]. Высказывается мнение о сложном влиянии центральных и периферических КХ на гомеостаз щитовидной железы и ее стресс-зависимую эндокринную реакцию [49]. В нашей выборке больных с КТ нарушения тиреоидного статуса выявлялись в 13,3% случаев.
Интересны данные литературы, касающиеся сахарного диабета (СД) при КТ. В ряде крупных исследований было показано, что распространенность СД у пациентов с КТ ниже, чем в общей популяции.
Так, по результатам американского национального исследования здоровья и питания (NHANES) было выявлено, что у 33894 пациентов с КТ (88,9% женщин) встречаемость СД была достоверно ниже по сравнению с общей популяцией (16,8% и 27%, соответственно) [12][50]. Этот феномен объяснялся наличием у больных СД автономной нейропатии, которая ослабляет взаимосвязи мозга и сердца, таким образом, охраняя миокард от последствий катехоламинового шторма.
Вместе с тем по некоторым данным у больных с КТ, имеющих СД, было больше внутрибольничных осложнений [51] и повышена долгосрочная смертность (медиана наблюдения =27,5 мес.) [52]. Но по результатам другого исследования с участием 12255 пациентов с КТ, внутрибольничная смертность не отличалась между пациентами с СД и без него, но при этом у пациентов с СД частота повторных госпитализаций в течение 90 дней была выше [53]. Таким образом, вопросы влияния СД на риск возникновения и течение заболевания требуют уточнения.
Гистологические изменения в миокарде при КТ
Морфологические исследования миокарда у больных с КТ немногочисленны. При изучении аутопсийного материала обнаруживался выраженный интерстициальный отек миокарда с мукоидным компонентом и нерезко выраженной лимфомакрофагальной инфильтрацией стромы очагового или диффузного характера, редко — небольшие субэндокардиальные кровоизлияния [41][54]. Признаки очагового некроза миокарда, как правило, отсутствуют [55], но наблюдается усиление фиброзных процессов в миокарде [12].
В кардиомиоцитах умерших отмечены также контрактуры кардиомиоцитов с участками некроза и воспалительной инфильтрации в виде поясков («contraction band necrosis») (рис. 7), что характерно для прямого токсического воздействия норадреналина на сердечную мышцу [1].

Рис. 7. «Contraction band necrosis» в миокарде при КТ (указан стрелками).
Как уже указывалось ранее, атеросклеротические изменения коронарных артерий (но без тромбоза) не исключают развития КТ. В литературе приводится описание клинического наблюдения, когда КТ у пациента развилась на фоне острого ИМ, при этом авторами ИМ был расценен как стрессовый фактор для возникновения КТ [56]. В нашей практике имеется наблюдение, при котором на фоне инфекции COVID-19 у пациентки развилась типичная КТ (апикальный вариант), а на 7 день заболевания при нарастании признаков интоксикации и воспалительных изменений — нижний ИМ 2 типа; через сутки больная умерла [10].
Заключение
Схематично патогенез КТ представлен на рисунке 8.

Рис. 8. Патогенез КТ (адаптировано из [12]).
Сокращение: АНС — автономная нервная система.
Эмоциональный или физический стресс, активируя СНС на разных уровнях (корковые и подкорковые центры мозга, автономная нервная система, ГГН система), приводят к чрезмерному выбросу КХ, которые, воздействуя на сердце, вызывают нарушение сократимости миокарда, опосредованное реакцией рецепторного аппарата кардиомиоцитов, а также — сосудистыми, воспалительными и метаболическими нарушениями. Тот факт, что сократимость миокарда при данной патологии довольно быстро восстанавливается, подтверждает гипотезу о ведущем значении метаболических и воспалительных нарушений, а не ишемии миокарда. Если последняя и имеет место, то, вероятно, возникает вследствие микрососудистых нарушений, кратковременна и сопровождается быстрой реперфузией. Заболевание развивается, по-видимому, у предрасположенных людей, имеющих несовершенную реакцию на психологический и гуморальный стрессы.
Однако следует подчеркнуть, что все указанные механизмы требуют дальнейшего исследования и подтверждения. Представляется, что полученные данные о процессах нарушения и восстановления сократительной функции миокарда при КТ помогут открыть пути к лечению не только больных с данной патологией, но также пациентов при других формах острой сердечной недостаточности.
Во второй части обзора будут обсуждаться вопросы, касающиеся клинической картины, алгоритма диагностики и подходов к лечению КТ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
