Стимуляция пучка Гиса — новый взгляд на метод
С недавнего времени, благодаря технологическому прогрессу электродных систем, стимуляция пучка Гиса (гисиальная стимуляция, СПГ) стала возможной альтернативой верхушечной стимуляции правого желудочка (ПЖ), а также бивентрикулярной стимуляции, реализующей близкое к физиологическому распространение импульса по проводящей системе сердца. Согласно рекомендациям рабочей группы по гисиальной стимуляции [1], пучок Гиса (ПГ) — часть атриовентрикулярного (АВ) соединения, стимуляция которой приводит к функциональному вовлечению левой и правой ножек ПГ без декременции. Современные электроды с активной фиксацией и системы доставки позволяют успешно проводить стабильную долговременную СПГ, избегая нарушений детекции и неконтролируемого роста порогов стимуляции. По данным метаанализа [2], включающего данные 1438 пациентов из 16 центров, средний успех имплантации постоянного кардиостимулятора с использованием электрода, стимулирующего ПГ, составляет 84,8%; средний порог стимуляции во время имплантации составляет 1,17 В и 1,79 В спустя 3 мес. наблюдения.
Анатомическое строение
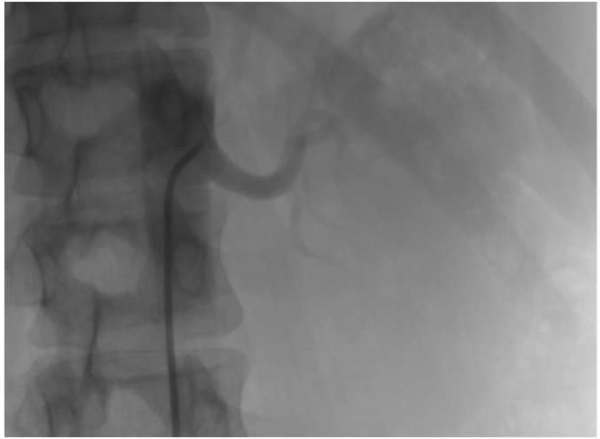
ПГ располагается в мембранозной части межжелу- дочковой перегородки (МЖП), причём проксимальная часть пучка лежит в правопредсердной части перегородки, выше кольца трикуспидального клапана (ТК). Затем ПГ переходит в желудочковую часть перегородки, разделяясь на левую и правую ножки. Выделяют 3 наиболее часто встречающихся варианта расположения ПГ [3]. Тип 1 (46,7% случаев) — ПГ проходит по нижней границе мембранозной части МЖП и прикрыт тонким слоем миокардиальных волокон, простирающихся от мышечной до мембранозной части МЖП. Тип 2 (32,4% случаев) — ПГ проходит в мышечной части МЖП, в стороне от нижней границы мембранозной части. Тип 3 (21,0% случаев) — ПГ не покрыт миокардом и проходит поверх мембранозной части МЖП. Встречаются и более редкие варианты расположения, в т.ч. когда ПГ смещен преимущественно к левой стороне МЖП. ПГ имеет длину 2,3+0,4 мм и ширину ‘7,3+1,2 мм [4]. Рентгенанатомическая позиция электрода в гисиальной позиции изображена на рисунке 1.

Рис. 1. Рентгенанатомическая проекция электрода в гисиальной позиции. Примечание: черная стрелка указывает на фиксирующую спираль электрода.
Специальные устройства и методика имплантации
Для СПГ применяются как стандартные электроды с активной фиксацией, так и специальный электрод, который устроен по типу кабеля (inner cable); его внешний диаметр составляет 4,2 Fr. Данный электрод не имеет внутреннего просвета, следовательно, для имплантации необходима система доставки. Наиболее часто применяемая система доставки имеет длину 43 см, её внутренний диаметр составляет 5,5 Fr, а наружный диаметр 7,0 Fr. Также она имеет две кривизны: первая создана для того, чтобы достичь верхней части кольца ТК, а вторая направляет электрод перпендикулярно к МЖП. Альтернативная управляемая система доставки в основном используется при изменённой анатомии сердца (расширение правого предсердия, низко расположенный ПГ и т.д.) [5]. Как только в клиническую практику вошли вышеперечисленные системы доставки и электрод [6], успешность процедуры стала достигать 92,1% по сравнению с ранними работами, в которых частота успеха была 54,6% (p<0,001) [2], что привело к активному распространению данной методики. В ходе имплантации необходимо использовать анализатор, который позволяет в униполярном режиме оценивать электрограммы (ЭГ) и осуществлять проверку параметров стимуляции. Для правильной оценки локализации электрода требуется дублировать сигнал с электрода на электрофизиологическую станцию, при этом важно использовать 12 отведений электрокардиограммы (ЭКГ) [7].
После получения сосудистого доступа в правые камеры сердца вводится проводник, по которому устанавливается система доставки (предориентирована в сторону передней части кольца ТК, в область ПГ), после чего проводник удаляется. Затем в систему доставки заводится электрод таким образом, чтобы его спираль немного выходила за пределы дистальной части системы, что отслеживается под контролем рентгеноскопии. Поворот всей конструкции по часовой стрелке позволяет смещать систему ближе к желудочку, а поворот против часовой стрелки — в правое предсердие. Для облегчения позиционирования в область ПГ может быть установлен электрофизиологический катетер бедренным доступом. Имплантация электрода в область ПГ в основном базируется на электрофизиологическом картировании. Необходимо достичь соотношения предсердной к желудочковой ЭГ 1:2 на картирующем электроде. Также очень важно получить отчетливый сигнал ПГ, т.к. это показывает, что спираль электрода находится в хорошем контакте с МЖП.
После того, как подходящее место найдено, можно оценить ответ ткани на стимуляцию. Рекомендуется начинать стимуляцию с амплитуды 5 В и длительностью импульса 1 мс. Порог стимуляции менее 2 В/1 мс большинством исследователей считается приемлемым [7], в дальнейшем программировать амплитуду стимула имплантируемого устройства рекомендуется не менее, чем на 1 В выше значения порога стимуляции [8]. Далее выполняется фиксация электрода: держа систему доставки в левой руке, электрод 4-5 раз вкручивают по часовой стрелке правой рукой. Наличие тока повреждения ПГ (встречается в 40% случаев) говорит о последующем снижении порогов стимуляции и является благоприятным прогностическим признаком [9] (рекомендуется изменить настройку фильтра высоких частот с 30 Гц на 0,5 Гц, что обеспечит лучшее качество сигнала ПГ) [1].
По результатам многоцентрового анализа имеет место кривая обучения данной методике: примерно после 40 выполненных имплантаций уменьшается время флюороскопии, операторы чаще отказываются от использования страховочного ПЖ электрода и картирующего электрода с бедренного доступа, а пороги стимуляции становятся ниже [10].
Типы стимуляции
Выделяют два основных вида СПГ [1]: селективная (С-СПГ) и неселективная (НС-СПГ). Дифференцировка между этими видами стимуляции осуществляется в зависимости от наличия имеющегося нарушения проведения импульса по системе Гиса- Пуркинье и с использованием 4 основных критериев:
- Соотношение интервалов “спайк стимуляции — QRS (S-QRS)”, который измеряется от спайка стимуляции до начала комплекса QRS на ЭКГ и “H-QRS”, который измеряется от сигнала ПГ на ЭГ до начала комплекса QRS на ЭКГ;
- Наличие или отсутствие прямого захвата локальной желудочковой ЭГ на униполярном сигнале, полученном с электрода;
- Морфология и длительность комплекса QRS;
- Значение порогов стимуляции и их динамическое изменение. В зависимости от преодоления предшествующего нарушения проведения, стимуляция может быть с коррекцией проведения (на ЭКГ и ЭГ будут отсутствовать паттерны предшествующего нарушения проводимости — корригированный комплекс ЭКГ) или без неё (на ЭКГ и ЭГ будут наблюдаться как признаки СПГ, так и имеющиеся паттерны нарушения проводимости), что также влияет на интерпретацию данных ЭКГ и ЭГ во время имплантации устройства и/или при наблюдении пациентов.
Селективность захвата ПГ зависит от индивидуальной анатомии пациента, амплитуды импульса, локализации электрода относительно ПГ, окружающей предсердной или желудочковой ткани [11].
При С-СПГ возбуждение желудочков происходит только через ПГ, при этом выявляются следующие признаки:
- Интервалы S-QRS и H-QRS приблизительно равны друг другу. У пациентов с нарушением проведения по системе Гиса-Пуркинье интервал S-QRS может быть короче, чем H-QRS, что связано с возбуждением латентной фасцикулярной ткани и коррекцией проведения;
- Локальная желудочковая ЭГ отделена от спайка стимуляции;
- Стимулированные комплексы QRS не отличаются от нативных по морфологии. У пациентов с нарушением проведения по системе Гиса-Пуркинье стимулированный комплекс может быть уже, чем исходный комплекс с блокадой ножки ПГ или замещающим ритмом, что связано с коррекцией проведения;
- Обычно определяется один порог стимуляции (С-СПГ), но у пациентов с нарушением проведения по системе Гиса-Пуркинье будет определяться 2 значения порога стимуляции — с и без коррекции нарушения проведения. На рисунке 2 изображен пример С-СПГ в сочетании с блокадой правой ножки ПГ.

Рис. 2. С-СПГ.
Примечание: пример достигнутой С-СПГ с интраоперационно развившейся блокадой правой ножки пучка Гиса. Черная стрелка указывает на дискретный желудочковый сигнал, полученный с электрода в гисиальной позиции. Скорость записи 100 мм/сек.
При НС-СПГ имеет место сочетание проведения импульса по ПГ и по прилежащей ткани желудочка:
- Интервал S-QRS обычно равен нулю, наблюдается псевдо-дельта волна, которая отображает возбуждение ткани желудочков. При имплантации и при программировании следует пользоваться 12 отведениями ЭКГ, т.к. псевдо-дельта волна в некоторых отведениях может быть изоэлектрической;
- Локальная желудочковая ЭГ напрямую захватывается спайком стимуляции и не является дискретным компонентом;
- Стимулированный комплекс QRS обычно шире нативного, если исходно не было нарушения проведения по системе Гиса-Пуркинье вследствие дополнительной активации прилежащей ткани желудочка. Электрическая ось комплекса QRS будет совпадать с нативной, после псевдо-дельта волны будет отмечаться увеличение dV/dt (показатель, характеризующий изменение электрического потенциала относительно времени; на поверхностной ЭКГ будет отмечаться резкое изменение морфологии комплекса QRS за единицу времени), что говорит о вовлечении проводящей системы сердца [1]. Более резкое отклонение комплекса QRS (более высокие значения dV/ dt) поможет отличить НС-СПГ от септальной стимуляции, что, однако, может вызывать трудности в клинической практике. Если же исходно имелось нарушение проведения по системе Гиса-Пуркинье, комплекс QRS может быть yже нативного, что связано с коррекцией блокады ножки ПГ;
- Если исходно не было нарушений проводимости, обычно определяются 2 порога стимуляции: захват ПЖ и ПГ. Порог СПГ может быть выше или ниже порога стимуляции ПЖ. У пациентов с исходным нарушением проведения могут быть выявлены 3 порога стимуляции в различных комбинациях: захват ПЖ, захват ПГ с коррекцией блокады ножки и без коррекции блокады ножки. На рисунке 3 изображен пример НС-СПГ.

Рис. 3. НС-СПГ
Примечание: белая стрелка указывает на псевдо-дельта волну, возникающую в результате стимуляции прилежащей к ПГ ткани ПЖ. Черная стрелка указывает на локальную желудочковую ЭГ, слитую со спайком стимуляции. Скорость записи 50 мм/сек.
При долгосрочном наблюдении за пациентами с de novo имплантированными устройствами между НС- СПГ и С-СПГ не было выявлено значимой разницы по смертности и частоте госпитализаций по поводу сердечной недостаточности (СН). Следует отметить, что в данном исследовании не изучались эхокардиографические показатели; не учитывалась степень слияния между стимуляцией ПЖ и ПГ, а также наблюдалась тенденция в пользу С-СПГ, что требует дальнейших рандомизированных исследований [12].
Показания к СПГ
Было показано, что апикальная стимуляция ПЖ может приводить к пейсмейкер-индуцированной кардиомиопатии [13]. Частота встречаемости этого состояния варьирует от 12,3% до 20,5% по данным разных авторов [11101 (12.3%, 14]. Исследования говорят о том, что даже доля стимуляции >20% ассоциирована с развитием пейсмейкер-индуцированной кардиомиопатии [14]101 (12.3%. Стимуляция ПЖ из альтернативных мест (выводящий тракт ПЖ, верхние отделы МЖП) также не исключает развития пейсмей- кер-индуцированной кардиомиопатии [15].
В исследовании, сравнивающем НС-СПГ и С-СПГ со стимуляцией МЖП, по данным SPECT MPI показатели синхронизации левого желудочка (ЛЖ) были выше при СПГ, по сравнению с септальной стимуляцией [16].
В настоящее время можно выделить следующие группы показаний для применения СПГ:
- Альтернатива классической ПЖ стимуляции
В исследовании, включавшем 765 пациентов, с периодом наблюдения 725±423 дней, сравнивалась стимуляция ПЖ и СПГ. Успешность последней была достигнута в 92% случаев. По первичным конечным точкам (смертности, частоте госпитализаций по поводу СН и частоте замены устройств на систему бивентрикулярной стимуляции) в группе СПГ (83 из 332 человек, 25%) отмечалось значительно меньше данных событий, чем в группе ПЖ стимуляции (137 из 433 человек, 32%; отношение рисков 0,71, 95% доверительный интервал 0,534-0,944; p=0,02), также была выявлена тенденция к снижению уровня смертности [17]. Успех процедуры, по-видимому, не отличается у пациентов с узловой и подузловой формами АВ блокады [18].
В исследовании, оценивавшем долгосрочные исходы СПГ по сравнению с ПЖ стимуляцией спустя 5 лет после имплантации, как ревизия электродов (6,7% vs 3%), так и замена устройства (9% vs 1%) требовались чаще в группе СПГ [19].
- Стимуляция после деструкции АВ соединения
Показания к деструкции АВ соединения и последующей имплантации кардиостимулятора отражены в рекомендациях Американской ассоциации сердца (American Heart Association) 2018г и рекомендациях Европейского общества кардиологов (European Society of Cardiology) 2019г [20][21]. Деструкция АВ соединения может рассматриваться в ситуациях, когда другими путями не удаётся достичь контроля над симптоматикой фибрилляции предсердий.
Впервые успешное применение СПГ в клинической практике было описано Deshmukh P, et al. в 2000г [22] у пациентов с постоянной формой фибрилляции предсердий, кардиомиопатией и без расширения комплекса QRS. В периоде наблюдения отмечалось увеличение фракции выброса (ФВ), уменьшение размеров ЛЖ.
В более новых исследованиях [23], в которых имплантация электрода в гисиальную позицию сопровождалась деструкцией АВ узла, успешная СПГ достигалась в 95% случаев. Порог стимуляции при имплантации составлял 1 ±0,8 В/1 мс, а при сроке наблюдения 19±14 мес. он увеличился до 1,6±1,2 В/1 мс. ФВ ЛЖ увеличилась с 43±13% до 50±11% (p=0,01), а функциональный класс (ФК) СН уменьшился с 2,5±0,5 до 1,9±0,5 (p=0,04).
- Сердечная ресинхронизирующая терапия
James TN и Sherf L в 1971г определили, что клетки в составе ПГ расположены преимущественно продольно, что отличает начало пучка Гиса от клеток АВ- узла; клетки изначально предрасположены в правую или левую ножку, а между их трактами имеются соединительнотканные перегородки [24]. Позднее эта теория была также подтверждена Narula OS в 1977г: у пациента с имеющейся блокадой левой ножки ПГ (БЛНПГ) стимуляция дистальной части ПГ приводила к сужению комплекса и элиминации блокады ножки, что говорит о возможной более проксимальной природе БЛНПГ [25]. Однако известны данные, что поперечные связи между продольными волокнами в ПГ всё же имеются [26].
В исследовании, направленном на выяснение уровня блокады, электрофизиологическое исследование у пациентов с БЛНПГ выявило, что проксимальное поражение левой ножки на уровне ПГ — наиболее часто встречающийся вариант (наблюдается в 46% случаев), и, соответственно, в большинстве случаев может быть скорректировано с помощью СПГ. Однако в 36% встречается поражение волокон Пуркинье на дистальном уровне, которое невозможно изменить СПГ. Следует отметить, что дистальное и проксимальное поражение могут сосуществовать у одного пациента [27].
Несмотря на развитие методики бивентрикулярной стимуляции, частота неполного ответа на ресинхронизирующую терапию остаётся 30-40% [28]. Группа Barba-Pichardo R, et al. (2013) впервые опубликовала серию клинических случаев имплантации электрода в гисиальную позицию пациентам, у которых имелись показания к ресинхронизируюшей терапии, однако коронарный синус у этих пациентов не мог быть каню- лирован [29]. В ходе исследования авторы отмечали значительное сужение комплекса QRS. Lustgarten DL, et al. (2015) в проспективном перекрестном исследовании сравнил результаты СПГ и бивентрикулярной стимуляции [30]. Отмечалось улучшение ФВ ЛЖ, ФК СН в группах с бивентрикулярной и СПГ, но различий между двумя изучаемыми методами получено не было. Исследования в острой фазе имплантации выявили преимущество СПГ над бивентрикулярной [31].
В рандомизированном исследовании HIS-SYNC [32] было продемонстрировано, что у пациентов с СПГ отмечались лучшие показатели ресинхронизации по результатам ЭКГ; эхокардиографический ответ у них был численно, но не статистически, выше. Основной причиной неудач и причиной перехода с СПГ на бивентрикулярную послужило нарушение внутрижелудочкового проведения, связанное с дистальным поражением проводящей системы сердца. В связи с этим планируется исследование HIS-SYNC 2, которое не будет включать пациентов с нарушением внутрижелудочкового проведения.
Кроме того, СПГ является перспективным направлением для лечения пациентов с блокадой правой ножки ПГ и сниженной ФВ. В исследовании Sharma PS, et al. (2018) [33] было показано, что СПГ приводила к сужению комплекса QRS и увеличению ФВ ЛЖ, однако не было проведено прямого сравнения с бивентрикулярной стимуляцией.
Ещё одно перспективное направление применения СПГ — Гис-оптимизированная сердечная ресинхронизирующая терапия. В исследовании пациентам с показаниями к ресинхронизирующей терапии и пациентам, не ответившим на стандартную бивентрикулярную стимуляцию, имплантировались левожелудочковый электрод и электрод в гисиальную позицию, что обеспечивало иной вектор возбуждения. Успех имплантации составил 93%; эхокардиографические показатели улучшились у всех пациентов, которым удалось имплантировать устройство; у 28% пациентов отмечалось увеличение ФВ ЛЖ более, чем на 20%; достижение I ФК СН стало возможным у 84% пациентов [34].
- Постоянная стимуляция у пациентов с механическим протезом трехстворчатого клапана
В связи с невозможностью проведения электрода в полость ПЖ через механический протез клапана, СПГ со стороны правого предсердия позволяет осуществить желудочковую стимуляцию у таких пациентов. Описаны единичные случаи подобных имплантаций [35]. Так как надежность методики не исследована в данной группе пациентов, в описанных случаях всегда имплантировался страховочный левожелудочковый электрод.
Ограничения применения методики
Количество неудач в достижении эффективной и надежной СПГ колеблется от 10 до 15%. Причинами могут быть: высокие пороги стимуляции, пластика ТК в анамнезе, невозможность надежной фиксации электрода, низкая чувствительность желудочкового сигнала, оверсенсинг предсердного сигнала, стимуляция предсердий, перманентная интраоперационная блокада правой ножки ПГ (развивается в 3% случаев) [36]. Также причинами неудач могут быть несовершенство системы доставки и конструкции электрода (электрод не имеет просвета для стилета, что обусловливает сложность управления электродом); особенности анатомического строения ПГ, его небольшой размер, а также возможное атипичное расположение со стороны ЛЖ; последующие дислокации электрода в гисиальной позиции.
Подход к программированию имплантированных устройств с СПГ
На данный момент не существует устройств, адаптированных специально для СПГ. Начинают появляться предложения для разработки оптимальных интервалов, подходящих для определенных клинических ситуаций, связанных с использованием СПГ [37]. Основные факторы, от которых будет зависеть выбор программы имплантированного электронного устройства [8]:
- Показания к имплантации;
- Наличие страховочного ПЖ электрода;
- Исходный ритм пациента;
- Порт, в который подключен электрод для СПГ.
Экстракции электродов
На данный момент опыт экстракции данных электродов из гисиальной позиции описан только в одном одноцентровом ретроспективном исследовании [38]. Наиболее частым показанием для удаления являлись неприемлемо высокие пороги стимуляции (74%), их рост, наиболее вероятно, вызван микродислокацией электрода. Успешная экстракция была достигнута в 97% случаев. Попытка реимплантации электрода в проводящую систему сердца предпринималась у 22 пациентов, успех был достигнут в 19 случаях.
Заключение
СПГ — перспективное, активно развивающееся направление, которое может изменить наши взгляды на электрокардиостимуляцию, в особенности на ресинхронизирующую терапию. Многими опытными операторами отмечается несовершенство оборудования, но имеющиеся инструменты позволяют в подавляющем большинстве случаев добиться желаемого результата.
Если раньше подход к ресинхронизирующей терапии включал только бивентрикулярную стимуляцию, то сейчас имеют место новые алгоритмы: СПГ, стимуляция левой ножки ПГ и левожелудочковая эндокардиальная стимуляция. Эти методы реализуют нивелирование диссинхронии миокарда на разных уровнях, и, возможно, следующим этапом развития электротерапии хронической СН будет более детальная неинвазивная оценка электрической активности сердца с последующим индивидуализированным подбором устройства и методики стимуляции.