Реабилитация пациентов после новой коронавирусной инфекции (COVID-19) и её влияние на сердечно-сосудистые конечные точки: propensity score matching анализ
Аннотация
В связи с большим количеством осложнений и снижением качества жизни после новой коронавирусной инфекции (COVID-19), актуальным является проведение физической и психологической реабилитации пациентов. Однако эффективность реабилитации в отношении конечных точек до сих пор не была показана.
Цель. Определить эффективность разных вариантов проведения реабилитации у госпитализированных больных, перенесших COVID-19, на развитие отдаленных неблагоприятных сердечно-сосудистых событий через 1 год после выписки.
Материал и методы. В одноцентровом нерандомизированном обсервационном исследовании было сформировано 3 группы пациентов после госпитализации с COVID-19: I — с телемедицинской реабилитацией (n=118), II — с реабилитацией в специализированном отделении (n=46) и III — без реабилитации (n=175). Через 1 год наблюдения проводилось сравнение между группами в отношении развития конечных точек: сердечно-сосудистой смертности, инфарктов миокарда, инсультов, тромбоэмболий лёгочной артерии, фибрилляции предсердий и сердечно-сосудистых госпитализаций. Для оптимизации различий между группами сравнения был использован propensity score matching анализ.
Результаты. Реабилитация после госпитализации больных с COVID-19 как в отделении больницы, так и дистанционная в течение 1 года способствует снижению частоты сердечно-сосудистых госпитализаций, дистанционная реабилитация уменьшает сердечно-сосудистую смертность.
Заключение. Оба варианта реабилитации уменьшают частоту сердечно-сосудистых госпитализаций по сравнению с её отсутствием.
Пандемия новой коронавирусной инфекции (COVID-19) привела к значительному росту заболеваемости, снижению качества жизни и долговременным последствиям для здоровья человека. Медицинскую реабилитацию пациентов с COVID-19 рекомендуется начинать уже в условиях отделений интенсивной терапии при достижении стабилизации состояния пациента и продолжать после завершения лечения в стационаре в домашних условиях1. Наиболее перспективными для респираторной реабилитации являются первые два месяца после острого периода COVID-19 в период так называемого терапевтического окна [1]. Также, учитывая распространенность COVID-19, продолжительность лечения в специализированном стационаре, длительное вирусоносительство и выраженное снижение функций организма, значительно ограничивающее активность и участие пациента с COVID-19, рекомендуется, на сколько возможно, проводить мероприятия по медицинской реабилитации дистанционно с использованием телемедицинских технологий [2].
Медицинская реабилитация направлена на восстановление функций внешнего дыхания, транспорта и утилизации кислорода тканями, органами и системами, восстановление толерантности к нагрузкам, психоэмоциональной стабильности, повседневной активности и участия [3]. Индивидуальная программа медицинской реабилитации должна учитывать все меры первичной и вторичной профилактики тромбозов и тромбоэмболий, регресса клинической симптоматики пневмонии, проявлений нарушения функций сердца, головного мозга, почек и других органов2. При этом возникает вопрос об оценке эффективности программ реабилитации, проводимых в различных форматах, в т. ч. на кардиоваскулярные конечные точки (сердечно-сосудистые смерти, инфаркты миокарда (ИМ), инсульты и сердечно-сосудистые госпитализации).
Цель исследования: определение эффективности разных вариантов проведения реабилитации у госпитализированных больных, перенесших COVID-19, на развитие отдаленных неблагоприятных сердечно-сосудистых событий через 1 год после выписки.
Материал и методы
В ретроспективном обсервационном неконтролируемом продольном исследовании по типу «случай-контроль» были сформированы три группы пациентов, госпитализированных с COVID-19 средней и тяжелой формами, с площадью поражения легких 8-80%: две основные группы с двумя вариантами воздействия (реабилитацией) и одна группа контроля. I группа — 118 пациентов, проходивших медицинскую реабилитацию дистанционно с применением телемедицинских технологий до 14 дней после выписки из инфекционного госпиталя, II группа — 46 пациентов, проходивших медицинскую реабилитацию стационарно с применением аппаратов для кинезиотерапии до 30 дней после выписки из инфекционного госпиталя, и III группа — 175 отказавшихся пациентов, не проходивших медицинскую реабилитацию после выписки из инфекционного госпиталя.
В исследование включили 118 пациентов, обратившихся в первые 14 дней после выписки из инфекционного госпиталя на дистанционную реабилитацию (группа I). В данной группе пациенты определялись в группу лечебной физкультуры: индивидуальная, группа с облегченным комплексом лечебной физкультуры (продолжительностью 25 мин, малой интенсивности) или группа со стандартным комплексом лечебной физкультуры (продолжительностью 40 мин, средней интенсивности). Пациентов инструктировали и устанавливали на их телефоны мобильные приложения WhatsApp и ZOOM, затем добавляли их в WhatsApp группу с членами мультидисциплинарной реабилитационной бригады. По расписанию в группу отправляли приглашение на занятие в ZOOM, пациенты подключались в свои группы лечебной физкультуры, инструктор-методист проводил занятие под контролем видеосвязи. На выходные в WhatsApp группу размещали видеоуроки для самостоятельных занятий по основному комплексу дыхательной гимнастики и короткий комплекс дыхательной гимнастики для повторений 3-5 раз в день (продолжительностью 10 мин, плотностью 60%, количество повторений 6-10 раз, темп медленный, режим двигательной активности — 2а-2б (адаптация к постепенной вертикализации, положение сидя, стоя)).
Вторая группа — 46 пациентов, проходивших медицинскую реабилитацию в условиях дневного стационара в период 14-30 дней после вписки из инфекционного госпиталя. Пациентов делили на 2 группы по состоянию пациента: первая группа — плотность 60-65%, темп медленный, количество повторений 6-8 раз, режим двигательной активности — 3а (щадящий), и вторая группа — плотность 70-80%, темп медленный, средний; количество повторений 1015, режим двигательной активности — 3б (щадяще-тренирующий). Также использовали механотерапию — в качестве базисного метода комплексной дыхательной реабилитации применялись велотренажер и кинезотерапия с помощью физиотерапевтического комплекса «ОРМЕД» («Орбита», г. Уфа). В состав комплекса входили роботизированный кинезотерапевтический аппарат «ОРМЕД — Кинезо» и бесконтактная гидромассажная ванна «ОРМЕД — Акварелакс». Средний курс медицинской реабилитации после выписки из стационара составил 14 дней, далее пациенты продолжали самостоятельно реабилитацию ежедневно в среднем 2-3 мес.: дыхательную гимнастику и аэробные упражнения, силовые тренировки разной интенсивности, психологическую поддержку.
Исследование проводилось на базе Клиники Башкирского государственного медицинского университета. По результатам телефонного опроса и анализа данных электронной системы регистрации событий Promed были получены отдаленные результаты неблагоприятных сердечно-с осудистых событий и выживаемости после выписки из инфекционного госпиталя. Конечные точки оценивались через 12 мес. после выписки из инфекционного госпиталя. В качестве конечных точек, отслеживаемых в период до года после госпитализации, рассматривались: сердечно-сосудистая смерть пациента, острый ИМ, острое нарушение мозгового кровообращения, фибрилляция предсердия, тромбоэмболия легочной артерии, госпитализация и отдельно сердечно-сосудистая госпитализация.
Для оценки достоверности влияния реабилитации, в т. ч. в различных форматах ее проведения, использовалась следующая схема псевдорандомизационного анализа (Propensity score matching, PSM).
На первом этапе определялись кандидаты в конфаундеры, признаки, из-за которых возможно смещение в исследуемых группах. Для этого определяли попарные межгрупповые различия, используя для непрерывных и частотных признаков соответственно тест Краскелла-Уоллиса и тест «хи-квадрат» с поправкой на правдоподобие или поправкой Йейтса. В качестве кандидатов в конфаундеры рассматривались демографические признаки (пол, возраст), индекс массы тела, наличие сопутствующих заболеваний (артериальная гипертензия, хроническая болезнь почек, ишемическая болезнь сердца, сахарный диабет, перенесенный ИМ, перенесенный инсульт, хроническая обструктивная болезнь легких (ХОБЛ)), особенности госпитализации по поводу COVID-19 (продолжительность госпитализации в днях, наличие респираторного дистресс-синдрома (РДС), перевод больного на искусственную вентиляцию легких (ИВЛ)/неинвазивную вентиляцию лёгких (НИВЛ)). Считали, что фактор может рассматриваться в качестве конфаундера в случае, если различия статистически значимы при уровне р<0,1.
На втором этапе строили уравнения логистической регрессии, где в качестве целевой переменной рассматривали случай попадания/непопадания пациента в группу, а в качестве признаков влияния рассматривались отобранные на предыдущем этапе кандидаты в конфаундеры. Считали, что признак, кандидат в конфаундеры, действительно им являлся, если коэффициент при нём уравнения регрессии статистически значимо отличался от нуля при p<0,05. Строили следующие варианты логистических регрессий для отбора в группы: в I или во II, в I или в III, в III или во II, в I и II или в III.
На третьем этапе проводилась непосредственно сама процедура PSM. Для этого на основании результатов логистической регрессии рассчитывали PS-индекс («индекс склонности» попадания пациента в определенную группу), и удаляли из групп пациентов с высоким индексом таким образом, чтобы группы становились сбалансированными и отсутствовали бы признаки, по которым выборки различались. В качестве метода сопоставления (мэтчинга) пар пациентов из двух выборок использовали метод ближайшего соседа. Здесь следует отметить, что при сопоставлении I и III групп, II и III групп, I+II и III групп использовали для оценки эффекта средний эффект воздействия фактора на объекты основной группы («average treatment effect for the treated» — ATT), а для сопоставления I и II групп — средний эффект воздействия фактора («average treatment effect» — ATE), т. к. здесь обе группы являются основными. Качество проведения процедуры псевдорандомизации контролировали по вариационному соотношению для значений конфаундера до и после рандомизации. В случае, если сбалансированность выборок после псевдорандомизации увеличивалась, то вариационное соотношение заметно уменьшалось.
На четвертом этапе после процедуры псевдорандомизации в новых сформированных выборках оценивали статистическую значимость в различии частоты конечных точек. Для этого использовали критерий «хи-квадрат», в т. ч. с поправкой на правдоподобие при редких частотах и с поправкой Йейтса, если в одной из групп сравнения признак не наблюдается вовсе. Считали, что различия статистически значимы, если р<0,1.
Для проведения PSM анализа использовали библиотеку «MatchIt» среды статистического моделирования R.
Результаты
В таблице 1 представлено сравнение возраста и продолжительности госпитализации пациентов в 3-х группах. Анализ различий между сформированными группами показал, что пациенты в группе проходивших медицинскую реабилитацию стационарно, в т. ч. с применением аппаратов для кинезиотерапии, были моложе: медианный возраст был 48 лет против медианных возрастов 57 и 56,5 лет в двух других исследуемых группах. Однако, согласно тесту Краскела-Уоллиса, такие различия не были значимы (p>0,1), за счет того, что межквартильный размах во II группе был очень большой. Различий в сроках госпитализации по поводу COVID-19 в обследуемых группах не наблюдалось (p>0,5): медианная продолжительность госпитализации была 10-11 дней.
Таблица 1
Сравнение характеристик исследуемых групп по возрасту и сроку госпитализации
(Me — медиана, Q1 — первая квартиль, Q3 — третья квартиль)
|
Параметр |
I дистант (основная), Ме (Q1;Q3) |
II отделение (основная), Ме (Q1;Q3) |
III (контроль), Ме (Q1;Q3) |
p-уровень различий согласно критерию Краскелла-Уоллиса |
|
n |
118 |
46 |
175 |
|
|
Возраст, лет |
57 (48;63) |
48 (29;60) |
56,5 (47;63) |
р=0,114 |
|
Продолжительность госпитализации, дней |
11 (9;14) |
10 (8;11,75) |
10 (8;12) |
р=0,658 |
|
Поражения легких (по КТ), % |
40 (28;52) |
40 (34,5;49,5) |
40 (28;48) |
р=0,222 |
Сокращение: КТ — компьютерная томография.
Медиана объема поражения лёгких во всех трех группах составила 40%, при этом межквартильные размахи отличались (для II группы было небольшое смещение вправо), однако согласно критерию Краскела-Уоллиса статистических различий по этому показателю не наблюдалось (p>0,2) (табл. 1). При парном сравнении распределения степени тяжести по классификации рекомендаций Минздрава России в группах различий выявлено не было (p>0,2, табл. 2). Соответственно, данные признаки, отвечающие за течение заболевания, в качестве кандидатов в конфаундеры не рассматривались.
Таблица 2
Сравнение характеристик исследуемых групп
по полу и сопутствующим заболеваниям (абсолютная частота, %)
|
Параметр |
I (основная) |
II (основная) |
III (контроль) |
p1 — сравнение I и II, |
|
n |
118 |
46 |
175 |
|
|
Пол, м/ж (%) |
53/65 (44,9/55,1) |
18/28 (39,1/60,9) |
85/90 (48,6/51,4) |
p1=0,502, |
|
АГ, n (%) |
48 (40,7) |
17 (37) |
60 (34,3) |
p1=0,662, |
|
СД, n (%) |
10 (8,5) |
7 (15,2) |
20 (11,4) |
p1=0,204, |
|
ХБП, n (%) |
5 (4,2) |
3 (6,5) |
8 (4,6) |
p1=0,542, |
|
ХСН, n (%) |
10 (8,5) |
3 (6,5) |
13 (7,4) |
p1=0,678, |
|
ИБС, n (%) |
5 (4,2) |
3 (6,5) |
8 (4,6) |
p1=0,542, |
|
ХОБЛ, n (%) |
5 (4,2) |
4 (8,7) |
3 (1,7) |
p1=0,261, |
|
Перенесенный ИМ, n (%) |
2 (1,7) |
2 (4,3) |
3 (1,7) |
p1=0,349#, |
|
Перенесенный инсульт, n (%) |
1 (0,8) |
1 (2,2) |
2 (1,1) |
p1=0,510#, |
|
ИВЛ, n (%) |
1 (0,8) |
0 |
0 |
p1=0,625&, |
|
НИВЛ, n (%) |
3 (2,5) |
2 (4,3) |
0 |
p1=0,560#, |
|
РДС, n (%) |
14 (11,9) |
2 |
4 (2,3) |
p1=0,100#,*, |
|
Степень тяжести по классификации Минздрава России (тяжелое/средне-тяжелое течение) |
102 (86,4)/16 (13,6) |
40 (87)/6 (13) |
155 (88,6)/20 (11,4) |
p1=0,931, |
Примечание: & — рассчитано с поправкой Йейтса,
# — рассчитано с поправкой на правдоподобие,
*, **, ***, **** — различия статистически значимы
при p<0,1, p<0,05, p<0,01, p<0,001, соответственно.
Сокращения: АГ — артериальная гипертония,
ИБС — ишемическая болезнь сердца,
ИВЛ — искусственная вентиляция легких,
ИМ — инфаркт миокарда,
НИВЛ — неинвазивная вентиляция лёгких,
РДС — респираторный дистресс-синдром,
СД — сахарный диабет,
ХБП — хроническая болезнь почек,
ХОБЛ — хроническая обструктивная болезнь легких,
ХСН — хроническая сердечная недостаточность.
При попарном межгрупповом сравнении I, II и III групп и I+II против III группы не было выявлено статистически значимых различий в гендерной принадлежности пациентов (p>0,2), в наличии сопутствующих заболеваний, таких как артериальная гипертензия (p>0,2), сахарный диабет (p>0,2), хроническая болезнь почек (p>0,5), ишемическая болезнь сердца (p>0,5), хроническая сердечная недостаточность (p>0,6), в перенесенных в анамнезе ИМ (p>0,3) и инсульте (p>0,5), таблица 2. Что касается ХОБЛ, то различия при уровнях p<0,05 и p<0,1 были значимы при сравнении II и III групп и I+II и III групп, соответственно. Статистически значимые различия в группах были по показателю РДС: у пациентов I группы синдром статистически значимо был чаще по сравнению с пациентами II (p<0,1) и III групп (p<0,001). Также среди пациентов I группы чаще наблюдался перевод на ИВЛ/ НИВЛ в период госпитализации (p<0,1), но следует отметить, что все пациенты, переведенные на инвазивную и неинвазивную вентиляцию легких, имели РДС. Таким образом, можно сделать вывод, что реабилитируемые в группе дистанционной реабилитации (I) имели в анамнезе более тяжелое течение COVID-19 по сравнению с пациентами, проходящими реабилитацию стационарно, или вовсе её не проходящими.
Как видно из проведенного анализа основной ковариатой реабилитируемых, из-за которой возможно получение смещения в оценках эффективности программы реабилитации с точки зрения возникновения неблагоприятных конечных точек в отдаленном периоде, может быть наличие РДС. В результате для проведения псевдорандомизации были оценены уравнения логистической регрессии, где в качестве конфаундера для попадания в группы I или II, в группы I или III и в группы I+II или III рассматривался признак РДС, а в группы II или III — признак ХОБЛ. Результаты оценивания в виде коэффициента при конфаундере ± стандартная ошибка (SE) и соответствующий p-уровень приведены в таблице 3.
Таблица 3
Результаты оценки логистических регрессий с учетом отобранных конфаундеров
|
Конфаундер |
Коэффициент ±SE |
p-уровень |
|
|
I и II группы |
Свободный член |
-1,519±0,164 |
<0,001*** |
|
РДС |
0,826±0,501 |
0,099 |
|
|
II и III группы |
Свободный член |
-0,879±0,179 |
<0,001*** |
|
ХОБЛ |
-0,826±0,441 |
0,061 |
|
|
I и III группы |
Свободный член |
0,639±0,120 |
<0,001*** |
|
РДС |
-1,652±0,596 |
0,006** |
|
|
I+II и III группы |
Свободный член |
0,838±0,116 |
<0,001*** |
|
РДС |
-1,444±0,521 |
0,006** |
Примечание: **, *** — различия статистически значимы
при p<0,05, p<0,01, соответственно.
Сокращения: РДС — респираторный дистресс-синдром,
ХОБЛ — хроническая обструктивная болезнь легких.
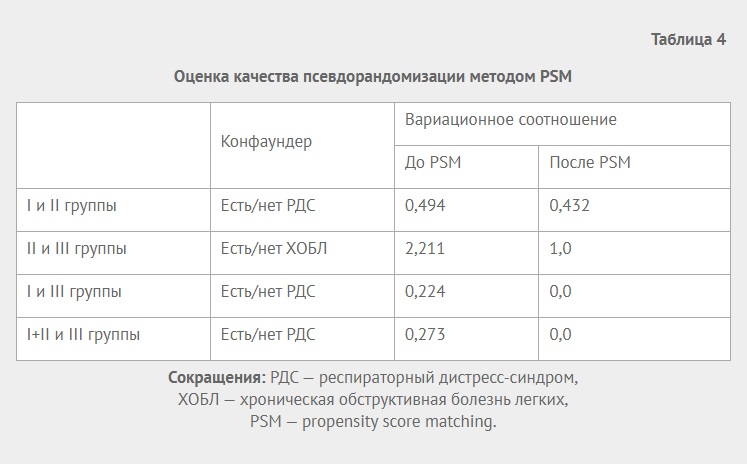
Из результатов оценки логистических регрессий для «склонности попадания» пациента в определенную группу видно, что истинным конфаундером, обеспечивающим смещения в группах, является признак наличия РДС (p<0,001 для I и III группы и для I+II и III группы). Для этих групп при процедуре непосредственно мэтчинга (сопоставления пар наблюдений в разных группах) при проведении псевдорандомизации вариационное соотношение различий уменьшилось до нуля (табл. 4), что позволяет получить достоверные оценки при сравнении по конечным точкам. Для групп I и II, II и III вариационное соотношение также после псевдорандомизации существенно сократилось (табл. 4).
Таблица 4
Оценка качества псевдорандомизации методом PSM
|
Конфаундер |
Вариационное соотношение |
||
|
До PSM |
После PSM |
||
|
I и II группы |
Есть/нет РДС |
0,494 |
0,432 |
|
II и III группы |
Есть/нет ХОБЛ |
2,211 |
1,0 |
|
I и III группы |
Есть/нет РДС |
0,224 |
0,0 |
|
I+II и III группы |
Есть/нет РДС |
0,273 |
0,0 |
Сокращения: РДС — респираторный дистресс-синдром,
ХОБЛ — хроническая обструктивная болезнь легких,
PSM — propensity score matching.
В результате проведения процедуры псевдорандомизации исходные выборки были усечены за счет отсева наблюдений, из-за которых группы были не сбалансированы. Так, при сравнении I группы со II она была сокращена до IPSM объемом 46 наблюдений, III группа была преобразована при сравнении со II группой в группу IIIPSM1 (n=46), при сравнении с I группой в группу IIIPSM2 (n=118), при сравнении с I+II группой в группу IIIPSM3 (n=164).
Подсчёт конечных точек при сравнении сбалансированных после псевдорандомизации групп проводился через год после госпитализации и представлен в таблице 5. Как видно, при уровне значимости p<0,1 было статистически значимо меньше сердечно-сосудистых смертей в группе, где проводилась реабилитация с применением телемедицинских технологий, по сравнению с группой пациентов без реабилитации и статистически значимо меньше было сердечно-сосудистых госпитализацией в группе, где применялась реабилитация в стационаре по сравнению с группой пациентов, отказавшихся от реабилитации. В целом в группах реабилитируемых статистически меньше было сердечно-сосудистых госпитализаций по сравнению с пациентами, не проходящими реабилитацию после госпитализации с COVID-19 (p<0,1).
Таблица 5
Сравнение частот появления неблагоприятных конечных точек
в исследуемых группах после PSM-анализа
|
Конечная точка |
IPSM и II группы, |
II и IIIPSM1 группы, |
I и IIIPSM2 группы, |
I+II и IIIPSM3 группы, |
|
n после PSM |
46/46 |
46/46 |
118/118 |
164/164 |
|
Сердечно-сосудистая смерть |
0/1 (2,2%), |
1 (2,2%)/0, |
0/3 (2,5%), |
1 (0,6%)/4 (2,4%), |
|
ОИМ |
1 (2,2%)/1 (2,2%) |
1 (2,2%)/2 (4,3%), |
1 (0,8%)/1 (0,8%) |
2 (1,2%)/3 (1,8%), |
|
ОНМК |
0/1 (2,2%), |
1 (2,2%)/2 (4,3%), |
1 (0,8%)/0, |
2 (1,2%)/2(1,2%) |
|
ФП |
0/0 |
1(2,2%)/0, |
0/0 |
1 (0,6%)/1 (0,6%) |
|
ТЭЛА |
0/0 |
0/0 |
0/0 |
0/0 |
|
Госпитализация |
12 (26,1%)/7 (15,2%), |
7 (15,2%)/13 (28,3%), |
22 (18,6%)/19 (16,1%), |
29 (17,7%)/26 (15,9%), |
|
Сердечно-сосудистая госпитализация |
4 (8,7%)/3 (6,5%), |
3 (6,5%)/9 (19,6%), |
8(6,8%)/9 (7,6%), |
11 (6,7%)/21 (12,8%), |
Примечание: & — рассчитано с поправкой Йейтса,
# — рассчитано с поправкой на правдоподобие,
* — различия статистически значимы при p<0,1.
Сокращения: ОИМ — острый инфаркт миокарда,
ОНМК — острое нарушение мозгового кровообращения,
ТЭЛА — тромбоэмболия легочной артерии,
ФП — фибрилляция предсердий,
PSM — propensity score matching.
Обсуждение
В ряде исследований была показана высокая частота сердечно-сосудистых осложнений после COVID-19 [4][5]. С начала пандемии была показана высокая актуальность проведения реабилитации у пациентов с COVID-19, в особенности у госпитализированных пациентов средне-тяжелой степени тяжести. Стали появляться международные и российские рекомендации, в которых описывалась длительность, методология и показания к респираторной и другой реабилитации. Однако до сих пор отсутствовали оригинальные исследования, направленные на оценку эффективности реабилитации в отдаленном периоде в отношении развития неблагоприятных сердечно-сосудистых событий, в частности смертей, развития инсультов, инфарктов и госпитализаций.
В нашем нерандомизированном неконтролируемом исследовании у госпитализированных больных с COVID-19 были сформированы 3 группы: с помощью телемедицинских технологий, реабилитация в условиях отделения реабилитации и пациенты, отказавшиеся от реабилитации. При оценке эффективности методов реабилитации возникает проблема смещённого отбора в группы реабилитируемых, обусловленная отсутствием рандомизации при формировании групп. В основном, в отделение реабилитации попадали более «тяжелые» пациенты, чем отказавшиеся от реабилитации. В связи с этим простое статистическое сравнение отдаленных событий в группах реабилитируемых и нереабилитируемых было некорректным. Одним из методов, позволяющих получить достоверные оценки при сравнении в таких группах, является проведение процедуры предварительной псевдорандомизации. Данный метод стал особенно часто применяться в последнее время, например, в работе, рассматривающей возможности улучшения результатов кардиореабилитации за счет применения мобильных технологий, применяется метод псевдорандомизации — PSM [6]. Также данный метод используют авторы для оценки достоверности влияния легочной реабилитации на переносимость физической нагрузки и иммунологию через 6 мес. после госпитализации по поводу COVID-19 [7].
В нашем исследовании после применения вышеуказанного Propensity Score Analysis было показано, что при госпитализации пациентов с COVID-19 после выписки из стационара в течение 1 года имелось различие между частотой смертей между 1 и 3 группами. Также при сравнении группы реабилитации (стационарной и телемедицинской) и отсутствии реабилитации показало снижение частоты сердечно-с осудистой госпитализации при проведении реабилитации.
Наши результаты подтверждаются рядом исследований по реабилитации у больных с COVID-19. Так, da Silva Vieira AG, et al. (2022) на почти 3000 пациентов показали, что телереабилитация, включая респираторные занятия, способна улучшить переносимость физической нагрузки, одышку, физический компонент качества жизни и не увеличивает количество неблагоприятных сердечно-с осудистых событий [8].
В метаанализе Huang J, et al. (2022) было показано, что телемедицинская реабилитация способна улучшать одышку, силу мышц конечностей, функциональную способность и уменьшать частоту депрессии [9]. В другом исследовании было показано, что у пациентов с средне-л егким ковидом аэробная физическая реабилитация уменьшает степень тяжести заболевания и способствует повышению качества жизни [10]. И, наконец, наши результаты по снижению смертности коррелируют с результатами систематического анализа на 1200 пациентов с сердечно-сосудистыми заболеваниями и COVID-19 [11], в котором было показано снижение смертности и частоты регоспитализаций в стационар в течение 4 мес. после заболевания. В нашей когорте >50% пациентов имели сердечно-сосудистые заболевания.
Ограничения исследования. Размер выборок был относительно небольшим и у всех пациентов был вариант (штамм) вируса Альфа. Кроме того, имелись различия между группами анализа, которые, впрочем, были скорректированы посредством выполнения PSM анализа. С учетом данного факта критерием достоверности было выбрано p<0,1.
Заключение
Таким образом, в нашем исследовании было показано, что проведение краткосрочной постковидной реабилитации после выписки из стационара уменьшает сердечно-сосудистую смертность. Кроме того, программы телереабилитации способствуют уменьшению частоты сердечно-сосудистых госпитализаций у пациентов.
Отношения и деятельность. Исследование выполнено при финансовой поддержке гранта РНФ «Методика оценки глобального экономического бремени болезни с учетом отдалённых последствий для здоровья и качества жизни населения (на примере новой коронавирусной инфекции)» № 22-18-20123.
1. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 8 (03.09.2020) (утв. Минздравом России). С. 1-18, 84-95.
2 Временные методические рекомендации Союза Реабилитологов России «Медицинская реабилитация при новой коронавирусной инфекции (COVID-19)», версия 2 (31.07.2020).
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Ласынова Г.Х., Лакман И.А., Гареева Д.Ф., Агапитов А.А., Садикова Л.Ф., Сахаутдинов А.Р., Павлов В.Н., Загидуллин Н.Ш. Реабилитация пациентов после новой коронавирусной инфекции (COVID-19) и её влияние на сердечно-сосудистые конечные точки: propensity score matching анализ. Российский кардиологический журнал. 2023;28(4S):5630. https://doi.org/10.15829/1560-4071-2023-5630. EDN: BVMKPQ
Скопировать