Программирование кардиальных имплантируемых электронных устройств при стимуляции проводящей системы: информационно-практический обзор
Аннотация
Стимуляция проводящей системы сердца получает широкое распространение в качестве альтернативы стимуляции правого желудочка и, в некоторых случаях, как альтернатива бивентрикулярной стимуляции для сердечной ресинхронизирующей терапии. Правильное программирование имплантируемого электронного устройства имеет важное значение для обеспечения безопасности пациента и получения максимальной пользы от кардиостимуляции. Целью статьи является предоставление информации о практических аспектах программирования стимуляции пучка Гиса и области левой ветви пучка Гиса и последующего наблюдения.
Стимуляция проводящей системы (СПС) (conduction system pacing, CSP) включает в себя стимуляцию пучка Гиса (СПГ) и стимуляцию области левой ножки пучка Гиса (СЛНПГ) и быстро получает широкое распространение. Впервые о постоянной СПГ было сообщено почти 20 лет назад, но метод только недавно получил более широкое распространение после облегчения процедуры имплантации с помощью специальных инструментов — беспросветных электродов и интродьюсеров. Методика имплантации широко представлена в современной литературе, описаны подходы, нюансы достижения поставленной цели. Однако эффективная СПС зависит не только от успешной имплантации системы, но и от правильного программирования устройства. Современные кардиальные имплантируемые электронные устройства (ИЭУ) не предназначены специально для СПС. Для такой стимуляции можно использовать однокамерные, двухкамерные или трехкамерные (СРТ, сердечная ресинхронизирующая терапия) устройства в соответствии с основным сердечным ритмом (синусовый ритм или постоянная предсердная аритмия) и целями кардиостимуляции [1]. В зависимости от конфигурации устройства могут возникнуть различные особенности программирования, которые следует учитывать при имплантации и последующем наблюдении таких пациентов.
Общие положения
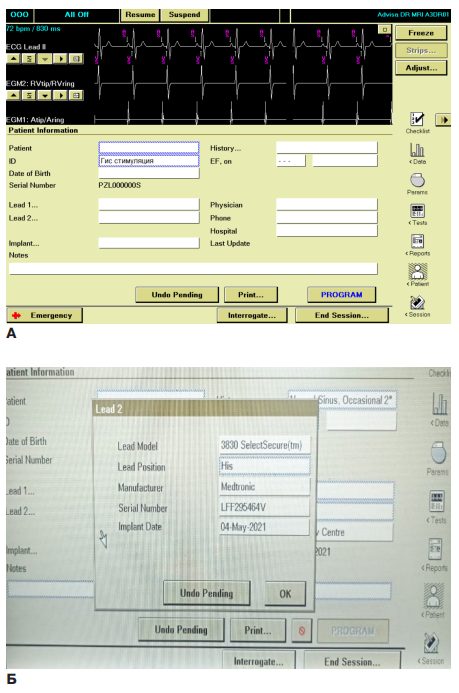
Маркировка устройств. Поскольку в настоящее время нет доступных ИЭУ с выделенным портом для СПС, в медицинской карте пациента, на карте устройства пациента и в окне свободного текста информации о пациенте непосредственно в самом устройстве должно быть ясно указано, что у системы стимуляции есть электрод для СПС (СПГ или СЛНПГ) и в какой порт он вставлен (рис. 1). Это особенно актуально, когда электрод СПС подключен к предсердному порту ИЭУ, что может сбить с толку, поскольку во время опроса устройства можно ошибочно предположить, что предсердный электрод дислоцирован в желудочек.
Значение электрокардиограммы (ЭКГ) в 12 отведениях. Во время последующего наблюдения у части пациентов (4%) может наблюдаться потеря захвата элементов проводящей системы [2-4]. Поэтому рекомендуется выполнять 12-канальную ЭКГ во время каждой последующей оценки. При выполнении пороговых тестов ЭКГ в 12 отведениях имеет первостепенное значение для распознавания различных типов захвата (селективный или неселективный захват системы проводимости, захват только миокарда или анодный захват) [5]. Недавно были предложены критерии для дифференциации морфологии СПГ и перегородочного захвата правого желудочка (ПЖ) путем тщательного анализа электрограммы устройства ближнего и дальнего поля [6]. Это может помочь сэкономить время в клинике при проведении процедуры программирования Follow up. Также Tan ESJ, et al. был предложен новый метод с использованием программируемой ЭКГ для оценки «псевдо-V1» и «псевдо-V6», который показал высокую корреляцию с измерениями, полученными с помощью 12-канальной ЭКГ [7]. Для достижения этого используется кабель ЭКГ программатора — отведения правой и левой руки располагаются рядом друг с другом справа в четвертом межреберье парастернально, в то время как электроды правой и левой ноги располагаются рядом друг с другом слева в пятом межреберье по средней подмышечной линии, рядом друг с другом. Псевдо-отведение V1 получается путем оценки отведения I в программаторе, тогда как псевдо-отведение V6 получается путем оценки отведения II/III в программаторе.
Частота наблюдения. Как правило, наблюдение за пациентами с СПС проводится непосредственно после имплантации, через 1, 3 и 6 мес., а затем продолжается каждые 6 мес. Это может происходить чаще, чем при стандартной стимуляции (обычно проводится ежегодно) из-за потенциально возможной потери захвата СПС, по некоторым данным, почти у 17% пациентов при СПГ, и необходимости ревизии электрода у 11% пациентов [8]. Долгосрочные результаты тестирования электродов для СЛНПГ показывают стабильные и высокие воспринимаемые амплитуды зубца R и низкие пороги захвата, поэтому скорее всего у пациентов с СЛНПГ в будущем такой частый ритм визитов может измениться на рутинное ежегодное наблюдение [9].
Конфигурация устройства. Порт генератора, к которому подключается электрод СПС, зависит от исходного ритма (синусовый ритм или хроническая предсердная аритмия), наличия резервного желудочкового электрода и показаний к электростимуляции (стимуляция для коррекции брадикардии или СРТ). Однокамерные ИЭУ применяют при СПС при хронических предсердных аритмиях. Двухкамерные устройства можно использовать либо при синусовом ритме с предсердным электродом и электродом СПС, либо — в случае хронической предсердной аритмии — с электродом СПС, подключенным к предсердному порту, и резервным электродом для стимуляции ПЖ (используется в отдельных случаях СПГ и редко при СЛНПГ) или в случае выбора имплантируемого кардиовертера-дефибриллятора (ИКД). Бивентрикулярные (биВ) устройства можно использовать для имплантации в случаях наличия у пациента синусового ритма с предсердным электродом, электродом СПС, подключенным к порту левого желудочка (ЛЖ), и резервной стимуляцией ПЖ или электродом ИКД. У пациентов с хроническими предсердными аритмиями электрод СПС подключается к предсердному порту, а электроды ПЖ и ЛЖ обеспечивают СРТ, оптимизированную по His (His-Optimized Cardiac Resynchronization Therapy, HOT-CRT) или СРТ, оптимизированную по левой ножке пучка Гиса (Left bundle branch pacing Optimized Cardiac Resynchronization Therapy, LOT-CRT), при этом СПС объединяется со стимуляцией ПЖ и/или ЛЖ для оптимизации электрической синхронизации [10, 11]. Запрограммированные параметры будут во многом зависеть от конфигурации устройства и показаний к кардиостимуляции.

Рис. 1. Вид экрана программатора с полями для введения данных пациента, вариант обозначения наличия Гис-стимуляции в поле ID пациента (А), заполнение референтного номера, вида и серийного номера электрода в выпадающем окне Lead 2 (Б).
Таблица 1
Рекомендации по программированию при СПС
|
Параметр |
Рекомендации при СПГ |
Рекомендации при СЛНПГ |
|
Режим стимуляции |
Однокамерное ИЭУ: VVI Двухкамерное или СРТ ИЭУ: • Гис-электрод в порт RV: DDD(R), DDI или УЖС • Гис-электрод в порт RA: хроническая ФП, со страховочным RV электродом: DDD(R), DDI(R) или DVI(R) |
Однокамерное ИЭУ: VVI Двухкамерное или СРТ ИЭУ: • ЛНПГ-электрод в порт RV: DDD(R), DDI или УЖС • ЛНПГ-электрод в порт RA: хроническая ФП, со страховочным RV или дефибрилляторным электродом: DDI(R) или DVI(R) |
|
Полярность стимуляции |
Монополярная (лучше визуализируется спайк стимула, не спутать с собственным ритмом, ниже пороги стимуляции) Биполярная (меньше расход батареи из-за более высокого импеданса) |
Биполярная (меньше расход батареи из-за более высокого импеданса, анодная стимуляция может сужать QRS) Монополярная — если анодная стимуляция нежелательна |
|
Полярность сенсинга |
Биполярная (монополярную можно пробовать при низкой амплитуде сигнала или овесенсинге Р-волны или потенциала п. Гиса) |
Биполярная |
|
Чувствительность |
Гис электрод в RA: установите максимальную часть (минимальное значение), т. к. желудочковый сенсинг обеспечивается электродом RV Гис-электрод в RV: подстройте чувствительность, чтобы обеспечить восприятие желудочкового сигнала, но избегать гиперсенсинга потенциалов предсердий или пучка Гиса |
Обычно это не проблема, т. к. R-волны достаточной амплитуды |
|
Вольтаж стимула |
2 Х порог стимуляции Фиксированный запас прочности, например, 1 В у ЭКС-независимых пациентов |
2 Х порог стимуляции |
|
Длительность стимула |
0,4 мс (1 мс при высоком пороге стимуляции). 0,2-0,4 мс можно применять в соответствии с хронаксией |
0,4 мс (обычно порог стимуляции не проблема) |
|
Алгоритмы автоматического контроля захвата |
Деактивировать, только монитор (измерение может быть неточным или невозможным, особенно при коннекции Гис-электрода в порт RA). Или активация, если точность будет подтверждена у пациента |
Установить в режим монитора или автоматически, если точность будет подтверждена у пациента |
|
АВ задержка (AVD) |
Гис-электрод в порт RV: вычесть длительность HV интервала (например, 40 мс) от желаемой AVD. Гис-электрод в порт RA со страховочным желудочковым электродом: AVD >His pace-RVS интервал (например, 150 мс) Гис-электрод в порт RA при HOT-CRT: оптимизируйте AVD в соответствии с самым узким QRS или установите эмпирически 60% от His pace-RVS интервала (например, 40-60 мс) |
Электрод ЛНПГ в порт RV: вычтите LBB-V интервал (например, 20 мс) от желаемой AVD. ЛНПГ-электрод в порт RA со страховочным желудочковым электродом: AVD >LBBP-RVS интервал (например, 150 мс) ЛНПГ-электрод в порт RA при LOT-CRT: оптимизируйте AVD в соответствии с самым узким QRS |
|
Межжелудочковая задержка VVD (Электрод СПС в порт LV) |
При страховочной стимуляции RV — выберите максимально возможное опережение LV (например, 80 мс) Если слив с ПЖ нежелателен (например, при некорректированной БПНПГ), запрограммируйте опережение LV 30-60 мс, оптимизируйте по поверхностной ЭКГ |
При страховочной стимуляции RV (например, в ИКД) выберите максимально возможное опережение LV (например, 80 мс) |
|
Безопасная стимуляция желудочков (Ventricular safety pacing, VSP) |
Отключить, если Гис-электрод в RA порте со страховочным RV электродом после подтверждения отсутствия перекрестной чувствительности cross-talk |
Отключить, если ЛНПГ-электрод в RA порте со страховочным RV электродом (например, ИКД или LOT-CRT) после подтверждения отсутствия перекрестной чувствительности cross-talk |
|
Автоматические алгоритмы контроля чувствительности |
Деактивировать (оверсенсинг Р-волны или HV сенсинг могут привести к асистолии) |
Можно оставить |
|
Сенсинг, если СПС электрод подключен в порт LV |
Деактивировать (Biotronik, Boston Scientific) |
Деактивировать (Biotronik, Boston Scientific) |
|
Алгоритмы оптимизации AV и VV интервалов |
Деактивировать |
Деактивировать |
|
Триггерная стимуляция желудочков (VSR и т. п.) |
Деактивировать |
Деактивировать |
Сокращения: АВ(AV)И — атриовентрикулярный интервал, БПНПГ — блокада правой ножки пучка Гиса, ИКД — имплантируемый кардиовертер-дефибриллятор, ИЭУ — имплантируемое электронное устройство, ПЖ — правый желудочек, СПГ — стимуляция пучка Гиса, СПС — стимуляция проводящей системы, СЛНПГ — стимуляция левой ножки пучка Гиса, СРТ — сердечная ресинхронизирующая терапия, УЖС — управляемая желудочковая стимуляция, ФП — фибрилляция предсердий, ЭКС — электрокардиостимулятор, ЭКГ — электрокардиограмма, AVD — атриовентрикулярная задержка, HOT-CRT — сердечная ресинхронизированная терапия, оптимизированная со стимуляцией пучка Гиса, HV — интервал Гис-желудочек, LOT-CRT — сердечная ресинхронизированная терапия, оптимизированная со стимуляцией левой ножки пучка Гиса, LV, RV, RA — порты электронного устройства, DDD, VVI, СРТ — режимы стимуляции, VV — межжелудочковый интервал.
HOT-CRT и LOT-CRT
Перспективное и неисследованное направление применения СПС — HOT-CRT и LOT-CRT. В данной конфигурации стимуляция с электрода в гисиальной позиции (или из области левой ножки) сочетается со стимуляцией эпикарда ЛЖ через венозную систему сердца. Методика позволяет преодолевать как полную блокаду левой ножки пучка Гиса (БЛНПГ), так и нарушения внутрижелудочкового проведения, вызванные периферическими нарушениями в проводящей системе [12].
Такая конфигурация может быть полезна пациентам, у которых не удалось достичь ресинхронизации как путем СПС, так и путем биВ-стимуляции.
Большинство паттернов блокад внутрижелудочкового проведения с QRS <150 мс обычно представляют собой задержку внутримиокардиальной межклеточной проводимости и могут не принести пользы от СПС, учитывая отсутствие очагового заболевания в системе атриовентрикулярной (АВ) проводимости. Однако у пациентов с выраженной кардиомиопатией и расширенными желудочками могут сосуществовать нарушения АВ-проводимости, такие как БЛНПГ, и внутрижелудочковая блокада. В этих обстоятельствах ресинхронизация может быть более полной за счет стимуляции на уровне специализированной проводящей системы (дистальнее места АВ-проведения) в сочетании с последовательной стимуляцией ЛЖ в областях отсроченной активации миокарда, называемой His-оптимизированной СРТ (HOT-CRT). HOT-CRT оценивалась на небольшой серии пациентов Vijayaraman P, et al. [10]. В этом исследовании 27 пациентов с БЛНПГ/внутрижелудочковой блокадой, у которых только частичное сужение QRS или отсутствие сужения QRS было достигнуто только за счет СПГ, подверглись имплантации эпикардиального электрода ЛЖ в дополнение к СПГ. HOT-CRT привела к улучшению электрической ресинхронизации по сравнению с обычной биВ-стимуляцией или СПГ и была сочтена лучшим клиническим вариантом для этих пациентов. Длительность QRS уменьшилась со 183±27 мс исходно до 120±16 мс (34%) при использовании HOT-CRT по сравнению со 162±18 мс (11%) при обычной биВ-стимуляции (p<0,05). У 95% пациентов с выраженной сердечной недостаточностью, получавших HOT-CRT, наблюдалось значительное эхокардиографическое и клиническое улучшение.
Vijayaraman P, et al. описали новый подход под названием «LOT-CRT», который сочетает в себе СЛНПГ и биВ-стимуляцию [13]. Для этого в трехкамерном устройстве с разъемом DF-1 используется стандартный электрод ЛЖ, который подключается к порту ЛЖ, и электрод СЛНПГ, который подключается к порту ПЖ. Изначально сообщалось, что успешность этой стратегии составляет 81%, в основном из-за невозможности выполнить СЛНПГ [14]. Однако в более позднем исследовании сообщалось об успешности в 96,8% случаев [15]. В рамках международного многоцентрового исследования авторы стремились оценить возможность и результаты СРТ на основе СЛНПГ (СЛНПГ вместо правожелудочкового электрода) в сочетании с коронарно-венозной стимуляцией ЛЖ. LOT-CRT оказалась успешной у 91 из 112 пациентов (81%). Исходные характеристики были следующими: средний возраст 70±11 лет, женщины — 20%, фракция выброса ЛЖ 28,7±9,8%, конечный диастолический диаметр ЛЖ 62±9 мм, уровень N-концевого промозгового натрийуретического пептида 5821±8193 пг/мл, БЛНПГ у 47 человек (42%), неспецифическая задержка внутрижелудочковой проводимости у 25 (22%), электростимуляция ПЖ у 26 человек (23%) и блокада правой ножки пучка Гиса (БПНПГ) у 14 (12%). Характеристики процедуры были следующими: среднее время рентгеноскопии 27,3±22 мин, порог захвата LBBAP 0,8±0,5 В при 0,5 мс и амплитуда зубца R 10 мВ. LOT-CRT привела к значительно большему сужению комплекса QRS со 182±25 мс исходно, до 144±22 мс (P<0,0001), чем биВ-CRT (170±30 мс; P<0,0001) и СЛНПГ (162±0,0001) 23 мс; P<0,0001). При сроке наблюдения ≥3 мес. фракция выброса ЛЖ улучшилась до 37±12%, конечный диастолический диаметр ЛЖ уменьшился до 59±9 мм, уровень N-концевого промозгового натрийуретического пептида снизился до 2514±3537 пг/мл, параметры электрокардиостимуляции были стабильными, а клиническое улучшение было отмечено у 76% пациентов (класс 2,9 по классификации NYHA vs 1,9). Заключением исследования стало заключение, что LOT-CRT осуществима и безопасна, и обеспечивает большую электрическую ресинхронизацию по сравнению с биВ-СРТ и может быть альтернативой, особенно когда с помощью биВ-СРТ достигается только субоптимальная электрическая ресинхронизация [14]. Таким образом, использование стратегии LOT-CRT было связано со значительно более короткой продолжительностью QRS, более высокой фракцией выброса ЛЖ и более низкой частотой комбинированного исхода в виде госпитализаций, связанных с сердечной недостаточностью, и смертности от всех причин по сравнению с биВ-стимуляцией [13, 14]. Эти результаты подтверждают целесообразность использования подхода LOT-CRT для пациентов, у которых изолированная СЛНПГ не приводит к значительному сокращению продолжительности QRS из-за дистальной БЛНПГ или неспецифической задержки внутрижелудочковой проводимости [13].
Программирование при прямой СПС сердца
Приводим некоторые обобщенные принципы, касающиеся настройки функционирования системы стимуляции с используемым электродом, имплантированным в область проводящей системы:
— «классический» тайминг электрокардиостимулятора (ЭКС) не предназначен для функционирования с СПС;
— общепринятый NBG (NASPE/BPEG Generic) код режимов стимуляции не всегда может корректно отразить схему СПС;
— некоторые автоматические функции могут работать некорректно;
— появляются дополнительные факторы выбора режима стимуляции и настроек;
— теряются некоторые диагностические возможности, а другие требуют интерпретации с учетом новых условий функционирования.
Отсутствие контролируемых статистически значимых данных пока не позволяет давать точные алгоритмизированные рекомендации по программированию ИЭУ с использованием прямой СПС. Программирование в таком случае всегда должно выполняться исходя из соображений конкретной клинической задачи, с учетом особенностей конфигурации системы и результатов выполненных тестов.
В таблице 1 представлен обзор рекомендаций по программированию ИЭУ с электродом, имплантированным в разные отделы проводящей системы сердца.
Режим стимуляции
Электрод СПС, подключенный к ПЖ порту. Пациенты с хроническими предсердными аритмиями и однокамерным устройством могут быть запрограммированы на режим VVI(R). Пациентам с двухкамерными или биВ устройствами чаще всего программируют режим DDD(R). Если собственная проводимость присутствует и желательна у пациентов с синусовым ритмом, можно запрограммировать алгоритм стимуляции, позволяющий избежать желудочковой стимуляции (например, «управляемая желудочковая стимуляция», MVP, Medtronic) или режим DDI(R).
Электрод СПС подключен к предсердному порту RA. В большинстве случаев можно запрограммировать режим DDI(R). Это особенно важно в случае СЛНПГ из-за того, что амплитуды восприятия часто превышают максимальные программируемые значения (например, 4 мВ) предсердного канала. Если устройство запрограммировано в режиме DDD, желудочковая экстрасистолия может распознаваться в предсердном канале и не распознаваться в желудочковом канале (из-за разной ориентации этих отведений). Это вызовет желудочковую стимуляцию, которая может попасть в уязвимый период. Еще одним соображением является то, что устройства работают с желудочковой синхронизацией, когда они запрограммированы в режиме DDI(R). Это приведет к тому, что частота стимуляции, управляемая стимулятором, превысит запрограммированную верхнюю частоту. Например, в устройстве с запрограммированной верхней частотой, управляемой аппаратом, 120 уд./мин (500 мс) и стимулированным АВ-интервалом 180 мс, интервал VA будет составлять 320 мс. Если интервал AP-VS составляет 80 мс, фактическая частота стимуляции составит 150 уд./мин (400 мс) [16]. Наконец, следует избегать режима AAI(R) (например, если отведение ПЖ используется только для функции ИКД), поскольку существует риск чрезмерной чувствительности зубца Т.
Полярность и вольтаж стимуляции
Монополярная стимуляция (обычно недоступна в ИКД), за исключением канала ЛЖ в некоторых устройствах, приводит к четкому пику стимуляции на поверхностной ЭКГ, что позволяет легче отличить его от внутреннего ритма (т. к. QRS в СПГ, а иногда и СЛНПГ, может напоминать внутренний ритм). Пороги стимуляции значительно ниже, чем при биполярной стимуляции, но сопротивление электрода составляет около двух третей сопротивления биполярного электрода, что может отрицательно повлиять на срок службы батареи (поскольку E=V2×PW/R) [17]. Когда электрод СПС подключен к порту ЛЖ устройства СРТ, можно запрограммировать расширенную конфигурацию биполярной стимуляции (т. е. использовать кончик электрода СПС в качестве катода, а кольцо или катушку ПЖ в качестве анода), и это может быть полезно в СРТ-Д, которые могут не иметь униполярной конфигурации стимуляции канала ЛЖ. Следует помнить, что такая конфигурация может привести к анодному захвату (т. е. захвату от кончика отведения СПС плюс кольца отведения ПЖ), что может привести к изменениям в морфологии QRS во время порогового тестирования и не должно быть ошибочно принято за доказательство захвата проводящей системы [12].
При СЛНПГ анодный захват (т. е. захват с помощью кольца отведения СПС) часто происходит при стимуляции в биполярной конфигурации, поскольку и кончик, и кольцо стимулирующего электрода проникают в межжелудочковую перегородку. Анодный захват ослабит паттерн правой ножки пучка Гиса (ПНПГ) (т. е. меньший зубец r в отведении V1) (рис. 2) [18].
Анодный захват следует тщательно наблюдать и документировать при проведении пороговых тестов, он обычно присутствует при более высоких напряжениях (>2,0 В/0,4 мс). За исключением обеспечения резервной стимуляции в случае перфорации кончика электрода или, в некоторых случаях, сужения QRS, анодный захват не дает каких-либо доказанных преимуществ, и запрограммированная амплитуда стимуляции должна сопоставлять клиническую необходимость анодного захвата с чрезмерным разрядом батареи. Если при СЛНПГ запрограммирована биполярная стимуляция, полезно проверить пороговые значения и импедансы в монополярной конфигурации, чтобы не пропустить вероятность перфорации кончика электрода во время первых последующих осмотров.
На графике кривые сила-продолжительность захвата пучка Гиса (His) имеют аналогичную картину по сравнению с кривыми захвата миокарда, хотя присутствует пересечение кривых (рис. 3) [19, 20].
Хронаксия (точка минимального расхода энергии) значительно ниже у пациентов с селективным захватом пучка Гиса (С-СПГ). Таким образом, хотя ширина импульса 1 мс часто используется для снижения порога стимуляции при высокой амплитуде, меньшая длительность импульса (0,2-0,4 мс) может сэкономить срок службы батареи в случае короткой хронаксии (E=V2×PW/R, где E — энергия стимула, V — вольтаж стимула, PW — длительность стимула, R — импеданс) [12]. В целом амплитуда стимуляции должна быть как минимум в 2 раза больше пороговой, но у отдельных пациентов (независимых от ЭКС, имеющих резервный желудочковый электрод или которым желательно использовать С-СПГ) также может быть установлен фиксированный запас безопасности (например, 1 В).
Было описано, что пороговые значения СПГ и миокарда могут значительно различаться в зависимости от режима стимуляции (DDD или VVI), который запрограммирован во время порогового теста [13]. Пока не будет определена распространенность этого результата, целесообразно проводить пороговые тесты в постоянно программируемом режиме.
Алгоритмы управления захватом для СПГ могут давать ошибочные значения или могут просто не работать вообще, если электрод подключен к предсердному порту устройства. Алгоритмы следует запрограммировать на «выключение» или «мониторинг» и активировать их только в случае клинической необходимости (например, в случае высокого порога захвата) и, если было доказано, что они обеспечивают точные измерения у данного пациента.
Следует отметить, что в устройствах СРТ Medtronic и Boston Scientific, если выходной сигнал резервного отведения ПЖ или ИКД запрограммирован на подпороговое значение (чтобы уменьшить потребление тока или избежать захвата ПЖ), алгоритм управления захватом ЛЖ должен быть деактивирован. Это связано с тем, что резервная стимуляция ПЖ осуществляется только с запрограммированной амплитудой во время порогового теста и может привести к временной асистолии в случае полной АВ-блокады. Другие производители обеспечивают биВ резервные импульсы (Biotronik) или мощные резервные импульсы ПЖ (5 В/≥0,5 мс для сердечно-сосудистой системы (Abbott) во время пороговых тестов ЛЖ).

Рис. 2. Анодный захват при биполярной стимуляции области ЛНПГ (захват с кончика (tip) и кольца (ring) электрода соответственно).
Примечание: на левой панели: потеря анодного захвата при катодном (tip) захвате (*) во время снижения амплитуды стимуляции ЛНПГ. На правой панели: изменения электрограммы во время потери анодного захвата (*). Обратите внимание также на изменение морфологии электрограммы дальнего поля. EGM 1: сигнал с предсердного канала. EGM 2: кончик электрода СЛНПГ. EGM 3: Электрограмма дальнего поля (can-ring СЛНПГ).

Рис. 3. Кривые сила-длительность для локального миокарда ПЖ (RV) и пучка Гиса (HIS) в режимах стимуляции VVI (сплошные линии) и DDD (пунктирные линии) при частоте стимуляции 80 уд./мин.
Примечание: стимуляция с длительностью импульса (pulse width) 0,3 мс и выше приводит к тому, что порог His (красные линии) превышает локальный порог RV (синие линии). При стимуляции длительностью импульса <0,3 мс порог RV выше порога His, что приводит к пересечению кривых (зеленые кружки) как в режиме стимуляции VVI, так и в режиме DDD. В режиме стимуляции DDD пороги напряжения (voltage output) выше для всего диапазона длительности импульса. На 0,1 мс был возможен только захват Гиса при пороге 8 В в режиме VVI (не показан); в режиме DDD захвата не было. Цветное изображение доступно в электронной версии журнала.
Сенсинг
При использовании СПГ амплитуды чувствительности ниже, чем при традиционной стимуляции ПЖ (обычно 2-4 мВ, но иногда <1 мВ), и могут возникнуть серьезные проблемы с чувствительностью, когда электрод СПГ подключен к предсердному или ПЖ-порту (восприятие ЛЖ недоступно, за исключением устройств Biotronik и Boston Scientific, где оно может быть отключено). На рисунке 4 показан фрагмент избыточного восприятия предсердного сигнала правожелудочковым электродом, имплантированным в пучок Гиса, что может иметь критическое значение для пациентов с АВ-блокадой после имплантации или с ИКД — избыточное восприятие предсердных потенциалов или потенциалов пучка Гиса может привести к асистолии в случае полной АВ-блокады, или к нанесению ненужной электротерапии в случае ИКД.
Желудочковая гипочувствительность может возникнуть из-за низкой амплитуды желудочковой электрограммы. В то же время для СПГ программирование фиксированной чувствительности предпочтительнее, чем активация автоматической чувствительности, поскольку сигналы низкой амплитуды (например, потенциалы предсердий и пучка Гиса) могут заставить устройство запрограммировать низкие значения, что может привести к чрезмерной чувствительности. Гиперчувствительность, как правило, не является проблемой при СЛНПГ, поскольку амплитуды зубца R выше (аналогично традиционной стимуляции ПЖ), а предсердный потенциал или потенциал пучка Гиса отсутствуют. Если электрод СПС подключен к предсердному порту, резервная стимуляция ПЖ или электрод ИКД обеспечивает желудочковую чувствительность. В этих случаях чувствительность предсердного канала можно запрограммировать на максимальное значение (например, 4 мВ), чтобы уменьшить проблемы чрезмерной чувствительности.
АВ и межжелудочковая задержки
Когда электрод СПГ подсоединен к порту ПЖ у пациентов с синусовым ритмом с предсердным электродом, следует учитывать интервал His-желудочка (HV) и вычитать его из желаемой АВ-задержки (AVD). В случае селективной СПГ можно измерить задержку начала спайка QRS или просто использовать значение по умолчанию 40 мс. Для электрода СЛНПГ, подключенного к порту ПЖ, можно запрограммировать AVD как обычно, поскольку задержка между потенциалом левой ветви пучка Гиса и началом QRS незначительна (<20 мс). Прямой захват левой ножки может даже отсутствовать у значительной части этих пациентов. У пациентов с хронической предсердной аритмией, у которых электрод СПС подключен к предсердному порту с помощью резервного электрода для стимуляции ПЖ или электрода ИКД, следует запрограммировать стимулированную AVD, достаточно длительную, чтобы избежать стимуляции из желудочкового канала (например, 150 мс). Потеря захвата от электрода СПС может быть оценена по проценту стимуляции от резервного отведения (%RVp). Интервал между СПГ и воспринятым потенциалом ПЖ составляет в среднем ~80 мс, но может достигать 150 мс при С-СПГ без коррекции БПНПГ [12]. Следует избегать режима AAI/DDD, чрезмерно длинных АВ-интервалов (>200 мс), а также АВ-гистерезиса, поскольку они могут привести к СПГ на предшествующем зубце T в случае периодической потери захвата пучка Гиса. Когда электрод СПС подключен к порту ЛЖ, можно запрограммировать либо последовательную стимуляцию, либо стимуляцию только проводящей системы через канал ЛЖ. Отведение ПЖ служит для желудочкового восприятия и резервной кардиостимуляции (или проведения терапии в случае ИКД). Последовательную стимуляцию можно запрограммировать с предварительным возбуждением проводящей системы (канала ЛЖ) и установить максимальное значение интервала VV (например, 80 мс), чтобы свести к минимуму нежелательное слияние с ПЖ. Стимуляция отведением ПЖ будет выполняться независимо от захвата СПС (т. е. даже если задержка СПС и желудочкового восприятия короче запрограммированного VV интервала) из-за межжелудочкового рефрактерного периода [12]. Это приводит к псевдослиянию, которое не является вредным, но приводит к ненужному разряду аккумулятора. Тем не менее, как и при коннекции электрода СПС в предсердный порт с резервным желудочковым отведением, эта опция обеспечивает безопасность в случае потери захвата электродом для СПС и позволяет программировать более низкие пределы безопасности вольтажа стимула. Чтобы избежать утечки тока из-за ненужной стимуляции ПЖ, можно запрограммировать стимуляцию только из канала ЛЖ (с детекцией от отведения ПЖ). Это следует программировать только после достижения стабильных порогов СПС. Потенциальной проблемой может быть двойной счетчик зубца R, если задержка между Гис-стимулом и восприятием ПЖ длиннее, чем слепой желудочковый период, например в случае длительного интервала потенциала пучка Гиса или нескорректированной БПНПГ (рис. 5) [21]. Поэтому слепой желудочковый период после желудочковой стимуляции должен быть запрограммирован на >200 мс (по умолчанию в большинстве устройств), но следует избегать длительных слепых периодов после желудочкового восприятия, поскольку это может привести к недостаточной чувствительности быстрой желудочковой тахикардии или фибрилляции желудочков.
В случае, если желательна стимуляция ПЖ и/или ЛЖ в сочетании с СПС, например в случае HOT-CRT или LOT-CRT, AVD может быть оптимизирована с использованием продолжительности QRS. Для HOT-CRT при программировании AVD можно использовать эмпирические значения 40-60 мс или 60% интервала HBP-RVs [11].

Рис. 4. Фрагмент записи эндограмм двухкамерного ЭКС с желудочковым электродом, имплантированным в область пучка Гиса.
Примечание: на желудочковом канале регистрируются частые события VS, периодически совпадающие по частоте с предсердными потенциалами. По предсердному каналу — фибрилляция предсердий (собственный архив).

Рис. 5. Фрагмент записи эпизода двойной детекции по желудочковому каналу — на маркерном канале после события Vp через 200 мс отмечается Vs в пределах одного комплекса QRS, прослеживаемого на электрограммах [13].
Программирование определенных функций устройства
Безопасная стимуляция желудочков (БСЖ): это полезная функция в стандартных конфигурациях, но она может привести к ненужной стимуляции, когда электрод СПС подключен к предсердному порту. Поскольку интервал между стимуляцией от предсердного канала (СПС) до детекции ПЖ очень короткий (в среднем 85±25 мс), событие, воспринятое в ПЖ, обычно попадает в окно БСЖ (которое колеблется от 64 мс в устройствах Abbott до 110 мс в устройства Medtronic) [6, 12]. Это приведет к стимуляции ПЖ в конце этого окна и, следовательно, к псевдослиянию и ненужному разряду батареи. Прежде чем деактивировать алгоритм БСЖ, следует сначала проверить риск АВ-перекрестных помех, увеличив вольтаж СПС до максимального значения (униполярного, если возможно) и, установив чувствительность желудочков на максимальное (наименьшее) значение, анализируется задержка между спайком СПС и желудочковым восприятием (и сравнивается с обычными настройками). Следует отметить, что БСЖ нельзя деактивировать в устройствах Biotronik и Microport, а для устройств Boston Scientific окно БСЖ отсутствует.
Алгоритмы автоматической оптимизации AVD и VV для CRT. Алгоритмы, которые автоматически оптимизируют AVD и межжелудочковую (VV) задержку, должны быть отключены, поскольку они не предназначены для СПС.
Триггерные алгоритмы желудочковой стимуляции для СРТ: их, как правило, следует деактивировать (номинально активировать в большинстве СРТ-устройств), поскольку они приводят к псевдослиянию и ненужному разряду батареи.
Программирование ИКД: если электрод СПС подключен к предсердному порту ИКД, все алгоритмы двухкамерной дискриминации должны быть деактивированы. В противном случае восприятие желудочковых событий ПЖ с помощью отведения СПС в случае истинной желудочковой тахикардии будет классифицироваться как узловая тахикардия 1:1, а все наджелудочковые тахикардии будут классифицироваться как желудочковая тахикардия, если отведение СПС не воспринимает желудочковые сигналы (критерий V>A). Следует использовать только однокамерные дискриминаторы (начало, стабильность и морфология).
В качестве примера приводим предложенный Diaz JC, et al. [22] поэтапный подход к программированию устройств у пациентов с сердечной недостаточностью, у которых используется СЛНПГ.
Во время СРТ особенно важно добиться максимально короткого общего времени активации желудочков, поскольку это коррелирует с улучшением гемодинамических показателей [23]. Стратегия программирования устройства представлена на рисунке 6.
Сначала измеряется продолжительность QRS при униполярной стимуляции на разных амплитудах стимула для поиска наименьшей продолжительности QRS. Затем выполняется биполярная стимуляция с использованием разного вольтажа, при этом может быть достигнут анодный захват, что приводит к сокращению QRS [24, 25]. Однако, если для достижения анодного захвата требуется очень высокая энергия, его не следует использовать, т. к. это может привести к преждевременному разряду батареи ИЭУ. В этом случае выбор между униполярной и биполярной кардиостимуляцией основывается на самой короткой продолжительности QRS. Затем программируется AVD, направленная на достижение слияния СЛНПГ с собственной проводимостью пациента через ПНПГ, если таковая имеется. Поскольку электрод RA обычно располагается в ушке правого предсердия, используется очень короткий АВ-интервал (иногда может потребоваться всего 50 мс) для появления зубца R в отведении V1 на 12-канальной ЭКГ, который затем следует скорректировать постепенным увеличением АВ-интервала. Рекомендуется программировать АВ-интервал на 20 мс короче, чем требуется для достижения полной коррекции вызванной стимуляцией блокады ПНПГ. Это гарантирует, что во время физической активности, которая увеличивает скорость АВ-проводимости, ускоренное проведение по АВ-узлу и ПНПГ не вызовет БЛНПГ.
При соответствующей оптимизации программирования устройства для достижения одновременного сокращения обоих желудочков, межжелудочковая синхронность при СЛНПГ может напоминать результаты СПГ (рис. 7) [24]. Наконец, поскольку во время СЛНПГ задействовано так много различных пороговых значений (например, левую ножку пучка Гиса, септальный миокард, анодный захват миокарда ПЖ), выходные данные устройства должны быть запрограммированы таким образом, чтобы фиксировать желаемые компоненты и максимизировать шансы на улучшение межжелудочковой синхронности.

Рис. 6. Поэтапный подход к программированию устройств у пациентов с сердечной недостаточностью.
Сокращения: АВ — атриовентрикулярный, АВЗ — атриовентрикулярный задержка, ЛНПГ — левая ножка пучка Гиса, ПНПГ — правая ножка пучка Гиса.

Рис. 7. Важность правильного программирования устройства при СЛНПГ.
Примечание: А: Влияние программирования АВ-интервала на продолжительность QRS. При использовании только стимуляции области левой ножки пучка Гиса наблюдается значительное сокращение продолжительности QRS по сравнению с базовой ЭКГ. Однако в отведении V1 (пунктирный прямоугольник) можно наблюдать неполную БПНПГ. При изменении предсердно-желудочковых интервалов сохраняется проводимость по правой ножке пучка Гиса, что приводит к сливному ритму с дальнейшим сокращением QRS. Б: Пример анодного захвата во время биполярной стимуляции. При униполярной стимуляции наблюдается неполная форма волны правой ножки пучка Гиса (пунктирный прямоугольник). Однако при биполярной стимуляции происходит анодный захват эндокарда ПЖ, что приводит к дальнейшему укорочению QRS.
Сокращения: АВ — атриовентрикулярный, БПНПГ — блокада правой ножки пучка Гиса, ПЖ — правый желудочек, ЭКГ — электрокардиограмма.
Заключение
Программирование для СПС может быть запутанным и сложным, поскольку в настоящее время не существует специальных устройств. Программирование при стимуляции пучка Гиса обычно более сложное, чем при СЛНПГ из-за большего количества проблем с распознаванием и более частого использования резервных желудочковых электродов. Однако отведения СЛНПГ также могут быть подключены к предсердному или ЛЖ-порту ИКД и, следовательно, требуют специальных настроек программирования. Клиницисты должны осознавать возможные подводные камни, чтобы обеспечить безопасную и эффективную СПС для своих пациентов.
Отношения и деятельность: автор заявляет об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Лебедева В.К. Программирование кардиальных имплантируемых электронных устройств при стимуляции проводящей системы: информационно-практический обзор. Российский кардиологический журнал. 2024;29(4S):6186. https://doi.org/10.15829/1560-4071-2024-6186. EDN: PRCRUE
Скопировать