Прогнозирование контроля синусового ритма после радиочастотной аблации у больных с фибрилляцией предсердий с помощью технологии спекл-трекинг и динамика структурно-функциональных показателей левого предсердия
Фибрилляция предсердий (ФП) является наиболее распространённым нарушением ритма, связанным с такими осложнениями, как сердечная недостаточность, дисфункция левого желудочка (ЛЖ) и ухудшение качества жизни [1]. Из за развития кардиоэмболических осложнений ФП ассоциируется с повышенным риском возникновения инсульта и смерти [1]. Недавние исследования показали, что провоцирующими триггерами ФП являются такие факторы, как ожирение, курение, алкоголь, наличие гипертонической болезни [1]. Однако решение некоторых вопросов в диагностике и лечении больных с ФП остаётся неоднозначным. Как известно, возникновение ФП зависит от размеров левого предсердия (ЛП). В ряде исследований [2][3] сообщается о прямо пропорциональной связи между риском возникновения/рецидива ФП со степенью увеличения ЛП. Однако в последнее время появились работы, в которых указывается, что у части больных с пароксизмальной или персистирующей ФП отсутствует ремоделирование ЛП. Тогда основным фактором риска, обусловливающем рецидивы ФП, является фиброз миокарда с поражением механики ЛП. Как показали некоторые авторы, косвенным признаком наличия фиброза миокарда ЛП было нарушение комплаентности или податливости стенок в фазу резервуара [4]. Наиболее адекватным методом оценки механики ЛП было применение спекл-трекинг эхокардиографии (ЭхоКГ) [3]. Однако пороговые значения деформации (S)/скорости деформации (SR) в зависимости от фазы ЛП не стандартизированы и не известны всем врачам, занимающимся ЭхоКГ.
Как известно, у больных с ФП, резистентной к антиаритмитической терапии, методом выбора является радиочастотная аблация (РЧА) устьев лёгочных вен [1][5]. По данным ретроспективных исследований, использование данного метода снижает риск возникновения ишемического инсульта и смертности в мире [1][5]. Эффективность РЧА доказана и в лечении пожилых пациентов с пароксизмами ФП, осложняющихся острой левожелудочковой недостаточностью, в качестве плановой стратегии “контроля ритма” [6]. В целом после проведения РЧА значительно улучшается качество жизни больных [1][7]. Несмотря на это, случаи рецидивов ФП встречаются нередко [2][4][5][8][9]. В течение последнего десятилетия ведутся активные поиски надёжных маркеров эффективности РЧА с помощью различных диагностических методов, в т.ч. с применением спекл-трекинг ЭхоКГ [8-11]. Трактовка рутинных ЭхоКГ-параметров ЛП у больных, направляемых на катетерную аблацию, до сих пор неоднозначна. В новых рекомендациях по диагностике и лечению больных с ФП рекомендовано определение не только размеров, но и функции ЛП, соответственно его 3-х-фазной механической деятельности [1]. Применение спекл-трекинг ЭхоКГ, вероятно, позволит кардиобригаде выработать индивидуальный подход к ведению/лечению больного с ФП.
Гипотеза исследования: предполагается, что эффективность РЧА зависит от исходных морфофункциональных параметров ЛП у больных с ФП.
Цель исследования: оценка динамики объёма ЛП, S в фазу резервуара и SR ЛП у пациентов с пароксизмальной и персистирующей формами ФП, направляемых на катетерную РЧА; сравнение прогностической ценности S и SR как маркера сохранения синусового ритма.
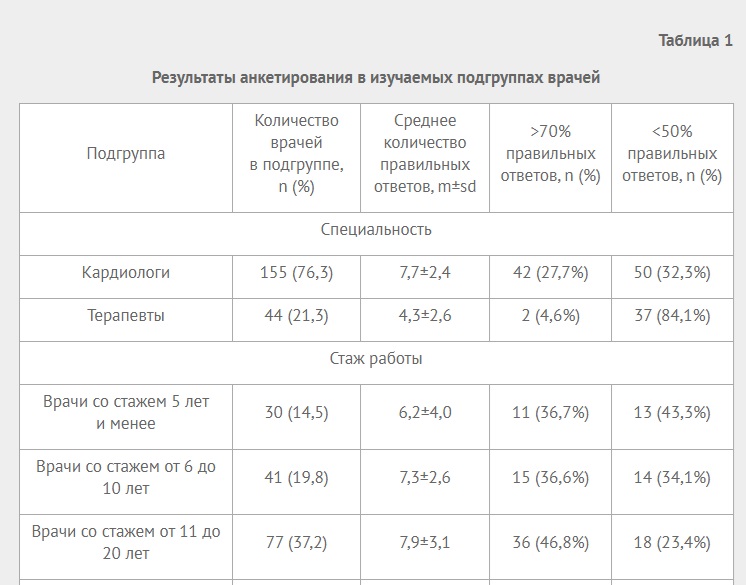
Материал и методы
Протокол исследования одобрен Этическим комитетом БГМУ. Все больные подписывали информированное согласие на обследование. В Клинике БГМУ обследовали 35 больных от 40 до 75 лет с жалобами на учащенное неравномерное сердцебиение, направленных на электрофизиологическое исследование (ЭФИ)-РЧА (рис. 1). Критериями включения в исследование были: документально зарегистрированная пароксизмальная/персистирующая ФП у больного без предшествующего анамнеза ревматического поражения митрального клапана и инфаркта миокарда, а также согласие больного на проведение ЭФИ-РЧА. Всем были проведены следующие обследования: электрокардиограмма (ЭКГ) покоя, суточное мониторирование ЭКГ по Холтеру (ХМ ЭКГ), ЭхоКГ (трансторакальная и чреспищеводная), коронарная ангиография. В результате выяснилось, что у 3 больных имеется умеренный митральный стеноз, у 2 больных выраженная гипертрофия миокарда межжелудочковой перегородки (МЖП) (МЖП ?1,2 см у женщин; МЖП ?1,3 см у мужчин), у 5 больных с помощью коронарной ангиографии выявлен гемодинамически значимый атеросклеротический стеноз коронарных артерий (сужение ?50%), у 2 больных ранее были проведены эндоваскулярные вмешательства по поводу ФП (один больной — баллонная криоаблация в РКЦ, г. Уфа; второй больной — катетерная РЧА в НМИЦ им. акад. Е.Н. Мешалкина). На первом этапе исследования 12 вышеперечисленных больных были исключены из исследования. Таким образом, критериями для исключения пациентов с ФП из исследования являлись клапанная патология митрального клапана, ранее проведённые аблации ФП, предшествующие операции на сердце, инфаркт миокарда, хроническая сердечная недостаточность II-IV классов по NYHA, заболевание щитовидной железы.

Рис. 1. Распределение больных с ФП, направленных на РЧА, по группам (объяснения в тексте).
Сокращения: АС КА — атеросклеротический стеноз коронарных артерий, ГЛЖ — гипертрофия миокарда левого желудочка, РЧА — радиочастотная аблация, МС — митральный стеноз, ФП — фибрилляция предсердий.
На втором этапе исследования через 12 мес. после ЭФИ-РЧА не смогли приехать на повторные исследования 2 больных из отдаленных сёл республики Башкортостан (отказались). Кроме того, у 2 больных после ЭФИ-РЧА в течение года были выявлены онкологические заболевания, потребовавшие проведения химиотерапии, что и явилось причиной их исключения из нашего наблюдения.
Была сформирована контрольная группа из 20 обследуемых без нарушений ритма сердца, сопоставимых по возрасту и полу: 12 мужчин (60%) и 8 женщин (40%) в возрасте 59,0±11,2 лет.
В итоге проводили анализ данных 19 пациентов, которым была проведена РЧА устьев лёгочных вен, в возрасте 62,32±10,76 лет, среди которых были 11 мужчин (58%) и 8 женщин (42%), включенных в проспективное исследование. Несмотря на исходно проводимую терапию антиаритмическими препаратами IC, II или III классов, у них сохранялась ФП: пароксизмальная форма в 33% случаев (6 пациентов); персистирующая форма в 67% случаев (13 пациентов). Все пациенты после РЧА проходили ЭКГ-исследование и ХМ ЭКГ сразу после РЧА, а также спустя 12 мес. и в тех случаях, когда у больного возникали симптомы, свидетельствующие о рецидиве аритмии, который определялся как зарегистрированный пароксизм ФП, продолжающийся >30 сек на ЭКГ или ХМ ЭКГ [1].
С помощью двумерной ЭхоКГ у всех пациентов за не более чем 2 нед. до РЧА и через год после данной процедуры оценивались структурные и функциональные параметры левых камер сердца: конечный диастолический размер левого желудочка (ЛЖ) (см), индекс конечного диастолического размера ЛЖ (см/м2), масса миокарда ЛЖ (г), индекс массы миокарда ЛЖ (г/м2), фракция выброса ЛЖ (%), объём ЛП (VЛП, мл), индекс VЛП (ИVЛП, мл/м2). Для статистической выборки учитывали максимальный VЛП в резервуарную фазу. Максимальный VЛП получали при трассировании эндокарда ЛП сразу перед открытием митрального клапана, исключая ушко и легочные вены, и используя метод 20 дисков, автоматически получали показатель. За верхний нормальный предел для 2D-объема ЛП принимали 34 мл/м2 независимо от гендерных различий [12].
Информацию о S ЛП в продольном направлении с помощью программного обеспечения на УЗИсканнере “EPIQ 7” (Philips, США) получали при регистрации от начала комплекса QRS (первый пик позитивной S ЛП в фазу резервуара). Для этого с помощью стандартной двухмерной серошкальной ЭхоКГ, синхронизированной с ЭКГ, при частоте смены кадров не <80 в сек (после выдоха на задержке дыхания пациента), из апикальной проекции 4-х и 2-х камер получали изображение с отчётливой визуализацией эндокарда ЛП. В режиме постобработки трассировали границу эндокарда ЛП ниже уровня фиброзного кольца митрального клапана на 10 мм. С помощью спекл-трекинг ЭхоКГ и “Авто CMQ” оценивалась пиковая положительная S ЛП (%) в резервуарную фазу ЛП в четырёх- (4С) и двухкамерной (2С) позициях как среднее значение от всех стенок ЛП (отмечалась пунктирной линией на графике). По данным метаанализа нижней границей нормы для резервуарной фазы ЛП считалось значение среднего стрейна равное 39% [11][13]. SR (с-1) ЛП в резервуарную фазу отслеживалась по автоматичеким графикам, и учитывали среднюю SR всех стенок ЛП в 4С и 2С позициях (пунктирная линия на графике с возможностью ручного контроля в точке интереса). Однозначных пороговых значений для SR в фазу резервуара ЛП не установлено. В связи с этим ориентировались на данные зарубежных исследований, где указывалось, что в группе здоровых лиц SR в резервуарную фазу ЛП составил 4,1 с-1 [9].
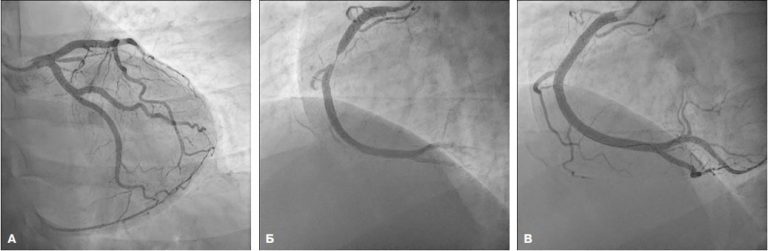
Процедура РЧА проводилась натощак у лиц, находящихся в стабильном клиническом состоянии, после отмены антиаритмических препаратов в течение периода, равного пятикратному периоду полураспада лекарственного средства. Под местной анестезией раствором 0,25% раствора лидокаина (6,0 мл) путём пунктирования правой бедренной вены через 2 катетера-интродьюсера Biosense Webster Preface Multiporse 8 Fr 62 см под контролем транспищеводной ЭхоКГ проводилась игла для транссептальной пункции St. Jude Medical BRK 1. С помощью внутрисердечного ультразвукового исследования (УЗИ) визуализировалась “тонкая” часть транссептальной перегородки. Производилась её пункция под контролем рентгеновским и внутрисердечного УЗИ. Через первый катетер-интродьюсер проводился диагностический катетер-электрод Biosense Webster LASSO 2515 Nav для установки в области устьев лёгочных вен ЛП.
Через второй катетер-интродьюсер проводился аблационный катетер Biosense Webster Navi Star ThermoCool F-type (Diamond Bar, США). Внутрисердечные электрограммы были получены с использованием электрофизиологической системы Prucka Cardio Lab TM (General Electric Marquette, Inc., Милуоки, Висконсин, США). Выполнялось трёхмерное картирование полости ЛП в условиях системы CARTO 3 (Biosense Webster, Diamond Bar, Калифорния, США) в режиме FAM с помощью диагностического и аблационного катетеров. Далее выполнялась изоляция устьев лёгочных вен ЛП аблационным катетером, которая подтверждалась с помощью стимуляции с аблационного и диагностического электродов.
После процедуры РЧА все пациенты продолжали антиаритмитическую терапию в течение 8 нед. и антикоагулянтную терапию 12 нед. (затем согласно шкале CHA2DS2-VASc продолжали терапию — женщины при наличии ?2 балла, мужчины — при наличии ?1) [1].
Статистический анализ материала проводился при помощи программ Statisticа версии 10, IBM SPSS Statistics 26. Количественные данные представлены в виде значения среднего (M) и стандартного отклонения (SD). Оценка статистической значимости различий (p) между группами выполнялась с использованием параметрических критериев (при нормальном распределении признака) двухвыборочного t-критерия Стьюдента. Сравнение показателей с распределением, отличающимся от нормального, проводилось с использованием U-критерия Манна-Уитни. Для проверки эффективности показателей S и SR в качестве диагностического теста использовался ROC-анализ (Receiver Operating Characteristic), определялась площадь под кривой (AUC, Area Under Curve), устанавливали точки разделения (cut-off point), ассоциированные с вероятностью развития рецидива ФП.
Результаты
Для анализа результатов среди больных с ФП через 12 мес. после РЧА были сформированы две группы больных: 1 группа — больные без рецидивов ФП после РЧА, 2 группа — больные с рецидивом ФП после РЧА. К 1 группе больных отнесли 12 из 19 исходных больных (63%), у которых сохранялся синусовый ритм по данным ЭКГ и ХМ ЭКГ в течение 12 мес. после РЧА. Ко 2 группе больных отнесли 7 из 19 исходных больных (37%), с выявленными рецидивами ФП в течение 12 мес. после РЧА. Между больными двух групп не выявлено разницы в возрасте: 1 группа — 66,50±11,50 лет и 2 группа — 56,00±9,35 лет (p=0,11).
Оценка результатов ЭхоКГ среди больных двух групп позволила выявить, что VЛП у больных 1 группы стал меньше через 12 мес. после РЧА, чем исходный VЛП: VЛП исходно 56,0±12,6 мл и VЛП после РЧА 47,0±12,1 мл (р=0,008). Такая же динамика показателей ИVЛП в 1 группе больных с эффективной РЧА, т.к. ИVЛП снизился через 12 мес. после РЧА (рис. 2): исходно ИVЛП 28,0±7,8 мл/м2 и после РЧА 22,6±8,3 мл/м2 (р=0,02). Во 2 группе больных с неэффективной РЧА не выявлено уменьшения ни VЛП, ни расчётного ИVЛП через 12 мес. после РЧА: VЛП исходно 52,0±23,2 мл и VЛП после РЧА 54,0±12,1 мл (р=1,0); исходно ИVЛП 25,1±13,6 мл/м2 и после РЧА 30,9±7,6 мл/м2 (р=0,3).

Рис. 2. Динамика ИVЛП у пациентов без рецидива ФП через 12 мес. после РЧА.
Сокращения: ИVЛП — индекс объёма левого предсердия, РЧА — радиочастотная аблация, ФП — фибрилляция предсердий.
При анализе S ЛП у больных 1 группы с эффективной РЧА не отмечалось изменения продольного стрейна в 4С- и 2С-позициях: 4С-S исходно 32,2±11,1% и 4С-S после РЧА 30,3±9,6% (р=0,287); 2С-S исходно 26,1±9,8% и после РЧА 28,9±9,1% (р=0,82).
У больных 2 группы с неэффективной РЧА показатели S ЛП в 4С- и 2С-позициях существенно не изменились в зависимости от проведенной РЧАпроцедуры: 4С-S исходно 21,4±0,6% и 4С-S после РЧА 17,4±6,2% (р=0,12); 2С-S исходно 16,2±3,2% и 2С-S после РЧА 16,5±6,8% (р=1,0).
При сравнении исходного VЛП (рис. 3) и ИVЛП (рис. 4) между 1 группой больных с эффективной РЧА и 2 группой больных с неэффективной РЧА не выявлено различий (р=0,78 и р=0,85, соответственно). Однако при анализе исходной продольной S ЛП у больных 1 группы с эффективной РЧА и у больных 2 группы с неэффективной РЧА отмечались более высокие показатели исходной S ЛП в 4С-позиции (р=0,0008) (рис. 5) и в 2С-позиции (р=0,0011) (рис. 6). Исходные показатели SR были выше у больных 1 группы по сравнению со 2 группой в 4С-позиции (рис. 7) и 2С-позиции (рис. 8): 4С-SR 2,36±0,37 с-1 и 1,39±0,50 с-1 (p=0,0013), 2С-SR 2,09±0,39 с-1 и 1,4±0,53 с-1 (p=0,0053).

Рис. 3. Сравнение исходного VЛП у пациентов без рецидива ФП и с рецидивом ФП.
Сокращения: РЧА — радиочастотная аблация, ФП — фибрилляция предсердий, VЛП — объём левого предсердия.

Рис. 4. Сравнение исходного ИVЛП у пациентов без рецидива ФП и с рецидивом ФП.
Сокращения: ИVЛП — индекс объёма левого предсердия, РЧА — радиочастотная аблация, ФП — фибрилляция предсердий.

Рис. 5. Сравнение исходной продольной S в 4С-позиции у пациентов без рецидива ФП и с рецидивом ФП.
Сокращение: ФП — фибрилляция предсердий.

Рис. 6. Сравнение исходной продольной S в 2С-позиции у пациентов без рецидива ФП и с рецидивом ФП.
Сокращение: ФП — фибрилляция предсердий.

Рис. 7. Сравнение исходной продольной SR в 4С-позиции у пациентов без рецидива ФП и с рецидивом ФП.
Сокращение: ФП — фибрилляция предсердий.

Рис. 8. Сравнение исходной продольной SR в 2С-позиции у пациентов без рецидива ФП и с рецидивом ФП.
Сокращение: ФП — фибрилляция предсердий.
Максимальное влияние на прогноз развития резервуарной дисфункции ЛП и, вследствие этого, рецидива ФП после катетерной РЧА выявлено для исходных значений S ЛП и SR.
Согласно ROC-анализу (рис. 9-11), надёжными индивидуальными предикторами сохранения синусового ритма были оптимальные пороговые значения (cut-off) для исходной продольной S ЛП в 4C-позиции S=20,7% (AUC 0,976±0,030; p=0,001), в 2C-позиции S=19,2% (AUC 0,964±0,041; p=0,001). Также высокой чувствительностью в прогнозировании успешности РЧА обладали оптимальные пороговые значения (cut-off) для исходной SR ЛП в 4С-позиции SR=1,8 с-1 (AUC=0,958±0,047; p=0,001), в 2C-позиции SR=1,75 с-1 (AUC=0,899±0,081; p=0,005) (рис. 12, 13).

Рис. 9. ROC-кривая для прогнозирования сохранения синусового ритма после РЧА в зависимости от значений продольной S ЛП в 4С- и 2С-позициях.

Рис. 10. AUC для прогнозирования сохранения синусового ритма после РЧА в зависимости от значений продольной S ЛП в 4С- и 2С-позициях.

Рис. 11. Координаты кривой для прогнозирования сохранения синусового ритма после РЧА в зависимости от значений продольной S ЛП в 4Си 2С-позициях.

Рис. 12. ROC-кривая для прогнозирования сохранения синусового ритма после РЧА в зависимости от значений SR ЛП в 4С- и 2С-позициях.

Рис. 13. AUC для прогнозирования сохранения синусового ритма после РЧА в зависимости от значений SR ЛП в 4С- и 2С-позициях.
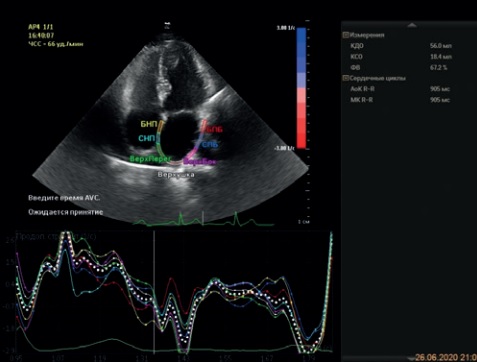
Приводим клинические примеры с демонстрацией полученных графиков продольной S (рис. 14 А) и SR (рис. 14 Б) у больного с эффективной РЧА. В клинической практике в условиях цейтнота врач способен быстро и надежно оценить снижение параметров механики ЛП по кривым стрейн и стрейн рейт в четырехкамерной и двухкамерной позициях (рис. 15 А, Б).

Рис. 14. Продольный стрейн ЛП в фазу резервуара (А) и стрейн рейт (Б) в 4С-позиции у больного с эффективной РЧА.

Рис. 15. Продольный стрейн ЛП в фазу резервуара (А) и стрейн рейт (Б) в 4С-позиции у больной с неэффективной РЧА.
Обсуждение
Немало работ посвящено изучению ремоделирования ЛП при основных сердечно-сосудистых заболеваниях, осложнённых развитием ФП. В то же время существование аритмии в течение длительного времени приводит к необратимым изменениям в миокарде ЛП в виде формирования фиброза. Как известно, ЛП характеризуется способностью к наибольшему растяжению и удлинению волокон (комплаентность) в фазу резервуара. Одновременно происходит сокращение ЛЖ. Плоскость митрального кольца движется от основания сердца к верхушке, что способствует присасыванию крови из лёгочных вен в фазу резервуара ЛП. Таким образом, обеспечивается 40% объёма крови, наполняющего ЛЖ. Затем при открытии митрального клапана кровь пассивно перетекает в ЛЖ в фазу ранней диастолы по градиенту давления (35% объёма наполнения ЛЖ) — кондуитивная фаза ЛП. В систолу ЛП оставшийся объём крови (25% объёма наполнения ЛЖ) активно отжимается в полость ЛЖ — контрактильная фаза ЛП [11][13].
Так как резервуарная фаза ЛП отражает механику ЛП, то, вероятно, при увеличении степени фиброза ЛП будет ухудшаться пиковая положительная S ЛП и SR ЛП. В свою очередь, процедура катетерной РЧА может привести к развитию локального фиброза в области аблационного рубца, что, в свою очередь, может снизить показатели продольной S ЛП. Учитывая неоднозначные динамические изменения геометрии и механики ЛП после РЧА, представляется важным определение предикторов рецидива ФП.
При анализе немногочисленных российских и зарубежных работ, основанных на использовании спекл-трекинг ЭхоКГ, выявился значительный разброс пороговых значений для S ЛП в разные фазы [11]. Данное обстоятельство, вероятно, связано: 1) с применением разного программного обеспечения (Soft) УЗИ-сканнеров, обеспечивающего один из двух возможных подходов, регистрирующим стрейн ЛП, либо от начала комплекса QRS (первый пик позитивный — в фазу резервуара ЛП), либо от начала зубца P на ЭКГ (анализируется первый негативный пик, соответствующий систоле ЛП); 2) значениями S ЛП, получаемыми в сроки наблюдения (follow up) от 3 мес. до 1,5 лет после проведения РЧА [2][9].
Agelaki М, et al. при наблюдении 39 пациентов с пароксизмальной ФП (74% мужчин), которым провели РЧА, отмечали, что через год сохраняли синусовый ритм 64% больных [4]. Пороговым значением исходной S ЛП в резервуарную фазу оказалась S 23,7% (AUC 0,794 согласно ROC кривой). Кроме того, авторы отметили, что независимыми предикторами рецидива ФП стали значение исходной S ЛП в контрактильную фазу и возраст больного (средний возраст 63,5 лет у больных с рецидивом ФП в сравнении с 54 года у больных без рецидива ФП).
После самой процедуры РЧА динамика показателей объёма и S ЛП, как выяснили корейские учёные, проходит неоднозначно в течение 12 мес. наблюдения [2]. В исследование были включены 99 пациентов: средний возраст составлял 58,0±8,2 года, 75 больных (74,7%) мужчины, пароксизмальная ФП — 59 пациентов (60%) и персистирующая ФП — 40 пациентов (40%). Рецидивы ФП наблюдались у 5 из 59 больных (8,5%) с пароксизмальной ФП и у 10 из 40 больных (25%) с персистирующей ФП.
ИVЛП, измеренный с помощью 3D-ЭхоКГ и соотнесённый с площадью поверхности тела, увеличился через 1 день, снизился через 3 мес., а затем снова увеличился через 1 год, но был ниже, чем этот показатель до РЧА. Динамика изменения показателей сократимости ЛП при 3D-ЭхоКГ (фракция выброса ЛП) была аналогичной динамике изменения объема, но данные параметры изменились более выраженно у больных с персистирующей формой ФП, чем у пациентов с пароксизмальной ФП.
Исходный уровень ИVЛП, измеренного при 3D-ЭхоКГ, был независимым предиктором рецидива ФП после РЧА, и пороговое значение было 44,13 мл/м2. На основании полученных данных Hwang J, et al. сделали вывод, что даже после 3 мес. после РЧА из-за образования рубцов структурное ремоделирование ЛП продолжалось, причем изменения были более отчётливыми у больных с персистирующей формой ФП [2].
Mirza М, et al. установили, что среди 63 больных в возрасте 63±10 лет с пароксизмальной (75%) и персистирующей (25%) формами ФП через 18±12 мес. сохранили синусовый ритм 34/63 больных (54%) [8]. Между больными с рецидивом ФП и больными с эффективной РЧА исходно не было выявлено различий по клинической характеристике больных, объёмным показателям ЛП и ЛЖ, допплеровской оценке диастолической функции и давлению заполнения.
Однако исходные фракция выброса ЛП, глобальная и локальная систолическая и диастолическая S, SR были снижены у пациентов с рецидивом ФП. Авторами было отмечено, что наблюдалось уменьшение пика исходной продольной S боковой стенки ЛП в фазу резервуара у больных с неэффективной РЧА по сравнению с больными с синусовым ритмом (11±7% vs 20±14%; р=0,007) и SR (0,9±0,4 с-1 vs 1,3±0,6 с-1; р=0,01) [8]. Таким образом, исходный показатель S боковой стенки ЛП предлагается в качестве предиктора рецидива ФП после РЧА, независимо от степени увеличения исходного размера ЛП.
Schneider C, et al. описали 118 пациентов с ФП (74 с пароксизмальной формой, 44 с персистирующей), направленных на РЧА. Из 118 пациентов 82 (69%) сохраняли стабильный синусовый ритм в течение 3 мес. [9]. Свойства миокарда предсердий после катетерной РЧА значительно различались у пациентов с пароксизмальной ФП (SR 2,5 с-1, S ЛП в резервуарную фазу 30%) от пациентов с персистирующим ФП (SR 2,3 с-1, S ЛП в резервуарную фазу 25%). Лучшими индивидуальными предикторами сохранения синусового ритма были пороговые значения SR >2,5 с-1 для перегородки и нижней стенки ЛП; S в резервуарную фазу >19,5% для нижней стенки. Параметры S были выше у пациентов с сохраненным синусовым ритмом во время 3-х месячного наблюдения в отличие от пациентов с рецидивирующим ФП (p=0,001).
По данным Hsu P-C, et al. снижение продольной S в фазу резервуара ассоциировалось с риском сердечно-сосудистых событий при пороговом значении S ЛП <16,5% [14].
Полученные нами результаты согласуются с данными зарубежных коллег. Успешность РЧА составила 63%. Как было показано, результат РЧА не зависел от возраста больных и объёмных показателей ЛП. Наше исследование подтвердило, что эффективность катетерной РЧА была напрямую связана с исходными показателями S ЛП как маркером возможного фиброза миокарда.
Влияние развивающегося фиброза ЛП на показатели S ЛП было убедительно доказано корейскими врачами [15]. При сравнении данных биопсии миокарда ЛП, полученных у больных во время хирургического вмешательства, с данными спеклтрекинг ЭхоКГ Her Ae-Y, et al. показали, что нарушение S ЛП напрямую зависит от степени фиброза [15].
Kuppahally SS, et al. сопоставляли данные DEМРТ сердца с контрастированием (Multihance, Bracco Diagnostic Inc) и спекл-трекинг ЭхоКГ (VVI Software) у больных с ФП. Метод DE-МРТ с контрастированием позволил обнаружить фиброз ЛП в виде локальных участков усиления сигнала (enhancement) [3]. Степень фиброза коррелировала с показателями стрейн и стрейн рейт, причем в исследовании была продемонстрирована обратная взаимосвязь между площадью фиброза ЛП (по локальному усилению сигнала от стенки ЛП) и уровнем S легочной артерии и SR боковой стенки ЛП [3].
Эта связь была более выраженной у пациентов с персистирующей ФП по сравнению с пароксизмальной формой ФП. Пациенты с персистирующей ФП имели больший фиброз стенки ЛП по сравнению с пациентами с пароксизмальной ФП (22±18% vs 14±9%, р=0,04) и более низкие показатели S нижне-перегородочной стенки ЛП (38±15% vs 27±15%, p=0,01) и средне-боковой стенки ЛП (45±14% vs 35±18%, p=0,03) [3].
Как утверждают авторы, пиковая продольная S боковой стенки достаточно хорошо визуализируется и может использоваться в качестве маркера фиброза стенок ЛП [3]. Не было значительной разницы в SR между пациентами, имевшими персистирующую ФП или пароксизмальную форму ФП [3].
Интересно, что фиброз ЛП и S не зависели от этиологии ФП, возраста пациента, наличия гипертонии, давления наполнения ЛЖ или степени митральной регургитации. Независимо от основной этиологии или продолжительности ФП, степень фиброза предсердий была основной детерминантой тяжести аритмии у этой когорты. Таким образом, неинвазивная визуализация фиброза ЛП может помочь в прогнозировании риска прогрессирования форм ФП, стать руководством к выработке лечебной стратегии и прогнозированию её результатов у пациентов с ФП [3]. Кроме того, в будущем это позволит выявить скрытые изменения миокарда ЛП на ранней стадии заболевания, до развития серьезных или необратимых нарушений систолической и диастолической функции ЛП.
Потенциальные ограничения исследования. Небольшое количество наблюдений ввиду тщательного подбора больных по критериям включения, невключения и досрочного исключения из исследования. Время наблюдения составило 1 год. Не было возможности верификации вероятного фиброза миокарда ЛП с помощью магнитно-резонансной томографии сердца, либо эндомиокардиальной биопсии (не входило в цель исследования ввиду высокой стоимости магнитно-резонансной томографии сердца и инвазивности эндомиокардиальной биопсии).
Заключение
Стабильный синусовый ритм после процедуры сохранялся в течение 12 мес. у больных с более высокими показателями исходной S и SR ЛП. Величина исходной S и SR ЛП обладает высокой прогностической ценностью для рецидива ФП у пациентов после РЧА. У больных с эффективной РЧА VЛП и ИVЛП уменьшились без изменения параметров S и SR. Не выявлено эффекта обратного ремоделирования ЛП и улучшения показателей S ЛП у больных с рецидивом ФП после РЧА.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Мусин Т.И., Багманова З.А., Гареев Д.А., Руденко В.Г., Загидуллин Н.Ш. Прогнозирование контроля синусового ритма после радиочастотной аблации у больных с фибрилляцией предсердий с помощью технологии спекл-трекинг и динамика структурно-функциональных показателей левого предсердия. Российский кардиологический журнал. 2021;26(2S):4256. https://doi.org/10.15829/1560-4071-2021-4256
Скопировать