Предикторы рецидива фибрилляции предсердий у пациентов с метаболическим синдромом после радиочастотной изоляции устьев легочных вен
Аннотация
Цель. Оценить прогностическую значимость молекулярных и антропометрических биомаркеров в прогнозировании рецидива фибрилляции предсердий (ФП) в течение 12-мес. периода после радиочастотной аблации (РЧА) (изоляции) устьев легочных вен у пациентов с метаболическим синдромом (МС).
Материал и методы. В исследование было включено 245 пациентов с ФП (муж./жен.) в возрасте от 35 до 65 лет: группы составили пациенты без составляющих МС (n=32), с 1-2 компонентами МС (n=62) и больные с ?3 компонентами МС (n=153). Всем пациентам проводилось комплексное клинико-анамнестическое, антропометрическое, лабораторное и эхокардиографическое обследования. Из них в проспективное 12-мес. наблюдение было включено 135 пациентов с ФП, которым выполнялась РЧА с электро-анатомическим картированием.
Результаты. Установлено, что наличие ?3 компонентов МС в 4,1 раза увеличивало риск рецидива ФП в течение 12-мес. после РЧА (относительный риск (RR) =4,1, 95% доверительный интервал (ДИ) 2,19-7,65, р<0,0001). По данным биномиальной логистической регрессии толщина эпикардиального жира (ТЭЖ) (отношение шансов (ОШ) =3,71, 95% ДИ 2,12-6,73, р=0,00001), степень выраженности фиброза левого предсердия (ОШ =1,48, 95% ДИ 1,03-1,78, р=0,0006), концентрации галектина-3 (ОШ =1,31, 95% ДИ 1,12-1,51, р=0,0001) и ростовой фактор дифференцировки-15 (GDF-15) (ОШ =1,11, 95% ДИ 1,02-1,18, р=0,0002) у пациентов с ФП и МС значимо увеличивали риск рецидива ФП после РЧА. Были установлены пороговые значения галектина-3 (>11,0 нг/мл; RR =3,43, 95% ДИ 1,79-6,58, р=0,0001), GDF-15 (>1380,7 пг/мл; RR =2,84, 95% ДИ 1,81-4,46, р<0,0001) и ТЭЖ (>6,4 мм; RR =4,50, 95% ДИ 2,32-8,71, р<0,0001), превышение которых в наибольшей степени влияло на риск послеоперационного рецидива ФП у больных с МС. У пациентов с МС и превышением всех трех пороговых значений биомаркеров суммарный риск рецидива ФП в течение 12-мес. после РЧА увеличивался в 3,2 раза (RR =3,16, 95% ДИ 1,97-5,11, р<0,00001). Заключение. Риск рецидива ФП в течение 12-мес. после РЧА у пациентов с ?3 компонентами МС выше, чем у больных, имеющих 1-2 компонента. Повышение концентрации таких профиброгенных биомаркеров, как галектин-3 и GDF-15, а также увеличение ТЭЖ ассоциировано с возрастанием риска рецидива ФП у пациентов с МС.
Метаболический синдром (МС) представляет собой кластер патологических состояний, в состав которого входят: артериальная гипертензия (АГ), абдоминальное ожирение (АО), инсулинорезистентность и нарушения липидного обмена, способствующие развитию сердечно-сосудистых заболеваний [1]. Распространенность МС в российской популяции высока и, по данным эпидемиологического исследования ЭССЕ-РФ, составляет 33% у обследованных в возрасте 25-64 лет [2]. Использование в реальной практике диагностики МС исходя из критериев Joint Interim Societies, Совместного промежуточного отчета (JIS 2009) позволяет чаще выявлять эту патологию и своевременно проводить профилактику сердечно-сосудистых заболеваний [3]. Фибрилляция предсердий (ФП) является широко распространенным видом нарушения ритма, связанным с возрастанием риск инсульта, системных эмболий, инвалидизации и смертности трудоспособного населения [4]. Основные компоненты МС, такие как АО, АГ и нарушения углеводного обмена, в значительной степени увеличивают риск развития ФП, в т.ч. у лиц молодого возраста [5]. Механизмы развития ФП у пациентов с МС многочисленны и обусловлены анатомическим ремоделированием предсердий с развитием дилатации на фоне увеличенного объема циркулирующей крови у пациентов с АО и увеличением давления наполнения в левом желудочке (ЛЖ) у пациентов с АГ [6][7]. Нарушения углеводного обмена и сахарный диабет (СД) совместно с висцеральной жировой тканью способствуют электрическому и структурному ремоделированию миокарда, что может приводить к формированию фиброза. Это, в свою очередь, способствует возникновению микро re-entry, служащей основой для развития ФП [8]. В последние годы активно изучается роль циркулирующих в крови биомаркеров фиброза и воспаления в развитии ФП в различных когортах пациентов. Ранее было выявлено повышение галектина-3, проколлагенов I и III типов у пациентов с ФП и МС, а также установлена связь биомаркеров со степенью выраженности фиброза левого предсердия (ЛП) [9]. Эпикардиальная жировая ткань — биомаркер висцерального ожирения, способствует не только системной циркуляции провоспалительных и профиброгенных цитокинов, но и оказывает паракринное воздействие на миокард, что приводит к развитию фиброза и электрического ремоделирования [10]. Определение роли различных биомаркеров обусловлено поиском прогностических факторов не только риска развития ФП, но и прогрессирования данной аритмии, а также предикторов прогноза эффективности медикаментозной и интервенционной терапии. По результатам исследования установлено, что повышение концентраций галектина-3 и альдостерона у пациентов с ФП ассоциировано с увеличением риска рецидива данного нарушения ритма после радиочастотной аблации (РЧА) [11]. В 2012г опубликованы результаты ретроспективного исследования, где МС являлся значимым предиктором рецидивирования ФП после РЧА (относительный риск (RR) =1,28, p=0,021), однако комплексного изучения роли различных биомаркеров не проводилось [12]. Целью данного исследования стало изучение роли клинических, антропометрических, профиброгенных и провоспалительных факторов в прогнозировании рецидива ФП у пациентов с МС после РЧА.
Материал и методы
При обследовании 1307 пациентов с ФП, госпитализированных в терапевтическую клинику ФГБОУ ВО ПСПбГМУ им. акад. И. П. Павлова в период с 2014-2018гг, были отобраны 245 пациентов — мужчины и женщины (55,9% и 44,1%) в возрасте от 35 до 65 лет без органических заболеваний сердца, клинических данных за острые и хронические заболевания. Все пациенты подписали информированное согласие, одобренное этическим комитетом Университета. В исследование были включены пациенты с пароксизмальной (n=191) и персистирующей (n=54) формами ФП и различным числом компонентов МС (JIS, 2009): без компонентов — контрольная группа (n=30), 1-2 компонента (n=62) и ?3 компонентов (n=153). У всех обследованных оценивали данные антропометрических, лабораторных и инструментальных исследований: электрокардиограмма (ЭКГ), многосуточное мониторирование ЭКГ («Normocard», г. Кемерово, Россия), эхокардиография («Vivid 7», GE, USA) с определением толщины эпикардиального жира (ТЭЖ). Всем пациентам, которым выполнялась РЧА, проводилось кардиореспираторное мониторирование для выявления сонно-зависимых нарушений дыхания («SOMNOlab 2 (PG) Polygraphy system», Loewenstein Medical, Weinmann, Германия). Все образцы плазмы и сыворотки крови были центрифугированы с последующим хранением при -40° С и с дальнейшим определением концентрации изучаемых биомаркеров с помощью стандартных наборов, данные которых представлены в таблице 1.
Таблица 1
Характеристика методик и компаний производителей реагентов для определения биомаркеров в крови

Сокращения: ИЛ-6 — интерлейкин-6, ИТДМ — иммунотурбидиметрический метод, ИФА — иммуноферментный метод, СРБ — С-реактивный белок, ФНО-? — фактор некроза опухоли альфа, TGF-beta1 — трансформирующий фактор роста-бета1, CT-1 — кардиотрофин-1, CTGF — соединительнотканный фактор роста фибробластов, PIIINP — N-концевой предшественник проколлагена III типа, PINP — N-концевой предшественник проколлагена I типа, GDF-15 — ростовой фактор дифференцировки-15.
В проспективное 12-мес. наблюдение были включены пациенты с клинически значимыми пароксизмами ФП (в т.ч. со снижением в следствии этого качества жизни) резистентные к медикаментозной антиаритмической терапии, которым выполнялась РЧА устьев легочных вен. Плановые визиты на амбулаторном этапе после РЧА проводились через 3, 6, 9 и 12 мес. Рецидивом ФП после РЧА считались жалобы пациентов и зарегистрированные длительностью ?30 сек по данным ЭКГ эпизоды ФП в период от 3 до 12 мес. Всем пациентам проводилось 3-х сут. мониторирование ЭКГ через 6 мес. после РЧА и более длительное до 7-и сут. мониторирование ЭКГ через 12 мес. после РЧА с использованием системы «Normocard» (г. Кемерово) для выявления/исключения пароксизмов ФП после процедуры РЧА, которая считалась эффективной при отсутствии жалоб и указаний на пароксизмы ФП в период от 3 до 12 мес. Перед выполнением РЧА устьев легочных вен в условиях рентгеноперационной с использованием нефлюороскопической системы электроанатомического картирования CARTO 3 (Biosense Webster, USA) и катетера с измерением силы контакта с миокардом ЛП (Smart Touch Thermocool, Biosense Webster, USA) на фоне синусового ритма выполнялось построение биполярных амплитудных карт ЛП, карт оценки времени локальной активации. Оценка зон низкого вольтажа в спектре амплитуд 0,2-0,5 мВ с измерением их площади с использованием функции программного обеспечения навигационной системы CARTO 3 «area measurement» проводилась в режиме «оff line» [13]. Распространенность фиброза оценивалась в процентном соотношении площади фиброза к общей площади ЛП.
Статистический анализ был выполнен с помощью лицензированного программного обеспечения IBM SPSS Statistics, версия 22.0. Оценка нормальности распределения числовых переменных проводилась с помощью критериев Колмогорова-Смирнова. В зависимости от вида распределения количественные переменные, подчиняющиеся закону нормального распределения, представлены средним значением (М) ± стандартное отклонение (?). Для сравнения в независимых группах показателей с нормальным распределением был использован параметрический непарный t-тест Стьюдента. При распределении количественных показателей, отличающемся от нормального, данные представлены в виде медианы (Ме) с указанием межквартильных интервалов (25-75%), а для сравнения в независимых группах таких показателей использован непараметрический U-тест Манна-Уитни. Множественные сравнения в группах (более двух) в параметрической статистике проводились с помощью ANOVA, а для непараметрической статистики — критерий Краскала-Уоллиса. Также использовались методы биномиального регрессионного анализа для прогнозирования вероятности наступления (отношение шансов (ОШ)) события и ROC-анализ для определения пороговых значений биомаркеров с расчетом риска событий (RR) с помощью четырехпольной таблицы сопряженности.
Результаты
В исследование были включены пациенты с ФП без компонентов МС и с различным числом компонентов МС. Исследуемые группы были сопоставимы в распределении по полу и статистически значимо не различались по возрасту. Пациенты с 1-2 компонентами МС имели больше индекс массы тела (ИМТ) и окружность талии (ОТ), чем обследованные без единого компонента МС, однако эти группы статистически значимо не различались по показателям липидного и углеводного обменов. Наибольшие значения ИМТ, ОТ, концентрации глюкозы в плазме крови установлены у пациентов с ?3 компонентами МС, а показатели липидного обмена были сопоставимы с группами сравнения. Пациенты с ФП и МС имели статистически значимо большие размеры левого и правого предсердия, большие значения индекса массы миокарда (ИММ) ЛЖ и ТЭЖ, чем больные с 1-2 компонентами МС и пациенты без МС. Размер и объем ЛП, а также ИММ ЛЖ у пациентов с 1-2 компонентами МС были больше, чем у пациентов без МС. Обследуемые группы были сопоставимы по фракции выброса ЛЖ и длительности анамнеза ФП. Основные клинические, лабораторные и инструментальные характеристики обследованных представлены в таблице 2.
Таблица 2
Клинические, лабораторные и эхокардиографические характеристики обследованных лиц

Сокращения: ИМТ — индекс массы тела, ИММ ЛЖ — индекс массы миокарда левого желудочка, ХС — холестерин, ЛП — левое предсердие, ЛПВП — липопротеины высокой плотности, ЛПНП — липопротеины низкой плотности, МС — метаболический синдром, ОТ — окружность талии, ПП — правое предсердие, ТГ — триглицериды, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий.
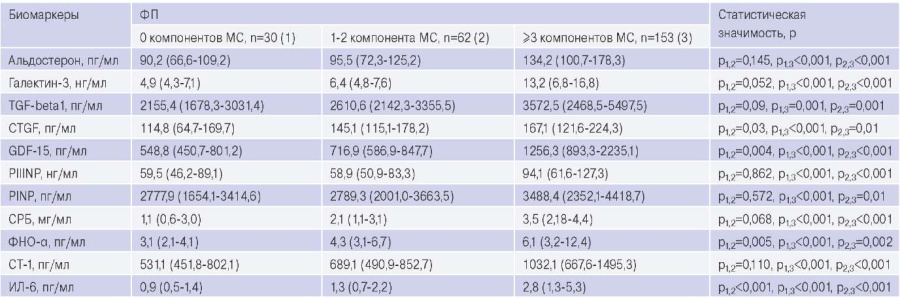
В таблице 3 представлены данные о концентрациях биомаркеров в сыворотке и плазме крови обследованных. Установлено, что концентрации профиброгенных и провоспалительных биомаркеров в крови у пациентов с ФП и МС выше, чем у пациентов с ФП и 1-2 компонентами МС, и выше, чем у больных с ФП без компонентов МС. Концентрации соединительнотканного фактора роста фибробластов, ростового фактора дифференцировки-15 (GDF-15), фактора некроза опухоли альфа и интерлейкин-6 у пациентов с ФП и 1-2 компонентами МС выше, чем у больных с ФП без МС.
Таблица 3
Концентрации биомаркеров фиброза и воспаления, циркулирующих в крови у пациентов с ФП и МС, ФП без МС, ФП с 1-2 компонентами МС

Сокращения: ИЛ-6 — интерлейкин-6, МС — метаболический синдром, СРБ — С-реактивный белок, ФНО-? — фактор некроза опухоли альфа, ФП — фибрилляция предсердий, CT-1 — кардиотрофин-1, CTGF — соединительнотканный фактор роста фибробластов, GDF-15 — ростовой фактор дифференцировки-15, PIIINP — N-концевой предшественник проколлагена III типа, PINP — N-концевой предшественник проколлагена I типа, TGF-beta1 — трансформирующий фактор роста-бета1.
В дальнейшее проспективное наблюдение в течение 12 мес. были включены пациенты с показаниями для проведения РЧА (n=135) без МС и различным числом компонентов МС: 0 компонентов МС (n=23), 1-2 компонентами МС (n=35), ?3 компонентами МС (n=77). Установлено, что у 42,9% пациентов (n=58) зарегистрирован рецидив ФП за время наблюдения после РЧА: 72,4% (n=49) пациентов с ?3 компонентами МС, 8,6% (n=5) больных с 1-2 компонентами МС и 6,9% (n=4) пациентов без компонентов МС. Среди больных с без компонентов МС пациентов с рецидивом ФП было меньше, чем больных без повторных эпизодов ФП и выявлен низкий риск рецидива ФП после РЧА (RR =0,34, 95% доверительный интервал (ДИ) 0,14-0,83, р=0,007). У пациентов с 1-2 компонентами МС выявлена тенденция к увеличению риска рецидива ФП, однако статистически значимой разницы с пациентами без компонентов МС не установлено (RR =0,82, 95% ДИ 0,21-3,25, р=0,779). В когорте пациентов с ?3 компонентами МС пациентов с рецидивом ФП было больше, чем пациентов без аритмии. Таким образом, наличие МС в 4,1 раза увеличивало риск рецидива ФП после РЧА в течение 12 мес. (RR =4,11, 95% ДИ 2,19-7,65, р<0,0001). При анализе риска рецидива ФП после РЧА у обследованных больных в зависимости от числа компонентов МС установлено, что статистически значимое увеличение данного показателя наблюдалось у пациентов с ?3 компонентами, а максимальный риск повторных эпизодов ФП после РЧА выявлен у пациентов с 5 компонентами МС (табл. 4). По данным биномиальной логистической регрессии установлено, что увеличение числа компонентов МС с 0 до 5 повышало вероятность рецидива ФП после РЧА в 2,2 раза (ОШ =2,16, 95% ДИ 1,61-2,89, р<0,0001).
Таблица 4
Риск рецидива ФП через 12 мес. после РЧА у пациентов с различным число компонентов МС

Сокращения: ДИ — доверительный интервал, МС — метаболический синдром, ФП — фибрилляция предсердий, RR — относительный риск.
Данные пациентов с ФП при наличии ?3 компонентов МС, которым выполнялась РЧА, были проанализированы более подробно. Группы пациентов с МС и ФП с рецидивом ФП и без рецидива после РЧА были сопоставимы по возрасту, ИМТ и в распределении по полу. При анализе данных установлено, что ОТ у пациентов с рецидивом ФП была больше, чем у пациентов с эффективной РЧА. Уровень триглицеридов в плазме крови у пациентов с рецидивом ФП был выше, чем у пациентов без повторных эпизодов аритмии. В целом группы были сопоставимы по распространенности АО, АГ, синдрома обструктивного апноэ сна, а частота СД у пациентов с рецидивами ФП после РЧА была выше, чем у больных с эффектом от интервенционной терапии. Группы сравнения были сопоставимы по встречаемости медикаментозной антиаритмической терапии после РЧА. Больные получали следующие препараты: бета-адреноблокаторы (32,6%), пропафенон (31,9%), соталол (25,9%), амиодарон (7,4%), аллапинин (2,2%). Следует отметить, что параметры, характеризующие дилатацию обоих предсердий, были сопоставимы в обеих группах, однако ИММ ЛЖ был больше у пациентов с рецидивами ФП после РЧА. ТЭЖ и степень выраженности фиброза миокарда ЛП были значимо больше у пациентов с повторными эпизодами ФП после интервенционной терапии, чем у больных без рецидива ФП (табл. 5).
Таблица 5
Клинические, антропометрические, лабораторные и эхокардиографические характеристики пациентов с ФП и МС с рецидивом и без рецидива ФП после РЧА

Сокращения: ААТ — антиаритмическая медикаментозная терапия, иАПФ/АРА — ингибиторы ангиотензинпревращающего фермента/антагонисты рецепторов ангиотензина, ИММ ЛЖ — индекс массы миокарда левого желудочка, ИМТ — индекс массы тела, ЛП — левое предсердие, ЛПВП — липопротеины высокой плотности, ЛПНП — липопротеины низкой плотности, МС — метаболический синдром, ПП — правое предсердие, РЧА — радиочастотная аблация, СОАС — синдром обструктивного апноэ сна, ТГ — триглицериды, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХС — холестерин.
По результату биномиальной логистической регрессии большая ТЭЖ (ОШ =3,71, 95% ДИ 2,126,73, р=0,00001) и значительная степень выраженности фиброза (ОШ =1,48, 95% ДИ 1,03-1,78, р=0,0006) у пациентов с ФП и МС увеличивали риск рецидива данной аритмии после РЧА. При анализе концентраций в крови биомаркеров фиброза и воспаления установлено, что у пациентов с ФП и МС с рецидивом ФП после РЧА концентрации галектина-3 и GDF-15 выше, чем у больных с отсутствием зарегистрированных повторных эпизодов ФП. Концентрации других профиброгенных и провоспалительных цитокинов статистически значимо не различались в группах сравнения (табл. 6).
Таблица 6
Концентрации биомаркеров фиброза и воспаления, циркулирующих в крови у пациентов с ФП и МС с рецидивом и без рецидива ФП после РЧА

Сокращения: ИЛ-6 — интерлейкин-6, МС — метаболический синдром, СРБ — С-реактивный белок, ФНО-? — фактор некроза опухоли альфа, ФП — фибрилляция предсердий, CT-1 — кардиотрофин-1, CTGF — соединительнотканный фактор роста фибробластов, GDF-15 — ростовой фактор дифференцировки-15, PIIINP — N-концевой предшественник проколлагена III типа, PINP — N-концевой предшественник проколлагена I типа, TGF-beta1 — трансформирующий фактор роста-бета1.
По результату биномиальной логистической регрессии установлено, что концентрации галектина-3 (ОШ =1,31, 95% ДИ 1,12-1,51, р=0,0001) и GDF-15 (ОШ =1,11, 95% ДИ 1,02-1,18, р=0,0002) у пациентов с МС увеличивали вероятность рецидива ФП в течение 12 мес. после РЧА. Для галектина-3, GDF-15 и ТЭЖ с помощью ROC-анализа были построены кривые прогнозирования вероятности рецидива ФП у пациентов с МС в течение 12 мес. после РЧА, по данным которого выявлены высокие значения площадей под кривыми, что соответствуют значимому влиянию данных биомаркеров на вероятность рецидива ФП после РЧА у пациентов с МС (рис. 1). Установлены пороговые значения для концентраций в крови галектина-3 (>11,0 нг/мл; RR =3,43, 95% ДИ 1,79-6,58, р=0,0001), GDF-15 (>1380,7 пг/мл; RR =2,84, 95% ДИ 1,81-4,46, р<0,0001) и ТЭЖ (>6,4 мм; RR =4,50, 95% ДИ 2,32-8,71, р<0,0001), превышение которых в наибольшей степени влияет на риск рецидива ФП после РЧА у больных с МС. У пациентов с превышением всех трех пороговых значений биомаркеров суммарный риск рецидива ФП у пациентов с МС в течение 12 мес. после РЧА увеличивается в 3,2 раза (RR =3,16, 95% ДИ 1,97-5,11, р<0,00001), а показатели чувствительности (Se — 75,5%) и специфичности (Sp — 96,4%) свидетельствуют о высокой значимости данной модели прогнозирования вероятности события.

Рис. 1. ROC-кривые прогнозирования вероятности рецидива ФП у пациентов с МС в течение 12 мес. после РЧА в зависимости от концентрации галектина-3 и GDF-15 в крови и ТЭЖ.
Сокращения: ТЭЖ — толщина эпикардиального жира, AUC — площадь под кривой, GDF-15 — ростовой фактор дифференцировки-15.
Обсуждение
ФП — наиболее часто встречающееся нарушение ритма в популяции. Предполагается, что заболеваемость ФП в ближайшие десятилетия значительно увеличится [14]. Механизмы развития данного нарушения ритма многообразны и представляют собой целую систему изменений, включающую электрическое и структурное ремоделирование с формированием фиброза миокарда, анатомическое ремоделирование с развитием дилатации предсердий и нарушением сократительной функции, а также изменения нейровегетативной регуляции [15]. Компоненты МС, такие как АГ, ожирение, нарушения углеводного и липидного обмена, входят в состав факторов риска развития ФП, а наличие большого числа компонентом МС в значительной степени увеличивает вероятность развития этой аритмии [16]. В современной стратегии ведения пациентов с ФП важную роль занимает контроль синусового ритма, что включает в себя медикаментозную антиаритмическую терапию и интервенционные методы лечения. По данным проспективного исследования EAST-AFNET установлено, что ранний контроль синусового ритма у пациентов с ФП позволяет снижать риск сердечно-сосудистой смерти и инсульта, что в еще большей степени делает антиаритмическую тактику ведения пациентов с ФП актуальной [17]. Вместе с тем небольшой выбор антиаритмических препаратов, их недостаточный эффект или нежелательные явления со стороны сердечно-сосудистой и других систем существенно ограничивают выбор медикаментозной терапии [18]. Современные методы интервенционного лечения ФП, включающие, в частности, РЧА — изоляцию устьев легочных вен, позволяют с высокой эффективностью контролировать синусовый ритм в течение длительного времени в большей степени у пациентов с пароксизмальной формой ФП, однако даже при персистирующей форме данный метод лечения имеет достаточно высокую эффективность. Согласно исследованию CABANA, катетерная аблация при ФП была эффективней с позиции контроля синусового ритма по сравнению с медикаментозной терапией, и обе тактики были сопоставимы в снижении риска сердечно-сосудистых осложнений [19]. В свою очередь, выбор антиаритмической тактики всегда требует персонализации стратегии с учетом коморбидных состояний. По данным многочисленных исследований ранее уже было установлено, что ожирение, СД, неконтролируемая АГ могут увеличивать риск рецидива аритмии после РЧА, что, вероятно, обусловлено сохраняющимися патогенетическими изменениями в структурном ремоделировании и прогрессирующем фиброзе миокарда [12][20].
В одном из крупнейших метаанализов, включающем 23 исследования и 12924 пациентов с ФП, установлено, что МС увеличивает риск рецидива ФП (RR =1,63, 95% ДИ 1,25-2,12) [21]. В нашем когортном исследовании [20] установлено, что наличие ?3 компонентов МС в 4,1 раза увеличивает риск рецидива ФП после РЧА (RR =4,11, 95% ДИ 2,19-7,65, р<0,0001). Выявлено, что увеличение числа компонентов МС от 0 до 5 повышает в 2,2 раза риск рецидива ФП. Полученные данные подтверждают тот факт, что ухудшение прогноза эффективности РЧА наблюдается только при наличии ?3 компонентов МС, т.е. при наличии критериев данного синдрома. Следует отметить, что обследованные группы пациентов с МС и рецидивом ФП были сопоставимы по встречаемости АГ, однако у больных с отсутствием эффекта от интервенционной терапии чаще имели место СД и АО. Прогнозирование риска рецидива ФП у пациентов с МС представляется чрезвычайно актуальным, т.к. выявление предикторов недостаточного эффекта РЧА позволит персонализировать стратегию ведения пациентов с ФП. В последние годы активно изучаются различные биомаркеры, влияющие на фиброз миокарда. Ранее установлено, что концентрации таких биомаркеров, как галектин-3, трансформирующий фактор роста-бета1, N-концевые предшественники проколлагенов I и III типов, повышены у пациентов с МС и ФП и ассоциированы с выраженностью фиброза миокарда ЛП [22]. Было установлено, что циркулирующий в крови биомаркер GDF-15 ассоциирован со степенью выраженности фиброза миокарда и, вероятно, имеет важное прогностическое значение для больных с ФП [23]. При исследовании биомаркеров фиброза и воспаления у пациентов с ФП и РЧА установлено, что повышение концентраций галектина-3 и альдостерона у пациентов с ФП ассоциировано с увеличением риска рецидива данного нарушения ритма у пациентов с ФП [11]. Повышение трансформирующего фактора роста-бета1 в сыворотке крови было независимым предиктором рецидива ФП после РЧА (ОШ =1,14, 95% ДИ 1,11-1,17, р=0,02) [24]. Однако до настоящего времени исследований, посвященных комплексной оценке роли биомаркеров фиброза и воспаления в развитии рецидивов ФП после РЧА у пациентов с МС, не было опубликовано. Следует отметить, что обследованные нами пациенты с МС и ФП имели высокие значения большого числа изучаемых биомаркеров фиброза, в сравнении с пациентами с ФП и с 1-2 компонентами МС. Особенность нашего исследования заключается в том, что пациенты с МС в группах с рецидивом и без рецидива ФП были сопоставимы не только по возрасту, ИМТ, длительности ФП и получаемой медикаментозной терапии, но также статистически значимо не различались по степени выраженности дилатации обоих предсердий. В то же время, по данным эхокардиографии, выявлена значительно большая ТЭЖ у пациентов с рецидивом ФП после РЧА, а по данным биномиального регрессионного анализа установлено, что данный биомаркер увеличивает вероятность риска возобновления аритмии (ОШ =3,71, 95% ДИ 2,12-6,73, р=0,00001) [25][26]. Известно, что золотым стандартом визуализирующей оценки ТЭЖ являются МРТ и КТ, однако эхокардиография с измерением ТЭЖ — более доступный скрининговый метод определения данного биомаркера в реальной клинической практике. В нашем исследовании по результатам ROC-анализа выявлено пороговое значение ТЭЖ 6,4 мм, превышение которого в значительной мере увеличивает риск рецидива ФП после РЧА (RR =4,50, 95% ДИ 2,32-8,71, р<0,0001). С большим увеличением ТЭЖ у пациентов с рецидивом ФП после РЧА может быть ассоциирована более выраженная степень фиброза при сопоставимом объеме ЛП в группах сравнения пациентов с МС. В свою очередь, выраженность фиброза ЛП увеличивала риск рецидива ФП у пациентов с МС (ОШ =1,48, 95% ДИ 1,03-1,78, р=0,0006).
Изучение провоспалительных и профиброгенных биомаркеров позволило выявить более высокие концентрации галектина-3 и GDF-15 у больных с МС и рецидивом ФП. В последние годы различные исследования, включая крупный метаанализ, подтвердили связь галектина-3 с риском развития ФП и фиброза миокарда [27]. Провоспалительные цитокины активируют макрофаги и увеличивают продукцию галектина-3, индуцирующего фибробласты повышать секрецию коллагена в межклеточное пространство, в связи с чем наиболее высокие концентрации данного биомаркера наблюдаются у пациентов с ожирением и СД [28, 29]. Установлено, что концентрация галектина-3 >5,83 нг/мл в плазме крови у пациентов с персистирующей ФП без структурных заболеваний сердца увеличивает риск рецидива аритмии после РЧА (RR =1,28, 95% ДИ 1,072-1,529, р<0,006). В нашем когортном исследовании изучена роль галектина-3 в прогнозировании риска рецидива ФП преимущественно у пациентов с пароксизмальной формой аритмии в сочетании с МС. Мы также установили прогностическую роль данного биомаркера, а пороговое значение галектина-3 >11,0 нг/мл увеличивало риск рецидива более, чем в 3 раза (RR =3,43, 95% ДИ 1,79-6,58, р=0,0001). Можно полагать, что продукция галектина-3 значительно повышена на ранних этапах формирования фиброза миокарда, однако с учетом его значимой прогностической роли у пациентов не только с пароксизмальной, но и персистирующей формами ФП можно предположить, что данный биомаркер служит предиктором более отдаленных прогнозов для пациентов с ФП.
Как показало наше исследование, не менее важный с точки зрения прогноза рецидива ФП после РЧА у больных с МС биомаркер — GDF-15, который, согласно многочисленным исследованиям, повышается на фоне воспаления, окислительного стресса, гипоксии и гипергликемии, что, вероятно, обуславливает его важную интегративную роль индикатора неблагоприятных метаболических патологических процессов в организме [30]. У пациентов с ФП хорошо известна прогностическая роль GDF-15 при оценке риска кровотечений, что было изучено в крупном рандомизированном исследовании ARISTOTLE, по данным которого GDF-15 был ассоциирован с риском сердечно-сосудистой смерти и кровотечений [31]. В 2020г впервые опубликованы данные о роли GDF-15 в прогнозировании рецидива ФП и установлено, что превышение порогового значения 1287,3 пг/мл увеличивало риск рецидива ФП (RR =1,053, 95% ДИ 1,007-1,1, р=0,022), однако данная прогностическая модель имела не высокую чувствительность (51,4%) и специфичность (70,8%) и больше половины пациентов в исследовании были с персистирующей формой ФП [32]. По результатам нашего исследования биомаркер GDF-15 также продемонстрировал высокую предикторную роль в прогнозировании рецидива ФП после РЧА в когорте пациентов с МС, при этом пороговое значение GDF-15 было выше (1380,7 пг/мл), а увеличение риска рецидива установлено в большей степени (RR =2,84, 95% ДИ 1,81-4,46, р<0,0001).
Использование различных биомаркеров в современной врачебной практике позволяет персонифицировать терапию для достижения лучшего результата в снижении риска конечных событий. В частности, комплексная оценка таких прогностических биомаркеров, как галектин-3, GDF-15 и ТЭЖ, у пациентов с ФП и МС позволяет с высокой степенью чувствительности и специфичности прогнозировать рецидив ФП в течение 12 мес. после РЧА. Основной практической значимостью такой персонификации терапии является своевременное выявление пациентов с неблагоприятным прогнозом РЧА с целью интенсификации первичной профилактики — воздействия на факторы риска ФП: снижение веса, нормализации артериального давления и стабилизации гликемического профиля, выявление и коррекция нарушений дыхания во время сна при подготовке к проведению интервенционной терапии, что, возможно, улучшит прогноз эффективности радиочастотной изоляции устьев легочных вен у пациентов с МС.
Заключение
- МС при наличии ?3 компонентов в 4,1 раза увеличивает риск рецидива ФП в течение 12 мес. после РЧА, а наибольший риск повторных эпизодов данной аритмии выявлен у пациентов с 5 компонентами МС.
- Используя биномиальную логистическую регрессию, выявлены независимые предикторы рецидива ФП в течение первых 12 мес. после РЧА: ТЭЖ, степень выраженности фиброза ЛП, увеличение концентрации галектина-3 и GDF-15 в крови у пациентов с МС.
- Установлены пороговые значения концентраций в крови галектина-3 (>11,0 нг/мл), GDF-15 (>1380,7 пг/мл) и ТЭЖ (>6,4 мм), превышение которых в значимой степени влияет на риск рецидива ФП после РЧА у больных с МС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Ионин В.А., Заславская Е.Л., Барашкова Е.И., Павлова В.А., Ананьев А.М., Морозов А.Н., Баранова Е.И. Предикторы рецидива фибрилляции предсердий у пациентов с метаболическим синдромом после радиочастотной изоляции устьев легочных вен. Российский кардиологический журнал. 2022;27(3S):5184. https://doi.org/10.15829/1560-4071-2022-5184
Скопировать