Особенности течения острого коронарного синдрома вследствие спонтанной диссекции коронарных артерий у женщин: серия случаев
Аннотация
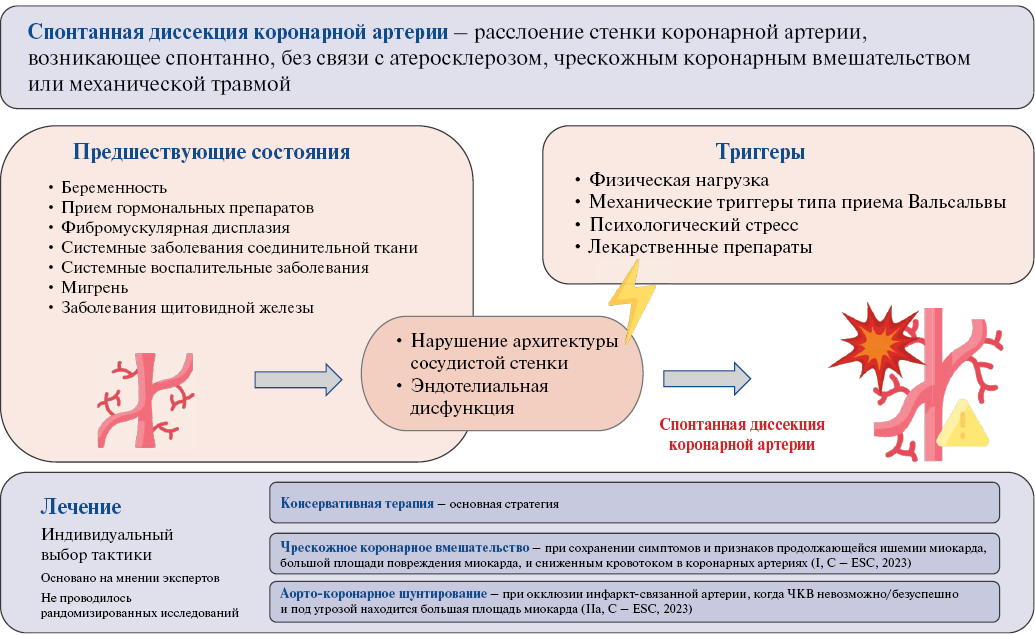
Спонтанная диссекция коронарных артерий (СДКА) — расслоение стенки коронарной артерии, возникающее спонтанно, без связи с атеросклерозом, чрескожным коронарным вмешательством или механической травмой. Особенностью заболевания является его преобладание у молодых женщин. Известно о связи данного состояния с беременностью и гормональными изменениями. Описан ряд факторов риска, таких как сосудистая патология (наиболее часто — фибромускулярная дисплазия), другие наследственные заболевания соединительной ткани, системные воспалительные заболевания, мигрень, заболевания щитовидной железы.
Тем не менее точные механизмы патофизиологической связи на сегодняшний день не определены, и не у всех пациентов удается выявить факторы риска, что свидетельствует о сложной и не до конца изученной природе заболевания. В данной статье мы приводим серию случаев, посвященных развитию СДКА у женщин, и рассматриваем предрасполагающие факторы развития заболевания.
Спонтанная диссекция коронарных артерий (СДКА) — расслоение стенки коронарной артерии, возникающее спонтанно, без связи с атеросклерозом, чрескожным коронарным вмешательством или механической травмой (рис. 1). СДКА чаще возникает у пациентов без известных факторов риска сердечно-сосудистых заболеваний и составляет от 1% до 4% случаев острого коронарного синдрома (ОКС). Особенностью заболевания является его преобладание у молодых женщин. Более 90% пациентов с диссекцией — женщины, их средний возраст составляет 44-53 года, хотя СДКА встречается от подросткового возраста до восьмого десятилетия жизни. Клинические проявления СДКА могут варьировать от боли в груди до внезапной сердечной смерти [1-3].
В последние годы в литературе были описаны случаи ОКС вследствие СДКА у женщин [4-8]. Одним из важных и часто встречающихся факторов, ассоциированных с СДКА, является беременность и длительный прием гормональных препаратов. Нередко провоцирующим фактором является стресс: по данным ряда исследований, порядка половины пациентов с СДКА (41-55%) испытывали высокий уровень психологического стресса до наступления события [3].
В данной статье мы представляем серию случаев, иллюстрирующих особенности течения ОКС вследствие СДКА у женщин.

Рис. 1. СДКА — графическое резюме.
Сокращение: ЧКВ — чрескожное коронарное вмешательство.
Клинический случай 1
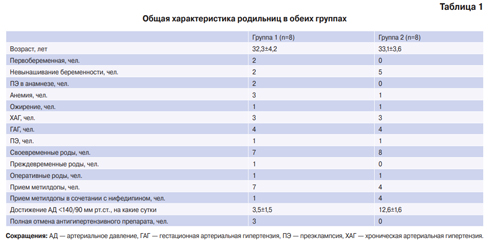
Пациентка 41 года, беременность 39 недель, госпитализирована в перинатальный центр в связи с развитием ангинозного болевого синдрома. Беременность первая, протекала без серьезных осложнений. Артериальное давление при поступлении 160/100 мм рт.ст., ранее значимого повышения артериального давления не регистрировалось. Отягощен наследственный анамнез (инфаркт миокарда (ИМ) у отца в возрасте 30 лет, повторные инсульты).
Обследована по протоколу ОКС: электрокардиограмма (ЭКГ) без признаков острых очаговых изменений (рис. 2), при проведении эхокардиографии (ЭхоКГ) зон нарушения локальной сократимости не выявлено, клапанный аппарат без особенностей, фракция выброса (ФВ) левого желудочка (ЛЖ) в пределах нормы. Отмечалось увеличение тропонина I максимально до 2,759 нг/мл (референсные значения 0-0,016 нг/мл). Была выполнена коронароангиография (КАГ) в экстренном порядке, по результатам которой значимых стенозов коронарных артерий не выявлено, кровоток удовлетворительный — TIMI 3 (рис. 3) Выполнена магнитно-резонансная томография аорты: признаков аневризматического расширения аорты не выявлено. Состояние было расценено как острое повреждение миокарда, генез которого оставался неясным (возможные причины — вазоспазм коронарных артерий, миокардит). При дообследовании данных в пользу инфекционного/воспалительного генеза заболевания получено не было. С учетом беременности возможности терапии и дообследования были ограничены. В связи со стабилизацией состояния (ЭКГ, ЭхоКГ без отрицательной динамики, тропонин со снижением) принято решение о дообследовании пациентки после родоразрешения.
На вторые сутки госпитализации пациентка была родоразрешена путем кесарева сечения в условиях общей анестезии. Проводили мультимодальное обезболивание, утеротоническую терапию, профилактику тромбоэмболических осложнений, антигипертензивную терапию.
В раннем послеоперационном периоде пациентка отметила рецидив болевого синдрома в грудной клетке, боли аналогичного характера с меньшей интенсивностью длительностью около 2 ч. На ЭКГ — синусовая тахикардия с частотой сердечных сокращений (ЧСС) 105 уд./мин. Признаки нагрузки на правое предсердие. Изменения реполяризации в области нижней стенки: тенденция к элевации ST III, aVF, изменение формы комплекса: rs III, aVF → qs III, qrs aVF (рис. 4).
По результатам ЭхоКГ ФВ — 65%, появление гипокинезии базального и срединного сегментов нижней стенки. Тропонин с повышением до 8,8 нг/мл (референсные значения 0-0,016). Таким образом, представленный эпизод критериально соответствует понятию «инфаркт миокарда»: помимо лабораторных проявлений повреждения миокарда имеются убедительные признаки его ишемии в виде характерной ЭКГ динамики, классического ангинозного синдрома, локальной потери сократительной функции ЛЖ на ЭхоКГ. Консилиумом были определены показания к срочной КАГ, по результатам которой был выявлен протяженный стеноз правой коронарной артерии (ПКА), обусловленный спонтанной диссекцией в дистальной трети с вовлечением устья доминирующей ретровентрикулярной ветви. С учетом анатомической характеристики повреждения, сохраняющегося стеноза и клинической картины (рецидивирующий болевой синдром) выполнено стентирование ПКА (имплантирован 1 стент — DES), реваскуляризация полная (рис. 5).
Течение послеоперационного периода без осложнений, содержание тропонина I снизилось до референсных значений, на ЭКГ — закономерная динамика ИМ (рис. 6). ЭхоКГ исследование — без отрицательной динамики, ФВ сохранена. При обследовании у пациентки выявлена дислипидемия (холестерин общий 8,03 ммоль/л, липопротеины низкой плотности 5,38 ммоль/л), начата терапия статинами. Проводилась двойная антиагрегантная терапия, назначены ингибиторы ангиотензинпревращающего фермента, бета-адреноблокаторы.
Из сопутствующей патологии известно, что у пациентки имеется пролактинсекретирующая микроаденома гипофиза и до наступления беременности проводилось медикаментозное лечение гиперпролактинемии. Также в анамнезе — фузиформная аневризма препетрозального сегмента правой внутренней сонной артерии — без признаков разрыва или диссекции по данным компьютерной томографии-ангиографии в данную госпитализацию. Изменений других артерий шеи или основания головного мозга не выявлено.
Таким образом, у молодой женщины в раннем послеродовом периоде имеет место СДКА, на фоне измененного гормонального статуса. Послеоперационный период без осложнений, болевой синдром не рецидивировал.

Рис. 2. ЭКГ при поступлении.
Примечание: синусовая тахикардия с ЧСС 115 уд./мин. Неполная блокада левой ножки пучка Гиса. Без острых очаговых изменений.
Сокращение: ЧСС — частота сердечных сокращений.

Рис. 3. КАГ при поступлении в стационар.
Примечание: коронарные артерии без значимого стенозирования, кровоток удовлетворительный, TIMI 3.

Рис. 4. ЭКГ при болевом синдроме.

Рис. 5. Результаты повторной коронарографии.
Примечание: А. Протяженный стеноз ПКА, обусловленный спонтанной диссекцией, в дистальной трети с вовлечением устья доминирующей ретровентрикулярной ветви, кровоток по артерии выраженно замедлен (TIMI I-II). Б. Результат стентирования участков диссекции. Кровоток по ПКА удовлетворительный (TIMI III).
Сокращение: ПКА — правая коронарная артерия.

Рис. 6. ЭКГ в динамике.
Примечание: ЭКГ картина динамики инфаркта миокарда с формированием патологического зубца Q в области нижней стенки ЛЖ. А — вторые сутки ИМ, Б — шестые сутки ИМ.
Сокращения: ИМ — инфаркт миокарда, ЛЖ — левый желудочек, ЭКГ — электрокардиограмма.
Клинический случай 2
Пациентка 45 лет без анамнеза ишемической болезни сердца, артериальной гипертензии, без тяжёлой сопутствующей патологии, госпитализирована с ОКС с подъемом сегмента ST. На ЭКГ при поступлении ритм синусовый, ЧСС 85 уд./мин, элевация сегмента ST в V3-V6 до 2-3 мм. Зарегистрировано повышение тропонина (максимальное значение 22 нг/мл, референсные значения 0-0,016). На ЭхоКГ — ФВ ЛЖ 60%, гипокинезия верхушки, апикального сегмента межжелудочковой перегородки. По данным экстренной КАГ в передней межжелудочковой артерии (ПМЖА) определяется дефект контрастирования на границе средней и дистальной трети, визуализируется спонтанная диссекция от уровня средней трети ПМЖА, периферия гипоперфузирована (рис. 7). Определена консервативная тактика лечения.
Проводили терапию антиагрегантами, бета-адреноблокаторами, блокаторами ренин-ангиотензин-альдостероновой системы, статинами, препаратами железа по поводу железодефицитной анемии легкой степени. В связи с отсутствием атеросклеротического поражения коронарных артерий по данным КАГ было рекомендовано амбулаторно продолжить монотерапию ацетилсалициловой кислотой. На фоне проводимого лечения положительная динамика: болевой синдром не рецидивировал, на контрольных ЭКГ — закономерная динамика ИМ передне-боковой стенки без зубца Q (рис. 8).
Пациентка была дообследована. Выполнен лабораторный скрининг на наличие ревматологической патологии (определение уровня антител к протеиназе 3, миелопероксидазе, определение антинуклеарного фактора) — патологических изменений не выявлено. С целью исключения атеросклероза, фибромускулярной дисплазии, паттернов воспалительных заболеваний артерий выполнена ультразвуковая допплерография брахиоцефальных артерий: признаков поражения сосудов не выявлено; по данным ультразвуковой допплерографии сосудов почек убедительных признаков гемодинамически значимых стенозов почечных артерий не выявлено. Характер и скорости кровотока на всех уровнях «сосудистого дерева» обеих почек сохранены. Таким образом, исключены поражения сосудов, в т. ч. фибромускулярной дисплазии, системные заболевания соединительной ткани как причины спонтанной диссекции. В удовлетворительном состоянии была выписана на амбулаторный этап, рекомендованную терапию принимала в полном объеме. В данном случае на момент госпитализации не было выявлено сопутствующих заболеваний и состояний, которые могли бы привести к диссекции коронарной артерии. Пациентке было рекомендовано амбулаторное наблюдение и дообследование.

Рис. 7. Результаты КАГ при госпитализации.
Примечание: спонтанная диссекция от уровня средней трети ПМЖА: дефект контрастирования на границе средней и дистальной трети.
Сокращение: ПМЖА — передняя межжелудочковая артерия.

Рис. 8. ЭКГ на третьи сутки ИМ.
Примечание: закономерная динамика инфаркта миокарда переднебоковой стенки без зубца Q. ST V3-V6 ближе к изолинии, сформировались отрицательные Т V3-V6.
Обсуждение
Рассматривая возможные причины диссекции коронарных артерий в описанных случаях, в первую очередь необходимо отметить беременность и изменения гормонального статуса. С беременностью связано ~10% от всех случаев СДКА. При этом треть случаев ОКС при беременности и почти половина в послеродовом периоде обусловлены СДКА. Большинство случаев диссекции отмечается в последнем триместре беременности и в течение первой недели после родов. СДКА, связанная с беременностью, имеет более тяжелое клиническое течение и чаще проявляется как ОКС с подъемом сегмента ST с развитием ИМ передней стенки ЛЖ, при этом ангиографически в большинстве случаев выявляется поражение ствола левой коронарной артерии или многососудистое поражение [1][9]. Точные механизмы патофизиологической связи на сегодняшний день не определены. Известно, что гормоны оказывают влияние на соединительную ткань и микроциркуляторное русло. Вследствие гормональных изменений происходят изменения эластических волокон и содержания мукополисахаридов в сосудах, а также нарушение синтеза коллагена. В сочетании с общим ослаблением сосудистой стенки острые гемодинамические изменения во время беременности, родов и послеродового периода могут повысить риск диссекции [9].
Патология соединительной ткани и коронарных сосудов также являются предрасполагающими факторами развития СДКА [3]. В описанном нами первом клиническом случае известно о наличии аневризмы внутренней сонной артерии, что может быть признаком системного заболевания, в связи с чем пациентке было рекомендовано дообследование на амбулаторном этапе.
Тем не менее при СДКА не всегда удается выявить предрасполагающий фактор, что свидетельствует о сложной и не до конца изученной природе заболевания. Среди таких факторов описан ряд состояний: сосудистая патология (наиболее часто — фибромускулярная дисплазия), несколько реже — другие наследственные заболевания соединительной ткани, системные воспалительные заболевания, мигрень, заболевания щитовидной железы. СДКА может быть начальным проявлением основного заболевания соединительной ткани, в связи с чем ряд авторов предлагает включить в диагностический алгоритм СДКА обследование для выявления системных заболеваний [10]. В качестве провоцирующих факторов известна физическая нагрузка и психоэмоциональный стресс. В последние годы генетическая предрасположенность к СДКА также рассматривается в качестве предрасполагающего фактора [3]. В связи с этим пациентам с СДКА необходимо наблюдение и дообследование для выявления причины заболевания.
Тактика ведения пациентов с СДКА преимущественно основана на консенсусе экспертов, поскольку нет данных рандомизированных клинических исследований, которые определяли бы специфическое лечение данной патологии. Пациенты после проведенного стентирования должны получать двойную антитромбоцитарную терапию, а пациенты с систолической дисфункцией ЛЖ — бета-адреноблокаторы и ингибиторы ангиотензинпревращающего фермента или блокаторы ангиотензиновых рецепторов в соответствии с клиническими рекомендациями [10].
Согласно современным клиническим рекомендациям, чрескожное коронарное вмешательство при СДКА показано при сохранении симптомов и признаков продолжающейся ишемии миокарда, большой площади повреждения миокарда, и сниженным кровотоком в коронарных артериях [10]. Выбор хирургической тактики в первом клиническом случае обусловлен рецидивирующим болевым синдромом, наличием клинических и лабораторных признаков продолжающейся ишемии миокарда. В соответствии с клиническими рекомендациями, пациентке в связи с ИМ и выполненным стентированием была назначена двойная антиагрегантная терапия, а также ингибиторы ангиотензинпревращающего фермента и бета-адреноблокаторы. С учетом дислипидемии инициирована терапия статинами. В связи с абсолютными показаниями к приему препаратов, несовместимых с лактацией, было принято решение о подавлении лактации.
У пациентов с СДКА после стентирования коронарных артерий необходимость назначения двойной антиагрегантной терапии не вызывает сомнений. Однако в случае выбора консервативной тактики при ОКС, вызванном диссекцией, тактика ведения определяется индивидуально. Учитывая риск расширения интрамуральной гематомы на фоне применения антитромбоцитарных препаратов, отсутствие долгосрочной пользы и более высокий риск кровотечений, рассматривается возможность деэскалации антитромбоцитарной терапии. Длительная антиагрегантная терапия может быть продолжена у пациентов с другими убедительными показаниями, в частности при наличии атеросклероза при визуализации сосудов [10][11].
Применение бета-адреноблокаторов было ассоциировано с более низким риском повторной СДКА в наблюдательном исследовании, проведенном в одном центре, однако эта связь не была подтверждена в других когортах. Учитывая клиническую пользу при ОКС атеросклеротического генеза, применение бета-адреноблокаторов после СДКА целесообразно, если они хорошо переносятся. Влияние статинов на рецидивы СДКА не было доказано в клинических исследованиях, и они рекомендуются только для лечения дислипидемии [11].
Во втором клиническом случае выбрана консервативная тактика. По результатам консилиума в связи с отсутствием атеросклеротического поражения коронарных артерий двойная антитромботическая терапия была завершена на стационарном этапе, амбулаторно рекомендовано продолжить монотерапию ацетилсалициловой кислотой.
Заключение
СДКА — редкая причина ОКС. Она рассматривается как причина ОКС у женщин, преимущественно молодого возраста без факторов риска развития атеросклероза. СДКА следует учитывать при дифференциальной диагностике ОКС в этой популяции.
Этиология и патогенез заболевания остаются неопределенными. Предполагается, что в основе СДКА лежат предшествующие поражения артерий, на фоне которых они становятся уязвимыми для диссекции. Показана роль в развитии СДКА ряда факторов, в т. ч. женского пола, беременности, гормональных изменений, системных заболеваний соединительной ткани.
Тактика ведения пациентов с СДКА не изучалась в рандомизированных исследованиях. Рекомендации сопоставимы с лечением пациентов с ОКС на фоне атеросклероза, хотя в основе этих двух похожих по симптомам и проявлениям состояний лежат разные патофизиологические механизмы. С учетом многообразия клинических вариантов СДКА, тактика ведения определяется индивидуально с учетом особенностей пациента и течения заболевания.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Недбаева Д.Н., Асеева А.С., Жидулева Е.В., Минеева Е.В., Яковлев А.Н., Кухарчик Г.А. Особенности течения острого коронарного синдрома вследствие спонтанной диссекции коронарных артерий у женщин: серия случаев. Российский кардиологический журнал. 2024;29(3S):5982. https://doi.org/10.15829/1560-4071-2024-5982. EDN: NBTKTE
Скопировать