Определение значимости ряда биомаркеров в периоперационном периоде при реконструктивных вмешательствах на грудном отделе аорты
Аннотация
Цель. Оценка связи уровня биомаркеров с развитием послеоперационных осложнений у больных после реконструктивных операций на грудном и торакоабдоминальном отделах аорты.
Материал и методы. В исследование вошли 132 пациента. Большая часть оперированы на восходящем отделе аорты и дуге аорты (65 и 57, соответственно). Определение концентрации проадреномедуллина, пресепсина (ПСП), прокальцитонина, тропонина I, N-концевого промозгового натрийуретического пептида осуществляли перед вводной анестезией, в конце операции и через 6 ч после окончания оперативного вмешательства.
Результаты. Осложнённое течение послеоперационного периода наблюдалось у 69 пациентов. Было отмечено преобладание воспалительных (27,3%) и сердечно-сосудистых (12,1%) осложнений. В конце операции уровни биомаркеров у пациентов без осложнений и с осложнённым течением послеоперационного периода составляли для ПСП 326 [206; 451] и 620 [332; 829], p<0,00001, тропонина I 0,77 [0,46; 1,39] и 1,49 [0,59; 3,39], p=0,01, проадреномедуллина 0,894 [0,683; 1,221] и 1,201 [0,944; 1,762], p=0,0002, прокальцитонина 0,206 [0,147; 0,452] и 0,563 [0,307; 2,107], p=0,0002, соответственно. По результатам лог-линейной регрессии уровни ПСП в конце операции >459,5 (отношение шансов (ОШ) 6,84, 95% доверительный интервал (ДИ): 3,14-14,87) или проадреномедуллина >0,788 (ОШ 5,47, 95% ДИ: 1,52-19,68) ассоциируются с повышением риска развития осложнений. ПСП >519,5 пг/мл в конце операции (ОШ 4,55, 95% ДИ: 1,97-10,47) связан с повышенным риском развития воспалительных осложнений. Относительно прогноза риска продленной инфузии кардиотонических препаратов пороговые значения для тропонина I составили в конце операции >1,04 (чувствительность 75%, специфичность 71,3%, AUC 0,785), через 6 ч после операции >1,57 (чувствительность 81,3%, специфичность 71,6%, AUC 0,794).
Заключение. Высокие уровни ПСП в конце операции могут быть полезны для прогноза развития осложнений в послеоперационном периоде у больных после вмешательств на аорте, однако невысокие уровни ПСП не исключают возможность развития осложнений. Повышение уровня тропонина I в конце операции и через 6 ч после операции может быть предиктором потребности в кардиотонической поддержке в послеоперационном периоде.
За последнее десятилетие уровень кардиохирургической помощи значительно возрос, выполняются сложные сочетанные оперативные вмешательства у пациентов с тяжелыми сердечно-сосудистыми и другими сопутствующими заболеваниями. Это возможно благодаря совершенствованию предоперационной подготовки, хирургической техники, анестезиологического обеспечения и лечения пациентов в послеоперационном периоде. Несмотря на современные достижения анестезиологии-реаниматологии и хирургической техники, летальность (в течение 30 дней после операции) у всех кардиохирургических больных по-прежнему составляет ~3% [1].
Прогнозирование продолжительности пребывания в отделении интенсивной терапии и исхода после кардиохирургических операций в настоящее время основано на клинических параметрах, имеющихся заболеваниях различных систем органов и их тяжести (Parsonnet model, EuroSCORE II и т.д.). Кардиохирургические операции включают применение искусственного кровообращения, которое активирует различные пути системного воспалительного ответа организма, чему также способствует обширная хирургическая травма. Системная воспалительная реакция характеризуется системными нарушениями ряда естественных защитных механизмов организма от травм и инфекций: фибринолиза, коагуляции, активации комплемента, активации иммунных клеток, и окислительный стресс в дополнение к воспалению. Повреждение органов-мишеней возникает в результате взаимодействия активированных защитных систем пациента с повреждением региональной стенки сосуда либо из-за физической травмы, либо из-за ишемии/реперфузии [2].
С целью улучшения клинических результатов и снижения смертности в кардиохирургической популяции пациентов для улучшения качества моделей прогнозирования исследуются новые биомаркеры. В частности, пресепсин (ПСП) и прокальцитонин имеют сравнимую прогностическую ценность в отношении неблагоприятных почечных, сердечно-сосудистых и респираторных исходов у кардиохирургических пациентов. Кроме того, ПСП обладает прогностической ценностью в отношении внутрибольничной, 30-дневной и 6-мес. смертности [3], а также высоко эффективен для ранней диагностики сепсиса у пациентов отделения реанимации и интенсивной терапии [4]. Некоторые биомаркеры рутинно используются в кардиохирургии, в т.ч. в предоперационной оценке, например, тропонины и мозговые натрийуретические пептиды [5][6], в то время как другие все еще находятся в стадии исследования.
В качестве маркера сердечно-сосудистого повреждения в настоящее время широко используются кардиоспецифические тропонины (cTnI, cTnT), локализованные преимущественно в миокарде [7]. Маркеры могут отражать повреждение кардиомиоцитов не только при возникновении необратимых патологических состояний (инфаркт миокарда), но и потенциально обратимых (повреждение миокарда в результате ишемии-реперфузии, механического воздействия во время операции, сепсиса, острой почечной недостаточности и других процессов) патофизиологических механизмов [8].
Адреномедуллин (ADM) экспрессируется во многих системах органов, включая сердечно-сосудистую, почечную, легочную, цереброваскулярную, желудочно-кишечную и эндокринную [9]. ADM воздействует на сердечно-сосудистую систему, вызывая вазодилатацию, натрийурез и ингибирование выработки альдостерона, тем самым обеспечивая общую оптимизацию сердечной преднагрузки [10]. Было обнаружено, что ADM предоставляет прогностическую информацию при сердечной недостаточности (СН) [9]. К сожалению, пептид ADM нестабилен и не подходит для клинического применения. Однако MR-proADM, белковый фрагмент, отражающий уровни ADM в кровотоке, оказался стабильным и пригодным для клинического применения [11].
Цель исследования: оценка связи уровня биомаркеров с развитием послеоперационных осложнений у больных поcле реконструктивных операций на грудном и торакоабдоминальном отделах аорты.
Материал и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской Декларации. Протокол исследования был одобрен Этическими комитетом ФГБНУ «Российский научный центр хирургии им. Б. В. Петровского». До включения в исследование у всех участников было получено письменное информированное согласие. Исследование зарегистрировано в ресурсе ClinicalTrials.gov. NCT04689139 Protocol ID039420200002.
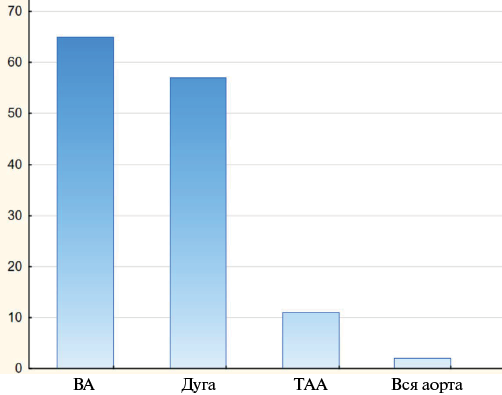
В проспективное нерандомизированное когортное исследование вошли 132 пациента, которым выполнена реконструктивно-восстановительная операция на грудном отделе аорты (рис. 1). В спектре оперативных вмешательств отмечается преобладание реконструкции восходящего отдела аорты.
Критерии включения: возраст 18-75 лет, реконструктивные операции при аневризмах грудного и/или торакоабдоминального отдела аорты.
Критерии исключения: невозможность анализа хотя бы одной из трех проб пациента из-за преаналитических погрешностей (гемолиз).
Забор крови с целью определения концентрации биомаркеров осуществлялся на трёх последовательных этапах:
- Перед вводной анестезией;
- Конец операции;
- 6 ч после окончания оперативного вмешательства.
Пациенты, вошедшие в исследование, были оперированы по поводу аневризмы/расслоения восходящей, дуги и/или торакоабдоминального отдела аорты (табл. 1). Антропометрические данные представлены в таблице 2. Исходно большая часть пациентов имела сохранную фракцию выброса левого желудочка, увеличенный конечно-диастолический объём левого желудочка. В сопутствующей патологии превалировала артериальная гипертензия, хроническая болезнь почек, ишемическая болезнь сердца, нарушения ритма в форме фибрилляции предсердий и другие нозологии (табл. 3).
Для сбора интраоперационных данных была использована уникальная научная установка «Коллекция электронных карт анестезии кардиохирургических больных РНЦХ им. акад. Б. В. Петровского»1.
До операции больные получали премедикацию препаратами из группы бензодиазепинов (сибазон 10 мг в/м или алпразолам 0,25-0,5 мг перорально) накануне операции и опиоидами (тримеперидин 20 мг в/м), блокаторами H1-гистаминовых рецепторов (хлоропирамина гидрохлорид 20 мг в/м). Вводная анестезия проводилась с использованием пропофола 2,0-2,5 мг/кг, фентанила 2-3 мкг/кг и цисатракурия безилата 0,15 мг/кг. Анестезия поддерживалась ингаляцией севофлурана 0,7-1,0 МАС и фентанилом с помощью перфузора в дозировке 2-3 мкг/кг?ч. Миоплегия поддерживалась непрерывной инфузией цисатракурия безилата со скоростью 0,06-0,1 мг/кг?ч.
Мониторинг включал в себя: электрокардиографию 7 отведений (I, II, III, avL, avR, avF, V5), инвазивное артериальное давление, центральное венозное давление, пульсоксиметрию и капнографию. Оперативные вмешательства на дуге аорты проводились в условиях циркуляторного ареста с целевой температурой 27? C, селективной моно- и/или бисферальной антеградной перфузией головной мозга с контролем объёмной скорости перфузии (8-12 мл/кг) по данным транскраниальной допплерографии и церебральной оксиметрии. Операции на торакоабдоминальном отделе аорты проводились в условиях селективной перфузии почечных, верхнебрыжеечной артерии, чревного ствола. В интра- и послеоперационном периоде проводился постоянный мониторинг давления спинномозговой жидкости с целевыми показателями 8-12 мм рт.ст.
Согласно протоколу, период наблюдения и сбора информации в рамках данного исследования составлял 10 дней или до выписки из стационара, в зависимости от того, какое событие наступит раньше.
Критериями включения тех или иных биомаркеров в исследование служили: наличие технической возможности определения концентрации биомаркера и время оборота теста (turnaround time) не >40 мин. Таким образом, в исследование были включены следующие показатели:
- прокальцитонин, ПСП — биомаркеры воспаления,
- проадреномедуллин — маркер органной дисфункции,
- тропонин I TnI-hs — маркер повреждения миокарда,
- N-концевой промозговой натрийуретический пептид (NT-proBNP) — маркер СН.
Определение концентраций прокальцитонина и проадреномедуллина выполнялось на анализаторе Kryptor Compact Plus (Thermo Fisher Scientific), тропонина I, NT-proBNP, ПСП — на анализаторе PATHFAST (LSI Medience Corporation).
Статистическая обработка данных проведена с помощью программы «Statistica 10 for Windows». Параметры были проверены на нормальность распределения с учетом критерия хи-квадрат. Сравнительный анализ выполнен с помощью t-критерия Стьюдента или Манна-Уитни в зависимости от результатов предшествующей проверки на нормальность. Значимые различия между группами принимались при значении p<0,05. Поиск предикторов развития осложнений в послеоперационном периоде осуществлен с помощью лог линейной регрессии, ROC-анализа, коэффициенты логистической регрессии использованы для оценки отношений шансов (ОШ) для каждой зависимой переменной модели. Для выявления влияния множества номинальных и неноминальных значений на количественный отклик биомаркеров выполнен регрессионный анализ.

Рис. 1. Виды оперативных вмешательств.
Сокращения: ВА — восходящая аорта, ТАА — торакоабдоминальная аорта.
Таблица 1
Исходная патология
|
Патология |
Все пациенты (n=132) |
|
Аортальная недостаточность 3 степени, n (%) |
32 (24%) |
|
Аортальная недостаточность 4 степени, n (%) |
8 (6%) |
|
Стеноз аортального клапана 3 степени, n (%) |
15 (11%) |
|
Стеноз аортального клапана 4 степени, n (%) |
5 (4%) |
|
Митральная недостаточность 3 степени, n (%) |
5 (4%) |
|
Митральная недостаточность 4 степени, n (%) |
1 (1%) |
|
Аневризма восходящей аорты, n (%) |
66 (50%) |
|
Аневризма дуги аорты, n (%) |
21 (16%) |
|
Аневризма корня аорты, n (%) |
44 (33%) |
|
Синдром соединительно-тканной дисплазии, n (%) |
17 (13%) |
|
Торакоабдоминальная аневризма аорты, n (%) |
27 (20%) |
|
Расслоение аорты 1 типа, n (%) |
20 (15%) |
|
Расслоение аорты 2 типа, n (%) |
6 (5%) |
|
Расслоение аорты 3 типа, n (%) |
13 (10%) |
|
Расслоение аорты ни А, ни B типа, n (%) |
3 (2%) |
|
Тромбоз восходящего отдела, дуги аорты, n (%) |
1 (1%) |
Таблица 2
Антропометрические данные пациентов, M±SD
|
Показатель |
Значение (n=132) |
|
Женщины, n (%) |
45 (34%) |
|
Мужчины, n (%) |
87 (66%) |
|
Возраст, лет |
56±13 |
|
Рост, см |
174±14 |
|
Вес, кг |
86±20 |
|
Площадь поверхности тела, м2 |
2±0,22 |
Таблица 3
Сопутствующие заболевания и данные трансторакальной эхокардиографии, M±SD
|
Показатель |
Все пациенты (n=132) |
|
ФВ ЛЖ, ? |
57±7,6 |
|
КДО ЛЖ, мл |
171±88 |
|
ХСН ФК по NYHA 3, n (%) |
9 (7%) |
|
ХСН ФК по NYHA 4, n (%) |
2 (2%) |
|
ХОБЛ, n (%) |
14 (11%) |
|
ЦВБ, n (%) |
18 (14%) |
|
СД, n (%) |
7 (5%) |
|
ХБП С2, n (%) |
16 (12%) |
|
ХБП С3, n (%) |
21 (16%) |
|
ХБП С4, n (%) |
2 (2%) |
|
Постоянная форма ФП, n (%) |
9 (7%) |
|
Пароксизмальная форма ФП, n (%) |
17 (13%) |
|
ОНМК в анамнезе, n (%) |
9 (7%) |
|
Синдром Лериша, n (%) |
6 (5%) |
|
Гипертоническая болезнь 3 стадии, n (%) |
64 (48%) |
|
ИБС, n (%) |
27 (20%) |
|
ВБВНК, n (%) |
15 (11%) |
|
Повторная кардиохирургическая операция, n (%) |
16 (12%) |
|
Наследственная тромбофилия, n (%) |
1 (1%) |
|
Полиорганная недостаточность, n (%) |
5 (4%) |
|
ЖДА, n (%) |
5 (4%) |
|
Ожирение 1 степени, n (%) |
13 (10%) |
|
Ожирение 2 степени, n (%) |
7 (5%) |
|
Ожирение 3 степени, n (%) |
3 (2%) |
Сокращения: ВБВНК — варикозная болезнь вен нижних конечностей, ЖДА — железодефицитная анемия, ИБС — ишемическая болезнь сердца, КДО ЛЖ — конечно-диастолический объём левого желудочка, ОНМК — острое нарушение мозгового кровообращения, СД — сахарный диабет, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь лёгких, ХСН ФК по NYHA — хроническая сердечная недостаточность по функциональной классификации Нью-Йоркской ассоциации сердца, ЦВБ — цереброваскулярная болезнь.
Результаты
Осложненное течение (наличие хотя бы одного из нижеперечисленных осложнений) послеоперационного периода наблюдалось у 69 пациентов из 132 (рис. 2).
Критерий увеличения потребности в кардиотонической поддержке — потребность в инфузии допамина/добутрекса >3 мкг/кг?мин и/или длительностью >24 ч с момента операции. Критерий сосудистой недостаточности — потребность в инфузии норадреналина >150 нг/кг?мин и/или длительность введения >24 ч с момента операции, острой почечной недостаточности — увеличение содержания креатинина в сыворотке ?26,5 мкмоль/л в течение 48 ч, увеличение сывороточного креатинина в ?1,5 раза по сравнению с предыдущими 7 днями, объём мочи <0,5 мл/кг?ч в течение 6 ч.
По результатам сравнительного анализа между группами с неосложненным и осложненным послеоперационным периодом на этапе «перед вводной анестезией» выявлены статистически значимые различия только для концентраций ПСП (рис. 3), при этом для группы пациентов с осложненным течением послеоперационного периода характерны статистически более высокие уровни ПСП.
На этапах «конец операции» и «6 ч после окончания оперативного вмешательства» для пациентов с осложненным течением послеоперационного периода характерны более высокие значения ПСП, тропонина I, прокальцитонина и проадреномедуллина (рис. 4).
Для поиска возможных предикторов использовался анализ лог-линейной регрессии, по результатам которого получено, что только повышенные уровни проадреномедуллина в конце операции ассоциируются с повышением риска развития осложненного течения послеоперационного периода (ОШ 6,23, 95% ДИ: 1,78-21,86).
С целью нахождения уровня проадреномедуллина, наиболее эффективно (с максимально возможной одновременно чувствительностью и специфичностью) позволяющего разделять группы пациентов с осложненным и неосложненным послеоперационным периодом был использован ROC-анализ. Получено, что оптимальный уровень cut-off для проадреномедуллина в конце операции составляет 0,788 (чувствительность 43,75%, специфичность 88,89%). Концентрации проадреномедуллина в конце операции >0,788 ассоциируются с повышением риска развития осложненного течения послеоперационного периода (ОШ 5,47, 95% ДИ: 1,52-19,68).
При анализе результатов определения ПСП отмечено, что для группы пациентов с осложненным течением послеоперационного периода хоть и характерны статистически более высокие уровни ПСП, но в то же время низкие значения ПСП не позволяют с достаточной уверенностью исключать развитие осложнений.
Вероятнее всего данная особенность распределения концентраций ПСП в группах пациентов с нормальным и осложненным послеоперационным периодом послужила причиной тому, что, согласно результатам лог-линейной регрессии, повышение уровня ПСП в конце операции не ассоциируется с увеличением риска развития осложненного течения послеоперационного периода.
В то же время по характеру распределения концентраций ПСП в конце операций было замечено, что для осложненного течения послеоперационного периода характерны такие высокие значения данного биомаркера, которые не встречались у пациентов с неосложненным течением послеоперационного периода. Этот факт позволил нам предположить, что, возможно, повышенные уровни ПСП могут ассоциироваться с повышением риска развития осложнений в послеоперационном периоде, однако низкие или незначительно повышенные уровни ПСП не позволяют исключать развитие осложнений.
Согласно результатам ROC-анализа, наиболее приемлемым уровнем cut-off для ПСП в конце операции составляет 459,5 (чувствительность 68,1%, специфичность 76,2%). Уровень ПСП в конце операции >459,5 ассоциируются с повышением риска развития осложненного течения послеоперационного периода (ОШ 6,84, 95% ДИ: 3,14-14,87) (рис. 5).
Что касается концентраций ПСП через 6 ч после операции, то замеченная тенденция в данном промежутке времени уже не выполнялась. Для данного периода времени, несмотря на то, что для группы пациентов с осложненным послеоперационным периодом были характерны статистически достоверно более высокие значения ПСП, значения ПСП в целом настолько были разнородными, что выявить предиктор не представилось возможности.
Таким образом, высокие уровни ПСП (>459,5) в конце операции могут быть полезны в плане прогноза развития осложнений в послеоперационном периоде у больных после вмешательств на аорте, но в то же время невысокие уровни ПСП в конце операции не могут исключать развитие осложнений в послеоперационном периоде у данных больных, что необходимо учитывать при интерпретации результатов данного биомаркера в послеоперационном периоде.
Воспалительные осложнения в послеоперационном периоде наблюдались у 36 пациентов из 132. Из них:
- пневмония — 29;
- раневая инфекция — 7;
- медиастинит — 3;
- сепсис — 5.
По результатам сравнительного анализа наиболее подходящим биомаркером для прогнозирования развития воспалительных осложнений в послеоперационном периоде является уровень ПСП в конце операции (рис. 6). Для группы с развитием воспалительных осложнений в послеоперационном периоде характерны более высокие значения ПСП (медиана значений в группе с нормальным течением 372,5, разброс 119-2173 и медиана значений в группе с осложненным течением — 668,5, разброс 157-2531, p=0,0029). С помощью ROC-анализа получено, что наиболее приемлемым пороговым значением биомаркера является уровень 519,5 пг/мл (чувствительность 69,4%, специфичность 66,7%, площадь под ROC-кривой (AUC) 0,669, 95% ДИ: 0,563-0,775), выше которого риск развития воспалительных осложнений повышен (ОШ 4,55, 95% ДИ: 1,97-10,47) при сохранении, однако, утверждения, что низкие или незначительно повышенные уровни ПСП не позволяют исключать развитие осложнений.
Высокая потребность в инфузии кардиотонических препаратов, косвенно свидетельствующая о СН, наблюдалась у 16 пациентов из 132. Сравнительный анализ очертил круг возможных предикторов — уровни NT-proBNP до операции, в конце операции и через 6 ч после операции, уровни тропонина I в конце операции и через 6 ч после операции (рис. 7). Однако по результатам лог-линейной регрессии было получено, что только повышение уровней тропонина после операции и через 6 ч после операции могут быть предикторами потребности продленной инфузии кардиотонических препаратов в послеоперационном периоде (ОШ 1,53, 95% ДИ: 1,15-2,04 и ОШ 1,23, 95% ДИ: 1,08-1,40, соответственно).
С помощью ROC анализа были определены оптимальные уровни cut-off для тропонина I (рис. 8):
- в конце операции >1,04 (чувствительность 75%, специфичность 71,3%, AUC 0,785),
- через 6 ч после операции >1,565 (чувствительность 81,3%, специфичность 71,6%, AUC 0,794).
Согласно результатам анализа лог-линейной регрессии риск высокой потребности продленной инфузии кардиотонических препаратов в послеоперационном периоде ассоциируется с повышением тропонина >1,04 в конце операции (ОШ 7,45, 95%, ДИ: 2,22-25,07) и уровнем тропонина >1,565 (ОШ 10,90, 95%, ДИ: 2,88-41,25) через 6 ч после оперативного вмешательства.

Рис. 2. Спектр осложнений (n=69).

Рис. 3. Исходные значения ПСП.
Примечание: * — p<0,01.

Рис. 4. Динамика маркеров и течение послеоперационного периода.
Сокращение: п/о — послеоперационный.

Рис. 5. ROC-анализ ПСП в конце операции и риск осложнений.

Рис. 6. Уровень ПСП в конце операции у пациентов с воспалительными осложнениями.
Примечание: * — p<0,01, 1 — осложнённый послеоперационный период, 2 — неосложнённый послеоперационный период.

Рис. 7. Маркеры и продленная инфузия кардиотонических препаратов в послеоперационном периоде.
Сокращение: п/о — послеоперационный.

Рис. 8. Roc-анализ для Тропонина I.
Обсуждение
Идеальный индикатор биологических процессов в современных клинических условиях должен обладать достаточной чувствительностью и специфичностью, быть информативным, доступным, воспроизводимым и своевременным, поскольку динамика показателя может использоваться не только для прогнозирования неблагоприятных событий в периоперационном периоде, но и для контроля проводимого лечения. В данном исследовании используются как биомаркеры, давно использующиеся в рутинной практике, так и относительно новые пептиды, применение которых в прогнозировании послеоперационных осложнений может быть достаточно перспективным (ПСП). Мы использовали проадреномедуллин, как маркер органной дисфункции, ПСП, прокальцитонин, как маркеры воспаления, тропонин I — индикатор повреждения миокарда, NT-proBNP — показатель СН. Концепция комплексной оценки биомаркеров, которая была использована в настоящем исследовании, согласуется с работами других авторов. В частности, Вершининой М. Г. и др. [4] было показано преимущество использования комбинации биомаркеров (наиболее эффективна модель с использованием ПСП и проадреномедуллина) для ранней диагностики сепсиса у пациентов отделения реанимации и интенсивной терапии в критическом состоянии.
Стоит отметить, что большая часть работ, посвященных прогностической значимости биомаркеров в кардиохирургии, сделаны в хирургии клапанной патологии и/или при реваскуляризации миокарда. В работе Clementi A, et al. была показана высокая прогностическая ценность ПСП и прокальцитонина для оценки послеоперационных почечных, сердечно-сосудистых и дыхательных осложнений. ПСП также был эффективен для прогнозирования внутрибольничной, 30-дневной и 6-мес. летальности [3].
Несмотря на значимость проблемы реконструктивных операций на грудном и торакоабдоминальном отделе аорты, публикации по применению биомаркеров для прогноза периоперационных осложнений носят единичный характер.
В нашем исследовании до основного этапа оперативного вмешательства были выявлены значимые различия только у ПСП. Однако даже при наличии статистически достоверных различий, значения концентраций данного биомаркера настолько пересекались как в области высоких значений, так и в области нормальных значений, что использовать данный показатель для прогнозирования развития воспалительных осложнений не представилось возможным.
Также представляется интересной выявленная закономерность, что для осложненного течения послеоперационного периода характерны такие высокие значения данного биомаркера, которые не встречались у пациентов с неосложненным течением послеоперационного периода. Этот факт позволил нам предположить и далее доказать, что повышенные уровни ПСП в конце операции ассоциируются с повышением риска развития осложнений в послеоперационном периоде, однако низкие или незначительно повышенные уровни ПСП не позволяют исключать развитие осложнений. Выявленную особенность необходимо учитывать при интерпретации результатов исследования ПСП: высокие уровни ПСП (>459,5 пг/мл) в конце операции могут быть полезны в плане прогноза развития осложнений в послеоперационном периоде у больных после вмешательств на аорте, но в то же время невысокие уровни ПСП в конце операции не могут исключать развитие осложнений.
Относительно прогнозирования воспалительных осложнений было обнаружено, что по результатам сравнительного анализа наиболее подходящим биомаркером для прогнозирования развития воспалительных осложнений в послеоперационном периоде является уровень ПСП в конце операции. Однако в характере распределений значений ПСП в анализируемых группах также отмечалось то, что даже при наличии статистически достоверных различий, значения пересекались как в области высоких значений, так и в области нормальных значений, и, согласно результатам анализа лог-линейной регрессии, повышение уровня ПСП не ассоциируется с увеличением риска развития осложненного течения послеоперационного периода.
Установлено, что наиболее приемлемым пороговым значением биомаркера является уровень 519,5 пг/мл (чувствительность 69,4%, специфичность 66,7%, AUC 0,669, 95% ДИ: 0,563-0,775), выше которого риск развития воспалительных осложнений повышен (ОШ 6,84, 95% ДИ: 3,14-14,87), но в то же время невысокие уровни ПСП в конце операции (<519,5 пг/мл) не могут исключать развитие осложнений.
В ходе изучения динамики изменения уровней анализируемых биомаркеров получено, что к предикторам развития воспалительных осложнений можно также отнести вспомогательные расчетные параметры, отражающие динамику изменений ПСП.
Увеличение уровня ПСП за время операции в 2 и более раз ассоциируется с повышением риска развития осложненного течения послеоперационного периода (ОШ 3,05, 95% ДИ: 1,34-6,95). Отсутствие нарастания уровня ПСП за первые 6 ч после операции ассоциируется с повышением риска развития осложненного течения послеоперационного периода (ОШ 4,15, 95% ДИ: 1,83-9,41). Сочетание же этих двух факторов риска — уровень ПСП в конце операции >519,5 пг/мл и отсутствие нарастания уровня ПСП за первые 6 ч после операции — ассоциируется с повышением риска развития осложненного течения послеоперационного периода (ОШ 5,80, 95% ДИ: 2,19-15,35).
Таким образом, для прогнозирования развития воспалительных осложнений в послеоперационном периоде целесообразно использовать не только абсолютные значения ПСП в конце операции, но и исследование динамики этого показателя.
Высокочувствительный тропонин I хорошо зарекомендовал себя в диагностике не столько инфаркта миокарда, сколько сердечно-сосудистого повреждения [12]. Он является независимым предиктором послеоперационных осложнений и летальности у пациентов с острым расслоением аорты, а у пациентов с исходно повышенным значением маркера наблюдалось большее количество сердечно-сосудистых осложнений [13]. В связи с этим тропонин I имеет некоторое преимущество перед классическими шкалами оценки (EuroSCORE, VA) у кардиохирургических пациентов [14].
В хирургии аорты диагностика миокардиального повреждения особенно важна, поскольку инфаркт миокарда в периоперационном периоде диагностируется достаточно редко. В нашем исследовании он выявлен всего у 5 (3,8%) пациентов, в то время как потребность в кардиотонической и вазопрессорной поддержке у 16 (12,1%) и 14 (10,6%), соответственно. Оценка уровня тропонина I во время операции позволит ускорить начало инотропной поддержки, поскольку чаще всего повреждение миокарда при операциях на грудном отделе аорты носит субклинический характер и вызвано опосредованными причинами (циркуляторный арест, синдром ишемии-реперфузии и другие факторы).
Стоит также отметить, что в публикациях, посвященных динамике высокочувствительного тропонина I у кардиохирургических пациентов, подчеркивается значительный вклад вида оперативного вмешательства. В работе Mastro F, et al. были обследованы пациенты, которым выполнялись вмешательства на митральном, аортальном клапанах, грудном отделе аорты, реваскуляризация миокарда и комбинированные операции. Максимальный рост показателя был отмечен у пациентов, оперированных на митральном клапане, а также после комбинированных операций [15]. Данные факты могут иметь значение при интерпретации результатов лабораторных исследований и принятии клинических решений в послеоперационном периоде.
Ограничением нашего исследования является то, что результаты распространяются на пациентов, которым выполняли реконструктивно-восстановительные вмешательства на грудном и торакоабдоминальном отделе аорты. В работу вошли 132 пациента, что также является одним из ограничений данного исследования. Для расширения применения данных биомаркеров в качестве предикторов осложнений у других категорий пациентов потребуются дальнейшие исследования.
Заключение
- Высокие уровни ПСП в конце операции могут быть полезны для прогноза развития осложнений в послеоперационном периоде у больных после вмешательств на аорте, однако невысокие уровни ПСП не исключают возможность развития осложнений.
- ПСП показал большую информативность в прогнозе осложнений в целом, чем именно воспалительных осложнений.
- Повышение уровня тропонина I после операции и через 6 ч после операции может быть предиктором потребности в кардиотонической поддержке в послеоперационном периоде.
Благодарности. Авторы выражают признательность сестрам и врачам отделения анестезиологии и реанимации II ФГБНУ «РНЦХ им. акад. Б. В. Петровского», осуществлявшим помощь в наборе материала.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Уникальная научная установка «Коллекция электронных карт анестезии кардиохирургических больных РНЦХ им. акад. Б. В. Петровского» ФГБНУ «Российский научный центр хирургии имени академика Б. В. Петровского» (г. Москва), руководитель УНУ: Аксельрод Б. А., д.м.н., профессор РАН, https://med.ru/ru/unikalnaa-naucnaa-ustanovka.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Аксельрод Б.А., Дымова О.В., Губко А.В., Краснощёкова А.П., Гуськов Д.А., Гончарова А.В., Гладышева В.Г., Губко К.В., Кулинченко О.С. Определение значимости ряда биомаркеров в периоперационном периоде при реконструктивных вмешательствах на грудном отделе аорты. Российский кардиологический журнал. 2023;28(2S):5314. https://doi.org/10.15829/1560-4071-2023-5314
Скопировать