Неблагоприятное воздействие внутрисердечной диссинхронии и стимуляции правого желудочка на сократительную функцию и прогноз
Аннотация
Пейсмейкер-индуцированная кардиомиопатия (ПИКМ) является осложнением частой правожелудочковой стимуляции, которое в большинстве работ расценивается как снижение фракции выброса (ФВ) левого желудочка (ЛЖ) на фоне постоянной правожелудочковой стимуляции, однако недостаточно описаны случаи возникновения ПИКМ с сохраненной ФВ ЛЖ, т.к. в начале состояния чаще всего протекает как фенотип хронической сердечной недостаточности с сохраненной ФВ ЛЖ. В работе проведен анализ выполненных исследований о роли постоянной правожелудочковой стимуляции и ее вкладе в развитии ПИКМ.
В настоящее время можно выделить две причины диссинхронии, которые ведут к снижению систолической функции левого желудочка (ЛЖ): естественную (блокада проведения ножек пучка Гиса, среди которых основное место занимает блокада левой ножки) и артифициальную (правожелудочковая стимуляция, которая имитирует блокаду проведения по типу полной блокады левой ножки пучка Гиса (ПБЛНПГ)).
Диссинхрония на фоне ПБЛНПГ была описана на электрокардиограмме более ста лет назад [1], но сейчас интерес к данному электрокардиографическому феномену возрастает. Еще в XXв впервые был предложен термин кардиомиопатии, индуцированной ПБЛНПГ, в связи с чем мы можем рассматривать ПБЛНПГ не только как патофизиологический фактор развития кардиомиопатии, но и как этиологический [2-5].
До появления классической постоянной брадистимуляции интерес к диссинхронии как причине хронической сердечной недостаточности (ХСН) был невелик. Однако с появлением постоянной электрокардиостимуляции и распространением данной методики в виде стандарта оказания медицинской помощи стало более очевидно, что одной из наиболее актуальных причин развития ХСН является нарушение синхронности и скорости возбуждения стенок ЛЖ. Это было обусловлено артифициальным эффектом правожелудочковой эндокардиальной стимуляции, которая была наиболее удобной для решения задач остро возникших брадиаритмий. В современных реалиях в мире имплантируется большое количество электрокардиостимуляторов в связи с отсутствием альтернативного их лечения, соответственно тема «артифициальной» диссинхронии стала крайне актуальна из-за переосмысления ее роли как этиологического фактора ХСН. Важно отметить, что паттерн комплекса QRS при стимуляции правого желудочка (ПЖ) схож с паттерном ПБЛНПГ. Нельзя не отметить, что проводились эксперименты на животных и исследования с участием человека, где в связи с брадиаритмиями имплантировался электрокардиостимулятор (ЭКС) и проводилась постоянная правожелудочковая стимуляция, соответственно искусственно создавалась модель диссинхронии, как и при ПБЛНПГ. По результатам исследований было отмечено, что высокий процент стимулированных комплексов приводил к незамедлительному появлению радиальной диссинхронии и уменьшению систолического продольного укорочения ЛЖ. Уменьшается также и фракция выброса (ФВ) ЛЖ в связи с уменьшением конечного диастолического диаметра и объема ЛЖ, при этом конечный систолический диаметр ЛЖ остается неизменным [6]. Учитывая все вышеперечисленное, можно сделать вывод, что постоянная правожелудочковая стимуляция является этиологическим фактором развития ХСН и определяется термином пейсмейкер-индуцированная кардиомиопатия (ПИКМ).
В данном обзоре мы постарались объединить имеющиеся данные об эпидемиологии, генезе и факторах риска развития ПИКМ, понимая, что во многом все эти аспекты будут схожи или даже идентичны для пациентов с кардиомиопатией, индуцированной ПБЛНПГ.
Определение
Общепринятого определения ПИКМ не существует, но само состояние характеризуется как снижение систолической функции ЛЖ на фоне постоянной или длительной (обусловлена высоким бременем) желудочковой стимуляции, которая приводит к клиническим проявлениям, таким как сердечная недостаточность (СН) [7, 8]. В клинических рекомендациях ПИКМ [9] характеризуется тремя критериями:
- снижение ФВ ЛЖ не менее чем на 10%, начиная с исходной ФВ ЛЖ >50% до стимуляции ПЖ;
- значительное бремя стимуляции ПЖ (процент стимуляции >20%);
- отсутствие другой определенной причины снижения ФВ ЛЖ после начала стимуляции ПЖ [9].
Данный алгоритм применим только в ситуациях, когда мы зарегистрировали у пациентов снижение ФВ ЛЖ, которое хронологически связано с началом постоянной правожелудочковой стимуляции без наличия других очевидных причин ее возникновения. Таким образом, диагноз ПИКМ является диагнозом исключения в случаях, когда мы не можем доказать другую первичную причину кардиомиопатии (ишемическая болезнь сердца, миокардиты, первичные кардиомиопатии, обусловленные генетическими предпосылками, вторичными кардиомиопатиями и др.) [10].
При этом немаловажно обратить внимание на пациентов с сохраняющейся ФВ ЛЖ ≥50%, на фоне постоянной правожелудочковой стимуляции. Так, было показано в исследовании PACE, что даже в этой группе пациентов отмечалось достоверное снижение ФВ ЛЖ без выхода из пределов референтных значений. Исследование включало 177 рандомизированных пациентов со средней ФВ ЛЖ 61,7%, 89 из которых были направлены на бивентрикулярную стимуляцию и 88 пациентов на правожелудочковую. За первый год наблюдения средняя ФВ ЛЖ в группе правожелудочковой стимуляции составляла 54,8%, когда средняя ФВ ЛЖ в группе бивентрикулярной стимуляции практически не изменилась и составляла 62,2%. После длительного наблюдения за данными пациентами (4,8 лет), были получены результаты, что в группе правожелудочковой стимуляции отмечалось снижение ФВ ЛЖ в среднем до 53,2% [11]. В исследовании Kaye G, et al. [12] сравнили три различных определения: (а) ФВ ЛЖ ≤40%, если исходная ФВ ЛЖ была ≥50%, или абсолютное снижение ФВ ЛЖ ≥5%, если исходная ФВ ЛЖ была <50%; (б) ФВ ЛЖ ≤40%, если исходная ФВ ЛЖ была ≥50%, или абсолютное снижение ФВ ЛЖ ≥10%, если исходная ФВ ЛЖ была <50%; и (в) абсолютное снижение ФВ ЛЖ ≥10%, независимо от исходного уровня. Период наблюдения длился 3,4±1,4 года, частота возникновения ПИКМ составила (а) 9,3%, (б) 5,9% и (в) 39,0%, соответственно. На основании данных исследований можно сделать вывод, что пациентам с постоянной правожелудочковой стимуляцией необходимо оценивать ФВ ЛЖ в динамике и оценить клинические, лабораторные проявления ХСН, потому что длительное время у данной группы пациентов эхокардиографические показатели остаются без изменений, что затрудняет верификацию ПИКМ.
Учитывая все вышеописанное важно отметить, что ПИКМ не всегда ассоциирована с изолированным снижением ФВ ЛЖ, соответственно необходимо обращать внимание на клиническую симптоматику, лабораторные маркеры ХСН, которые могут иметь фенотип ХСН с сохраненной ФВ ЛЖ.
Патогенез развития ПИКМ
В настоящий момент, имеются уже обширные научные данные, что одними из значимых факторов ремоделирования камер сердца являются изменения транскрипции рибонуклеиновой кислоты и эпигенетические факторы [13-15], которые приводят к дисрегуляции кодирования различных белков, включая саркомерные и структурные белки и, что более важно, протеины, ответственные за возбуждение и сократительную способность [16]. Нарушенные энергетические и метаболические процессы миоцитов могут изменить экспрессию генов, которые регулируют захват ионов кальция или целостность цитоскелета и также могут приводить к структурным изменениям миокарда. Более того, в литературе описаны независимые генетические варианты, которые ассоциированы с различными фенотипическими проявлениями, такими как гипертрофия миокарда, интрамиокардиальный фиброз, и так называемыми идиопатическими «электрическими» заболеваниями сердца [17]. В настоящее время описано множество мутаций в генах (ACTC, TNNT2, TNNI3, DES, LMNA и др.), предрасполагающих к структурным и функциональным заболеваниям миокарда [17-22]. Многие из мутаций могут не привести к каким-либо существенным изменениям, однако в условиях предрасполагающих факторов, к которым может быть отнесена хроническая правожелудочковая стимуляция, реализовать свое негативное влияние [15]. Так, было выявлено, что длительность стимулированного комплекса QRS коррелирует с изменениями экспрессии гена SERCA2 и предшествует ремоделированию и снижению функции ЛЖ у пациентов с имплантированным ЭКС и постоянной желудочковой стимуляцией. И что также примечательно, что у пациентов с узкими стимулированными комплексами QRS статистически значимых изменений экспрессии SERCA2 выявлено не было [23]. Ранее были продемонстрированы и другие примеры изменения экспрессии не только SERCA2, но и MYH6, MYH7, NPPA, NPPB, OPA1 на фоне длительной правожелудочковой стимуляции и взаимосвязью с развитием ремоделирования желудочков и снижения их сократительной способности [24-32] (табл. 1).
Таблица 1
Исследования, показавшие изменения в уровне экспрессии генов на фоне постоянной стимуляции
|
Группа исследования |
Оценка экспрессии гена |
Длительность наблюдения |
Результат наблюдения |
|
|
Arkolaki EG, |
52 пациента с брадиаритмиями: Группа А: 24 пациента с АВ-блокадой Группа Б: 28 пациентов с синдромом слабости синусового узла |
SERCA2, MYH6 и MYH7 |
12 мес. |
В группе А гены SERCA2 и MYH6 снизились по сравнению с MYH7, который увеличился. В общей сложности, 25% пациентов из группы А продемонстрировали значительное ремоделирование ЛЖ. Ранние изменения в экспрессии генов были связаны с ухудшением функции и геометрии ЛЖ, что стало очевидным спустя месяцы при эхокардиографической оценке |
|
Vanderheyden M, |
24 пациента, направленных на имплантацию ресинхронизирующего устройства |
MYH6, MYH7 и NPPB |
4 мес. |
У пациентов, ответивших на СРТ, наблюдалось увеличение уровней мРНК MYH6 и соотношения белков α-/β-MHC. Кроме того, в той же популяции наблюдалось снижение уровней мРНК NPPB |
|
Xu H, et al. [32] |
60 пациентов с полной АВ-блокадой и сохранной фракцией выброса ЛЖ (>50%): — Группа А: 30 пациентов с апикальной стимуляцией правого желудочка — Группа Б: 30 пациентов со стимуляцией правого желудочка из выносящего тракта |
OPA1 и SERCA2a |
24 мес. |
Уровни мРНК OPA1 и SERCA2a были значительно ниже в группе A по сравнению с группой Б. По сравнению с исходным значением уровни мРНК SERCA2a и OPA1 были снижены в группе A в первый месяц оценки. В группе Б эта разница не была статистически значимой между начальными и конечными уровнями мРНК обоих генов |
Сокращения: АВ — атриовентрикулярный, ЛЖ — левый желудочек, СРТ — сердечная ресинхронизирующая терапия, α-MHC — тяжелая цепь α-миозина, MYH — ген тяжелой цепи миозина, NPPB — ген, кодирующий натрийуретический пептид B, OPA1 — атрофия зрительного нерва 1, SERCA2 — саркоплазматическая ретикулумная кальциевая АТФаза-2.
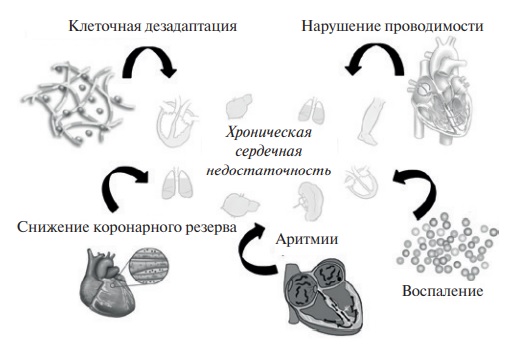
Активация симпатоадреналовой и ренин-ангиотензин-альдостероновой систем играет значимую роль в аритмогенезе и ремоделировании сердца. При СН перманентная активация β-адренергического пути может привести к нарушению регуляции и десенситизации β-адренорецепторов, которая, в свою очередь, приводит к снижению сократительной функции миокарда и снижению чувствительности на симпатическую активацию [33]. В свою очередь, лечение, включающее применение β-адреноблокаторов и антагонистов ренин-ангиотензин-альдостероновой системы, препятствует этому процессу и в т. ч. развитию ПИКМ [34]. Известно, что даже временная стимуляция ПЖ повышает базовый уровень норэпинефрина, снижает сократимость ЛЖ, замедляет фазу изоволюмического расслабления и повышает конечно-диастолическое давление в нем [35]. Если же провести сравнение с бивентрикулярной стимуляцией [36], то уровень симпатической активации достоверно был выше у пациентов с апикальной правожелудочковой стимуляцией. У пациентов с сохранным атриовентрикулярным (АВ) проведением и предсердной стимуляцией также отличался уровень локальной симпатической активности в сравнении с изолированной правожелудочковой [37]. В настоящий момент отсутствуют убедительные данные о повышении уровня ангиотензина II на фоне стимулированного ритма, однако очевидно, что ренин-ангиотензин-альдостероновая система не может не участвовать в каскаде развития СН.
Перманентная стимуляция сердца обычно не приводит к гипертрофии миоцитов или минимально ее провоцирует, но при этом значительно влияет на ремоделирование желудочков, снижает общее количество миоцитов, что связано как с апоптозом, так и изменениями во внеклеточном матриксе [38]. Установлено несколько факторов, вызывающих индукцию апоптоза в кардиомиоцитах при СН, включая нарушение цикла обмена Ca2+ и повреждения митохондрий [39]. При этом процесс апоптоза может не достигать финального разрыва сарколемы, но приводить к нарушению клеточных процессов и способствовать обширной потере митохондриями цитохрома и в конечном итоге потере сократительной способности [40]. В экспериментальных моделях индуцируемой стимуляцией СН было отмечено уменьшение общего числа миоцитов и связанной с этим уменьшением толщины стенок желудочков при увеличении конечно-диастолического объема.
Внеклеточный матрикс миокарда желудочков представляет собой динамическую ткань, которая содержит организованную структурную сеть матричных белков, включая матричные металлопротеиназы (ММП), тканевые ингибиторы матричных металлопротеиназ (ТИМП) и фибриллярные коллагены [41]. Правожелудочковая стимуляция влияет на внеклеточный матрикс, модулируя функцию различных металлопротеиназ и коллагена [41], играющих ключевую роль в процессе ремоделирования посредством деградации компонентов матрикса, таких как коллаген и эластин. Кроме того, внеклеточный матрикс включает в себя большое количество сигнальных молекул, включая ангиотензин, эндотелины и цитокины. Известно, что изменения в функциональной экспрессии ТИМП и ММП были идентифицированы как причина структурного ремоделирования при СН [42]. Экспрессия матричных ММП и ТИМП, а также коллагенов I и II типов была повышена в животных моделях с длительной правожелудочковой стимуляцией, а также экспрессия коллагена II типа, белка ММП-2, ММП-9, ТИМП-1 и ТИМП-3 в боковой стенке ЛЖ [36]. Считается, что механическое перенапряжение отделов ЛЖ с наиболее поздней активацией может быть одним из основных неблагоприятных факторов фиброза и структурного ремоделирования [43].
Длительная желудочковая стимуляция может вызывать воспалительную реакцию в миокарде, включая экспрессию цитокинов. В свою очередь, воспаление способствует не только всем ранее описанным механизмам ремоделирования миокарда, но и проаритмогенному эффекту. В настоящий момент есть данные, свидетельствующие о том, что это реализуется за счет опосредованного эффекта интерлейкина-6 [44] и фактора некроза опухолей-α (ФНО-α) [45]. Более того, в контексте СН, вызванной желудочковой стимуляцией, у пациентов наблюдается значительная корреляция между концентрацией интерлейкина-6 в плазме и уровнем норадреналина в плазме, что предполагает потенциальную связь между нейрогормональной активацией и воспалением, опосредованным цитокинами [44].
Повышенная экспрессия ФНО-α у пациентов с ХСН считается одной из потенциальных причин дисфункции ЛЖ. Это объясняется активацией проапоптотического эффекта, способствующего гибели кардиомиоцитов, а также способствующего экспрессии матричных ММП. Хотя экспрессия ФНО-α повышена у пациентов с длительной стимуляцией ПЖ, имеет ли она прямое значение в глобальном ремоделировании, до конца не ясно [45, 46], поскольку ранее было отмечено, что воспаление возникает в первую очередь в результате электрической стимуляции, локализованного в месте подачи энергетического импульса [47]. Похожую картину наблюдали в модели эпикардиальной левожелудочковой стимуляции, где отмечался воспалительный ответ непосредственно в прилегающем эпикарде [48]. Электрическая диссинхрония миокарда формируется за счет изменений его электрофизиологических свойств, структуры и метаболических процессов. Эти изменения представляют собой три механизма компенсации, направленные на задержку или уменьшение прогрессирования СН, однако при достижении порога дезадаптивности начинают способствовать прогрессированию заболевания [49]. Проведенные исследования с созданием животной модели тахииндуцированной ХСН показали, что электромеханическая диссинхрония приводила к метаболическим изменениям, связанным с энергетическими процессами. Так, в ходе анализа биоптата верхушки ЛЖ были получены данные, указывающие на заметные различия между моделями с желудочковой (диссинхронной) и наджелудочковой (синхронной) стимуляцией. В первом случае у лиц с диссинхронной моделью наблюдалось снижение уровня аденозинтрифосфата (АТФ), фосфокреатина и креатина и более низкое соотношение фосфокреатина/АТФ. Более того, уровень миокардиального карнитина и жирных кислот был значительно меньше в диссинхронной модели. Хотя и синхронная, и диссинхронная модели показали снижение уровня креатина и промежуточных продуктов гликолиза, а также цикла трикарбоновых кислот, степень скорости восстановления варьировалась в зависимости от этих двух условий. Эти данные свидетельствуют о системном несоответствии между предложением и спросом в энергетических процессах. Также крайне важным наблюдением являлся перевес энергетического дефицита во время диастолы, что можно объяснить значительным снижением доставки жирных кислот в путь β-окисления, прежде всего за счет снижения содержания миокардиального карнитина [50]. Аналогичным образом, в моделях с предсердной стимуляцией было обнаружено значительное снижение активности ферментов фосфотрансфераз, креатинкиназы и аденилаткиназы, а также истощение запасов высокоэнергетических фосфатов (АТФ и креатинфосфата), что указывает на схожую патофизиологию биоэнергетических процессов в предсердном миокарде [51].
Эпидемиология, сроки возникновения и факторы риска развития ПИКМ
В настоящее время исследователи ставили перед собой очевидные вопросы, а именно: распространенность ПИКМ в популяции, временные рамки, за которые развивается патологическое состояние, и факторы риска, влияющие на ее развитие.
Наиболее показательный краткосрочный эффект правожелудочковой стимуляции был продемонстрирован в исследовании Nahlawi M, et al. [52], которое включало 12 пациентов (9 женщин) без структурных заболеваний сердца, сохраненной АВ-проводимостью, которым был имплантирован двухкамерный ЭКС с позиционированием желудочкового электрода в апикальной позиции (АП). На протяжении одной недели ЭКС пациентов были запрограммированы в режим AAI с минимизацией желудочковой стимуляции. Исходная ФВ ЛЖ после одной недели в режиме AAI с нормальной АВ-проводимостью составила 66,5±4,5%. Временное переключение устройств в р-синхронизированную правожелудочковую (апикальную) стимуляцию в течение 2 ч привело к снижению ФВ ЛЖ до 60,3±5,2% (p=0,0002). Длительность QRS во время режима DDD составила 168±16 мс vs 90±16 мс на исходном уровне (p=0,0003). Попытка обратного перехода в предсердную стимуляцию не привела к быстрому восстановлению насосной функции ЛЖ к исходным значениям. Влияние же 7-дневной апикальной стимуляции на ФВ ЛЖ проявлялось еще более значительным снижение функции ЛЖ по сравнению с исходным уровнем (66,5±4,5% vs 52,9±8,3%, p=0,0001). Немедленное увеличение ФВ ЛЖ после прекращения 7-дневного периода произошло у 9 из 12 пациентов. У оставшихся троих пациентов через 2, 5, 8 и 24 ч после прекращения 7-дневного периода стимуляции ФВ ЛЖ оставалась сниженной (от 59% до 60%) по сравнению с исходным значением. Только через 32 ч ФВ ЛЖ восстановилась до уровня достоверно не отличающегося (62,9±7,6%).
При ретроспективных исследованиях, которые оценивали более длительный эффект стимуляции, наблюдались схожие патологические эффекты. Так, Li DL, et al. [53] включили 325 пациентов от 18 до 59 лет с полной АВ-блокадой и имплантированным ЭКС. У 38 пациентов регистрировалось снижение систолической функции ЛЖ на фоне ≥20% правожелудочковой стимуляции (другие причины снижения ФВ ЛЖ были исключены). Самый короткий период от имплантации ЭКС до развития ПИКМ был 2,5 мес., а самый длительный 16,9 лет. Более возрастные пациенты (группа 50-59 лет) имели более высокий риск развития ПИКМ (71%) в отличии от более молодых групп пациентов. По результатам данного исследования было выявлено, что пациенты старшего возраста более подвержены развитию ПИКМ, однако необходимо отметить, что группы молодых пациентов, которым имплантировался ЭКС по поводу АВ-блокады, имели сравнимый риск развития ПИКМ с более возрастными пациентами в более позднее время. В исследовании Merchant FM, et al. [54], которое включало 21202 пациентов, в первые 6 мес. после имплантации ЭКС пациенты с АВ-блокадой 3 степени имели более высокий риск снижения ФВ ЛЖ в сравнении с группой пациентов с более низкой градацией АВ-блокады. Исходя из вышеописанного, можно сделать вывод, что процент правожелудочковой стимуляции (>20%) является первым и главным предиктором развития ПИКМ вне зависимости от возраста.
Наличие постоянной формы фибрилляции предсердий (ФП) с АВ-блокадой 3 степени увеличивает риск развития впервые возникшей ХСН у пациентов с имплантируемым ЭКС в сравнении с группой ФП без АВ-блокады 3 степени. В более длительном наблюдении было показано, что наличие ФП в группе без АВ-блокады 3 степени было прогностическим неблагоприятным фактором, который увеличивал риск возникновения ХСН [54].
Изначально сниженная ФВ ЛЖ также является фактором риска развития ПИКМ. В исследовании DAVID [55] пациенты были разделены на 2 группы, каждой группе была необходима имплантация кардиовертер-дефибриллятора с целью первичной или вторичной профилактики внезапной сердечной смерти. Сравнение заключалось в оценке бремени правожелудочковой стимуляции (первая группа пациентов режим стимуляции VVI, вторая группа пациентов DDDR). По результатам было отмечено, что изначально сниженная ФВ ЛЖ при высоком бремени ПЖ стимуляции является фактором риска для прогрессирования снижения систолической функции сердца. Одним из оцениваемых критериев была частота госпитализации по поводу ХСН, у пациентов с частотой стимуляции >40% риск госпитализации возрастал в 3 раза по сравнению с группой с более низким процентом стимуляции. Исследование DAVID II [56], проведенное среди пациентов с имплантированным кардиовертером-дефибриллятором, не продемонстрировало никакой разницы в смертности и прогрессировании ХСН, когда бремя правожелудочковой стимуляции поддерживалось на низком уровне с помощью предсердной стимуляции (AAI) или страховочной стимуляции (VVI 40).
В исследовании Pastore G, et al. [57], которое включало 153 пациента с имплантированным ЭКС, пациенты были разделены на 3 группы с ФВ ЛЖ >55%; ФВ ЛЖ <55-35%, ФВ ЛЖ <35%. По результатам наблюдения в 1 группе у 44,9% пациентов, во 2 группе у 92,9% пациентов, в 3 группе у 100% пациентов было отмечено увеличение ЛЖ диссинхронии.
В исследовании Kaye GC, et al. [58] было проведено прямое сравнение выбора места имплантации правожелудочкового электрода. Было выбрано 240 пациентов, 120 из которых выполнена имплантация ПЖ электрода в АП, и 120 пациентам имплантация была выполнена в высокую септальную позицию (ВСП). Наблюдение проводилось на протяжении 2 лет, по результатам которого было отмечено, что значимых изменений в снижении ФВ ЛЖ, смерти, госпитализаций по поводу ХСН, повышения уровня натрийуретического пептида, возникновения ФП между группами исследования не было. Сердечно-сосудистая смерть произошла у 5 пациентов группы АП (2 внезапные и 3 связанные с СН) и у 4 пациентов с ВСП электрода (1 внезапная и 3 связанные с СН). Госпитализация из-за декомпенсации СН была зарегистрирована у 7 пациентов в группе ВСП, и у 2 в группе АП. Таким образом, подтверждалась теория об отсутствии разницы неблагоприятного воздействия любой из эндокардиальных позиций правожелудочкового электрода.
В исследовании MOST [59] были получены результаты, что у пациентов с высоким процентом желудочковой стимуляции (>40%) госпитализаций по поводу ХСН было в 2,5 раза больше в сравнении с пациентами с более низкой стимуляционной нагрузкой. По результатам исследования Khurshid S, et al. [46] из 257 пациентов, соответствующих критериям исследования, у 50 (19,5%) развилась ПИКМ со снижением средней ФВ ЛЖ с 62,1% до 36,2% за средний период наблюдения 3,3 года. Те, у кого развилась ПИКМ, были чаще мужчинами с более низкой исходной ФВ ЛЖ и более широкой нативной длительностью QRS (блокады ножек пучка исключены, p=0,005, p=0,03 и p=0,001, соответственно). В многофакторном анализе мужской пол (отношение рисков 2,15, 95% доверительный интервал: 1,17-3,94, p=0,01) и более широкая нативная длительность QRS были независимо связаны с развитием ПИКМ. Собственная продолжительность QRS >115 мс была 90% специфична для развития ПИКМ.
Исследование Khurshid S, et al. [60], которое включало 184 пациента, с имплантированным ЭКС и сохраненной ФВ ЛЖ, ПИКМ развилась у 42 пациентов (22,8%) за период 2,5±2,3 года. ФВ ЛЖ с 62,1±8,6% на исходном уровне снизилась до 35,3±9,7% на момент постановки диагноза. Продолжительность стимуляционного QRS >150 мс являлась высокочувствительным маркером наличия ПИКМ. Пациенты с продолжительностью QRS <150 мс имели более низкий риск ее развития. В исследовании Kiehl EL, et al. [61] было отобрано 823 пациента с сохраненной ФВ ЛЖ и средним возрастом 68,9 лет. Средний показатель ФВ ЛЖ до имплантации ЭКС составил 58±5%. У 101 пациента развился ПИКМ. При этом доля апикальной стимуляции составила 38,6%, а неапикальной 62,4%, соответственно. Время наблюдения составило в среднем 4,3±3,9 года. ФВ ЛЖ после окончания наблюдения у пациентов с ПИКМ составило 33,7±7,4% по сравнению с пациентами без ПИКМ 57,6±6,1%.
Заключение
Как было упомянуто ранее, ПИКМ это кардиомиопатия, ассоциированная с постоянной правожелудочковой стимуляцией, при исключении других известных причин ее развития. Процесс ремоделирования миокарда имеет два этапа развития, которые схожи с классическим протеканием ХСН, а именно постепенный переход от ХСН с сохранной ФВ ЛЖ в аналогичное состояние со снижением глобальной функции миокарда. Очевидно, что к настоящему моменту сложный генез заболевания имеет неверифицированные факторы риска его развития, однако наиболее достоверными на развитие ПИКМ определены высокий процент желудочковой стимуляции, исходно сниженная ФВ ЛЖ, продолжительность нативного и стимулированного комплекса QRS. Учитывая генез ПИКМ и невозможность точного выявления группы риска ее развития, следует обратить внимание на физиологичные методы стимуляции у пациентов с ожидаемым ее высоким бременем.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Андреев Д.Ю., Глезер М.Г., Калемберг А.А. Неблагоприятное воздействие внутрисердечной диссинхронии и стимуляции правого желудочка на сократительную функцию и прогноз. Российский кардиологический журнал. 2024;29(4S):6259. https://doi.org/10.15829/1560-4071-2024-6259. EDN: RVWBZV
Скопировать