Молекулярно-генетические маркеры инфаркта миокарда в сочетании с сахарным диабетом 2 типа
Сердечно-сосудистые заболевания (ССЗ) в настоящее время сохраняют лидирующие позиции в структуре причин смертности населения в мировой статистике [1]. В России смертность от ССЗ в 2019г составила 46,3%, их них 28,4% приходится на ишемическую болезнь сердца (ИБС). В Новосибирской области смертность от ССЗ на 2,6% выше общероссийского уровня [2][3]. Другой не менее важной проблемой здравоохранения является сахарный диабет (СД), преимущественного 2 типа, поскольку на него отводится ~90% среди всех типов СД. Согласно данным, опубликованным Международной диабетической ассоциацией, к 2030г количество пациентов с СД в мире увеличится до 578 млн больных, а к 2045г достигнет 700 млн человек [4]. В России по данным регистра больных СД по состоянию на 01.01.2021 количество больных СД 2 типа составляет 4,43 млн человек. Однако все эксперты сходятся во мнении, что истинное количество пациентов с СД 2 типа в Российской Федерации в 2 раза выше, ~8-9 млн человек. Подтверждением тому является исследование NATION, результаты которого продемонстрировали, что доля не верифицированного СД 2 типа в России составляет 54%. Среди причин смертности пациентов с СД 2 типа первое место занимают сердечно-сосудистые осложнения (ССО). По данным федерального регистра СД на 01.01.2021 на долю ССЗ в структуре причин смертности пришлось 52%. Аналогичная ситуация характерна для мировой эпидемиологической ситуации. По данным IDF (International Diabetes Federation) каждые 8 секунд в мире умирает больной с СД, более половины случаев смерти связаны именно с ССО [5-7].
Главной задачей медицинского сообщества является разработка программ первичной и вторичной профилактики ССЗ, с целью снижения смертности больных. Поскольку наследственная предрасположенность играет большую роль в развитии СД 2 типа и ССО, перспективным направлением является генетическое тестирование с выявлением молекулярногенетических факторов риска. Основную роль в генетике заболеваний играют полногеномные ассоциативные исследования (GWAS). Первое исследование GWAS было проведено в 2005г, к настоящему времени известно более чем о 70 тыс. ассоциаций однонуклеотидных полиморфизмов (ОНП), данные о которых собраны в общедоступном каталоге GWAS, созданном Национальным институтом исследования генома человека, Европейской лабораторией молекулярной биологии и Европейским институтом биоинформатики. Это позволяет использовать знания о молекулярно-генетических ассоциациях в рамках когортных исследований, проводимых в разных популяциях. В настоящем исследовании были изучены два генетических маркера: полиморфизм rs2464196 гена HNF1A (ген ядерного фактора гепатоцитов 1A) и полиморфизм rs11212617 гена ATM (ген серин/тирозин киназа), которые по результатам GWAS показали ассоциацию с развитием СД 2 типа, ССЗ. Ген HNF1A картирован на длинном плече 12-й хромосомы (12q24.31), кодирует ядерный (транскрипционный) фактор гепатоцитов 1А. Ген HNF1А регулирует работу >300 генов печени и поджелудочной железы, участвуя в углеводном и липидном обмене, синтезе белков острой фазы, также HNF1A регулирует экспрессию натрий глюкозного котранспортера 2 типа. Ген ATМ локализован на длинном плече хромосомы 11, кодирует белок серин/тирозин киназу. Второе название гена — ген атаксии-телеангиоэктазии. АТМ кодирует синтез клеточной протеинкиназы, которая, в свою очередь, участвует в синтезе липидов, процессе тромбобразования, синтезе и транспорте глюкозы [8][9].
Представленное исследование позволит определить ассоциации молекулярно-генетических маркеров, которые будут полезны для выявления когорты пациентов более высокого риска развития инфаркта миокарда (ИМ) в сочетании с СД 2 типа и дальнейшего выбора методов персонифицированного подхода ведения таких пациентов. Данная работа актуальна, поскольку полученные результаты вносят вклад в глобальную цель здравоохранения по снижению сердечно-сосудистой смертности.
Цель исследования: изучить ассоциации полиморфизмов rs2464196, rs11212617 с развитием ИМ в сочетании с СД 2 типа.
Материал и методы
В исследовании сформировано две группы. Основная группа включает 115 больных с ИМ с подъемом сегмента ST и СД 2 типа, группа сравнения — 116 пациентов с ИМ с подъемом сегмента ST без сопутствующего СД 2 типа, госпитализированных в период с 1 декабря 2018г по 31 декабря 2019г в Региональный сосудистый центр № 1 Городской клинической больницы № 1 города Новосибирска. В работе выделено 3 этапа исследования. Первый этап исследования соответствует первым суткам госпитализации пациентов в стационар, второй этап — день выписки пациентов, третий этап (проспективная часть исследования) — через 12 мес. от момента настоящей госпитализации. В данной публикации приводятся результаты первого этапа исследования. Итак, на первом этапе всем включенным в исследование пациентам проводилась оценка анамнестических, клинико-демографических, функциональных, лабораторно-инструментальных параметров, данных молекулярно-генетического исследования (rs2464196 гена HNF1A, rs11212617 гена ATM).
Характеристика пациентов основной группы и группы сравнения. В основной группе выделено 55 мужчин и 60 женщин, в группе сравнения 60 мужчин, 56 женщин (p=0,554). Средний возраст пациентов в основной группе и группе сравнения составил 63,2±5,3 лет vs 63,6±5,4 лет (р=0,96), мужчин 62,3±5,5 лет vs 62,1±4,2 лет (р=0,98), женщин 64,3±4,9 лет vs 65,2±5,7 лет (р=0,93).
Локализация ИМ в основной группе отмечалась следующая: передняя локализация в 46,9% случаев (у 26 мужчин, 28 у женщин), нижняя локализация — в 49,6% случаев (у 27 мужчин, у 30 женщин), циркулярный ИМ отмечался в 3,5% случаях (у 2 мужчин, у 2 женщин). В группе сравнения: передняя локализация отмечалась в 29,3%, нижняя — в 66,4% случаев, циркулярный ИМ развивался в 4,3% случаях. При проведении селективной коронарографии в основной группе отмечалось в 12,2% случаев однососудистое поражение, в 87,8% случаев многососудистое поражение. В группе сравнения: однососудистое поражение отмечалось в 44,0% случаев, многососудистое поражение в 56,0% (р<0,001). Таким образом, статистически значимо в группе пациентов с СД 2 типа чаще отмечались передняя локализация ИМ (р=0,01), многососудистое поражение коронарного русла (р<0,001).
Лечение ИМ в обеих группах проводилось в соответствии с клиническими рекомендациями и стандартами оказания медицинской помощи, а именно: проведение фармакоинвазивной стратегии (тромболитическая терапия и чрескожное коронарное вмешательство) отмечалось у 26 пациентов (22,6%) основной группы и 25 пациентов (21,6%) группы сравнения; проведение инвазивной стратегии (чрескожное коронарное вмешательство) отмечено у 89 (77,4%) и 91 больного (78,4%), соответственно (p=0,847); назначение двойной антиагрегантной терапии выполнено у 99 пациентов (86,1%) основной группы и 108 пациентов группы сравнения (93,1%), в остальных случаях ситуация требовала дополнительного назначения антикоагулянта ввиду наличия фибрилляции предсердий (p=0,081) [10][11]. Представленные данные свидетельствуют о сопоставимости пациентов основной группы и группы сравнения по полу, возрасту и принципам лечения ИМ.
Средний возраст верификации диагноза СД 2 типа в основной группе равен 54,2±7,1 лет, длительность СД 2 типа на момент проведения исследования составляет 9,9±5,5 лет. Структура осложнений СД 2 типа: хроническая болезнь почек со снижением скорости клубочковой фильтрации до 60 мл/мин/1,73 м2 n=61 (53,0%), диабетическая ретинопатия n=60 (52,2%), периферическая полинейропатия n=105 (91,3%), значимый стеноз (>50%) брахиоцефальных артерий n=10 (8,7%), значимый стеноз периферических артерий n=19 (16,5%), синдром диабетической стопы n=3 (2,6%).
Лечение СД является важным фактором в развитии ССО, в связи с этим была проведена оценка сахароснижающей терапии в основной группе пациентов до развития ИМ. Мужчины получали следующее лечение: 14,5% — монотерапия метформином; 56,4% — комбинированная таблетированная терапия; 20,0% — комбинация таблетированных препаратов и инсулина; 9,1% — инсулинотерапия. Среди таблетированных препаратов особое внимание заслуживают лекарственные средства с доказанным кардиопротективным эффектом, а именно ингибиторы натрий глюкозного котранспортера 2 типа, прием которых зафиксирован у 10,9% мужчин. Женщины получали следующую терапию: монотерапия метформином — 6,7%; комбинированная таблетированная терапия — 50,0%; комбинация таблетированных препаратов и инсулина — 35,0%; инсулинотерапия — 8,3%. Препараты группы ингибиторов натрий глюкозного котранспортера 2 типа не использовались в лечении СД 2 типа у женщин.
Генотипирование молекулярно-генетических маркеров производилось следующим образом: осуществляли забор 10 мл венозной крови у пациентов основной группы и группы сравнения в период госпитализации по поводу развития ИМ. Затем из данного образца выделяли ДНК методом фенол-хлороформной экстракции с последующим определением полиморфизмов методом полимеразной цепной реакции в реальном времени (Real time PCR) с использованием зондов TaqMan, Thermo Fisher Scientific (USA) на приборе StepOnePlus (в соответствии с прилагаемой инструкцией фирмой производителя). После проводили статистическую оценку полученных данных в отношении генотипов полиморфизмов rs2464196 гена HNF1A, rs11212617 гена ATM.
Статистический анализ данных проводился с помощью пакета программ SPSS версии 23.0. Характер распределения количественных признаков определялся методом Колмогорова-Смирнова. При нормальном распределении количественные признаки представлены средними значениями и стандартным отклонением. Качественные показатели представлены в виде абсолютных чисел и/или относительных величин в процентах. При определении значимости генетических факторов сначала определяли частоты генотипов и аллелей полиморфизмов в основной группе и группе сравнения, оценивали соответствие частот генотипов равновесию Харди-Вайнберга. Ассоциации полиморфизмов проверялись с помощью критерия хи-квадрат по Пирсону, метода отношения шансов (ОШ) с 95% доверительными интервалами (ДИ). Критический уровень значимости при проверке статистических гипотез принимался равным 0,05. Мощность выборки рассчитывалась при помощи формулы: Nmin=15,4*(p*(1-p))/W2, где: p — ожидаемое значение вероятности случайного события; W — ширина ДИ для значения вероятности. А также с использованием авторского калькулятора определения выборки через ОШ1. Проведение исследования было одобрено этическим комитетом (протокол № 111 от 29.11.2018). Все пациенты перед включением в исследование были информированы о предстоящем проекте и подписывали добровольное информированное согласие.
Результаты
В настоящем исследовании были проанализированы два ОНП (rs11212617 гена ATM, полиморфизм rs2464196 гена HNF1A) в отношении ассоциации данных маркеров с ИМ у больных СД 2 типа. Вначале оценили соответствие частот генотипов изучаемых ОНП равновесию Харди-Вайнберга: частота генотипов rs2464196 соответствовала равновесию ХардиВайберга (?2=1,5694); частота генотипов rs11212617 соответствовала равновесию Харди-Вайберга (?2=1,319). Затем провели анализ частоты генотипов и аллелей обоих полиморфизмов в основной группе и группе сравнения (использовали критерий хи-квадрата по Пирсону). После с целью выявления ассоциации изучаемых полиморфизмов с развитием ИМ при СД 2 типа использовали авторский калькулятор ОШ. Принцип работы которого изложен в ранее опубликованной нами статье [12].
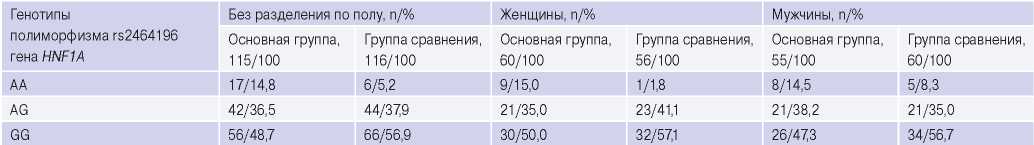
При анализе частот генотипов полиморфизма rs2464196 гена HNF1A без разделения по полу, в основной группе частота генотипа АА rs2464196 достоверно выше по сравнению с группой сравнения (14,8% vs 5,2%, p=0,015). При разделении по полу достоверные различия сохранялись в группе женщин для генотипа АА (15,0% vs 1,8%, p=0,010). При анализе частот генотипов AG и GG полиморфизма rs2464196 гена HNF1A без разделения и с разделением по гендерному признаку достоверных различий не было выявлено (табл. 1).
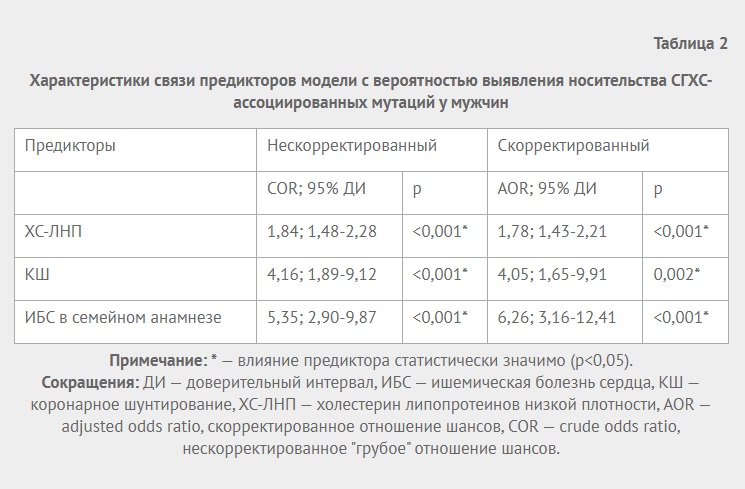
При анализе частот генотипов AA, AC, CC rs11212617 гена ATM в основной группе и группе сравнения без разделения и с разделением по половому признаку выявлены достоверные различия для женщин по генотипу СС (13,3% vs 33,9%, p=0,009) (табл. 2).
При расчете ОШ для полиморфизмов rs2464196, rs11212617 в основной группе и группе сравнения без разделения по гендерному признаку выявлено, что носительство генотипа АА rs2464196 гена HNF1A в 3,18 раз чаще отмечается в основной группе пациентов (95% ДИ 1,206-8,387, р=0,015). Анализ других генотипов rs2464196 и rs11212617 не показал достоверных различий (табл. 3).
При анализе ОШ в основной группе и группе сравнения при разделении по полу для полиморфизма rs2464196 гена HNF1A в подгруппе мужчин не получено статистически значимых различий. Среди женщин выявлено, что носительство генотипа АА полиморфизма rs2464196 гена HNF1A в 9,7 раз чаще встречается в основной группе по сравнению с группой сравнения (ОШ =9,706, 95% ДИ 1,188-79,325, p=0,011).
При расчете ОШ для полиморфизма rs11212617 гена ATM в основной группе и группе сравнения при разделении по гендерному признаку достоверные различия получены в подгруппе женщин. Выявлено, что наличие генотипа СС полиморфизма rs11212617 выполняет условно протективную роль среди женщин (ОШ =0,300, 95% ДИ 0,119-0,757, р=0,009).
Следующим шагом мы провели оценку частоты аллелей изучаемых полиморфизмов в основной группе и группе сравнения с разделением и без разделения по половому признаку. В отношении полиморфизма rs2464196 гена HNF1A получены следующие данные: частота аллели А по сравнению с аллелью G в основной группе отмечалась в 1,6 раза чаще по сравнению с группой сравнения (ОШ =1,551, 95% ДИ 1,032-2,331, р=0,034). При разделении по гендерной принадлежности статистически значимых различий не выявлено (табл. 4).
Оценка частоты аллелей полиморфизма rs11212617 гена ATM и расчет ОШ показал достоверные различия только в группе женщин. Выявлена ассоциация аллели А с ИМ в сочетании с СД 2 типа (ОШ =1,728; 95% ДИ 1,022-2,892, р=0,040), при этом аллель С играет условно протективную роль (ОШ =0,579; 95% ДИ 0,346-0,978; р=0,040) (табл. 5).
Таблица 1
Частоты генотипов полиморфизма rs2464196 гена HNF1A

Таблица 2
Частоты генотипов полиморфизма rs11212617 гена ATM

Таблица 3
Ассоциации молекулярно-генетических маркеров с ИМ у пациентов с СД 2 типа без разделения по полу

Сокращения: ДИ — доверительный интервал, ОНП — однонуклеотидный полиморфизм (номер в международной классификации), ОШ — отношение шансов, р — уровень значимости.
Таблица 4
Частоты аллелей полиморфизма rs2464196 гена HNF1A

Таблица 5
Частоты аллелей полиморфизма rs11212617 гена ATM

Обсуждение
В настоящем исследовании было проведено реплицирование данных GWAS в отношении двух полиморфизмов rs11212617 гена ATM и rs2464196 гена HNF1A. Показано, что наличие генотипа АА полиморфизма rs2464196 гена HNF1A ассоциировано с ИМ в сочетании с СД 2 типа в общей группе (ОШ =3,1895% ДИ 1,206-8,387, р=0,015) и среди женщин (ОШ =9,7% 95% ДИ 1,188-79,325, p=0,011). При определении значимости аллелей изучаемых генотипов выявлено, что наличие аллеля А ассоциировано с ИМ в сочетании с СД 2 типа, по сравнению с группой сравнения (ОШ =1,595% ДИ 1,032-2,331, р=0,034). При изучении ассоциации полиморфизма rs11212617 гена ATM с ИМ при СД 2 типа достоверно выявлено, что генотип СС выполняет условно протективную роль в отношении развития ИМ у женщин с СД 2 типа (ОШ =0,300, 95% ДИ 0,119-0,757, р=0,009); наличие аллеля С также выполняет условно протективную функцию в группе женщин (ОШ =0,579, 95% ДИ 0,346-0,978, р=0,040), аллель А ассоциирован с ИМ в сочетании с СД 2 типа (ОШ =1,728; 95% ДИ 1,022-2,892, р=0,040).
По данным литературы ген HNF1A в первую очередь ассоциируется с развитием MODY-диабета (HNF1A-MODY; MODY3) [13]. Кроме этого, в ряде исследований было показано, что полиморфизмы гена HNF1A ассоциированы с развитием ИБС, ИМ, СД 2 типа, дислипидемией и артериальной гипертензией [14]. Так, например, в одном из исследований была показана ассоциация полиморфизмов rs2464196, rs2259820, rs1169288 и rs2650000 гена HNF1A с ИБС и инсультом [8]. В отношении гена АТМ имеется несколько крупных исследований по ассоциации маркера rs11212617 с СД 2 типа и ССЗ. В исследовании, проведенном в Германии, авторы оценили ассоциацию полиморфизма rs11212617 гена АТМ с риском развития ИБС у мужчин. Показали, что аллель А полиморфизма rs11212617 гена АТМ ассоциирован с риском развития ИБС [15]. В другом исследовании по изучению влияния rs11212617 гена АТМ на эффективность лечения метформином авторы выявили, что данный полиморфизм играет роль не только в эффективности лечения СД 2 типа, но влияет на развитие ИБС и ИМ у пациентов с СД 2 типа [9]. Стоит отметить, что исследования по изучению ассоциаций полиморфизмов rs2464196 гена HNF1A и rs11212617 гена АТМ с риском развития ИБС не многочисленны, а по изучению ИМ у пациентов с СД 2 типа единичны. Это определило выбор данных молекулярно-генетических маркеров в нашем исследовании и позволило, соответственно цели работы, проверить наличие ассоциации rs2464196 гена HNF1A и rs11212617 гена ATM с вероятностью развития ИМ в сочетании с СД 2 типа.
Ограничения исследования. Данное исследование является локальным, ограничено небольшой выборкой пациентов. Планируется увеличение выборки и длительности исследования.
Заключение
В настоящем исследовании было проведено реплицирование данных GWAS в отношении двух ОНП: rs2464196 гена HNF1A, rs11212617 гена ATM. Выявлено, что наличие генотипа АА полиморфизма rs2464196 гена HNF1A ассоциировано с развитием ИМ в сочетании с СД 2 типа (ОШ =3,180, 95% ДИ 1,206-8,387, р=0,015 без разделения по полу, ОШ =9,706, 95% ДИ 1,188-79,325, p=0,011 в группе женщин). Полученные данные можно использовать при персонифицированном подходе оценки развития ИМ в сочетании с СД 2 типа.
Отношения и деятельность. Исследование выполнено в рамках бюджетной темы государственного задания Минздрава России № АААА-А18-118030790009-4 “Влияние различных стратегий лечения с использованием молекулярно-генетических маркеров на отдаленные исходы острого коронарного синдрома” и гранта Пфайзер № 63312535 “New prognostic markers of atrial fibrillation in patients with acute myocardial infarction and type 2 diabetes mellitus”.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Толмачева А.А., Ложкина Н.Г., Максимов В.Н., Гуражева А.А., Рагино Ю.И. Молекулярно-генетические маркеры инфаркта миокарда в сочетании с сахарным диабетом 2 типа. Российский кардиологический журнал. 2022;27(2S):4605. https://doi.org/10.15829/1560-4071-2022-4605
Скопировать