Математические модели и искусственный интеллект для исследования проблемы диссинхронии желудочков и улучшения эффективности сердечной ресинхронизирующей терапии
Аннотация
Обзор посвящен современному состоянию применения методов искусственного интеллекта (ИИ), математического моделирования (ММ) и их комбинации в анализе механизмов сердечной диссинхронии и ее коррекции при помощи сердечной ресинхронизирующей терапии (СРТ). Недавние научные статьи и обзоры демонстрируют высокую перспективность применения ИИ и ММ в персонализированной медицине, но также выявляют существующие препятствия к их внедрению в клиническую практику. Обсуждаемые работы посвящены ряду актуальных задач клинической кардиологии: анализу фенотипов пациентов с сердечной диссинхронией, поиску новых прогностических факторов эффективности СРТ, оптимизации стимуляции, построению высокоточных предиктивных моделей ответа на СРТ. Впервые дается обзор работ, в которых предлагаются комбинированные подходы с использованием механистических ММ и ИИ. Такие подходы открывают новые горизонты применения персонифицированных моделей сердца и для генерации реалистичных синтетических данных (цифровых двойников), на которых обучаются модели ИИ, и в качестве предикторов, которые наряду с клиническими признаками используются в обученных прогностических моделях ИИ для повышения точности персонифицированной диагностики, прогноза эффективности и оптимизации лечения.
Обзор состоит из трех разделов, сфокусированных на исследованиях с использованием: 1) ИИ; 2) персонифицированных ММ желудочков сердца; 3) комбинированных подходов (ММ+ИИ).
Обзор дает представление о современном состоянии применения методов искусственного интеллекта (ИИ), компьютерного моделирования, в т.ч. использования персонифицированных сердечных моделей, а также их комбинации в исследованиях, посвященных анализу механизмов сердечной диссинхронии и ее коррекции при помощи электрокардиотерапии и, в частности, сердечной ресинхронизирующей терапии (СРТ). Природа сердечной диссинхронии разнообразна, она может быть обусловлена хроническими нарушениями функции проводящей системы, генетически-обусловленными заболеваниями, хроническими последствиями ишемии, постинфарктными повреждениями миокарда, приводящими к и/или сопровождающими хроническую сердечную недостаточность (ХСН). В данной работе мы сосредоточимся на обзоре только тех публикаций, где исследуются клинические данные пациентов, направляемых на СРТ согласно существующим клиническим рекомендациям [1]. Среди основных рекомендаций — широкий QRS комплекс >150 мс, свидетельствующий о наличии электрической диссинхронии возбуждения желудочков, низкая фракция выброса (ФВ) левого желудочка (ЛЖ) <35%, как основной признак ХСН, и специфическое нарушение функции проводящей системы сердца — полная блокада левой ножки пучка Гиса (БЛНПГ), которая может быть как причиной, так и следствием ХСН. Именно для таких пациентов эффективность имплантации устройств СРТ, обеспечивающих стимуляцию предсердия и одного или двух желудочков сердца с целью его более синхронного возбуждения и сокращения, была доказана в многочисленных клинических исследованиях, продемонстрировавших улучшение гемодинамических показателей сердца и общего состояния пациентов. Однако, несмотря на рекомендованный отбор кандидатов на СРТ и получение ими оптимального медикаментозного лечения, у 30-50% пациентов не наблюдалось улучшения состояния после проведения дорогостоящей и небезопасной процедуры. В связи с этим продолжается активный поиск новых, более чувствительных и специфичных характеристик состояния пациентов, которые повысят точность прогноза ответа и улучшат отбор потенциальных кандидатов на СРТ. Кроме этого, разрабатываются новые подходы для оптимизации процедуры, в т.ч. с применением мультисайтовой стимуляции ЛЖ, стимуляции пучка Гиса или проводящей системы, а также комбинации различных вариантов стимуляции [2][3]. Среди основных параметров оптимизации СРТ рассматривается выбор целевого расположения стимулирующих электродов, в частности левожелудочкового электрода (ЛЖЭ), при бивентрикулярной (BiV) стимуляции, наиболее часто применяемой в клинической практике. В современных работах авторы акцентируют внимание на необходимости применения индивидуального подхода к пациенту в отличие от традиционной практики, основанной на популяционных правилах. В данном обзоре мы фокусируем внимание читателя на применении современных цифровых технологий для персонифицированной медицины — ИИ и компьютерного моделирования, которые активно развиваются в последние несколько лет и все более успешно заявляют о себе как об эффективных инструментах в помощь принятия решений врачу.
Внедрение ИИ во многие сферы человеческой деятельности не обошло стороной и медицину. Ярким примером тому может служить радиомика, т.е. компьютерный анализ медицинских изображений с целью извлечения специфических признаков для дальнейшего фенотипирования болезней или построения прогностических моделей различной направленности. Кроме того, ИИ уже сейчас широко применяется для автоматической сегментации медицинских снимков, что значительно упрощает жизнь рентгенологам и другим врачам. Способность алгоритмов машинного обучения (ML) выявлять сложные нелинейные связи между параметрами может помочь в прогнозировании исходов лечения, в частности, в кардиологии.
В последнее время появились обзорные работы, описывающие применение ИИ в терапии сердечной недостаточности. Например, в своем обзоре Gautam N, et al. [4] отмечают большое количество данных, считываемых носимыми устройствами и датчиками (тоны сердца, грудной импеданс, частота дыхания, частота сердечных сокращений, электрокардиограмма (ЭКГ), фотоплетизмограмма), что может значительно увеличить точность существующих алгоритмов ML. При этом остается проблемой интеграция этих данных в единые базы медицинской информации для последующей структуризации и использования их в обучении моделей.
Среди проблем, стоящих на пути внедрения ИИ в рутинную клиническую практику, авторы выделяют использование ретроспективных данных, зачастую малого объема, которые невозможно обобщить на целую популяцию. Плохая интерпретируемость результатов ИИ мешает принимать клинически обоснованные решения. Воспроизводимость результатов некоторых моделей вызывает вопросы в связи с отсутствием публично доступных обучающих данных и самих алгоритмов, поэтому, чтобы справиться с проблемой генерализуемости и валидации, необходимы большие открытые базы данных.
В отношении применения ML для решения задач ресинхронизации сердца, авторы указывают на возможность фенотипирования пациентов по вероятности ответа на лечение и оценки риска гибели пациента в заданный период на основе данных ЭКГ, эхокардиографии (ЭхоКГ), клинических и других важных признаков (например, амплитуда деформации, наличие аномального движения перегородки (септальный флэш), вид кардиомиопатии, пол, возраст и т.д.), а также клинических визуализаций различных модальностей. В первой части нашего обзора мы обсудим несколько недавних обзоров и оригинальных статей, посвященных применению ИИ для оптимизации СРТ.
Многомасштабные компьютерные модели сердца являются важным инструментом исследования сердечной функции, который основан на надежных физических представлениях, предоставляет полный контроль над параметрами эксперимента, обеспечивая его воспроизводимость и возможность комплексной оценки механизмов работы сердца в норме и при патологии. Компьютерные многомасштабные модели включают математическое описание биологических процессов в клетках и ткани, а также представление об анатомических структурах органа. Такие модели в зарубежной литературе часто называют механистическими (или основанными на теории). Большая часть оригинальных работ и обзоров, посвященных сердечным механистическим моделям и их успешному использованию в фундаментальной и клинической медицине, сосредоточены на их применении для анализа механизмов сердечных аритмий и их лечения [5]. Значительно меньше работ посвящено моделированию нарушений механической функции сердца и проблеме ХСН [6]. Во втором разделе статьи мы сосредоточимся на применении механистических моделей к решению еще более конкретных проблем, связанных с диссинхронией сердца и ресинхронизацией.
Благодаря развитию реалистичных механистических компьютерных моделей сердца и появлению разнообразных методов ИИ объединение этих перспективных методов генерации и анализа данных представляет новые возможности для исследования механизмов сердечных патологий и открывает новую эпоху в применении цифровых технологий в кардиологии. Возможности механистических (биофизических, биомеханических) моделей исследовать более широкий набор переменных, которые затруднительно или невозможно наблюдать в клинике, могут позволить не только улучшить точность, но и объяснимость моделей ИИ, сделать прогнозы ИИ интерпретируемыми на уровне механизмов, лежащих в основе функции сердца. Возможность моделирования предсказывать ответы миокардиальной системы в различных условиях и при широком диапазоне варьируемых параметров, что также практически невозможно реализовать в клинических испытаниях, дает огромный материал для обучения моделей ИИ, которые затем можно тестировать и на ретроспективных клинических данных, и в проспективных клинических исследованиях. Более того, можно объединять и реальные клинические данные, и виртуальные результаты механистических моделей, имитирующие ответы сердца пациентов на предполагаемое воздействие, чтобы до проведения того или иного воздействия оценить его эффективность и в популяции (виртуальные клинические исследования), и персонально для конкретного субъекта (персонифицированная медицина). Такие комбинированные алгоритмы применения математических моделей и методов ИИ должны помочь в выборе инструментов и решений для персонифицированной терапии и повысить эффективность диагностики, лечения и профилактики ухудшения состояния пациентов.
Целый ряд успешных примеров применения перспективного комбинированного подхода (математическое моделирование (ММ) + ИИ) [7-11] был продемонстрирован в работах, посвященных анализу механизмов, поиску субстрата и выбору стратегии лечения сердечных аритмий. Для знакомства с ними мы адресуем читателя к недавним обзорам [12-14]. В отношении проблематики сердечной диссинхронии такие работы пока единичны. В третьем разделе нашего обзора мы остановимся именно на этих работах, которые появились в последние несколько лет. Начнем мы с короткого описания собственных работ, которые предлагают пионерский и, на наш взгляд, потенциально эффективный подход использования в моделях ИИ комбинированных клинических и расчетных данных, полученных в механистических моделях, для улучшения персонифицированного отбора пациентов на СРТ и оптимизации ее проведения для конкретного пациента. Далее мы сделаем обзор других работ и обсудим сходство и отличия применяемых подходов и постановок задач, а также перспективы развития новых технологий рассматриваемой области цифровой кардиологии.
ML в изучении сердечной диссинхронии и ресинхронизации
В систематическом обзоре [15] Nazar W, et al. исследуют две группы алгоритмов ML — с учителем (20 моделей) и без учителя (9 моделей) в контексте их применимости в качестве альтернативы традиционным клиническим рекомендациям по отбору пациентов для СРТ. Были проанализированы результаты, полученные на когортах свыше 100 пациентов, которым были установлены пейсмейкеры и дефибрилляторы СРТ. Большинство моделей ИИ были основаны на данных, собранных в ходе ретроспективных когортных исследований (n=16,55%). Оставшиеся включали в себя проспективные когортные исследования (n=8,28%), рандомизированные контролируемые исследования (n=5,17%) и исследования типа «случай-контроль» (n=1,3%). Медиана числа пациентов составила 328 [ 117; 1668] человек. Конечные точки делились на ЭхоКГ (снижение конечно-систолического объема, увеличение ФВ ЛЖ) и клинические (смерть, госпитализация, изменение функционального класса и т.д.). Медиана достижения первичной контрольной точки (как правило смерть, уменьшение конечного систолического объема ЛЖ, улучшение ФВ ЛЖ) — 47% (диапазон 15-78%). Наиболее часто используемым алгоритмом без учителя оказался k-means. Все модели сумели выявить фенотипы со значимо худшим прогнозом терапии. В алгоритмах с учителем медиана ROC AUC для предсказания респондеров составила 0,76 (диапазон 0,69-0,81) и 0,75 (диапазон 0,69-0,86) для ЭхоКГ и клинических исходов соответственно.
Анализ авторами выявленных кластеров вероятностей ответа на СРТ показал, что более благоприятные исходы (определяемые отношением рисков) наиболее часто были ассоциированы с наличием БЛНПГ, широкого QRSd, неишемической кардиомиопатией и меньшей дилатацией желудочков. В дополнение к этому, многие клинические, демографические, электрокардиографические и ЭхоКГ признаки, выявленные с помощью моделей ИИ с учителем, были прогностическими для ответа на СРТ. Следовательно, необходимо включать в оценку широкий спектр факторов риска сердечно-сосудистых заболеваний. Более того, идентификация тех же самых предикторов ответа на СРТ, что и в клинических рекомендациях, с помощью моделей ИИ подтверждает надежность и достоверность использования ИИ в этой области.
Основные выводы, которые делают авторы: модели ИИ более точно определяют респондеров по сравнению с существующими рекомендациями (точность >80% vs 70%), и их использование возможно и оправдано в клинической практике. Кроме того, они отмечают сложности с определением ответа в группе мужчин без БЛНПГ с ишемической кардиомиопатией и QRSd <150 мс.
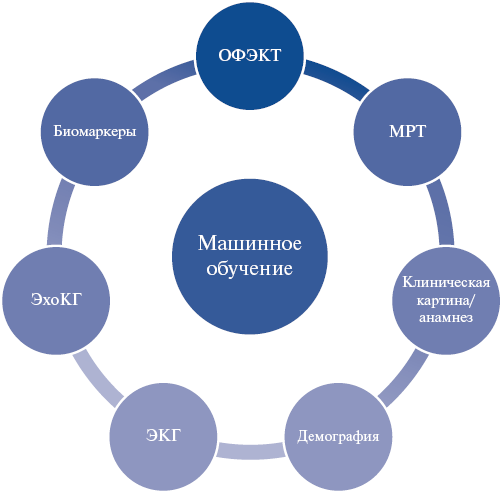
Качество модели ML напрямую определяется данными, которые используются для обучения. Как уже отмечалось выше, данными могут являться: демографические характеристики, результаты анализов, особенности заболевания, анамнез, изображения и видео, показания диагностических приборов и в последнее время результаты моделирования тех или иных биологических и физиологических процессов (рис. 1). Далее мы рассмотрим особенности применения различных данных в работах последних лет по теме использования ML в СРТ.
Мы приводим обзор недавних оригинальных статей, посвященных применению ИИ к анализу клинических данных пациентов, прошедших процедуру СРТ. В таблице ЭП1 (см. приложение) представлена краткая информация о рассмотренных исследованиях и их основные результаты.
В исследовании Cai C, et al. [16] использовался широкий спектр предоперационных клинических характеристик для разработки классификатора ответа на СРТ (увеличение на 5% ФВ ЛЖ через 6 мес.). Они включали: демографические данные пациентов (возраст и пол), сопутствующие заболевания, лабораторные анализы и полученные данные ЭКГ (частота сердечных сокращений, интервал PR, QRSd, интервал QT) и допплеровской ЭхоКГ за 12 мес. до начала операции. Всего было проанализировано 487 параметров. Отбор признаков проводился при помощи нейронной сети. Классификатором ответа авторы выбрали ансамбль равнозначных алгоритмов (bagging/adaboost/xgboost) с целью избежать переобучения и добиться наибольшей генерализации входных данных. Целью было изучение зависимости качества предсказаний от используемого набора данных. Группы признаков выглядели следующим образом: (1) CRT Guide = предиктор на основе клинических рекомендаций (QRSd >120 мс, БЛНПГ, блокада правой ножки пучка Гиса (БПНПГ), нарушение внутрижелудочковой проводимости), (2) CRT Base = CRT Guide + демография + результаты ЭхоКГ + медикаменты, (3) CRT Labs = CRT Base + результаты лабораторных исследований, (4) CRT Clinical = CRT Labs + сопутствующие заболевания, (5) CRT ECG = CRT Clinical + параметры ЭКГ. Результаты предсказаний на первой группе были наименее впечатляющими (ROC AUC =0,56). При переходе из второй в третью группу качество предсказаний практически не изменилось (ROC AUC =0,69 и 0,70). Переход в четвертую и пятую группы сопровождался повышением метрик на три процентных пункта каждый раз (ROC AUC =0,73 и 0,76). Таким образом, переход из первой в пятую группу добавил 35% к площади под ROC-кривой. Данный факт говорит о необходимости расширения набора критериев для отбора пациентов для СРТ.
В похожем исследовании Haque A, et al. [17] изучалось влияние биохимических биомаркеров (таких как матриксная металлопротеиназа 2, растворимый супрессор туморогенности 2, C-реактивный белок, рецептор фактора некроза опухоли 2 и т.д.) на качество предсказаний. Увеличение ROC AUC при добавлении маркеров к функциональным и демографическим признакам составило 5%.
Gallard A, et al. [18] использовалась комбинация только ЭхоКГ и ЭКГ признаков для предсказания вероятности ответа на СРТ в виде снижения конечно-систолического объема (ESV, end-systolic volume) на 15% в течение полугода после операции. Данные были предоставлены тремя клиниками Франции, Норвегии и Бельгии и включали в себя информацию о пациентах, прошедших СРТ в период с 2010 по 2017гг. Условием включения в исследование были показания к СРТ: симптоматическая сердечная недостаточность, ФВ <35%, QRSd >120 мс [19].
Данные для моделей ML включали интегральные и локальные параметры стрейна в 16-ти сегментах АНА (амплитуда, время), ширину QRS, наличие септального флэша (аномального внутрь направленного движения перегородки до начала систолы), конечно-диастолический объем и др. Всего из 311 признаков было отобрано 14, которые затем отправлялись на вход классификатору случайного леса. Площадь под ROC-кривой составила 0,81. Наиболее значимыми признаками оказались: наличие септального флэша (присутствует у 78% респондеров и у 34% нереспондеров), максимальная скорость кровотока при расслаблении ЛЖ в раннюю диастолу (Е), отношение максимальных скоростей раннего и позднего наполнения трансмитрального кровотока (E/A). Интересно отметить, что ширина QRS оказалась лишь на 13 месте в списке значимых признаков.
Важным источником информации о работе сердца является магнитно-резонансная томография (МРТ). Ее применение в задачах классификации может увеличить точность предсказаний. Так, в работе Bivona DJ, et al. [20] используется целый спектр предоперационных исследований, таких как результаты анализов, параметры ЭхоКГ и электрокардиографии, функциональная МРТ и применявшиеся медикаменты. Всего было отобрано 39 признаков, которые подавались на вход линейной регрессии для предсказания комбинированной трехфакторной конечной точки. Результаты регрессии использовались для кластеризации пациентов на три группы в соответствии со степенью вероятности быть респондером (61,5% пациентов в группе высокой вероятности, 22% — в группе промежуточной вероятности и 16,5% в группе низкой вероятности). Затем принадлежность к тому или иному кластеру включалась в набор из четырех признаков для предсказания 4-летней выживаемости после СРТ при помощи логистической регрессии (LR). Три других признака, наиболее важные для предсказания респондеров, оказались следующими: CURE-SVD (показывает, насколько равномерно сокращаются и укорачиваются стенки ЛЖ, определяется по МРТ), уровень натрийуретического пептида В-типа в сыворотке крови до операции и пиковое значение потребления кислорода. Разница в ROC AUC между классификацией с использованием кластеров и без нее составила 10% (0,86 vs 0,78). Это говорит о потенциальном ответе на СРТ как о важном предикторе долгосрочной выживаемости пациентов с ХСН.
Попытка построить предсказательную модель, основанную целиком на данных кино-МРТ, была предпринята в Puyol-Antón E, et al. [21]. Для этого вариационный автоэнкодер (англ. Variational AutoEncoder) предобучался на 10 тыс. снимках сердца из медицинской базы данных Великобритании (как здоровых, так и патологических) и дообучался на снимках 73 пациентов с ХСН. Автоэнкодер состоит из двух нейронных сетей, одна из которых является кодировщиком (последовательно снижает размерность данных, оставляя наиболее важные особенности), а другая — декодировщиком (восстанавливает размерность, основываясь на результате работы кодировщика). Цель — добиться наибольшего сходства между изображением на входе и на выходе. Полученные опорные признаки автоэнкодера отправлялись на вход классификатору полносвязной нейронной сети, которая предсказывала ответ на СРТ (снижение ESV ЛЖ на 15% в течение 6 мес.). Поскольку нейронные сети известны своей плохой интерпретируемостью, авторы добавили в алгоритм процесс определения септального флэша на тех же признаках, чтобы клиницист мог обосновать полученный моделью результат. В принципе, наряду с септальным флэшем модель можно научить выделять любые другие признаки, которые определяются по данным МРТ. Чувствительность и специфичность предложенной модели в задаче прогнозирования ответа на СРТ составляют 88,43% и 84,39%, что является очень хорошим показателем, учитывая, что никаких других клинических признаков не использовалось. Тем не менее небольшая выборка пациентов заставляет относиться к этим результатам с настороженностью. Кроме того, МРТ является относительно дорогостоящим и не всегда доступным исследованием, и понимая это, те же авторы [22] разработали методику прогнозирования ответа на СРТ при помощи данных ЭхоКГ. Ключевая особенность заключается в использовании канонического корреляционного анализа для связи изображений двух модальностей (МРТ и ЭхоКГ) в единый вектор признаков, на котором обучается предсказательная модель (метод опорных векторов). При этом для тестирования (соответственно, и применения в клинике) использовались только изображения двухмерного ЭхоКГ, что значительно повышает применимость алгоритма на практике. Разница в точности предсказаний между алгоритмами, обученными только на ЭхоКГ и на МРТ + ЭхоКГ, составила 6% (72,9% vs 77,4%, соответственно). Однако, опять же, тестовая выборка состояла из крайне малого числа пациентов (12 человек, 7 респондеров).
Продолжая тему использования «сырых» данных, упомянем об исследовании Wouters PC, et al. [23], где авторы предложили регрессионную модель предсказания комбинированной конечной точки и ответа на СРТ (имплантация вспомогательного устройства для работы ЛЖ, трансплантация сердца или смерть от любой причины) на основе лишь сигнала ЭКГ (ROC AUC =0,69, протестировано на 1306 пациентах). Статья демонстрирует принципиальную возможность клинического внедрения прогностических информационных моделей, которые эффективны как с точки зрения сбора данных, так и с точки зрения точности прогнозирования ответа на СРТ. Модель находится в открытом доступе. Более того, когда к исходной модели ЭКГ были добавлены дополнительные клинические данные, авторы заметили увеличение качества всего на 4,3% (с 0,69 до 0,72). Таким образом, пожертвовав небольшим снижением прогностической точности, можно добиться значительного увеличения потенциальной клинической применимости.
ИИ также может использоваться не только на предоперационном, но и на послеоперационном этапе. Krzowski B, et al. [24] применяют сверточные нейронные сети для оценки эффективности СРТ по данным 30-секундного сигнала ЭКГ. Данные размечались на несколько паттернов активации врачом-специалистом (эффективная/неэффективная стимуляция, собственный ритм), и по этим данным обучался классификатор. Такой подход может использоваться в случае необходимости обработать большое количество данных за обозримый срок (например, для создания обучающей выборки) или при недостатке квалифицированных специалистов, хотя при этом возникает вопрос об ответственности за принимаемые решения.
Еще одним методом получения информации об активности сердца является однофотонная эмиссионная компьютерная томография (ОФЭКТ). He Z, et al. [25] применяют автоэнкодер для поиска более устойчивой к искажениям альтернативы фазовому стандартному отклонению и ширине фазовой гистограммы как параметрам диссинхронии ЛЖ. В наборе из клинических признаков и ширины фазовой гистограммы классификатор ответа на СРТ показал ROC AUC 0,69, в то время как в наборе из клинических и отобранных автоэнкодером признаков — 0,72. Среди преимуществ авторы отмечают отсутствие необходимости в ручной предобработке данных.
Данные ОФЭКТ использовались также в исследовании de A Fernandes F, et al. [26]. В нем также прогнозировался ответ на СРТ, но уже с двумя вариантами положительного исхода: респондеры (увеличение ФВ ЛЖ на 5% в течение полугода) и суперреспондеры (увеличение ФВ ЛЖ на 15%). Модели обеих конечных точек на первом месте по значимости имели признаки, определяемые по ОФЭКТ, что говорит о высокой важности данного метода исследования при сердечной недостаточности.
Несмотря на большой диапазон различных методов диагностики сердечных патологий, клиническая применимость модели ML зависит от практической осуществимости всех необходимых для этой модели исследований. В других работах [27-29] авторы сконцентрировались на предсказании ответа на СРТ [27, 29] и пятилетней выживаемости [28], ограничиваясь лишь рутинно собираемыми данными. Наибольшую точность достигла модель Tokodi (ROC AUC =0,79). В двух моделях наличие БЛНПГ является значимым предиктором достижения конечной точки. Кроме того, предлагаются онлайн-калькуляторы.
Из десяти моделей ML, предсказывающих ответ на СРТ, девять имеют площадь под ROC-кривой >0,7 (рис. 2). Наилучшие результаты из всех показала модель предсказания смертности Bivona (ROC AUC =0,86), в которой использовалась комбинация большого числа признаков (МРТ, ЭхоКГ, ЭКГ, биохимия, функциональное состояние и т.д.).
К сожалению, не все исследования имеют одинаковые конечные точки, методы оценки качества и валидации моделей, поэтому прямое сравнение провести не удалось. Это еще раз поднимает проблему внешней независимой оценки как гарантии клинической применимости новых методов в медицине.

Рис. 1. Применение различных данных в статистических моделях.
Сокращения: МРТ — магнитно-резонансная томография, ОФЭКТ — однофотонная эмиссионная компьютерная томография, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография.

Рис. 2. Значения метрик предсказания ответа на СРТ.
Сокращение: СРТ — сердечная ресинхронизирующая терапия.
ММ сердечной диссинхронии и ее коррекции
Среди единичных обзорных работ, сфокусированных на применении компьютерных моделей сердца в исследованиях диссинхронии сокращений сердца и СРТ, остановимся на недавней статье Lee AWC, et al., 2018 [30]. Здесь дается обзор исследований, в которых компьютерные модели применялись для изучения влияния свойств эндокардиального слоя миокарда и постинфарктных рубцов на электрическую и механическую диссинхронию при БЛНПГ и стимуляции желудочков, для выбора оптимального расположения стимулирующих электродов и внутрисердечных задержек активации электродов с точки зрения улучшения модельных признаков диссинхронии желудочков, а также для изучения потенциала новых способов стимуляции желудочков, применяемых с развитием технологий СРТ, в т.ч. многосайтовой стимуляции или эндокардиальной стимуляции ЛЖ. Авторы обзора отмечают, что основными причинами, препятствующими применению моделей в клинической практике, являются: 1) отсутствие вычислительных инструментов, которые бы позволяли выполнять персонализацию моделей и расчеты в клинически реализуемые временные рамки и не требовали при этом от специалиста экспертных знаний в области вычислительного моделирования и построения сеток; 2) недостаток данных, в т.ч. инвазивных, требуемых для персонализации модели; 3) большой объем вычислительных ресурсов, главным образом, времени, для расчета моделей. Отмечалась необходимость демонстрации надежности прогнозов моделей и количественной оценки погрешности таких прогнозов, связанных как с допущениями моделирования, так и точностью входных данных.
Со времени написания обзора прошло более 6 лет. За этот период появились новые работы и новые подходы, использующие компьютерные модели для анализа проблемы электрической и механической диссинхронии активности миокарда и ее коррекции при помощи СРТ.
Ниже мы проанализировали 17 статей, опубликованных после 2020г, в которых персонифицированные компьютерные модели сердечной функции (от 2-х и более моделей) используются в исследованиях СРТ (см. краткую информацию о целях проведенных исследований, клинических данных, моделях и полученных результатах в таблице ЭП2 в приложении к статье). Работы нашего научного коллектива представлены в следующем разделе, где описываются результаты исследований с использованием комбинированного подхода применения компьютерного моделирования активности сердца и ML. Можно выделить несколько основных целей применения вычислительных моделей: 1) для определения области поздней активации ЛЖ, как одной из потенциальных целевых зон для установки ЛЖЭ при BiV-стимуляции, 2) для поиска новых предикторов ответа на СРТ, 3) для исследования возможностей новых техник стимуляции при CРT, 4) для оптимизации расположения электродов при различных методах стимуляции желудочков, 5) для предсказания респондеров/нереспондеров на СРТ.
Виды моделей, применяемых в исследованиях диссинхронии и СРТ
В зависимости от целей моделирования и описания тех или иных биофизических свойств и процессов, многомасштабные модели сердца на органном уровне могут включать различные комбинации из четырех основных блоков, описывающих биологические процессы в миокарде в различной степени детализации. В данном обзоре мы остановимся только на моделях желудочков сердца, как наиболее значимых камер в определении феномена диссинхронии сокращения сердца и возможности ее электрокардиотерапии.
1) Анатомическая модель желудочков — представление геометрии желудочков как конечно-элементной сетки, построенной по реальным клиническим данным компьютерной томографии (КТ), МРТ, или при помощи идеализированных объектов. Модели могут содержать информацию о поврежденных участках миокардиальной ткани — фиброзе, постинфарктных рубцах, жировых инфильтратах и др., которые могут влиять на электрическую и механическую функцию миокарда.
2) Электрофизиологическая модель миокарда — воспроизводит электрическую активацию (возбуждение) миокарда при распространении динамической волны изменения мембранного потенциала в сердечных клетках ткани в геометрической области заданной формы. Эти модели опираются на клеточные ионные модели генерации потенциала действия в клетке, а также описывают сердечную ткань, как проводящую анизотропную среду с различными свойствами проводимости вдоль и поперек миокардиальных волокон. Временной ход активации сердца зависит от источников начальной активации миокарда, которые имитируют либо естественный ход возбуждения с участием проводящей системы сердца, либо воспроизводят искусственную стимуляцию сердца при помощи устройств электрокардиотерапии, например, традиционную BiV-стимуляцию желудочков из точечных источников, установленных в определенных зонах поверхности правого желудочка (ПЖ) и ЛЖ. Результатом модели служат динамические карты мембранного потенциала в миокарде, а также активационные карты — т.е. карты времени прихода волны возбуждения в локальные участки миокарда. На основе этих данных рассчитываются разнообразные показатели электрической активности желудочков, в т.ч. полное время активации обоих и каждого из желудочков (TAT, total activation time); индексы межжелудочковой диссинхронии, например, задержка активации ЛЖ по отношению к ПЖ; индексы внутрижелудочковой диссинхронии, например, вариабельность времени активации ЛЖ, задержка активации боковой стенки по сравнению с перегородкой; а также другие пространственные и временные показатели. Наряду с активностью сердца могут рассчитываться временные карты потенциала на поверхности тела и соответствующие сигналы ЭКГ. На их основе рассчитываются количественные признаки ЭКГ, которые традиционно оцениваются в клинике, и по которым может происходить либо настройка параметров модели и даже персонализация модели по индивидуальным данным, либо верификация предсказаний модели. Детальный обзор существующих электрофизиологических моделей от клеточного до органного уровня с описанием уравнений моделей и их применения к разнообразным задачам электрофизиологии и кардиологии можно найти в недавней статье Bai J, et al. [12].
3) Модель механики миокарда — описывает механическую деформацию и напряжение миокарда в течение цикла сокращения, на основе которых может рассчитываться изменение объема полости желудочков, давление, работа и другие характеристики сократительной и насосной функции сердца, в т.ч. индексы механической активности и диссинхронии желудочков: ФВ ЛЖ, задержка сокращения между желудочками, вариабельность пика механической активности внутри ЛЖ и другие [6].
4) Модель циркуляции крови (гемодинамики) — описывает кровоток в закрытой системе кровообращения и позволяет воспроизвести равенство объема крови, поступающей в ПЖ и выбрасываемой из ЛЖ [31][32].
Конечно, в реальном сердце электрические и механические процессы взаимосвязаны прямыми и обратными связями и вместе влияют на гемодинамику и зависят от нее. Прямые и обратные связи между возбуждением и сокращением описываются в электромеханических моделях миокарда от клеточного до органного уровня, в т.ч. сопряженных с моделями циркуляции [33]. Однако, в соответствии с целями исследования, а также исходя из наличия определенных входных данных и разработанных инструментов для моделирования, ситуацию часто упрощают: те или иные блоки модели заменяют феноменологическими описаниями, позволяющими разделить процессы между собой. Поэтому далее мы будем рассматривать электрофизиологические модели, не содержащие механических переменных; механические модели, не описывающие в деталях процессы активации; объединенные электромеханические модели, связывающие электрические и механические процессы в миокарде и интегративные модели, содержащие все 4 блока — сердечно-сосудистые модели.
Расчет многомасштабных моделей, а особенно электромеханической связи [30], имеет высокую вычислительную стоимость. Для ускорения вычислений могут применяться редуцированные модели, упрощающие описание тех или иных процессов. Например, часто исследователя интересует только характер распространения фронта волны электрического возбуждения, а этого бывает достаточно, например, для расчета QRS комплекса ЭКГ. Тогда вместо трудоемких бидоменных или монодоменных моделей, описывающих временной ход изменения внутриклеточного и внеклеточного потенциала в миокарде в виде уравнений реакционно-диффузионного типа, можно использовать очень эффективные и быстро рассчитываемые модели эйконала, описывающие непосредственно время активации миокарда на основе параметров электропроводности ткани [34-36]. Вместо сложных механических моделей, основанных на уравнениях механики деформируемого тела, можно использовать редуцированные модели, в т.ч. и регрессионные, которые позволяют проводить расчет механических переменных на основе феноменологических правил (см. обзоры [30][37], а также оригинальные работы с участием нашей группы [38]). Кроме того, для упрощения моделирования реалистические модели геометрии желудочков заменяются простыми суррогатными моделями. Примером такой модели, в которой выходными параметрами являются механические и гемодинамические характеристики, является CircAdapt (www.circadapt.org) [39]. По аналогии с анатомическими моделями, применяемыми для решения различных клинических задач, в версии CircAdapt MultiPatch реализована возможность деления стенки желудочка на определенное количество сегментов, что позволяет назначать сегментам локальные свойства, например, различное время локальной активации, и частично сохранять информацию о пространственной неоднородности миокарда.
Среди рассматриваемых далее работ в десяти статьях использовались электрофизиологические модели 2-х желудочков (BiV модели) [40-48] или только ЛЖ [49]; в одной статье рассмотрена механическая модель ЛЖ [50] и в одной электромеханическая BiV модель [51]; в двух статьях представлены сердечно-сосудистые модели с 2-мя желудочками [52][53]; в двух статьях — сердечно-сосудистые модели CircAdapt с редуцированными моделями ЛЖ (18 сегментов) [54] или ПЖ (6 сегментов) [55]. Наконец, в Taconné M, et al., 2024 [56] использовалась редуцированная сердечно-сосудистая модель с 16-сегментным ЛЖ и 3-сегментным ПЖ.
В обзоре Lee AWC, et al., 2018 [30] сообщалось, что наиболее распространенными для исследования электрического ответа на стимуляцию желудочков являются монодоменные модели. В проанализированных нами недавних работах, бидоменные или монодоменные модели использовались значительно реже, всего в трех статьях [45][52][53], а большинство авторов для электрофизиологических моделей применяли уравнения эйконала [40-43][46-49][51]. Это отражает тенденцию к сокращению времени вычислений, что более приемлемо для клинических приложений. Еще одним вариантом упрощения расчета электрической функции миокарда является использование клеточных автоматов. Такой подход применялся в редуцированной модели из Taconné M, et al., 2024 [56].
Быстрые вычислительные модели могут позволить проводить большие серии симуляций, что важно для проведения виртуальных клинических исследований. В некоторых случаях вычисления можно проводить почти в реальном времени, что в перспективе может позволить применять такие модели интраоперационно [44][48]. Однако упрощение моделей ведет к потере информации, например, об анатомических особенностях сердца или субклеточных процессах. Таким образом, перед использованием упрощенных моделей следует убедиться, что их предсказания значимо не отличаются от предсказаний более детализированных моделей.
Персонификация параметров моделей
Как отмечалось Lee AWC, et al., 2018 [30], компьютерные модели имеют множество входных параметров, и, как следствие, персонализация моделей требует большого объема клинических измерений, в т.ч. инвазивных. Персонализированные анатомические модели, кроме непосредственно самих конечно-элементных сеток сердца, должны включать информацию о структурно-функциональных повреждениях миокарда (фиброз и постинфарктные рубцы), а также о коронарных венах, если расположение электродов связано с ними. Однако такая информация не всегда доступна. Данные о расположении и конфигурации фиброза и рубца обычно получают из МРТ исследований с усилением контрастом. Могут применяться и данные визуализации различной модальности. Например, рубец определялся как плохо перфузируемые области по данным КТ с динамической перфузией [46].
Как уже отмечалось выше, миокард — анизотропный материал, и его электрические и механические свойства отличаются в направлении вдоль миокардиальных волокон или поперек. Поэтому вопрос отображения в моделях поля направления волокон является одним из важных элементов построения реалистичных моделей. В рассмотренных работах направления волокон в миокарде не были персонифицированы в моделях. В большинстве работ ход волокон задавался по основанным на правилах алгоритмам [57]. Только в исследовании Strocchi M, et al., 2020b [51] персонифицированную ориентацию миофибрилл построили по ЭКГ-синхронизированным КТ изображениям, и в Craine A, et al., 2024 [52] топология волокон была получена на основе проецирования данных диффузионно-тензорной МРТ, полученных пост-мортум на референтном сердце, на индивидуальную геометрию желудочков конкретного пациента.
Особую проблему при моделировании электрической активности желудочков на естественном ритме представляет определение областей начальной активации миокарда. В цитируемых работах для этого использовались либо феноменологические модели проводящей системы волокон Пуркинье в виде дерева одномерных элементов [40-42], связывающих волокна Пуркинье и миокард, либо применялся так называемый быстрый эндокардиальный слой [43][46][47][53], проводимость в котором задавалась в несколько раз выше, чем в миокарде. Оба варианта моделей основывались на общих представлениях о системе Пуркинье и в большинстве работ не были персонифицированы. Только в работах [44][53] расположение зон начальной активации, связанных с волокнами Пуркинье, было оптимизировано при решении задачи минимизации различий между расчетным и клиническим ЭКГ. Но при этом авторы также не имели возможности оценить, насколько предсказанные области соответствуют реальным. В работе Taconné M, et al. [56] проводящая система моделировалась как система из пяти клеточных автоматов.
Как мы обсуждали выше, для описания возбуждения миокарда нужны клеточные модели генерации потенциала действия, а также параметры проведения возбуждения от клетки к клетке в ткани. В большинстве рассмотренных нами работ параметры клеточной активности не были персонализированы, и применялись модели, которые генерируют реалистичный усредненный сигнал потенциала действия, характерный для клеток человека в популяции. А вот параметры электропроводности миокарда в персонализированных моделях, как правило, настраиваются по индивидуальным клиническим данным. Для этого в рассматриваемых работах использовались данные инвазивного электроанатомического картирования, т.е. сигналы электрограмм, записанные непосредственно на поверхности миокарда [49]; сигналы ЭКГ, записанные на поверхности тела [44][47][53], а также преобразованные сигналы, например, векторкардиограммы, полученные из ЭКГ [52]. Для того, чтобы минимизировать разницу между вычисленными и измеренными характеристиками, наряду с фитингом параметров электропроводности [47][48][52], могут учитываться зоны ранней активации [44][53], а также геометрия постинфарктного рубца и трансмуральное распределение параметров клеточных моделей [53].
В механических моделях миокарда для персонификации механических и гемодинамических свойств миокарда авторы наиболее часто использовали данные ЭхоКГ [50][52-56], например, данные о динамических локальных деформациях (англ. strain), изменении объема желудочков. В моделях циркуляции применяли данные ультразвуковой кардиограммы о характеристиках кровообращения [53], инвазивные измерения внутрижелудочкового давления [50][52], неинвазивные измерения артериального давления [52][53]. Одним из способов персонализации редуцированных моделей была минимизация расстояния между рассчитанными и клиническими кривыми деформации сегментов [54][56], при этом большинство параметров подбиралось индивидуально для каждого сегмента. Такой подход также позволяет редуцированным моделям опосредованно учитывать влияние постинфарктного рубца, влияющего на кривые деформации.
Вслед за обзором Lee AWC, et al., 2018 [30] отметим, что входные параметры модели в разной степени влияют на характеристики диссинхронии и ответ на СРТ, поэтому в моделях, как правило, персонифицируют лишь немногие значимые параметры. Например, сообщалось о сопоставимых паттернах распространения электрической волны возбуждения при моделировании ориентации волокон, основанной на правилах, и на основе диффузионно-тензорной МРТ у животных [57][58]. Кроме того, при недоступности индивидуальных измерений можно использовать популяционные клинические данные, в соответствии с которыми будут определяться усредненные значения параметров. В рассматриваемых работах этот подход наиболее часто применялся для моделирования паттерна активации желудочков при БЛНПГ. Однако, как и в случае с применением редуцированных моделей, отказ от персонализации тех или иных параметров требует предварительного анализа чувствительности модели к их вариации, в частности, при моделировании стимуляции желудочков.
Стоит отметить, что если целью исследования не является получение индивидуального прогноза, а проводится оценка эффективности той или иной техники для групп пациентов, использование моделей с частичной персонализацией параметров представляется вполне оправданным. Так, в серии работ [40-42][48], выполненных на одном наборе из двадцати четырех конечно-элементных сеток сердца, результаты представлены для групп моделей в целом. При этом модели были персонализированы только по анатомии сердца, валидация электрофизиологических характеристик происходила на уровне групп моделей по соответствию модельных результатов диапазонам величин из литературных данных. Моделирование постинфарктного рубца осуществлялось с помощью трансляции его геометрии и расположения из другой анатомии [41][42], а в другом исследовании для расчета ЭКГ использовалась общая анатомия торса [40].
Основные результаты, полученные с использованием компьютерных моделей
В работах Sidhu BS, et al., 2023, Vergara C, et al., 2022 и Melgaard J, et al., 2022 [44][46][48] результаты электрофизиологических моделей желудочков были использованы вместе с другими клиническими визуализациями для нахождения целевой зоны, в которую необходимо имплантировать электроды устройств СРТ с целью потенциального уменьшения времени и повышения эффективности процедуры имплантации. Так, в проспективном исследовании Sidhu BS, et al., 2023 [46] перед имплантацией WiSE-CRT целевой сегмент для установки эндокардиального стимулирующего электрода в ЛЖ определялся как зона поздней электрической и механической активации с толщиной стенки ≥5 мм (предположительно без постинфарктных повреждений) и без дефектов перфузии. Зона поздней электрической активации вычислялась в электрофизиологической модели, а остальные измерения были получены из данных КТ, в т.ч. КТ с динамической перфузией. Интраоперационное тестирование подтвердило, что наилучший острый ответ на стимуляцию, оцененный как максимальное увеличение скорости нарастания внутрижелудочкового давления (dP/dtmax) по сравнению с естественным ритмом, достигался именно в целевом сегменте у всех 10 пациентов, и у 8 из них электрод был установлен в пределах целевого сегмента.
Разработанная Vergara C, et al. [49] модель ЛЖ воспроизводит пациент-специфичную карту активации по данным электроанатомического картирования (electroanatomic mapping) у 10 пациентов. Во время процедуры имплантации СРТ c помощью электроанатомического картирования были получены локальные времена активации на эпикарде ЛЖ, которые измерялись в процентах относительно ширины QRS комплекса. Зона поздней активации определялась как область, в которой локальные времена активации превышали 80% от длительности QRS. Для простоты зону поздней активации определяли как точку с абсолютной максимальной активацией внутри этой области. Модели были использованы для проведения двух тестов, в первом тесте персонификация модели, а именно подбор скоростей проводимости, осуществлялась на полных данных электроанатомического картирования (тест согласованности), во втором тесте с этой же целью использовались только измерения в области коронарного синуса. По результатам первого теста расстояние между рассчитанными и измеренными зонами поздней активации не превышало 4,1 мм, после второго теста не было отмечено увеличения максимальной ошибки по сравнению с первым. Таким образом, в перспективе модели могут использоваться для вычисления зоны поздней активации по меньшему количеству данных инвазивного картирования, что позволит упростить эту процедуру.
Время от начала Q-зубца ЭКГ до прихода волны возбуждения к ЛЖЭ (QLV) при естественной активации рассматривается в ряде работ в качестве предикторов ответа на СРТ. Melgaard J, et al., 2022 [44] предлагают неинвазивный метод измерения QLV по данным 12-канальной ЭКГ. Для этого модель расчета ЭКГ используется в алгоритме решения обратной задачи электрофизиологии, который по сигналу ЭКГ воспроизводит карту активации на референтной анатомии желудочков, оптимизируя расположение ранних зон активации и задержки между ними. Для проверки метода использовались ретроспективные данные 135 пациентов, прошедших процедуру имплантации СРТ с расположением ЛЖЭ в зоне поздней механической активации, а именно записанные одновременно во время процедуры 12-канальные поверхностные ЭКГ и биполярные электрограммы в месте окончательного расположения ЛЖЭ, используемые для измерения QLV. При этом расположение ЛЖЭ в модели определялось как центр сегмента ЛЖ, в который электрод был имплантирован пациенту. Разница между рассчитанными в персонифицированных по ЭКГ моделях, и измеренными QLV составила 3,0±22,5 мс. Авторы работы предполагают, что расчетное QLV потенциально может использоваться во время отбора пациентов, а также для оптимизации процедур имплантации и моделирования оптимальных параметров стимуляции перед процедурой. Однако использование референтной анатомии является серьезным ограничением метода и требует валидации.
С помощью компьютерных моделей можно вычислять и тестировать потенциальные предикторы ответа на СРТ, получение которых в клинике может быть ограничено, например, из-за необходимости инвазивного вмешательства, или невозможно в принципе. Кроме того, моделирование позволяет использовать в качестве предикторов ответа модельные изменения тех или иных характеристик в ответ на стимуляцию миокарда. Заметим, что в клинике такие показатели могут быть получены либо интраоперационно и использоваться в качестве критериев оценки эффективности СРТ в остром ответе или в отдаленном периоде после операции и использоваться для прогноза долгосрочного хронического ответа. В отличие от этого вычисление и анализ эффектов стимуляции желудочков в рамках моделей можно проводить предоперационно на стадии принятия решения об отборе пациента на терапию.
Во многих клинических исследованиях снижение ESV ЛЖ после СРТ (∆ESV), например, более чем на 10-15%, является критерием хронического ответа на СРТ. В ряде работ компьютерные модели используются для отыскания предикторов снижения ESV. В Albatat M, et al., 2023 [50] персонифицированные по данным ЭхоКГ механические модели использовались для вычисления напряжения волокон с помощью вычисления тензора напряжений Коши и выделения компонента вдоль оси волокна. Анализировалось стандартное отклонение регионального напряжения волокон стенки (SD_MVC), вычисленного во всех узлах конечно-элементной сетки во время закрытия митрального клапана (начальной точки изоволюметрической фазы, четко определяемой в петлях давление-объем). Было показано, что рассчитанное SD_MVC коррелирует с клиническим значением ∆ESV (r=-0,859, p=0,018, n=7), и поэтому предполагает возможность использовать найденный показатель для прогноза ответа на СРТ.
Была изучена связь между изменением максимальной скорости нарастания давления в ЛЖ (∆dP/dtmax) и снижением ESV [53][54]. У Isotani А, et al., 2020 [53] BiV-стимуляция с оптимизированным расположением ЛЖЭ была рассчитана в 8 персонифицированных сердечно-сосудистых моделях. Для этого в каждой модели была проведена BiV-стимуляция при четырех наиболее часто используемых положениях ЛЖЭ: в базальном или срединном передне-боковом, базальном или срединном нижне-боковом сегменте, и выбран вариант позиции ЛЖЭ с максимальным расчетным ∆dP/dtmax. Для каждой модели был вычислен ∆dP/dtmax и было обнаружено, что порог равный 11,6% позволяет точно разделить все модели на респондеров и нереспондеров в соответствии с клиническим критерием (∆ESV <15%), измеренным у пациентов. Далее 5 других моделей были классифицированы по критерию ∆dP/dtmax >11,6%, и в 4 случаях ответ совпал с ответом по клиническому критерию. Также отметим, что вычисленное изменение полного времени активации желудочков имело более низкий предсказательный потенциал, чем ∆dP/dtmax. Однако количество изученных моделей было слишком мало, чтобы сделать надежные выводы.
В отличие от результатов Isotani A, et al. [53], Koopsen Т, et al., 2023 [54] не обнаружили корреляцию между модельными значениями ∆dP/dtmax, рассчитанными в персонифицированных моделях CircAdapt, и ∆ESV, измеренным у пациентов (r=
-0,34, P=0,02, n=45). Поэтому Koopsen Т, et al. предложили дополнительный индекс механической диссинхронии ЛЖ — разница в локальной работе между септальными и латеральными регионами ЛЖ. Его базовый уровень, а также изменение при стимуляции в отличие от ∆dP/dtmax, коррелировали с ∆ESV (r=-0,60, P<0,001 и r=0,62, P<0,001, соответственно, n=45) [54].
Индексы локальной работы миокарда были рассмотрены в рамках 8 персонифицированных моделей CircAdapt как потенциальные предикторы ответа на СРТ в Craine A, et al., 2024 [52]. Работа рассчитывалась как площадь петли напряжение-деформация в различных сегментах миокарда. Петли, направленные против часовой стрелки, указывали на положительную работу, выполняемую миокардом, а по часовой стрелке — на отрицательную работу, выполняемую над миокардом. При БЛНПГ часто наблюдается аномальное движение ранее активируемых септальных регионов (septal flash) — пресистолическое сокращение, которому соответствует близкая к нулю или отрицательная работа этих регионов. Напротив, в латеральных поздно активируемых регионах наблюдается гиперположительная работа, компенсирующая неэффективное сокращение перегородки. При стимуляции неоднородность локальной работы уменьшается. Оказалось, что в моделях наиболее высокая корреляция была обнаружена между ∆ESV и объемной долей ЛЖ, выполняющей отрицательную работу, при естественном ритме в условиях БЛНПГ (R2=0,82, p<0,01). Примечательно, что ни величина исходной или увеличение глобальной работы, ни снижение гиперположительной работы поздно активируемых сегментов, ни степень неоднородности региональной работы не были способны предсказать ответ на стимуляцию. Результаты моделирования позволяют предположить, что обратимые изменения в перфузии, метаболизме и клеточной сигнализации, которые происходят в рано активированных областях перегородки при БЛНПГ, могут быть важными факторами, определяющими возможность обратного ремоделирования (RR, reverse remodeling) желудочков после СРТ. Кроме того, авторы предложили метод упрощенной оценки работы миокарда, который, однако, также позволяет разделять респондеров и нереспондеров.
Как уже упоминалось выше, в ряде работ в рамках моделей исследовался потенциал применения новых техник исполнения СРТ, в т.ч. стимуляции пучка Гиса (His-bundle pacing, HBP), стимуляции левой ножки пучка Гиса (left bundle pacing, LBP) или комбинации стимуляции эпикардиального ЛЖЭ с HBP (His-optimized CRT) и LBP (LBBP-optimized CRT), беспроводная стимуляция LBP или эндокарда боковой стенки, а также мультисайтовая стимуляция (Multisite pacing), при которой устанавливается несколько ЛЖЭ или, например, четырехполюсный электрод. В работах Strocchi M, et al., 2020a, 2022a, 2022b и 2023 [40-42][48] с помощью электрофизиологических моделей исследовалось влияние разных техник стимуляции на индексы электрической диссинхронии желудочков, в частности, на полное время активации желудочков. Оценивали степень уменьшения индексов диссинхронии активации при различных типах стимуляции для различных семейств моделей, имитирующих наличие или отсутствие повреждений миокарда. В целом, в большинстве рассмотренных случаев лучшие результаты моделирования ресинхронизации были получены при стимуляции проводящей системы (HBP, LBP, LBBP-optimized CRT) по сравнению со стандартной BiV-стимуляцией. Однако в некоторых случаях, например, у пациентов с септальным рубцом, наиболее эффективной оказалась стандартная BiV-стимуляция. Кроме того, было показано, что LBP требует оптимизации предсердно-желудочковой задержки, что невозможно при полной предсердно-желудочковой блокаде. В то же время, когда оптимизация предсердно-желудочковой задержки возможна, стандартная LBP позволяет достигать лучшей синхронности, чем беспроводная LBP, в противном случае, применение беспроводной LBP более эффективно, чем стандартной LBP. Наконец, при БПНПГ HBP, как правило, эффективнее стандартной BiV-стимуляции и LBP, при которых сохраняется задержка активации ПЖ. Однако при сильном снижении проведения в системе Гиса-Пуркинье в ПЖ стандартная BiV-стимуляция превосходит HBP, а при сильном снижении проведения в системе Гиса-Пуркинье в ЛЖ и HBP, и BiV-стимуляция не эффективны. Сочетание LBP c анодным захватом перегородки ПЖ улучшает ответ по сравнению с просто LBP. Влиянию стимуляции проводящей системы на механическую функцию была посвящена работа Strocchi M, et al., 2020b [51], в которой на группе из четырех электромеханических моделей было показано, что HBP восстанавливает нормальное движение перегородки, а LBP без предсердно-желудочковой задержки, напротив, вызывает аномальное движение перегородки слева направо из-за задержки активации ПЖ. Более подробно in-silico исследования стимуляции проводящей системы описаны в обзоре Strocchi M, et al., 2024 [59].
Кроме того, стоит упомянуть работу Albatat M, et al., 2021 [45], в которой электрофизиологические модели, построенные на данных 3-х пациент-специфичных желудочковых анатомий с постинфарктными рубцами, использовались для анализа максимального фронта волны активации (MAF, maximum activation front) при СРТ. Фронт активации в момент времени t мс рассчитывался как объем активированных элементов, нормализованный на общий объем ЛЖ, в промежутке времени (t-5, t+5) мс. Площадь под графиком зависимости фронта активации от времени всегда одинакова и соответствует объему ЛЖ. Поэтому более высокий MAF означает, что за более короткий период времени активируется больший объем ЛЖ, что может быть достигнуто либо за счет сокращения общего времени активации, либо за счет более крутого роста фронта активации после начала возбуждения, либо за счет того и другого. Моделировали BiV-стимуляцию, в т.ч. мультисайтовую, с ПЖ электродом в стандартном апикальном положении и 12 вариантами расположения электрода в ЛЖ, из которых комбинаторно выбирались комбинации от одного до трех мест одновременного размещения ЛЖЭ. Было показано, что при стимуляции с одним ЛЖЭ максимальный MAF достигается, когда этот электрод находится в зоне поздней активации для естественного ритма и вне постинфарктного рубца. При мультисайтовой стимуляции максимальный MAF достигается, когда электроды расположены таким образом, чтобы слияние всех фронтов активации происходило как можно позже. Авторы предполагают, что MAF можно использовать интраоперационно для анализа острого ответа на СРТ во время выбора оптимального расположения электродов при мультисайтовой стимуляции.
Наиболее часто СРТ используется при БЛНПГ, но она может быть также полезна и при БПНПГ, возникающей, например, после восстановления тетрады Фалло. Ložek et al., 2024 [55] на двух персонализированных моделях CircAdapt исследовали влияние ПЖ-СРТ на механические и гемодинамические характеристики ПЖ. Цифровые двойники, как были названы сердечно-сосудистые модели в данной работе, подтвердили вклад электромеханической диссинхронии ПЖ в его дисфункцию и продемонстрировали улучшение эффективности сокращения ПЖ после его стимуляции, в т.ч. увеличение dP/dtmax. У одного пациента, которому была проведена успешная постоянная ПЖ-СРТ в рамках процедуры ревальвации легочного клапана, улучшения функции ПЖ соответствовали прогнозам, сделанным на основе его цифрового двойника. Авторы считают, что построение цифровых двойников способно помочь оценить необходимость в ПЖ-СРТ в рамках выбора стратегии лечения тетрады Фалло и подобных врожденных пороков сердца.
Ограничения исследований с использованием моделей
Основное ограничение описанных выше исследований — слишком малый размер когорт, не позволяющий гарантировать надежность предсказаний. В трех работах использовалось всего 2-3 модели, в других от 8 до 45, и только в 2 работах [44][56] количество моделей превышает 100. Однако либо персонифицировались только параметры электрической функции миокарда и применялась общая референтная модель анатомии сердца [44], либо использовали редуцированную модель анатомии [56]. Это иллюстрирует другое ограничение применения моделей — недостаток данных для персонализации моделей.
Представленные в нашем обзоре результаты применения компьютерных моделей, несмотря на их ограничения, а в моделях всегда присутствуют элементы идеализации и упрощения реальности, убедительно демонстрируют пользу применения моделирования для решения разнообразных фундаментальных и практических задач клинической медицины. Модели позволяют проанализировать механизмы диссинхронии сердца, выявить наиболее частые фенотипы проявления диссинхронии и связать их с прогнозом эффективности коррекции. Благодаря возможности проводить неограниченное количество разнообразных тестов модели могут служить для проведения первичного виртуального клинического исследования новых технологий стимуляции, для выбора индивидуальной стратегии и тактики проведения процедуры имплантации для конкретного пациента. К сожалению, затруднения к практическому внедрению компьютерных моделей в клиническую практику сохраняются и стимулируют дальнейшую разработку подходов для ускорения расчетов, упрощения моделей, персонализации индивидуальных параметров, оценки модельных результатов и их применения в прогностических моделях.
Особенно интересных решений можно ожидать от применения механистических компьютерных моделей в комбинации с моделями ИИ, благодаря потенциальным объемам генерируемых данных, а также возможности предсказывать изменения функции сердца пациента в результате лечения, в частности, при электрокардиостимуляции и в дооперационном периоде. В следующем разделе мы приведем обзор еще немногочисленных, но уже многообещающих, собственных и других работ, сделанных в этой области применительно к задачам анализа сердечной диссинхронии и ресинхронизации.
Комбинированные подходы применения ММ и ИИ к проблеме сердечной диссинхронии
Комбинированные методы компьютерного моделирования и ИИ для прогноза ответа на СРТ и оптимизации стимуляции желудочков
Ранее нашей группой в рамках проекта, поддержанного грантом РНФ, при помощи методов ML на основе комбинированного датасета, включающего наряду с клиническими данными, результаты ММ, была построена прогностическая модель успешности СРТ [60]. Насколько нам известно, в наших работах впервые были применены персонифицированные модели сердца пациентов для предсказания ответа желудочков на стимуляцию. Полученные расчетные индексы диссинхронии активации желудочков до и после стимуляции были использованы для обучения классификатора, прогнозирующего положительный или отрицательный ответ на СРТ. Точность построенного классификатора достигла 84%, что превысило точность предложенных ранее калькуляторов ответа, основанных только на дооперационных клинических данных, традиционно регистрируемых при предварительном обследовании пациентов перед назначением на процедуру СРТ.
Основная идея метода заключается в применении персонифицированных моделей для оценки влияния стимуляции желудочков конкретного пациента на электрическую активность миокарда и прогноза изменения количественных показателей диссинхронии активации. Модельные данные можно рассчитывать дооперационно и использовать их при расчете классификатора (калькулятора), прогнозирующего ответ на терапию.
Важно отметить, что в отличие от эмпирических подходов для выбора места установки стимулирующих электродов, во многом зависящего от опыта оператора, наш метод дает возможность оптимизировать процедуру и указать позицию электрода, обеспечивающую наибольшую вероятность положительного ответа, если такой вариант теоретически возможен [61]. А именно, математическая модель позволяет провести серию виртуальных испытаний с разнообразными вариантами размещения электродов, в частности, ЛЖЭ. Например, можно протестировать различные положения ЛЖЭ на поверхности эпикарда ЛЖ. При этом, имея сопряженную модель желудочков и вен коронарного синуса, можно ограничиться только контактными зонами, доступными для трансвенозного доступа оператора, и указать целевую вену, обеспечивающую наибольшую вероятность ответа на стимуляцию [62]. А можно протестировать и другие зоны на внутренней и внешней поверхностях ЛЖ для потенциального эпикардиального или эндокардиального доступа, если трансвенозный доступ не дал желаемого результата, либо оцененный шанс на успех такой стимуляции невелик. Можно также в рамках модели сравнить шансы на успех при стандартной BiV-стимуляции и при стимуляции проводящей системы для выбора оптимального способа стимуляции. Возможность моделирования активации желудочков конкретного пациента при различных способах стимуляции и расчет вероятности успеха при помощи обученного классификатора, использующего результаты моделирования, позволяют оценить шансы на успех СРТ дооперационно и решить сразу 2 задачи — проводить стратификацию пациентов для СРТ и оптимизировать планируемую процедуру. Такая методика может помочь врачу принять решение в отборе пациентов для СРТ, а также выбрать тактику проведения операции.
В рамках предлагаемой технологии нам представляются особенно важными следующие факты: в анатомически детализированных 3-мерных персонифицированных моделях желудочков, построенных на основе КТ изображений сердца, учитываются не только индивидуальные геометрические особенности формы желудочков, но и данные МРТ о структурных повреждениях миокарда в виде постинфарктных рубцов или миокардиального фиброза. Известно, что такие повреждения существенно влияют на процессы распространения волны возбуждения в миокарде и усугубляют диссинхронию активации, вызванную нарушениями проводящей системы сердца, в частности, при БЛНПГ, которая входит в основные рекомендации по отбору пациентов для СРТ. В частности, мы показали, что среди признаков (независимых переменных), значимо влияющих на вероятность положительного ответа пациента, выделяются близость ЛЖЭ к зоне постинфарктного рубца или фиброза, а также расстояние от ЛЖЭ до зоны поздней активации, которая определяется при моделировании исходной активации желудочков без стимуляции. Оптимизация положения ЛЖЭ представляет собой некий компромисс между близостью к зоне поздней активации, но без пересечения или близкого расположения к зоне структурных нарушений, препятствующих эффективной активации ЛЖ. Предлагаемый нами алгоритм автоматически находит оптимальное расположение ЛЖЭ на эпикардиальной поверхности ЛЖ.
Ниже мы вкратце опишем разработанную нами технологию построения классификатора и его применения.
Клинические данные. Для построения персонифицированных моделей и разработки классификатора ответа на СРТ были использованы ретроспективные данные, полученные для когорты пациентов (n=80) с ХСН, которым была выполнена имплантация устройств СРТ в НИМЦ им. В. А. Алмазова [60-62]. Были собраны клинические данные из стандартных протоколов обследования пациента с ХСН: пол, рост, вес, анамнез, сопутствующие заболевания, медикаментозная терапия, этиология кардиомиопатии, функциональный класс ХСН, лабораторные исследования (клинический и биохимический анализ крови, скорость клубочковой фильтрации), 12-канальная ЭКГ, стандартное исследование ЭхоКГ. По данным ЭКГ у всех пациентов была констатирована полная БЛНПГ согласно критерию Strauss [63].
Эффективность терапии оценивалась по данным, полученным при повторном визите пациента через 6 мес. после установки СРТ устройства с проведением повторных инструментальных исследований: стандартной ЭхоКГ, 12-канальной ЭКГ. Положительный ответ на терапию определялся по результатам ЭхоКГ при увеличении ФВ ЛЖ пациентов более чем на 10%. Выбор этого критерия был обусловлен потребностью сравнения разрабатываемого нами классификатора с известными классификаторами ответа на СРТ на основе клинических данных, в которых применялся аналогичный критерий [64]. При построении классификатора ответа также были протестированы и другие традиционно используемые критерии ответа — уменьшение ESV более чем на 15% и сочетанные критерии улучшения ЭхоКГ показателей сократительной функции ЛЖ.
Клинические показатели в когорте из 57 пациентов демонстрировали улучшение объективных показателей сердечно-сосудистой системы у пациентов после процедуры СРТ [60][61]. Так, в среднем QRSd уменьшился на 23±14%, ESV и конечно-диастолический объем уменьшились на 18±31% и 24±36%, соответственно, ФВ увеличилась на 9±8%, функциональный класс NYHA снизился, как минимум, на 1 балл у 54% пациентов.
Респондеры и нереспондеры на СРТ в когорте пациентов классифицировались по увеличению ФВ ЛЖ в течение года после проведения СРТ на ≥10%. В нашей когорте пациентов оказалось 40% положительных и 60% отрицательных по этому критерию пациентов [60]. По клиническим индексам, таким как пол, возраст, функциональный класс, QRSd, мы не нашли значимых различий между респондерами и нереспондерами. При этом ФВ была исходно несколько выше у нереспондеров. После СРТ значительно большее увеличение ФВ ЛЖ (17±5 vs 3±5, p<0,01), а также уменьшение ESV (-47±19 vs -9±37, p<0,01) наблюдалось в группе респондеров по сравнению с нереспондерами. Интересно отметить, что мы не обнаружили значимых различий в динамике снижения ширины QRSd между группами.
Для построения персонифицированных моделей желудочков сердца пациентов использовались данные КТ, выполненной в течение 6 мес. после установки СРТ устройств. Первичная сегментация изображений была проведена экспертом при помощи программного обеспечения системы неинвазивного электрофизиологического картирования АМИКАРД (Amycard, EP Solutions SA, Yverdon, Switzerland). Точное расположение установленных стимулирующих электродов определялось согласно данным КТ. Кроме того, пациентам выполнялось исследование МРТ с отсроченным контрастированием до имплантации кардиостимуляторов. Протоколы исследования со схематическим описанием расположения постинфарктных рубцов и миокардиального фиброза в сегментах миокарда ЛЖ согласно 17-сегментной схеме ЛЖ были использованы для разметки участков миокарда со сниженной электропроводностью в электрофизиологической модели желудочков. Для части пациентов (n=19) наряду со схематическим описанием повреждений миокарда, была проведена детальная сегментация фиброзной и рубцовой зон в ЛЖ [62]. Кроме того, данные КТ визуализации вен коронарного синуса этих же пациентов были сегментированы и интегрированы в единую модель для определения целевых вен, в которые устанавливается ЛЖЭ [62].
Создание цифровой когорты персонифицированных электрофизиологических моделей сердца
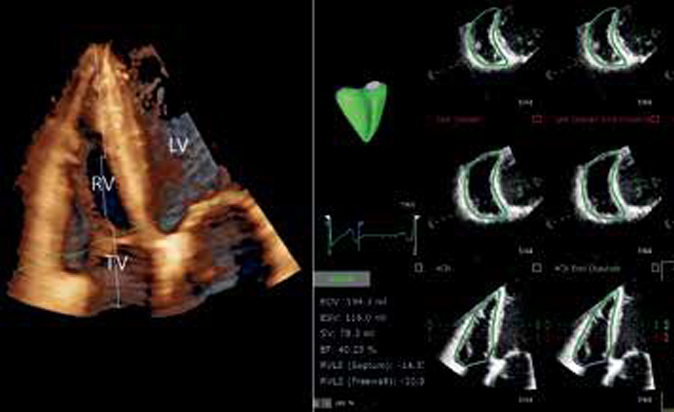
Цифровая модель желудочков сердца. Для создания персонифицированных моделей сердца человека мы разработали и применили оригинальную методику построения цифровых моделей желудочков сердца и расчета их электрической активности (рис. 3), основанную на работах Khamzin S, et al., 2021; Dokuchaev A, et al., 2023 [60][61].

Рис. 3. Схема разработки модели ML [61].
Примечание: (I) Построение и расчет персонализированной электрофизиологической модели желудочков: (1) Обработка данных КТ-изображения. (2) Сегментация конечно-элементных сеток торса, легких и желудочков; (2*) Персонализация модели желудочков: (A) Генерация миокардиальных волокон методом, основанным на правилах. (B) Назначение области постинфарктного рубца/фиброза в желудочках (показано сзади) и расчет карты активации желудочков при базовом паттерне БЛНПГ и BiV-кардиостимуляции с клиническим положением электродов. (3) Расчет ЭКГ-сигналов по карте активации желудочков. (II) Разработка классификатора машинного обучения с учителем: создание набора данных, включающего комбинацию клинических данных и смоделированных признаков электрофизиологической модели от каждого из 57 пациентов, отмеченных как респондеры и нереспондеры; обучение классификатора ML с учителем и расчет ML-баллов ответа на СРТ.
Для каждого пациента по данным КТ с помощью полуавтоматических методов сегментируются индивидуальные геометрии торса, легких, сердца, и на основе полученной сегментации строятся геометрические сеточные модели. Ткань стенки ЛЖ дополнительно аннотируется либо как проводящая миокардиальная ткань, либо как поврежденный миокард (постинфарктный рубец или фиброзная ткань на основе данных МРТ [60]).
Моделирование электрической активации желудочков. Для моделирования электрической активности миокарда сердечная ткань рассматривается как анизотропная непрерывная среда с большей скоростью проведения электрического сигнала в продольном направлении миокардиальных волокон по сравнению с поперечным. Глобальный коэффициент проводимости миокарда в направлении волокна задается единственным параметром σ для всех регионов желудочков. В персонифицированных моделях именно этот коэффициент настраивается индивидуально для каждой модели, чтобы воспроизвести основную клиническую характеристику электрической диссинхронии возбуждения желудочков — ширину QRS комплекса ЭКГ. Соотношение проводимостей вдоль и поперек волокна тоже является параметром модели. В наших работах он был взят равным 16:1, что обеспечивает соотношение 4:1 для скоростей проведения волны возбуждения вдоль и поперек волокон, как и в ряде других работ. Для определения тензора направления волокон в каждой точке миокарда используется подход, основанный на правилах [57]. Сегменты с постинфарктным рубцом моделируются как невозбудимые и непроводящие области желудочков, а сегменты с фиброзом моделируются как участки с пониженной проводимостью ткани (например, мы задавали проводимость в фиброзных зонах от 1% до 50% проводимости здорового миокарда). Для расчета времени прихода волны возбуждения в каждую точку сердца (локального времени активации) используется модель эйконала [34]. Уравнения модели приведены в Neic A, et al. [36].
Результаты расчета визуализируются в форме карты активации миокарда желудочков [61]. На основе этой карты рассчитывается ряд характеристик диссинхронии возбуждения желудочков, в т.ч. TAT, время активации ЛЖ и ПЖ и задержка возбуждения ЛЖ по сравнению с ПЖ (ADRVLV, activation delay), среднее время активации желудочков, его дисперсия и др.
Протоколы стимуляции моделей. Последовательность активации желудочков зависит от области начальной активации миокарда. Эта область определяется двумя способами: при активации из проводящей системы сердца в условиях БЛНПГ (собственный ритм) или при искусственной стимуляции. В модели исходной (дооперационной) активации желудочков используется модель проводящей системы сердца [65]. Поскольку проведение возбуждения в проводящей системе происходит на порядок быстрее (3 м/c), чем в миокарде (0,3-0,7 м/с), ее конфигурация определяет точки начальной активации поверхностей желудочков. В случае БЛНПГ мы исключали из модели проводящей системы всю левую ножку, так что начальная активация осуществлялась на поверхности ПЖ в точках контакта с ветвями правой ножки (красные зоны на рис. 3 B, LBBB). Далее волна возбуждения распространяется по миокарду ПЖ и ЛЖ, и зона поздней активации наблюдается в свободной стенке ЛЖ (синие зоны на рис. 3 B, LBBB). Именно такая последовательность активации миокарда характерна для пациентов с БЛНПГ.
Последовательность активации при BiV-стимуляции сердца (после имплантации СРТ устройств) определяется расположением стимулирующих электродов. Имея данные КТ о расположении клинически установленных электродов в верхушке ПЖ и на свободной стенке ЛЖ, мы могли воспроизвести ход активации при стимуляции желудочков и использовать модельные показатели электрической активности для обучения классификаторов ответа на СРТ [61]. Кроме того, мы могли варьировать положение электродов, в частности, ЛЖЭ, и оценить влияние его положения на эффективность стимуляции. Эти модельные данные мы использовали для выбора оптимального расположения ЛЖЭ.
Моделирование ЭКГ. Как уже отмечалось выше, основным показателем электрической диссинхронии возбуждения желудочков и отбора пациентов на терапию является ширина QRS комплекса ЭКГ (QRSd). Укорочение QRSd при стимуляции часто используется при настройке аппарата и в качестве критерия эффективности терапии [66-70]. Для моделирования ЭКГ на торсе пациента мы использовали псевдобидоменный подход [71] на основе модельного временного сигнала потенциала действия в одиночных клетках, используемого в узлах сетки желудочков с временными сдвигами, установленными в соответствии с рассчитанной картой активации желудочков. Решение псевдобидоменного уравнения дает сигнал внеклеточного потенциала на торсе, что позволяет вычислить ЭКГ в стандартных отведениях [61] и определить ее признаки, в т.ч. ширину QRSd.
Естественно, что ширина QRSd зависит от паттерна активации желудочков, в частности, полного времени активации TAT, которое, в свою очередь, зависит от коэффициента проводимости миокарда σ. Мы делали настройку параметра проводимости по известному клиническому значению ширины QRSd. Для этого использовали решение задачи оптимизации, обеспечивающее минимальное отклонение модельного значения от клинического [60].
Модельные ЭКГ хорошо воспроизводят сигналы ЭКГ, записанные в клинике и на собственном ритме без стимуляции желудочков и при BiV-стимуляции для каждого из пациентов [61]. Корреляция между модельным и клиническим QRSd превышает k=0,94, p<0,01. Хотя параметры модели были подобраны таким образом, чтобы были близки только средние значения модельного и клинического QRSd, морфология самих комплексов также показала хорошее соответствие для обоих протоколов стимуляции.
Семейство моделей. Нами построена коллекция из 57 персонифицированных электрофизиологических моделей сердца на основе клинических изображений, информации о повреждениях миокарда и ЭКГ сигналов. Модели реалистично предсказывают изменение электрических признаков после СРТ. Средние значения TAT и модельного QRSd уменьшились на 45±22% и 26±17%, что хорошо согласуется с уменьшением клинического QRSd. Индексы электрической диссинхронии также демонстрируют значительное снижение в популяции моделей, с наибольшим снижением индекса межжелудочковой диссинхронии ADRVLV на -76±24%.
Анализируя индексы геометрии у респондеров и нереспондеров, мы не обнаружили различий в относительном объеме инфаркта/фиброза в миокарде ЛЖ между группами респондеров и нереспондеров [60]. В то же время мы нашли, что расстояние от места стимуляции ЛЖ до поврежденной зоны миокарда в группе нереспондеров значимо меньше, чем у респондеров (28±27 мм у нереспондеров vs 45±28 мм у респондеров), что предполагает менее эффективную стимуляцию нормальной ткани у нереспондеров. Расстояние между стимулирующими ПЖ и ЛЖ электродами между группами статистически не различалось. Не было обнаружено значимого отличия и в расстоянии от места стимуляции ЛЖ до области поздней активации, определенной при моделировании исходной активации при БЛНПГ. Между модельными индексами электрической диссинхронии, например, TAT, QRSd, мы также не обнаружили значимых различий как в случае БЛНПГ, так и в случае BiV-стимуляции. Не было найдено и разницы в относительном снижении показателей при BiV между группами респондеров и нереспондеров [60].
Построение классификатора ответа на СРТ с использованием модельных данных
Важно, что в большинстве своем ни отдельно взятые дооперационные клинические индексы, ни модельные индексы до и после BiV-стимуляции не различались в нашей когорте между группами респондеров и нереспондеров на терапию. Это не позволило качественно разделить пациентов на базе какого-либо одного набора данных. Поэтому мы впервые использовали результаты персонифицированных моделей вместе с дооперационными клиническими данными для построения классификатора ответа на СРТ, обученного на основе данных об ЭхоКГ ответе пациентов (10% увеличение ФВ ЛЖ) [60]. Кроме этого, созданная коллекция моделей была нами использована для изучения влияния расположения ЛЖЭ на результат СРТ и выбора оптимального местоположения электродов [61].
Для разработки классификатора мы применили несколько подходов ML с учителем для определения комбинации оптимального набора признаков и алгоритма обучения, которая имеет наилучшие показатели точности для нашего набора данных для пациентов, содержащего гибридные данные [60]. На шаге предобработки признаки с пропущенными значениями исключались. Некатегориальные данные нормализовывались вычитанием среднего и делением на стандартное отклонение. Коллинеарные признаки с коэффициентом корреляции >0,85 также исключались.
Среднее значение AUC для различных алгоритмов и методов автоматического отбора признаков варьировало в пределах от 0,7 до наилучшего значения 0,84. Несколько классификаторов демонстрировали ROC AUC, превышающий 0,8, в т.ч. Support Vector Machines и Linear Discriminant Analysis [60], а также LR [61]. Для дальнейшего применения и сравнения с другими опубликованными классификаторами мы выбрали LR классификатор как наиболее простой в интерпретации и устойчивый к переобучению, при этом демонстрирующий высокую точность, схожую с более сложными ML-моделями.
Из всего набора входных признаков, рассматриваемых для LR-классификации, были выбраны 7 наиболее значимых признаков с наибольшими весами LR [61].
Среди них 3 предоперационных клинических признака: ФВ ЛЖ (%), индекс массы тела (безразмерный) и конечный диастолический диаметр ЛЖ (в мм). Заметим, что дооперационное значение ФВ ЛЖ показывает наибольшую важность среди остальных признаков, что соответствует обнаруженной корреляции между этим показателем и изменением ФВ после операции, и согласуется с необходимостью оценки ФВ ЛЖ в клинических рекомендациях для отбора пациентов на СРТ. Показатели индекса массы тела и конечного диастолического диаметра ЛЖ не входят в клинические рекомендации, хотя ранее в многочисленных работах было показано, что наличие избыточного веса и увеличенные размеры ЛЖ являются важными признаками, влияющими на состояние сердечно-сосудистой системы пациентов и исход СРТ [64][72].
Большинство (4 из 7) отобранных для классификатора признаков — это модельные признаки: геометрические индексы, найденные в рамках цифровой модели желудочков, построенной на основе КТ/МРТ изображений; и рассчитанные модельные признаки, характеризующие активацию желудочков в режимах исходного ритма при БЛНПГ и при BiV-стимуляции. Среди модельных индексов в классификатор вошли следующие 4 признака: расстояние от места расположения ЛЖЭ до зоны постинфарктного рубца (Scar-LVPS расстояние, мм), общее время активации 95% миокарда желудочков (TAT95, мс) на собственном ритме и индексы электрической межжелудочковой диссинхронии, а именно, задержка активации между ПЖ и ЛЖ (ADRVLV, мс) на собственном ритме и при BiV-стимуляции. Оказалось, что расстояние между ЛЖЭ и зоной инфаркта/фиброза ранжируется вторым в списке важности прогностических признаков. Кроме того, отметим, что 2 из 4 показателей, полученных с помощью модели, расстояние Scar-LVPS и ADRVLV при BiV-кардиостимуляции, зависят от положения ЛЖЭ и могут изменяться при перемещении ЛЖЭ по поверхности ЛЖ.
Эти 7 признаков были использованы для обучения окончательной LR модели классификации [61], ROC AUC составил 0,84, точность модели — 77%, чувствительность 0,65 и специфичность 0,85 [61].
Построенный LR классификатор на основе набора клинических и модельных признаков рассчитывает ML-балл, прогнозирующий потенциальных респондеров и нереспондеров c пороговым значением 0,5, разделяющим классы. Важно отметить, что значения ML-балла в нашей когорте пациентов коррелировали с пост-операционным улучшением ФВ ЛЖ (r=0,46, p<0,001). Более того, распределения баллов в группах респондеров и нереспондеров значительно различались, и медиана ML-балла у респондеров была значимо выше, чем у нереспондеров (0,73 [ 0,36; 0,95] vs 0,19 [ 0,07; 0,39], p<0,01 [61]). Это позволило нам рассматривать величину ML-балла как оценку вероятности положительного или отрицательного ответа и использовать ее значение не только для бинарной классификации потенциальных респондеров и нереспондеров, но и для оптимизации выбора ЛЖЭ.
Важным результатом нашего исследования является тот факт, что классификаторы, построенные на гибридных данных, показали существенно более высокую точность по сравнению с классификаторами, построенными только на клинических данных. Мы сравнили наш классификатор с калькулятором, основанным на клинических дооперационных показателях, предложенным Feeny AK, et al. [64]. Эти авторы для отбора прогностических признаков и обучения классификатора использовали набор клинических данных более 1000 пациентов и получили прогностическую модель LR с ROC AUC равным 0,7, что значительно ниже, чем у нашего классификатора на гибридных данных. Применение этого калькулятора для нашей группы пациентов дало еще более низкие характеристики качества прогноза со средним AUC 0,63, средней точностью 0,56, чувствительностью 0,56 и специфичностью 0,57 по сравнению с классификатором на гибридных данных [60]. Заметим, что калькулятор на множественных клинических признаках давал точность, близкую к LR классификатору, обученному только на дооперационных значениях ФВ ЛЖ, что позволяет предположить, что остальные клинические данные значительного влияния на предсказания модели не имели.
Итак, мы разработали и валидировали ML-классификаторы для прогнозирования долгосрочного улучшения ФВ ЛЖ более чем на 10% у пациентов, получивших СРТ [60][61]. Далее мы опишем как мы использовали такой LR-классификатор в качестве важного компонента новой технологии для оптимизации СРТ.
Способ оптимизации расположения стимулирующих электродов при СРТ с применением результатов персонифицированных моделей сердца
Как мы отметили выше, ML-балл разработанного нами классификатора зависит от модельных признаков, связанных с расположением ЛЖЭ. Это обстоятельство позволило нам предположить, что, варьируя положение ЛЖЭ и рассчитывая соответствующие значения ML-балла при помощи нашего классификатора, мы сможем предсказать расположение ЛЖЭ на поверхности ЛЖ, которое дает максимальную вероятность прогноза успешности СРТ. Такой подход, во-первых, даст оценку целесообразности отбора данного пациента на СРТ. Если максимальный ML-балл ниже порога (<0,5), что дает отрицательный прогноз при любом расположении ЛЖЭ, то следует серьезно подумать о целесообразности проведения операции, по крайней мере, в стандартном варианте BiV-стимуляции. И, во-вторых, в случае положительного прогноза (>0,5), наш алгоритм указывает целевую зону для установки ЛЖЭ, при которой успех процедуры наиболее вероятен.
Алгоритм оптимизации ML-балла
Для отыскания зоны с оптимальным расположением электрода (т.е. зоны с максимально возможным ML-баллом) выполняется следующая итерационная процедура расчетов [61]. Сначала моделируются различные комбинации размещения ЛЖЭ с полюсами электрода, установленного поочередно в центр каждого из сегментов свободной стенки ЛЖ на эпикардиальной поверхности (согласно 17-сегментной схеме ЛЖ). Если электроды попадают в зону постинфарктного рубца, то данный сегмент исключается из рассмотрения. Результаты моделирования для каждой комбинации расположения электродов подаются на вход классификатора и рассчитывается соответствующий ML-балл для прогноза успеха СРТ.
Полученный набор значений ML-балла используется для его дальнейшей интерполяции на всей доступной для стимуляции поверхности ЛЖ. Интерполяция проводится методом регрессии на основе гауссовских процессов (GP регрессия) [73]. В итоге получается регрессионная модель, предсказывающая значение ML-балла в зависимости от местоположения электродов. Выбор оптимального местоположения ЛЖЭ, соответствующего максимальному значению ML-балла, производится с помощью метода байесовской оптимизации [74]. Подробное описание алгоритма представлено в работе Dokuchaev A, et al. [61].
Результатом работы алгоритма является карта значений ML-балла на поверхности ЛЖ (рис. 4). На этой карте зоны со значениями ML-балла выше порога 0,5 указывают рекомендуемые места для установки ЛЖЭ с потенциально положительным ответом (красная зона), а зоны с ML-баллом ниже порога картируют места, нежелательные для установки ЛЖЭ с потенциально отрицательным прогнозом (синяя зона). При максимальном значении ML-балла ≥0,5 прогнозируют положительный ответ на СРТ, а при значении ML-балла <0,5 прогнозируют отрицательный ответ на СРТ (рис. 4).

Рис. 4. Примеры карты ML-балла с оптимальным расположением места кардиостимуляции ЛЖ в персонализированных моделях желудочков.
Примечание: цветовые карты ML-балла показаны на поверхности ЛЖ персонализированных моделей и на схемах сегментов ЛЖ AHA. Темно-серым цветом на схеме AHA ЛЖ отмечены сегменты, содержащие постинфарктный рубец, которые исключаются из области установки ЛЖЭ. Оттенки красного цвета показывают зоны поверхности ЛЖ с ML-баллами >0,5 (положительный прогноз ответа), а оттенки синего — с ML-баллами <0,5 (отрицательный прогноз ответа). Синяя и красная точки показывают расположение имплантированного ЛЖЭ и оптимального расположения ЛЖЭ. Слева направо показаны примеры карты ML-баллов у респондера (пациент № 2) с положительным прогнозом по максимальному ML-баллу >0,5; нереспондера (пациент № 1) с отрицательным прогнозом по карте ML-баллов, и нереспондера (пациент № 7), которому алгоритм дает положительный прогноз при оптимальном положении ЛЖЭ на основе ML-балла, но который не ответил на терапию, возможно вследствие расположения имплантированного ЛЖЭ в нерекомендуемой зоне на значительном расстоянии от теоретически рекомендованного оптимального расположения ЛЖЭ. Цветное изображение доступно в электронной версии журнала.
Результаты оптимизированного прогноза
В нашей когорте из 57 пациентов в подгруппу с максимальным значением ML-балла >0,5, предсказывающим положительный ответ на СРТ, вошел 31 (54% от общего числа) пациент. При этом клинический ответ, т.е. увеличение ФВ ЛЖ более, чем на 10% без оптимизации расположения электрода при его установке, был получен у 20 пациентов, т.е. у 65% данной группы. Этот показатель эффективности значительно выше частоты успеха 40% во всей нашей когорте, отобранной согласно клиническим рекомендациям. Напротив, в группе с максимальным ML-баллом <0,5 (n=26,46% от общего числа) оказалось только 3 (12%) клинических респондера и подавляющее большинство 23 (88%) нереспондеров. Отношение шансов стать респондером с положительным прогнозом по сравнению с отрицательным составило в нашей когорте пациентов 13,9 (доверительный интервал: 3,4; 57). Таким образом, наш подход является перспективным инструментом, помогающим врачу отбирать кандидатов на СРТ.
Кроме того, 11 (19%) из 57 пациентов при клиническом расположении электродов классифицировались как отрицательные (ML-балл <0,5), а при оптимальном положении ЛЖЭ (максимальный ML-балл >0,5) прогнозировались как положительные. Один из таких примеров представлен на рисунке 4 (правая панель). Данный факт также свидетельствует в пользу потенциального увеличения частоты положительного прогноза на ответ при оптимизации расположения ЛЖЭ на основе величины ML-балла. Оптимизированный выбор расположения ЛЖЭ в нашей когорте потенциально увеличил бы долю положительных прогнозов (31 к 26 ≈1,2) по сравнению с фактическим соотношением респондеров и нереспондеров (23 к 34 ≈0,67).
Валидация ML модели
Для валидации предложенной модели прогноза успешности СРТ на нашей когорте пациентов мы оценили, влияет ли близость имплантированных ЛЖЭ к теоретически предсказанному оптимальному положению на частоту успеха. Оказалась, что у клинических респондеров среднее расстояние от ЛЖЭ до оптимального положения значимо меньше, чем у нереспондеров (42±25 мм (медиана 35 [ 21; 61] мм) vs 65±30 мм (медиана 64 [ 41; 92] мм, p=0,005, соответственно). Более того, в группе с положительным прогнозом (максимальный ML-балл >0,5) расстояние от установленного ЛЖЭ до оптимального положения было значительно меньше у респондеров по сравнению с нереспондерами (40±25 мм, медиана 29 [ 20; 61] мм vs 66±28 мм, медиана 72 [ 45; 88] мм, p=0,005). Высокий потенциал предлагаемого нами алгоритма отбора пациентов также подтверждается тем фактом, что частота ответа в подгруппе пациентов с положительным прогнозом и расстоянием до оптимального положения ЛЖЭ <30 мм (n=12, 21% от общего числа) достигла 83% (10 респондеров из 12), что значительно выше частоты ответа 29% (13 респондентов из 45) в остальной группе пациентов.
Таким образом, наш алгоритм позволяет улучшить отбор пациентов на основе оценки максимального ML-балла успеха СРТ. Кроме того, для пациентов с положительным прогнозом наш алгоритм дает карту рекомендуемых мест для установки ЛЖЭ, прогнозирующих положительный ответ, в т.ч. оптимальную позицию, обеспечивающую максимальный ML-балл. Близость к оптимальному положению при установке ЛЖЭ еще более увеличивает шанс на успех СРТ. В целом, предложенный нами подход может помочь существенно повысить эффективность СРТ.
Электрофизиологическое компьютерное моделирование и анализ данных для предсказания оптимальной конфигурации квадриполярного электрода
В недавней статье Rodero C, et al., 2022 [43] был предложен основанный на модели подход к выбору оптимального места расположения активных полюсов ЛЖ квадриполярного электрода путем минимизации TAT желудочков в персонализированных электрофизиологических моделях сердца. Величина TAT часто используется как показатель желудочковой диссинхронии, и его снижение с помощью BiV-стимуляции или других видах стимуляции рассматривается как цель при выборе позиции электродов [43][61][75-77].
Rodero C, et al. попытались проанализировать влияние сердечной анатомии и выбора вены, в которой установлен ЛЖЭ, а также RR сердца в направлении нормальной конфигурации на оптимальное расположение электродов и величину потенциального ответа, оцененную как относительное снижение времени активации желудочков при BiV-стимуляции по сравнению с ПЖ стимуляцией.
В исследовании были использованы персонифицированные геометрические модели (тетраэдральные сетки) желудочков пациентов, построенные на основе КТ изображений сердца для 24 пациентов с ХСН (HF группа) и 20 здоровых индивидов без сердечной патологии, у которых геометрия сердца предполагалась нормальной. Эта когорта моделей имитировала идеализированный вариант полного RR геометрии сердца в сторону нормальной геометрии, поэтому группа называлась RR группой.
Каждая сетка включала универсальные желудочковые координаты [78], которые, в частности, использовались для разметки ЛЖ на 17 сегментов согласно АНА модели. Направления миокардиальных волокон, используемые для электрофизиологического моделирования, задавались методом, основанным на правилах [57]. В данной работе параметры электрофизиологической модели не персонализировались, для всех моделей использовался один и тот же глобальный коэффициент электродиффузии, дающий скорость проведения 0,5 м/c вдоль волокон, как в нормальном миокарде. Скорость поперек волокон задавалась 0,3 м/с соотношением коэффициентов электропроводности вдоль и поперек волокон. Скорость проведения на эндокардиальном слое желудочков задавалась в 5 раз больше, чем в остальном миокарде. Моделирование электрической активации желудочков проводилось при помощи решения уравнения эйконала с различными начальными условиями, зависящими от положения и конфигурации стимулирующих электродов.
Расположение квадриполярных электродов в ЛЖ моделировалось на поверхности эпикарда феноменологически на основе 17 сегментной АНА модели ЛЖ без привязки к персональной анатомии вен коронарного синуса. Рассмотрены 5 идеализированных положений вен вдоль границы между соседними (4,5), (5,6), (6,1) сегментами или вдоль центральной линии 5 и 6 сегментов. Вдоль каждой линии рассмотрено 8 возможных позиций полюсов на расстоянии 7,5 мм друг от друга, расположенных от верхнего уровня базальных сегментов (на уровне 80% апикобазальной оси) до нижнего уровня срединных сегментов с максимальным расстоянием между базальным и апикальным полюсами 52,5 мм. В каждом электроде предполагалось 4 активных полюса.
Стимуляция ПЖ велась из апикальной позиции на эндокарде, традиционно используемой при установке устройств СРТ. Характеристики активации желудочков при ПЖ стимуляции (RV pacing, RVP) использовались в качестве контрольных, с которыми сравнивались характеристики BiV-стимуляции. При BiV-стимуляции, стимуляция ЛЖ велась либо из 1 полюса, имитируя стандартный вариант, или из 2-х полюсов, имитируя мультисайтовую стимуляцию. Всего рассмотрено 70 комбинаций расположения 1 или 2-х активных полюсов в каждой из 5 вен ЛЖ для 24+20=44 пациентов, что составило: n=70×5×44=15400 различных вариантов BiV-стимуляции, рассчитанных в моделях.
В качестве показателя электрической диссинхронии желудочков использовали время активации 90% миокарда желудочков (AT090). Относительное укорочение ∆AT090 при BiV стимуляции по сравнению с контрольным при RVP использовали в качестве количественной меры ответа на BiV стимуляцию. Расположение полюсов ЛЖЭ с максимальным значением ∆AT090 для конкретной модели называли персонализированной оптимальной конфигурацией. Конфигурацию ЛЖЭ, обеспечивающую оптимальную стимуляцию в большинстве моделей для каждой из рассмотренных когорт (HF, RR или HR+RR), назвали когортной оптимальной конфигурацией.
Сначала авторы собрали в один датасет результаты моделирования BiV стимуляции при всех возможных позициях ЛЖЭ и провели кластеризацию без учителя методом ML (Hierarchical Agglomerative Clustering, HAC [79]) для определения групп пациентов, которые имели сходную реакцию на близкие конфигурации электродов и для выявления конфигураций электродов, которые дали положительный результат наибольшему количеству пациентов. Получили 4 различных кластера, где один из кластеров в основном состоял из симуляций с апикальным расположением одного ЛЖЭ, и другой, самый большой кластер — с хотя бы одним базальным электродом. Примечательно, что кластеры не различались в зависимости от вен, где были установлены электроды. На всей когорте моделей авторы обнаружили, что больший разброс снижения AT090 наблюдался в зависимости от анатомии сердца, нежели в зависимости от выбора вены; это привело их к выводу, что выбор вены в меньшей степени влияет на ответ на стимуляцию.
И при персонифицированном, и при когортном выборе оптимальных электродов, их доминирующим положением было положение в базальных отделах идеализированных вен. В случае 2-х полюсной стимуляции ЛЖ, оптимальная комбинация у большинства пациентов при персонифицированном выборе оптимальной пары соответствовала наиболее удаленному расположению полюсов на базальном и апикальном уровнях. Однако при когортной оптимизации наиболее частные комбинации в HF группе включали также пары с полюсами на базальном и срединном продольном уровнях. Неожиданным и важным с практической точки зрения выводом проведенного исследования является отсутствие значимого улучшения ответа при персонифицированном выборе положения электродов по сравнению с когортным. Так, в НR когорте персонализированный оптимальный дизайн улучшил AT090 по сравнению с когортной оптимизацией незначительно — с 12,68% до 13,16%. А в RR когорте снижение AT090 составило в среднем 10,81% при когортной оптимизации до 11,13% при персонифицированной оптимизации.
Сравнение ответов в когортах привело авторов к заключению, что ответ в НF когорте превышал ответ в RR когорте, имитирующей возврат к нормальной геометрии желудочков вследствие RR. Возможно, этот результат частично объясняет снижение частоты положительного ответа при повторных имплантациях, связанных со сроком эксплуатации батареи, когда частичное ремоделирование желудочков и улучшение состояния уже произошло.
Кроме этого, авторы установили, что применение 2-х полюсов при стимуляции ЛЖ не слишком сильно увеличивает ответ по сравнению с 1-полюсной стимуляцией. Так, при когортной оптимизации в группе HF снижение AT090 составило 14,52±3,25% при 2-х полюсной стимуляции ЛЖ, и 10,91±2,77% при однополюсной стимуляции. Поэтому выбор конфигурации электродов должен быть тщательно взвешен с учетом не только прогноза степени улучшения ответа при 2-х полюсах стимуляции ЛЖ, но и потенциального сокращения срока службы батареи.
К ограничениям проведенного исследования можно отнести отсутствие сравнения предсказаний, полученных в рамках моделей, с реальными клиническими данными. Кроме того, в моделях не учитывались данные о повреждениях миокарда, что могло бы существенно повлиять на выводы, особенно в связи с выбором оптимальной вены для установки ЛЖЭ. В ряде клинических исследований было показано, что выбор вены, не пересекающейся с зонами фиброза, постинфарктного рубца приводил к улучшению ответа [80][81].
Выбор критерия оптимизации ответа по величине снижения времени активации желудочков при BiV-кардиостимуляции также является спорным. Мы не обнаружили корреляции между улучшением ФВ ЛЖ и относительным снижением TAT по сравнению с исходным уровнем при различных стратегиях выбора позиции ЛЖЭ, которые мы протестировали, в т.ч. при минимизации TAT [61]. Кроме этого, расстояния между позицией реально установленного ЛЖЭ и прогнозируемой позицией, максимизирующей изменение TAT у пациента, не отличались между респондерами и нереспондерами, определенными по изменению ФВ ЛЖ. Эти результаты не соответствуют гипотезе о том, что близость к позиции, максимизирующей изменение TAT, может дать увеличение частоты или величины функционального ответа желудочков в реальной популяции.
Несмотря на ограничения исследования, оно ярко демонстрирует потенциал виртуальных клинических испытаний в качестве инструмента для изучения новых технологий кардиостимуляции. Объем проведенных виртуальных тестов (почти 15 тыс.) для различных конфигураций электродов значительно превышает реалистические возможности клинических испытаний и создает платформу для более целенаправленных протоколов проспективных исследований.
Применение моделей механической активности и ИИ в прогнозе эффективности СРТ
Во многих клинических исследованиях отмечается, что параметры электрической диссинхронии не являются исчерпывающими для понимания механизмов дискоординации возбуждения и сокращения миокарда и прогноза ответа на СРТ. В частности, механическая задержка в ЛЖ, отличия регионального стрейна и работы миокарда, особенно между перегородкой и боковой стенкой, дисперсия региональной механической активности, оценка напрасно потраченной энергии миокарда в разной степени выражены у респондеров и нереспондеров на СРТ. Это позволяет использовать механические характеристики сокращения миокарда в прогнозе ответа на СРТ [82-85]. Выше (см. раздел «ММ сердечной диссинхронии и ее коррекции») мы также упомянули несколько работ, в которых применяются модели электромеханического сопряжения в миокарде, которые также показывают значимость механических признаков для анализа паттернов диссинхронии и прогноза состояния пациентов.
Здесь мы остановимся на единичных работах, в которых описывается комбинированный подход применения механистических моделей и ИИ для анализа электромеханического сопряжения у пациентов с ХСН, прошедших процедуру СРТ.
В недавней работе Lee AWC, et al., 2021 [47] комбинированные методы компьютерного моделирования и ИИ применялись для предсказания острого гемодинамического ответа (AHR) на стимуляцию, который может определяться интраоперационно как увеличение максимальной скорости нарастания внутрижелудочкового давления (∆dP/dtmaх).
В своем желании оптимизировать положение ЛЖЭ на основе прогноза AHR, авторы опирались на положительные результаты недавнего многоцентрового рандомизированного контролируемого исследования, в котором было показано, что выбор положения ЛЖЭ с AHR >10% улучшает долгосрочный ответ по сравнению с традиционным СРТ (73% vs 60%) [86]. В этом исследовании также было обнаружено, что разброс AHR в лучших и худших позициях ЛЖЭ был относительно большим (21±18%), что предполагает возможность целенаправленного выбора оптимального положения.
Lee AWC, et al., 2021 [47] отвечали на вопрос, который мог бы помочь оптимизировать процедуру имплантации: могут ли электрические, механические или анатомические характеристики сердца предсказать AHR при разных положениях ЛЖЭ. Для построения классификатора AHR использовались комбинированные клинические и модельные данные, но и те, и другие признаки были получены при помощи цифровых моделей сердца. Авторы применили разнообразные методы извлечения и анализа данных различной модальности при помощи компьютерных моделей: автоматизированное определение региональных механических деформаций на основе динамической визуализации КТ изображений сердца в сердечном цикле на исходном ритме, построение цифровой модели желудочков и определение зон истончения стенки, предположительно связанных с наличием структурных повреждений миокарда, прямые электрофизиологические симуляции активации миокарда и анализ зависимости параметров активации от расположения электрода. В исследовании использовали ретроспективные данные 27 пациентов, которым ранее была установлена СРТ система с ПЖ стимуляцией и затем проведена повторная процедура имплантации устройства для BiV-стимуляции. Во время имплантации устройства у пациентов измеряли AHR, варьируя положение эпикардиального электрода (в среднем было протестировано по 2 места у каждого пациента, максимально 5 мест). Положительный ответ пациента определялся как AHR ≥10%. Данных о долгосрочном ответе в работе не было представлено.
Сегментация ЛЖ использовалась для создания трехмерной сетки. При помощи построенной цифровой модели определяли толщину стенки в каждом месте тестового расположения ЛЖЭ и затем использовали этот признак в качестве входной переменной для классификатора положительного AHR.
Региональные особенности сокращения ЛЖ оценивали, вычисляя поле деформации на эндокардиальной поверхности ЛЖ сердца при контрольной ПЖ стимуляции. Применяли многоуровневый алгоритм деформации свободной формы на основе B-сплайнов для анализа КТ изображений на протяжении всего сердечного цикла. На автоматически сегментированных эндокардиальных поверхностях делали разметку на 16 сегментов в соответствии с АНА моделью ЛЖ, используя в качестве ориентиров точки прикрепления ПЖ, а также апикальные и базальные точки вдоль продольной оси сетки ЛЖ. Измеряли локальное изменение во времени площади в каждом из сегментов AHA модели на протяжении всего сердечного цикла. Также оценивали изменение площади эндокардиальных сегментов вокруг проекции каждого из тестируемых электродов, используя размеры областей (1/3 высоты и 1/6 диаметра ЛЖ), сопоставимые с размерами АНА сегментов. Код для анализа КТ-изображений имеется в открытом доступе (https://cemrg.com/software/cemrgapp.html). Для классификации AHR использовали следующие контрольные характеристики механической диссинхронии ЛЖ: время достижения 10% и пика сокращения АНА сегментов, а также участков вокруг позиции стимулирующего ЛЖЭ. Отклонение времени механической активации в местах установки ЛЖЭ от средних показателей в неапикальных сегментах применяли как меру механического асинхронизма ЛЖ.
Электрофизиологические модели использовали для расчета активации желудочков и извлечения индексов электрической диссинхронии. BiV сетки были сгенерированы для каждого пациента на основе сегментации КТ-изображений. Для определения ориентации волокон использовались методы, основанные на правилах. Клеточные параметры миокарда менялись с учетом неоднородных свойств сердечных тканей. Электрическая активация моделировалась с помощью уравнений эйконала, при этом скорость проведения по эндокардиальным поверхностям ЛЖ и ПЖ устанавливали в 6 раз выше, чем в остальной части миокарда. Расположение ПЖ электрода было вручную сегментировано на КТ-изображениях в конце систолической фазы. Время полной BiV-активации использовали в качестве суррогата QRSd. Клинически зарегистрированный QRSd использовался для персонализации электрических свойств сердца для каждого пациента.
Персонализированные электрофизиологические модели для каждого пациента рассчитывались при контрольной RVP стимуляции, имитирующей исходный паттерн активации, а также при BiV стимуляции при варьируемом положении ЛЖЭ без временной задержки стимуляции между ПЖ и ЛЖ электродами. При тестировании различных положений ЛЖЭ предполагали, что места стимуляции ЛЖ на его эпикардиальной поверхности расположены в сегментах передней, передне-латеральной, латеральной, задне-латеральной стенки между средним и базальным участками 16-сегментной AHA модели ЛЖ на высоте 2/3 расстояния от апикального (0) до базального уровня (1). Рассчитывали следующие характеристики диссинхронии активации желудочков при различных положениях ЛЖЭ: время задержки активации ЛЖЭ при стимуляции ПЖ электродом (RV-LV задержка), а также изменение при BiV стимуляции по сравнению с RVP ширины комплекса QRS, основного (10-90%) времени активации желудочков (времени подъема активности), времени полной активации ЛЖ. Полученные признаки использовали для классификации положительного AHR.
Анализ полученных данных выявил прогностическую значимость следующих индивидуальных признаков для прогноза AHR в зависимости от положения ЛЖЭ: RV-LV задержка ≥60% от полного времени активации при ПЖ-стимуляции, время до 10% сокращения ≥15% длительности сердечного цикла при ПЖ-стимуляции и время до пика сокращения ≥40% сердечного цикла, а также более короткое время подъема электрической активности желудочков при BiV-стимуляции <50% от исходной величины признака при ПЖ-стимуляции. Показательно, что наряду с признаками, рассчитанными на исходном ритме при ПЖ стимуляции, модельный прогноз изменения времени активации желудочков при BiV-стимуляции также оказался значимым для предсказания положительного AHR. Далее авторы построили классификаторы положительного AHR по единичному признаку, комбинации 2-х признаков и по всем рассчитанным признакам. Из всех протестированных моделей ML наибольшую точность показала модель LR. При использовании единичных признаков наибольшая точность была получена в модели классификации на основе ADRVLV задержки (ROC AUC 0,73, точность на обучающей выборке 0,64±0,15, на тестовой выборке 0,62, AHR в сегментах с положительным прогнозом 11,81±15,18, в сегментах с отрицательным прогнозом 0,85±7,33). Добавление в модель показателя механической диссинхронии на исходном ритме — времени до пика сокращения в области ЛЖЭ, — увеличило точность классификатора (ROC AUC 0,73, точность 0,70±0,11).
Модель, построенная с учетом всех рассчитанных признаков, давала сравнимые показатели точности. Надо отметить, что толщина стенки ЛЖ в позиции ЛЖЭ в данном исследовании не показала прогностической значимости, возможно, потому, что в анализируемой выборке у всех пациентов толщина стенки ЛЖ в области ЛЖЭ была >5 мм, что превосходит критическую толщину 5 мм, ранее ассоциированную с наличием рубцовой зоны [87], которая могла бы повлиять на ответ на стимуляцию.
Основным ограничением представленной работы является малость выборки (n=27), что требует дальнейшей валидации модели на большем объеме данных. Авторы не пользовались автоматическим отбором признаков, позволяющим количественно сравнить их значимость для прогноза AHR. Они также не обсуждали возможности определения оптимального (наилучшего из хороших) положения ЛЖЭ среди потенциально положительных сегментов у конкретного пациента и не проводили их ранжирования с точки зрения величины AHR. Другим ограничением, на которое обращают внимание авторы работы, является отсутствие данных о наличии повреждений миокарда, в т.ч. фиброза и постинфарктных рубцов, влияющих на процессы активации и сокращения. В наших исследованиях [60][61] расстояние от положения ЛЖЭ до зоны инфаркта было отобрано различными методами определения значимости признаков среди наиболее значимых переменных при построении моделей ML для прогноза долгосрочного ответа на СРТ. Этот результат согласуется с выводами ряда клинических исследований [88][89]. Заметим, что в отличие от результатов Lee AWC, et al., 2021 [47], в нашем исследовании [61] RV-LV задержка не была отобрана среди наиболее значимых признаков для классификатора долгосрочного ответа на СРТ, который мы использовали для выбора оптимального расположения ЛЖЭ. Этот результат согласуется с полученными нами ранее данными [90] о том, что выбор активного полюса с максимальной RV-LV задержкой может ускорить процесс ремоделирования желудочков и обеспечить достижение положительного результата в более короткий послеоперационный срок. Однако выбор максимальной RV-LV задержки не влиял на результаты стимуляции в отдаленном периоде более года после операции. Поэтому важно было бы более детально оценить прогностическую значимость положительного AHR в отношении долгосрочной перспективы.
В статье Taconné M, et al., 2024 [56] было построено семейство из 162 персонализированных компьютерных моделей сердечно-сосудистой системы (авторы по аналогии со многими работами по моделированию называют множество моделей популяцией моделей) на основе предоперационных данных о региональной деформации ЛЖ у пациентов, перенесших СРТ. Датасет, состоящий из найденных пациент-специфичных параметров модели, проанализирован методами ML без учителя и с учителем, чтобы определить фенотипы пациентов в отношении их ответа на СРТ и построить интерпретируемый классификатор.
Используемая модель сердечно-сосудистой системы содержит несколько блоков: электрическую активацию миокарда, сократительную функцию предсердий и желудочков, а также системный и легочный кровоток. Модель была ранее описана и валидирована на клинических данных 20 пациентов с БЛНПГ и 10 здоровых добровольцах в предыдущих работах [91][92]. Основной особенностью модели является усредненное описание региональной электромеханической функции желудочков, разделенных на регионы согласно общепринятой 16-сегментной АНА модели ЛЖ и 3-слойной модели ПЖ. Электрическая активность сердца представлена моделью 26 взаимосвязанных клеточных автоматов, каждый из которых описывается циклами из 4 фаз электрического возбуждения на основе предопределенного потенциала действия в клетках соответствующей миокардиальной ткани: синусного узла, атриовентрикулярного узла, пучка Гиса и ветвей проводящей системы, а также сегментов ЛЖ и ПЖ. Такой подход позволяет учесть особенности распространения возбуждения в миокарде и задавать особые свойства в поврежденных участках с нарушениями электрической функции кардиомиоцитов. Механическая активность желудочков моделируется в виде феноменологических формул, описывающих активное и пассивное напряжение в сегментах миокарда в зависимости от деформации. В модели можно менять сократимость сегмента, которая определяется рядом физически интерпретируемых параметров, варьировать свойства пассивной упругости миокарда. Это позволяет описать сократительную дисфункцию сегментов с измененными механическими свойствами, например, ишемически поврежденных. Наконец, сосудистая система описывается простой интегративной моделью, связывающей изменение объемов в камерах и давления в сосудах.
Авторы провели индивидуальную параметризацию моделей по клиническим данным регионального стрейна, записанного при ЭхоКГ у пациентов до проведения СРТ. На основе предварительного анализа чувствительности стрейна к параметрам модели были выбраны 7 наиболее значимых параметров для каждого из 16 сегментов ЛЖ, а также 2 параметра электрической активности (всего 113 параметров). Задача идентификации решалась методом эволюционных эпох, подробно описанным в работах группы. В итоге был получен датасет из 162 индивидуальных наборов параметров персонифицированных моделей сердечно-сосудистой системы пациентов, при которых модель воспроизводит клинические данные регионального стрейна со средним значением глобальной по времени и сегментам ЛЖ ошибки (средняя в 16 сегментах величина средне-квадратичного отклонения между клиническими и модельными сигналами) 4,48% (±1,08).
Далее этот набор параметрических данных был подвергнут кластеризации без учителя. Наилучшее разделение было получено для 5 кластеров. Анализ особенностей параметров моделей в кластерах и результирующей сегментарной кинетики позволил выявить основные интерпретируемые различия между кластерами, определяющие различные фенотипы пациентов. Во-первых, кластеры отличались по частоте ответа на СРТ, который определялся на основе послеоперационных данных по снижению ESV более чем на 15%. Частота ответа варьировала от величин ниже среднего уровня 52-54% в 1-2 кластерах до высокой частоты 77%, 78% и 84% в 3-5 кластерах. Кластеры 4-5 с наиболее высокой частотой ответа имели большие значения параметра сократимости по сравнению с остальными кластерами. Интересно отметить, что значимо большее время электрической активации было отмечено в кластерах 1 (минимальная частота ответа) и 5 (максимальная частота) со средними значениями по 16 сегментам (82,0 мс и 88,4 мс) по сравнению с другими кластерами (69,1, 55,8 и 69,2 мс, соответственно). В соответствии с более длительной электрической задержкой, время задержки пика сокращения ЛЖ также было выше в кластерах 1 и 5. Это подтверждает, что одни только электрические параметры диссинхронии не дают достаточной информации об особенностях нарушений активности у пациентов и для прогноза ее коррекции. К сожалению, авторы не описывают, были ли такие важные свойства региональной сократимости, как, например: сниженная сократимость септальных или латеральных сегментов или глобальное снижение сократимости, ассоциировано с теми или иными кластерами.
Далее, проведя дихотомическую разметку набора данных на респондеров и нереспондеров, авторы построили классификатор ответа на СРТ на основе модельных параметров методом случайного леса. Они отобрали 22 наиболее значимых параметра: 11 — это параметры модели или извлеченные признаки, участвующие в определении активной силы сегментов, 8 — параметры, определяющие свойства ткани, 3 — параметры электрической модели или извлеченные признаки. В основном в список вошли признаки, характеризующие активность латеральных и септальных сегментов, а также базального слоя ЛЖ. Итоговая модель определения респондеров дала среднее значение ROC AUC 0,86±0,06. Авторы обращают внимание, что построенные ими ранее классификаторы ответа на СРТ, использующие признаки, извлеченные из клинических записей регионального стрейна, давали меньшую точность ~0,8 [18].
Таким образом, основным результатом рассмотренной работы можно считать построение классификатора, основанного не на выходных данных моделирования, а на параметрах модели, которые описывают особенности нарушений внутриклеточных процессов в различных регионах стенки ЛЖ, лежащие в основе электромеханической диссинхронии желудочков, и позволяют объяснить причины ответа или неответа при ресинхронизации.
К сожалению, авторы не обсуждают возможности использования и клинических, и модельных данных одновременно для построения классификатора. Интересно было бы проанализировать, какие модельные признаки вошли бы в итоговую модель прогноза. К сожалению, принадлежность пациента к тому или иному кластеру также не вошла в число прогностических признаков классификатора, хотя частота ответа существенно зависит от кластера. Авторы также не сравнивали значения прогнозируемых баллов классификатора для разных кластеров, что тоже помогло бы оценить значимость проведенной кластеризации. Кроме того, авторы использовали только дооперационные данные для фенотипирования пациентов и прогноза ответа. Казалось бы, их модели позволяют рассчитывать активность желудочков при стимуляции, и предсказания моделей также могли бы быть учтены в прогнозе ответа на СРТ.
Представленные работы ярко демонстрируют существенное значение не только электрофизиологической диссинхронии миокарда, но и других характеристик: особенностей региональной механической функции и извлеченных параметров механической диссинхронии в нарушении активности сердца у пациентов с ХСН и для эффективности ее ресинхронизации при помощи электрокардиостимуляции.
Комбинированный подход применения математических моделей и ИИ для решения обратной задачи электрофизиологии
При описании схемы построения персонифицированных моделей мы обращали внимание на необходимость нахождения параметров, специфичных для конкретного пациента, что представляет собой самостоятельную и непростую математическую задачу и зачастую требует проведения инвазивных измерений [93]. Ранее для идентификации параметров электрофизиологических моделей, прежде всего проводимости миокарда и начальных зон активации предлагалось использовать данные неинвазивного картирования потенциала на поверхности тела (Body Surface Potential Mapping, BSPM) [93-96].
Giffard-Roisin S, et al. [97] для обучающего датасета, содержащего карты активации желудочков и соответствующие им BSPM сигналы электрограмм на торсе, использовали синтезированные данные прямого моделирования стимуляции желудочков в референтной (эталонной) персонифицированной модели желудочков и торса, построенной на основе данных КТ. Анизотропная электрическая активация сердца моделировалась с помощью монодоменной версии феноменологической модели Митчелла-Шеффера [98]. Электрические потенциалы на поверхности эталонного торса в стандартизованных 251 позициях датчиков рассчитывались одновременно с потенциалами миокарда в упрощенной схеме, состоящей из источников и датчиков в бесконечной и однородной области. Такой подход, согласно исследованию Giffard-Roisin S, et al. [95], экономит время расчетов и генерирует сигналы BSPM, близкие к результатам стандартного метода граничных элементов.
Было синтезировано и рассчитано 5 тыс. виртуальных моделей с различными значениями параметров. Одна симуляция рассчитывалась примерно за 2 мин на кластере (CPU core Xeon 2.6 GHz). Для моделирования большой вариабельности карт активации и связанных с ними сигналов BSPM случайным образом варьировали 3 вида параметров: 1-2 места начальной активации среди вершин эндо- и эпиповерхности сердечной сетки; глобальную скорость проведения по миокарду в клинически приемлемом диапазоне значений [ 0,3; 0,7] м/с; положение и форму рубцовой ткани в 50% моделей.
Далее на полученном датасете синтезированных данных была обучена регрессионная модель, рассчитывающая карту активации желудочков по стандартизованному вектору BSPM параметров, включающему по 7 признаков QRS комплекса электрограммы, извлеченных для сигнала BSPM в каждом из 251 референтных позиций на торсе, т.е. входной вектор содержал всего 7×251 признаков для каждого случая. Для решения обратной задачи восстановления карты активации применяли процедуру снижения размерности пространства (декомпозицию) формы желудочков при помощи разложения по первым M собственным векторам матрицы жесткости, связанной с Лапласианом исходной тетраэдральной формы желудочков. Для решения обратной задачи регрессии времени активации миокарда по признакам BSPM использовали метод регрессии вектора релевантности (the relevance vector regression) [99]. Средняя ошибка реконструкции карты активации (показана на одном из примеров из синтезированного датасета) составила <1,5 мс (максимум: 8 мс). Общее время подготовительной работы для создания модели регрессии составило 6 ч. При этом определение индивидуальной карты активации занимало всего около 2 мин.
Разработанные алгоритмы восстановления карты активации были использованы для предсказания карт активации для 20 пациентов, прошедших процедуру имплантации СРТ устройства. У этих пациентов были записаны сигналы BSPM при различных вариантах активации желудочков — на естественном ритме (без стимуляции), при одиночной ПЖ или ЛЖ активации, а также при BiV-стимуляции без задержки между ПЖ и ЛЖЭ или при задержке 40 мс одного из электродов. Восстановление карты активации и определение параметров проводимости миокарда проводили на основе клинических сигналов BSPM, записанных на естественном ритме, а карты активации при стимуляции желудочков рассчитывали при помощи прямого моделирования при найденных значения проводимости. Поскольку реальных данных об активации желудочков пациентов не имелось, качество восстановления карты активации оценивали по близости восстановленной карты к карте, полученной с применением системы неинвазивного электрофизиологического картирования CardioInsight. Медиана отклонения времен активации между двумя картами составила 23,8 мс и практически не зависела от способа стимуляции. Ошибка в определении положения электрода по восстановленной карте для приведенного в статье примера составила 20-30 мм в зависимости от вида стимуляции. К сожалению, в работе не описана статистика по всем пациентам, чтобы оценить разброс возможных ошибок. Заметим, что в предлагаемом алгоритме для восстановления карты активации и BSMP при стимуляции желудочков не требуется проводить тесты со стимуляцией сердца пациента! Для этого нужна только запись BSPM на естественном ритме, по которой восстанавливается не только карта активации на естественном ритме, но еще и индивидуальные параметры электропроводности миокарда, необходимые для прямого расчета электрофизиологических моделей.
Обобщая результаты данной работы, можно резюмировать, что авторами был предложен достаточно конструктивный, хотя и трудоемкий, регрессионный метод восстановления карт активации желудочков и проводимости миокарда по данным BSMP на естественном ритме, позволяющий предсказать зоны нарушения проведения, возможно ассоциированные с наличием повреждений миокарда и постинфарктных рубцов (не проверялось). Важно, что для обучения регрессионной модели применялись синтетические данные, полученные при прямом моделировании на референтной модели с варьируемыми параметрами в широком диапазоне. При решении обратной задачи электрофизиологии для конкретного пациента индивидуальные клинические данные о форме желудочков и торса трансформировались на ту же самую референтную геометрию, и использовалась заранее построенная регрессионная модель. Это существенно сокращало процесс персонификации модели для конкретного пациента. Полученные персонифицированные параметры проводимости авторы использовали для прямого электрофизиологического моделирования и расчета карты активации при стимуляции желудочков. Результаты такого прогноза ответа на стимуляцию могли бы быть использованы для дальнейшей классификации пациентов как респондеров или нереспондеров на СРТ. Но этот аспект применения процедуры в статье не обсуждался.
Основным ограничением для применения построенного алгоритма, на наш взгляд, является использование сигналов BSPM, который рутинно не применяется в клинической практике. Поэтому остается открытым вопрос, можно ли реализовать предлагаемую методику, используя только ЭКГ в стандартных отведениях. Также возникает вопрос, можно ли вместо трудоемкой итеративной процедуры обучения регрессионной модели использовать более современные методы ML и нейронные сети. Такой подход, например, был реализован в более поздней работе Bacoyannis T, et al. [100], где для решения обратной задачи использовались глубокие генеративные нейронные сети, обученные на синтетических данных, сгенерированных в нескольких анатомических моделях при различных вариантах стимуляции желудочков. Предложенный метод продемонстрировал способность генерировать объемные карты активации с хорошей точностью на модельных данных: средняя абсолютная ошибка составляла 9,40 мс с отклонением 2,16 мс на тестовом наборе. Однако в этой работе алгоритм не был применен для анализа клинических данных, поэтому его применимость для решения клинических задач должна быть далее изучена.
Хочется отметить, что развитие методов ИИ в совокупности с безграничными возможностями моделирования в отношении генерации больших объемов реалистичных данных, позволяет решать все более амбициозные задачи. В частности, обратим внимание на недавнюю работу, в которой предлагается решение обратной задачи с применением нейронных сетей без использования данных о персонифицированной геометрии желудочков и торса пациента [101]. Применение такого подхода позволяет существенно упростить процедуру обследования пациента в клинике, не требуя получения трудоемких и дорогостоящих клинических визуализаций сердца (КТ, МРТ) и их постобработки. В данной работе предложено решение задачи пространственной локализации источника активации в обоих желудочках (в частности, источника внеочередного сокращения желудочков) непосредственно из BSPM с помощью нескольких сверточных нейронных сетей. Результат работы алгоритма визуализируется либо на некоторой усредненной форме желудочков, либо, при наличии, на геометрии желудочков конкретного пациента. Для обучения сетей авторы также использовали результаты прямого электрофизиологического моделирования. Эффективность применения построенных алгоритмов они демонстрируют применительно к реальным сигналам клинических пациентов.
В настоящем обзоре мы не останавливаемся подробно на многообразии существующих работ в области решения обратных задач электрофизиологии, поскольку наше внимание сфокусировано на работах, в которых так или иначе отражено применение ИИ и компьютерного моделирования для анализа диссинхронии и ресинхронизации активности сердца, особенно в связи с клиническими приложениями моделей. Развернутый обзор существующих методов решения обратной задачи, в т.ч. с применением компьютерного моделирования и ИИ, можно найти в недавней статье Li L, et al., 2024 [102]. Следует отметить, что большинство представленных работ сфокусировано на поиске источников аритмий, связанных с наличием локального субстрата и спонтанной активности миокарда. Проблемам диссинхронии активации, вызванным нарушениями функционирования проводящей системы сердца, уделяется значительно меньше внимания, и эта ниша является областью дальнейшего применения компьютерных моделей и ИИ.
Заключение
Мы представили современные работы, проведенные нашей группой и другими авторами, посвященные применению ММ и ИИ для решения важных фундаментальных и практических задач кардиологии в связи с диагностикой и лечением пациентов с электрической и механической диссинхронией желудочков. Разработанные методы демонстрируют высокий потенциал применения комбинированных технологий для выяснения механизмов реализации различных фенотипов диссинхронии и предсказания ответа на СРТ. Важно, что результаты механистического моделирования электрической и механической функции желудочков применяются и с целью генерации больших объемов синтетических данных для обучения моделей ИИ, и для предсказания пациент-специфичных характеристик активности желудочков на естественном ритме и при стимуляции, которые либо затруднительно, либо даже практически невозможно измерить в рутинной клинической практике. Это позволяет построить высокоточные прогностические модели ИИ, предсказывающие ответ на СРТ с более высокой точностью, чем модели, построенные только на клинических данных. Более того, прогноз ответа на стимуляцию желудочков различного типа с учетом результатов моделирования можно оценить дооперационно, что значительно повышает качество отбора пациентов и дает возможность оптимизировать саму процедуру для конкретного пациента, повышая эффективность индивидуального лечения и в популяции в целом.
Благодарности. Авторы выражают благодарность А. В. Белоусовой за прочтение текста и полезные советы по его улучшению.
Отношения и деятельность. Выполнено при поддержке грантом РНФ № 24-15-00335.
Приложение
Таблица ЭП1
Обзор статей, посвященных применению ИИ к анализу клинических данных пациентов, прошедших процедуру СРТ
|
Исследование |
N (число достигших к.т.) |
Цель |
Конечные точки |
Данные для обучения |
Лучший алгоритм |
Результаты |
Наличие калькулятора |
|
Исследование |
N (число достигших к.т.) |
Цель |
Конечные точки |
Данные для обучения |
Лучший алгоритм |
Результаты |
Наличие калькулятора |
|
Bivona (2022) |
200 (51 погибло) |
(1) Предсказание ответа на СРТ (2) Предсказание долгосрочной выживаемости |
(1) Комбинированный ответ на СРТ (относительное снижение КСО ЛЖ, пиковое VO2, уровень натрийуретического пептида В-типа в сыворотке крови) (2) Смерть в течение 4 лет |
Клинические, демографические признаки, сопутствующие заболевания, медикаменты, лабораторные исследования, МРТ сердца, ЭхоКГ, ЭКГ |
(1) Linear Regression + Gaussian Mixture Model Clusters для выявления кластеров респондеров (2) Logistic Regression для предсказания смертности |
(2) ROC AUC =0,86±0,02 Наиболее значимые признаки: CURE-SVD, уровень натрийуретического пептида В-типа перед СРТ, пиковое потребление кислорода перед СРТ |
gmmxcrt.pythonanywhere.com/ |
|
Cai (2021) |
1664 (846) |
Предсказание ответа на СРТ |
Увеличение на 5% ФВ ЛЖ через 6 мес. |
Демографические, клинические признаки, сопутствующие заболевания, лабораторные исследования, ЭКГ, ЭхоКГ |
Stacked Contractive Autoencoder для выявления значимых признаков Bagging, Boosting для предсказания ответа |
ROC AUC =0,76 |
Нет |
|
Fernandes (2023) |
153 (70 респондеров, |
Предсказание ответа на СРТ |
(1) Увеличение на 5% ФВ ЛЖ через 6 мес. (респондеры) (2) Увеличение на 15% ФВ ЛЖ через 6 мес. (суперреспондеры) |
Клинические, демографические признаки, ОФЭКТ перфузии миокарда, ЭКГ |
(1) Prediction of Analysis Microarrays (2) Naive Bayes |
(1) ROC AUC =0,80 (2) ROC AUC =0,87 Наиболее значимые признаки: (1) SPECT stroke volume, Myocardial infarct, (2) SPECT stroke volume SPECT EDV, SPECT systolic phase peak, SPECT systolic standard deviation |
Нет |
|
Gallard (2020) |
323 (221) |
Предсказание ответа на СРТ |
Снижение КСО ЛЖ на 15% в течение 6 мес. |
ЭхоКГ, ЭКГ |
Random Forest |
ROC AUC =0,81±0,05 Наиболее значимые признаки: Septal Flash, E/A, E, Mid Lateral 4-chamber Peak Strain Amplitude |
Нет |
|
Haque (2022) |
794 (398) |
Предсказание ответа на СРТ |
Снижение КСО ЛЖ на 15 мл в течение 6 мес. |
26 демографических показателей пациентов и данных анамнеза, 12 биомаркерных показателей и 18 функциональных показателей ЛЖ |
Majority-voting Ensemble |
ROC AUC =0,78 Accuracy =0,73 Recall =0,71 F1 =0,73 Наиболее значимые признаки: 1D stretch, биомаркерный счет, отсутствие ишемической кардиомиопатии, счет оценки качества жизни |
Нет |
|
He (2023) |
278 (155) |
Предсказание ответа на СРТ |
Увеличение на 5% ФВ ЛЖ через 6 мес. |
ЭКГ, ЭхоКГ, ОФЭКТ перфузии миокарда, клинические, демографические признаки |
Deep Learning AutoEncoder (DLAE) для выявления значимых признаков в изображениях Logistic Regression для предсказания ответа на СРТ |
ROC AUC =0,74 |
Нет |
|
Howell (2021) |
741 (337) |
Предсказание комбинированной конечной точки |
Отсутствие летального исхода и госпитализации по поводу СН, а также снижение КСО ЛЖ на 15% через 6 мес. после СРТ |
Демографические, клинические признаки, сопутствующие заболевания, медикаменты, лабораторные исследования, ЭКГ, ЭхоКГ |
Adaptive Lasso |
ROC AUC=0,76 70% accuracy, 70% sensitivity и 70% specificity Наиболее значимые признаки: Тип электрического проведения Неишемическая кардиомиопатия QRSd, мс Натрийуретического гормона (В-типа) N-концевой пропептид, пмоль/Л |
Да, в приложении к публикации |
|
Krzowski (2022) |
547 (Н/Д) |
Классификация эффективности СРТ |
Сокращение длительности QRS комплекса, оцениваемое специалистом |
30-секундный сигнал ЭКГ |
Convolutional Neural Network (CNN) |
Sensitivity определения эффективного паттерна стимуляции =99,2% Precision =92,4 |
Нет |
|
Liang (2021) |
752 (354) |
Предсказание ответа на СРТ |
Абсолютное увеличение ФВ ЛЖ не менее чем на 10% в течение 12 мес. |
Демографические характеристики, анамнез, клинический статус, биохимические анализы, ЭКГ, ЭхоКГ, медикаменты |
Logistic Regression |
ROC AUC =0,77 Наиболее значимые признаки: Coronary artery bypass grafting, LBBB, non-specific interventricular conduction delay, percutaneous coronary intervention |
Ссылка не активна |
|
Puyol-Antón (2020) |
73 (47) |
Предсказание ответа на СРТ, наличия септального флэша |
Снижение КСО ЛЖ на 15% в течение 6 мес. |
МРТ сердца |
Variational AutoEncoder (VAE) для выявления признаков Fully Connected Neural Network для классификации |
Sensitivity =88,4% Specificity =84,4% |
Нет |
|
Puyol-Antón (2022) |
62 (39) |
Предсказание ответа на СРТ |
Снижение КСО ЛЖ на 15% в течение 6 мес. |
МРТ сердца, ЭхоКГ |
CNN для сегментации CNN + Canonical Correlation Analysis для выявления признаков Support Vector Machines для классификации |
Sensitivity =83,3% Specificity =71,4% |
Нет |
|
Tokodi (2020) |
1668 (885) |
Предсказание 1-5-летней выживаемости |
Смерть от любых причин в заданный период |
Клинические, демографические данные, лабораторные исследования, ЭхоКГ, ЭКГ |
Random Forest |
ROC AUC =0,79 в среднем для всех периодов Наиболее значимые признаки: возраст, морфология QRS, |
arguscognitive.com/crt |
|
Wouters (2022) |
(1) 1306 (385) (2) 821 (355) |
Предсказание комбинированной конечной точки и ответа на СРТ |
(1) Имплантация вспомогательного устройства для работы ЛЖ, трансплантация сердца или смерть от любой причины (2) Снижение КСО ЛЖ на 15% в течение 6-12 мес. |
Сигнал ЭКГ (FactorECG) |
VAE для выявления признаков (1) Cox Regression (2) Logistic Regression |
(1) ROC AUC =0,69 (2) ROC AUC =0,69 |
crt.ecgx.ai |
Сокращения: ДИ — доверительный интервал, КСО — конечно-систолический объем, ЛЖ — левый желудочек, МРТ — магнитно-резонансная томография, ОФЭКТ — однофотонная эмиссионная томография, СРТ (CRT) — сердечная ресинхронизирующая терапия, ФВ — фракция выброса, СН — сердечная недостаточность, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография, ROC AUC — площадь под кривой рабочей характеристики приемника, VO2 — потребление кислорода.
Таблица ЭП2
Обзор исследований в области персонализированного математического моделирования коррекции сердечной диссинхронии посредством СРТ. Размер групп больше 2 моделей
|
Сокращения |
|
nС — n сегментов; Δx — разница параметра x после и до СРТ стимуляции; 2Ж — левый и правый желудочки; А — анатомическая модель, АД — артериальное давление, БЛНПГ — блокада левой ножки пучка Гиса, БПНПГ — блокада правой ножки пучка Гиса, БЭС — быстрый эндокардиальный слой, ВЖД — внутрижелудочковое давление, ВКГ — вектрограмма, Г — гемодинамическая модель, КА — конечный автомат, КДС — метод конечного дипольного слоя для расчета ЭКГ, КО — классификатор ответа, КТ — компьютерная томография, КЭС — конечно-элементная сетка, ЛЖ — левый желудочек, ЛЖЭ — Л Ж электрод, ЛНПГ — левая ножка пучка Гиса, М — механическая модель, МРТ — магнитно-резонансная томография, МСС — механика сплошных сред, МСП — модель сосредоточенных параметров, ОC — оптимизация стимуляции, ОФЭКТ — однофотонная эмиссионная компьютерная томография, ПЖ — правый желудочек, ПС — проводящая система, ПФ — прогностический фактор, Р — постинфарктный рубец или фиброз, СРТ — сердечная ресинхронизирующая терапия, УКГ — ультразвуковая кардиограмма (англ. ultrasonic cardiogram), ФК — функциональный класс, ЦС — целевой сегмент, ЭАК — электроанатомическое картирование, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография, ЭФ — электрофизиология; ADLVRV — задержка возбуждения ЛЖ по сравнению с ПЖ, AHA (American Heart Association) — американская кардиологическая ассоциация, AHR (acute hemodynamic response) — острый гемодинамический ответ, A-V задержка — атриовентрикулярная задержка, BiVAT-90 — время активации 90% желудочков, BiVDI — индекс бивентрикулярной диссинхронии, BiV-endo — бивентрикулярная стимуляция с расположением ЛЖ электрода на эндокарде, BiV-epi — бивентрикулярная эпикардиальная стимуляция, BiV-LBP — комбинация стимуляции с верхушки ПЖ и LBP, BSPM (Body Surface Potential Mapping) — неинвазивное картирование потенциала на поверхности тела, dP/dtmax — максимальное увеличение скорости нарастания внутрижелудочкового давления, ESV (end-systolic volume) — конечно-систолический объем, HBP (His-bundle pacing) — стимуляция пучка Гиса, HF (heart failure) — сердечная недостаточность, HOT-CRT (His-optimized CRT) — комбинация стимуляции эпикардиального ЛЖ электрода с HBP, LBBB — (здесь) паттерн стимуляции при БЛНПГ, RBBB — (здесь) паттерн стимуляции при БПНПГ, LBBBP — пациенты с БЛНПГ, LBP (left bundle pacing) — стимуляция левой ножки пучка Гиса, LOT-CRT (LBBP-optimized CRT) — комбинация стимуляции эпикардиального ЛЖ электрода и LBP c оптимизированной A-V задержкой, LVAT-95 — время активации 95% ЛЖ, LVDI — индекс диссинхронии ЛЖ, LVEF (left ventricular ejection fraction) — фракция выброса левого желудочка, LVP (left ventricular pacing) — стимуляция из ЛЖ, LVSP (left ventricular septal pacing) — стимуляция перегородки ЛЖ, LVTA — время полной активации ЛЖ, MAF (maximum activation front) — максимальная доля одномоментно активируемых элементов КЭС ЛЖ, MSP (multisite pacing) — многоточечная стимуляция, MWLW-S — разница локальной работы между септальными и латеральными регионами ЛЖ, NYHA (New York Heart Association) — Нью-Йоркская ассоциация сердца, PRToF (post-repair tetralogy of Fallot) — восстановленная тетрада Фалло, QLV — время от начала Q-зубца ЭКГ до прихода волны возбуждения к ЛЖ электроду, QRSd (QRS duration) — длительность QRS комплекса, Risetime — относительное изменение времени электрической активации 10-90% желудочков при BiV-epi по сравнению с RVP, ROC AUC — площадь под ROC-кривой, RR (reverse remodeling) — обратное ремоделирование после СРТ, RVAT-95 — время активации 95% ПЖ, RV-CRT — стимуляция ПЖ как СРТ, RVDI — индекс диссинхронии ПЖ, RV-LV delay — время задержки активации ЛЖ электрода при стимуляции ПЖ электродом, RVP (right ventricular pacing) — стимуляция из ПЖ, SD-MVC — стандартное отклонение регионального напряжения волокон стенки при закрытии митрального клапана, измеренного в каждом элементе КЭС, SVM (support vector machine) — метод опорных векторов, TAT (total activation time) — общее время активации, V-V задержка — межжелудочковая задержка, WiSE-CRT (the wireless stimulation endocardially for CRT) — беспроводная стимуляция эндокарда для СРТ. |
|
Статья |
Цель |
Клинические данные |
Моделирование |
Основной результат |
||||||
|
Пациенты |
Исследования |
Ответ на СРТ |
Тип |
Персонифицированные параметры |
Стимуляция |
Выходные данные |
||||
|
Статья |
Цель |
Клинические данные |
Моделирование |
Основной результат |
||||||
|
Пациенты |
Исследования |
Ответ на СРТ |
Тип |
Персонифицированные параметры |
Стимуляция |
Выходные данные |
||||
|
Математические модели |
||||||||||
|
Isotani 2020 |
in-silico оценка потенциальных предикторов ответа на СРТ |
8 (Train) + |
1) анамнез; 2) КТ; 3) ЭхоКГ + определение сегментов со сниженной активностью; 4) ЭКГ; 5) УКГ; 6) АД |
ΔESV <15% (3 мес.) |
А Р ПС ЭФ М Г |
КЭС 2Ж сегментарный БЭС бидоменная МСС МСП |
КЭС желудочков и торса; сегментарная разметка постинфарктного рубца с уточнением границ для воспроизведения реального ЭКГ; |
персонифици-рованные зоны начала активации; BiV-epi |
dP/dtmax, TAT; ΔdP/dtmax и ΔTAT — макс. при стимуляции из 4С ЛЖ |
КО: 1) ΔdP/dtmax >11,6% — 100% точность на Train и 80% — на Test; 2) ΔTAT не разделяла респондеров/нереспондеров |
|
Strocchi 2020a |
сравнение эффективности разных видов СРТ и оптимизация стимуляции |
24 |
КТ |
– |
А ПС ЭФ |
КЭС 2Ж дерево эйконал |
КЭС желудочков; |
LBBB; BiV-epi, |
QRSd, BiVDI, LVAT-95, |
ОС: 1) HBP эффективнее |
|
Strocchi 2020b |
сравнение эффективности разных техник СРТ в устранении аномального движения межжелудочковой перегородки |
4 |
1) КТ, 2) ВЖД |
– |
А ПС ЭФ М Г |
КЭС 2Ж дерево эйконал феноменологическая (активная) + Guccione (пассивная механика) Windkessel |
КЭС желудочков; геометрия волокон; постоянное давление |
синхронная, LBBB, HBP, LBP |
движение перегородки, пик в движении перегородки при пред-выбросе желудочков |
ОС: движение межжелудочковой перегородки: |
|
Albatat 2021 |
in-silico оценка потенциального критерия острого ответа на СРТ и оптимизация стимуляции |
3 |
МРТ |
– |
А Р ЭФ |
КЭС 2Ж анатомический монодоменная |
КЭС желудочков; 17С AHA модель ЛЖ; анатомическая разметка постинфарктного рубца |
RVP; BiV-epi, MSP |
MAF (макс. доля одномоментно актируемых элементов |
ПФ: величина MAF — количественный показатель острого ответа; ОС: выбор расположения ЛЖЭ с макс. MAF; |
|
Melgaard 2022 |
разработка in-silico метода неинвазивного измерения QLV |
135 |
1) ЭКГ; 2) данные о процедуре СРТ |
– |
А ПС ЭФ |
КЭС 2Ж зоны нач. активации обратная задача физиологии (КДС) |
зоны нач. активации, их расположение и задержки активации, расположение ЛЖЭ с точностью до сегмента |
– |
QLV |
ПФ: ошибка модельного QLV: -3,0±22,5 мс |
|
Strocchi 2022a |
сравнение эффективности разных видов СРТ и оптимизация стимуляции |
24 |
КТ |
– |
А Р ПС ЭФ |
КЭС 2Ж анатомический дерево эйконал |
КЭС желудочков; анатомическая разметка постинфарктного рубца перенесена из референтной модели на персонифицированную |
LBBB, |
LVAT-95, |
ОC: BiV-endo-lateral и BiV-LBP эффективнее чем LBP без оптимизации A-V задержки, но LBP с оптимизацией A-V задержки эффективнее BiV-endo-lateral |
|
Strocchi 2022b |
сравнение эффективности разных техник СРТ при БПНПГ |
24 |
КТ |
– |
А ПС ЭФ |
КЭС 2Ж дерево эйконал |
КЭС желудочков |
RBBB, BiV-epi, HBP, LBP, LBP + перегородка ПЖ, LBP + правый пучок |
RVAT-95, LVAT-95, BiVAT-90, BiVDI, RVDI, LVDI |
ОС: 1) HBP эффективнее BiV-epi и LBP при БПНПГ: |
|
Vergara 2022 |
разработка in-silico метода нахождения зоны поздней активации по данным инвазивного ЭАК в области коронарного синуса |
10 |
1) МРТ; 2) времена активации в точках из ЭАК |
– |
А Р ЭФ |
КЭС ЛЖ сегментарный фиброз эйконал |
КЭС ЛЖ; сегментарная разметка фиброза, разметка коронарных вен по данным ЭАК; |
LBBB |
зоны поздней активации |
ОC: ошибка модельных зон поздней активации по данным ЭАК в области коронарного синуса, ≤4,1 мм |
|
Albatat 2023 |
in-silico оценка потенциальных предикторов ответа на СРТ |
7 (Control) + 7 (LBBBP) |
1) ЭхоКГ изображения, объемы ЛЖ и деформации; 2) ВЖД (для LBBBP) |
ΔESV <15% (6 мес.) |
А М |
КЭС ЛЖ МСС |
КЭС ЛЖ; 17С AHA модель ЛЖ; механические параметры |
– |
SD_MVC (разброс регионального напряжения волокон стенки при закрытии митрального клапана) |
ПФ: 1) корреляция между ΔESV и SD_MVC: r=-0,859, p=0,018; 2) SD_MVC выше в LBBBP по сравнению с контролем (p<0,001) |
|
Koopsen 2023 |
in-silico оценка потенциальных предикторов ответа на СРТ |
45 |
1) ЭхоКГ кривые деформации для сегментов ЛЖ и объемы; 2) данные о процедуре СРТ |
ΔESV (6 мес.) |
А M Г |
редуцированная, CircAdapt CircAdapt |
75 п-ров (сердечный выброс, глобальная длительность активации ЛЖ, A-V задержка |
LBBB, BiV-epi |
MWLW-S (разница локальной работы между септальными и латеральными регионами ЛЖ), dP/dtmax, ΔMWLW-S, |
ПФ: корреляция 1) между MWLW-S и ΔESV: r=-0,60, P<0,001; 2) между ΔMWLW-S и ΔESV: r=0,62, P<0,001; 3) между ΔdP/dtmax и ΔESV: r=-0,34, P=0,02 |
|
Sidhu 2023 |
оценить метод нахождения целевого сегмента (ЦС) для ЛЖЭ при WiSE-СРТ по вычисленной in-silico зоне поздней электрической активации ЛЖ и данным КТ о зоне поздней механической активации, толщине стенки и перфузии |
10 (проспективное) |
для моделирования: КТ анатомия; другие исследования для поиска ЦС: 1) перфузионная КТ, 2) измерения деформации и площади сегментов ЛЖ по КТ |
ΔdP/dtmax (остр.) |
А ЭФ |
КЭС 2Ж эйконал |
КЭС желудочков; |
RVP |
зона поздней электрической активации; толщина стенки |
ОC: 1) увеличение ответа при стимуляции в ЦС (%ΔdP/dtmax: 25,5% ±8,8% (ЦС) против 12,9% ±8,6% (не ЦС), P<0,001); 2) электрод имплантирован в ЦС у 80% пациентов |
|
Strocchi 2023 |
сравнение эффективности разных техник СРТ |
24 |
КТ |
– |
А Р ПС ЭФ |
КЭС 2Ж анатомический дерево эйконал |
КЭС желудочков; анатомическая разметка постинфарктного рубца перенесена |
LBBB, BiV-epi, HBP, LBP, HOT-CRT, |
LVAT-95, |
ОC: наиболее эффективны: |
|
Craine 2024 |
in-silico оценка потенциальных предикторов ответа на СРТ |
8 |
1) анамнез; 2) КТ или МРТ; 3) ОФЭКТ 4) времена активации по ВКГ из ЭКГ; 5) ВЖД; 6) ПЖ и ЛЖ объемы, характеристики клапанов, сердечный выброс по ЭхоКГ; 7) АД; 8) данные о процедуре СРТ |
↓ФК по NYHA; ΔESV <10% (6 мес.) |
А Р ЭФ М Г |
КЭС 2Ж сегментарный монодоменная МСС CircAdapt |
КЭС желудочков; 17С AHA модель ЛЖ; разметка постинфарктного рубца; параметры клеточных моделей; скорости проведения; эктопический стимул в субэндокарде ПЖ; пассивные параметры материала; активные сократительные параметры; параметры кровообращения; V-V задержки и расположение электродов для BiV-epi |
RVP, BiV-epi |
региональная работа, приближенные измерения работы, характеристики работы |
ПФ: 1) самая высокая корреляция получена между ΔESV и объемной долей ЛЖ, выполняющей отрицательную работу (R^2=0,82, p<0,01); 2) стат. значимые различия между некоторыми характеристиками работы, в т.ч. при приближенном расчете, в группах респондеров и нереспондеров (p<0,05) |
|
Ložek 2024 |
разработка и валидация модели ПЖ |
2 |
1) анамнез; 2) желудочковые объемы, характеристики клапанов, механическая задержка |
– |
А M Г |
редуцированная 6С (ПЖ) CircAdapt CircAdapt |
механические задержки в 6 сегментах ПЖ, увеличивающиеся от перегородки к боковой стенке; другие параметры CircAdapt |
PRToF, RV-CRT |
параметры механической и насосной функции желудочков |
продемонстрировано возможное применение модели для прогноза эффективности ПЖ стимуляции |
|
Математические модели + искусственный интеллект |
||||||||||
|
Giffard- Roisin 2019 |
решение обратной задачи ЭФИ по данным неинвазивного картирования на основе синтезированных модельных данных, валидация |
20 |
BSPM, КТ |
– |
A ПС ЭФ |
КЭС 2Ж БЭС эйконал |
карта активации ЛЖ и ПЖ на естественном ритме, локальные скорости проведения |
для обучения регрессионной модели — 1-2 места начальной активации среди вершин эндо- и эпи- поверхности сердечной сетки. Для тестирования RVP, LVP, BiV |
7 признаков QRS комплекса электрограммы, извлеченных для сигнала BSPM в каждом |
предложен регрессионный метод восстановления карт активации желудочков и проводимости миокарда по данным BSMP на естественном ритме на основе синтетического датасета (5000 строк) из модельных данных прямого ЭФ моделирования на референтной модели. Протестировано на данных пациентов при стимуляции желудочков. Медиана отклонения времени активации на восстановленных картах в сравнении с картами CardioInsight — 23,8 мс. Ошибка в положении ЛЖ электрода по восстановленной карте 20-30 мм |
|
Lee 2021 |
оптимизация положения ЛЖ электрода и разработка классификатора острого ответа на СРТ на основе клинических признаков, КТ-признаков и модельных ЭФ признаков |
27 |
1) КТ, 2) ЭКГ, 3) клинические параметры, 4) ВЖД |
AHR (ΔdP/dtmaх) ≥10% (остр.) |
А ПС ЭФ |
КЭС 2Ж БЭС монодоменная |
КЭС желудочков; |
RVP, BiV-epi |
RV-LV delay, QRSd, LVTA, Risetime |
КО: лог. регрессия: 1) ROC AUC >0,7 — лучший показатель по двум признакам, включая RV-LV delay; 2) ROC AUC =0,79 — по всем признакам |
|
Khamzin 2021 |
разработка классификатора ответа на СРТ на основе клинических и модельных данных |
57 |
1) клинические параметры, 2) КТ, 3) МРТ, 4) ЭКГ, 5) ЭхоКГ |
ΔLVEF >10% |
А Р ПС ЭФ |
КЭС 2Ж сегментарный дерево эйконал |
КЭС желудочков; сегментарная разметка фиброза и рубцов, позиции ЛЖ и ПЖ электродов; скорость проведения |
LBBB, BiV-epi |
набор клинических параметров, модельных индексов электрической диссинхронии (TAT, ADLVRV) |
KO: лучший ROC AUC =0,82 (SVM). Среди наиболее значимых индексов — большинство модельных — расстояние до зоны рубца, расстояние до зоны поздней активации, общее время активации |
|
Rodero 2022 |
1) разработка оптимальной конфигурации четырехполюсного электрода 2) анализ влияния обратного ремоделирования геометрии желудочков на ответ на СРТ |
24 (HF) + 20 (RR) |
КТ |
– |
А ПС ЭФ |
КЭС 2Ж БЭС эйконал |
КЭC желудочков |
BiV-epi или MSP (двухполюсная ЛЖ стимуляция с четырехполюсного электрода) |
BiVAT-90, ΔBiVAT-90 |
ОС: 1) отсутствие значимого увеличения ΔBiVAT-90 при персонифицированном выборе положения ЛЖ электродов по сравнению с когортным; 2) снижение ΔBiVAT-90 при обратном ремоделировании желудочков; 3) небольшое увеличение ΔBiVAT-90 при 2-х полюсной ЛЖ стимуляций по сравнению с однополюсной |
|
Dokuchaev 2023 |
1) построение логистической регрессии — калькулятора ответа на СРТ. 2) оптимизация стимуляции на основе максимального балла калькулятора ответа и алгоритм отбора кандидатов на СРТ |
57 |
1) клинические параметры, 2) КТ, 3) МРТ, 4) ЭКГ, 5) ЭхоКГ |
ΔLVEF >10% |
А Р ПС ЭФ |
КЭС 2Ж сегментарный дерево эйконал |
КЭС желудочков; сегментарная разметка фиброза и рубцов, позиции ЛЖ и ПЖ электродов; скорость проведения, 17С АНА модель |
LBBB, BiV-epi при референтном расположении электродов и при вариации позиции ЛЖЭ в 17С ЛЖ |
набор клинических параметров, модельных индексов электрической диссинхронии (TAT, ADLVRV) на LBBB и при BiV стимуляции, расстояние до рубца, расстояние до зоны поздней активации, RV-LV delay |
KO: логистическая регрессия на клинических и модельных данных ROC AUC =0,84. ОС: Алгоритм оптимизации положения ЛЖ электрода на основе максимального балла логистической регрессии. Навигационные карты прогноза ответа на СРТ в зависимости от положения ЛЖ электрода с указанием оптимальной позиции. Валидация алгоритма: положительный прогноз ответа при максимальном балле >0,5 и близость ЛЖ электрода к предсказанному оптимальному положению <30 мм предсказывает респондеров с точностью 0,77. Частота ответа при выполнении этих условий 0,8 |
|
Taconné 2024 |
разработка классификатора ответа на СРТ на основе индивидуальных параметров моделей сердечно-сосудистой системы пациента |
162 |
кривые деформации для сегментов ЛЖ по ЭхоКГ |
ΔESV <15% (6 мес.) |
A ПС ЭФ М Г |
16С (ЛЖ) 3С (ПЖ) КА КА феноменологическая сегментарная |
113 параметров (7 наиболее значимых параметров модели для каждого из 16 сегментов ЛЖ, а также 2 параметра электрической активности) |
– |
113 персонифи-цированных параметров |
КO: ROC AUC =0,86±0,06 (случайный лес); наиболее важные предикторы ответа: параметры региональной сократимости миокарда, жизнеспособности тканей и задержки электрической активации |
|
Ссылки |
|
|
Albatat 2021 |
Albatat M, Arevalo H, Bergsland J, et al. Optimal pacing sites in cardiac resynchronization by left ventricular activation front analysis. Comput Biol Med. 2021;128:104159. doi:10.1016/j.compbiomed.2020.104159 |
|
Albatat 2023 |
Albatat M, Finsberg HN, Arevalo H, et al. Regional Left Ventricular Fiber Stress Analysis for Cardiac Resynchronization Therapy Response. Ann Biomed Eng. 2023;51(2):343-51. doi:10.1007/s10439-022-03030-y |
|
Craine 2024 |
Craine A, Krishnamurthy A, Villongco CT, et al. Successful cardiac resynchronization therapy reduces negative septal work in patient-specific models of dyssynchronous heart failure. PLOS Comput Biol. 2024;20(10):e1012150. doi:10.1371/journal.pcbi.1012150 |
|
Dokuchaev 2023 |
Dokuchaev A, Chumarnaya T, Bazhutina A, et al. Combination of personalized computational modeling and machine learning for optimization of left ventricular pacing site in cardiac resynchronization therapy. Front Physiol. 2023;14:1162520. doi:10.3389/fphys.2023.1162520 |
|
Giffard-Roisin 2019 |
Giffard-Roisin S, Delingette H, Jackson T, et al. Transfer Learning From Simulations on a Reference Anatomy for ECGI in Personalized Cardiac Resynchronization Therapy. IEEE Trans Biomed Eng. 2019;66(2):343-53. doi:10.1109/TBME.2018.2839713 |
|
Isotani 2020 |
Isotani A, Yoneda K, Iwamura T, et al. Patient-specific heart simulation can identify non-responders to cardiac resynchronization therapy. Heart Vessels. 2020;35(8):1135-47. doi:10.1007/s00380-020-01577-1 |
|
Khamzin 2021 |
Khamzin S, Dokuchaev A, Bazhutina A, et al. Machine Learning Prediction of Cardiac Resynchronisation Therapy Response From Combination of Clinical and Model-Driven Data. Front Physiol. 2021;12. doi:10.3389/fphys.2021.753282 |
|
Koopsen 2023 |
Koopsen T, Gerrits W, van Osta N, et al. Virtual pacing of a patient’s digital twin to predict left ventricular reverse remodelling after cardiac resynchronization therapy. Eur Eur Pacing Arrhythm Card Electro- |
|
Lee 2021 |
Lee AWC, Razeghi O, Solis-Lemus JA, et al. Non-invasive simulated electrical and measured mechanical indices predict response to cardiac resynchronization therapy. Comput Biol Med. 2021;138:104872. doi:10.1016/j.compbiomed.2021.104872 |
|
Ložek 2024 |
Ložek M, Kovanda J, Kubuš P, et al. How to assess and treat right ventricular electromechanical dyssynchrony in post-repair tetralogy of Fallot: insights from imaging, invasive studies, and computational modelling. Eur Eur Pacing Arrhythm Card Electrophysiol J Work Groups Card Pacing Arrhythm Card Cell Electrophysiol Eur Soc Cardiol. 2024;26(2). doi:10.1093/europace/euae024 |
|
Melgaard 2022 |
Melgaard J, van Dam PM, Sommer A, et al. Non-invasive estimation of QLV from the standard 12-lead ECG in patients with left bundle branch block. Front Physiol. 2022;13:939240. doi:10.3389/fphys.2022.939240 |
|
Rodero 2022 |
Rodero C, Strocchi M, Lee AWC, et al. Impact of anatomical reverse remodelling in the design of optimal quadripolar pacing leads: A computational study. Comput Biol Med. 2022;140:105073. doi:10.1016/j.compbiomed.2021.105073 |
|
Sidhu 2023 |
Sidhu BS, Lee AWC, Gould J, et al. Guided implantation of a leadless left ventricular endocardial electrode and acoustic transmitter using computed tomography anatomy, dynamic perfusion and mechanics, and predicted activation pattern. Heart Rhythm. 2023;20(11):1481-8. doi:10.1016/j.hrthm.2023.07.007 |
|
Strocchi 2020a |
Strocchi M, Lee AWC, Neic A, et al. His-bundle and left bundle pacing with optimized atrioventricular delay achieve superior electrical synchrony over endocardial and epicardial pacing in left bundle branch block patients. Heart Rhythm. 2020;17(11):1922-9. doi:10.1016/j.hrthm.2020.06.028 |
|
Strocchi 2020b |
Strocchi M, Neic A, Gsell MAF, et al. His Bundle Pacing but not Left Bundle Pacing Corrects Septal Flash in Left Bundle Branch Block Patients. In: Computing in Cardiology. Vol 2020-September; 2020. doi:10.22489/CinC.2020.030 |
|
Strocchi 2022a |
Strocchi M, Wijesuriya N, Elliott MK, et al. Leadless biventricular left bundle and endocardial lateral wall pacing versus left bundle only pacing in left bundle branch block patients. Front Physiol. 2022;13:1049214. doi:10.3389/fphys.2022.1049214 |
|
Strocchi 2022b |
Strocchi M, Gillette K, Neic A, et al. Comparison between conduction system pacing and cardiac resynchronization therapy in right bundle branch block patients. Front Physiol. 2022;13:1011566. doi:10.3389/fphys.2022.1011566 |
|
Strocchi 2023 |
Strocchi M, Gillette K, Neic A, et al. Effect of scar and His-Purkinje and myocardium conduction on response to conduction system pacing. J Cardiovasc Electrophysiol. 2023;34(4):984-93. doi:10.1111/jce.15847 |
|
Taconné 2024 |
Taconné M, Le Rolle V, Galli E, et al. Characterization of cardiac resynchronization therapy response through machine learning and personalized models. Comput Biol Med. 2024;180:108986. doi:10.1016/j.compbiomed.2024.108986 |
|
Vergara 2022 |
Vergara C, Stella S, Maines M, et al. Computational electrophysiology of the coronary sinus branches based on electro-anatomical mapping for the prediction of the latest activated region. Med Biol Eng Comput. 2022;60(8):2307-19. doi:10.1007/s11517-022-02610-3 |
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Нестерова Т.М., Кабак В.Ю., Лебедев Д.С., Соловьева О.Э. Математические модели и искусственный интеллект для исследования проблемы диссинхронии желудочков и улучшения эффективности сердечной ресинхронизирующей терапии. Российский кардиологический журнал. 2024;29(4S):6194. https://doi.org/10.15829/1560-4071-2024-6194. EDN: LNDWQI
Скопировать