Лечение фибромускулярной дисплазии почечной артерии посредством ангиопластики баллоном с лекарственным покрытием и внутрисосудистой визуализации: клинический случай

Аннотация
Фибромускулярная дисплазия (ФМД) — сегментарная, невоспалительная и неатеросклеротическая болезнь гладких мышц сосудов неизвестной этиологии, которая приводит к стенозам артерий среднего и мелкого калибров. Выбор тактики хирургического лечения при ФМД почечных артерий (ПА) зависит от тяжести клинических проявлений и ответа на применяемое консервативное медикаментозное лечение. Молодой возраст, женский пол, высокое артериальное давление с недостижением целевых значений на фоне применяемой медикаментозной терапии, а также отсутствие атеросклероза в других артериальных бассейнах дает повод заподозрить ФМД ПА. По современным рекомендациям при инвазивном лечении гемодинамически значимых стенозов ПА предпочтение отдается транслюминальной баллонной ангиопластике ПА баллоном с лекарственным покрытием. Стентирование при данной патологии ПА не рекомендуется, однако к имплантации стента прибегают в случае недостижения оптимального результата баллонной ангиопластики или в результате развития перипроцедуральных осложнений, таких как диссекция артерии. Открытая реконструктивная операция показана при сложной анатомии пораженной артерии, макроаневризмах, при которых стентграфты неэффективны, при резистентном интимальном фибропластическом поражении, при повышенном риске эндоваскулярного лечения или после неудачного эндоваскулярного вмешательства.
В статье представлен клинический случай ведения молодой больной с ФМД ПА, вазоренальной артериальной гипертонией, которой успешно проведена транслюминальная баллонная ангиопластика ПА баллоном с лекарственным покрытием.
Вазоренальная артериальная гипертензия (АГ) — наиболее часто встречающаяся форма симптоматической АГ, развивающаяся в следствии нарушения магистрального кровотока в почках без первичного повреждения их паренхимы и мочевыводящих путей [1]. В патогенезе АГ наибольшее значение имеет активация ренин-ангиотензивной системы вследствие гипоперфузии почки, что ведет к спазму сосудов, увеличению синтеза ренина и альдостерона, задержке ионов натрия и воды, увеличению внутрисосудистого объема и стимуляции симпатической нервной системы [1]. Системная АГ является главным фактором нахождения почки в длительно прогрессирующей гипоксии, что оказывает фиброгенное действие на ткань почек. Это приводит к нарушению функции почечных клеток, уменьшению массы функционирующих нефронов и в последствии к развитию почечной недостаточности [1]. Фибромускулярная дисплазия (ФМД) является второй по частоте причиной развития вазоренальной гипертензии, что составляет ~10-15% случаев [2]. Она представляет собой идиопатическое, не атеросклеротическое, не воспалительное поражение артерий мышечно-эластического типа, выявляемое преимущественно у молодых женщин [3]. Характерное поражение имеет типичную картину при контрастных исследованиях в виде «нити бус», что является патогномоничным признаком ФМД [4]. В 2017г нами было выполнено успешное лечение пациентки с ФМД почечной артерии (ПА) при помощи баллонной катетерной дилатации без последующего стентирования (согласно рекомендациям Европейской ассоциации кардиологов 2017г). С момента вмешательства прошло 7 лет, уровень артериального давления (АД) без антигипертензивной терапии 110-120/60-70 мм рт.ст. [5].
В 2019г был выпущен первый международный согласительный документ по диагностике и лечению ФМД с поражением различных сосудов: почечные, цереброваскулярные, коронарные и другие [3]. Согласно документу, первичным методом диагностики пациентов с подозрением на ФМД ПА является компьютерная томография с агиографией, которые позволяют выявлять неравномерность артериального просвета или формирование вида артерии по типу «нити бус», что обусловлено стенозом ПА не атеросклеротического характера [3]. Дополнительные методы диагностики ‒ внутрисосудистое ультразвуковое исследование (ВСУЗИ) и оптическая когерентная томография позволяют дифференцировать ФМД и атеросклероз ПА, васкулиты и другие заболевания [6]. Выбор лечебной тактики при ФМД ПА зависит от тяжести клинических проявлений и ответа организма на применяемое консервативное медикаментозное лечение.
Клинический случай
Информация о пациенте. Пациентка Л., 25 лет, длительное время болеет АГ с максимальными цифрами АД до 200/150 мм рт.ст. с субъективно плохой переносимостью. Из анамнеза заболевания известно, что в 2011г была госпитализирована с диагнозом анемия тяжелой степени тяжести в стационар по месту жительства, где впервые была зарегистрирована АГ 3 степени. В ходе диагностического поиска выявлено изменение скорости кровотока в воротах правой ПА (ППА) до 156 мм/сек. Помимо терапии препаратами железа назначена антигипертензивная терапия ингибитором ангиотензинпревращающего фермента эналаприлом 5 мг/сут. Диагностические поиски не приводили к улучшению общего самочувствия пациентки. Ежегодные обследования заканчивались назначением различных комбинаций симптоматического лечения АГ. По словам пациентки, спустя некоторое время на фоне назначенной терапии вовсе перестали достигаться целевые значения АД. По совету родственницы была направлена на консультацию кардиолога в НМИЦ ТПМ (рис. 1).

Рис. 1. Хронология заболевания.
Сокращение: АД — артериальное деление.
Росла и развивалась нормально, соответственно возрасту и полу. Аллергический анамнез не отягощен. Курение отрицает. Алкоголь не употребляет. Сахарный диабет отрицает. Наследственный анамнез не отягощенный.
Планово госпитализирована 08.2023г с жалобами на дестабилизацию цифр АД до 200/150 мм рт.ст. с субъективно плохой переносимостью. На момент госпитализации на терапии препаратами эналаприл и индапамид. Гемоглобин составлял 114 г/л на фоне раннее пройденного курса препаратом сорбифер дурулес.
Результаты физикального осмотра. При физикальном осмотре кожные покровы обычной окраски и влажности. Лимфатические узлы не увеличены. Подкожно-жировая клетчатка развита умеренно. Периферических отеков нет. Варикозного расширения вен нет. Аускультация легких — дыхание везикулярное, проводится по всем легочным полям, хрипы не выслушиваются. Частота дыхательных движений 16 в минуту. Сатурация 98%. Сосуды шеи не изменены, видимых пульсаций нет. Аускультация сердца: тоны сердца ритмичные. Частота сердечных сокращений 68 уд./мин. Пульс 68 уд./мин, ритмичен. АД 180/120 мм рт.ст. на обеих руках. При аускультации выслушивается локальный «дующий» систолический шум в области проекции брюшного отдела аорты, в эпигастрии. В точках аускультации почечных, сонных, бедренных артерий патологические шумы не выслушиваются. Живот мягкий, безболезненный. Симптом раздражения брюшины отрицательный. Печень по краю реберной дуги. Стул оформленный, регулярный. Мочеиспускание безболезненное. Симптом поколачивания отрицательный. Сознание ясное, пациентка контактна, ориентирована в пространстве и во времени.
Антропометрические данные: рост 165 см, вес 60 кг, индекс массы тела 22,04 кг/м².
Акушерско-гинекологический анамнез: менструация с 13 лет, по 5 дней, через 28-35 дней, умеренные, болезненные. Половая жизнь с 18 лет. Количество беременностей — 0. Родов — 0. Аборты — 0. Выкидыши — 0. Замершие беременности — 0. Операций не было.
Предварительный диагноз. Основное заболевание: АГ, неконтролируемая АГ. Фоновое заболевание: Стеноз ППА. Сопутствующие заболевания: Хроническая железодефицитная анемия легкой степени тяжести.
Диагностическая оценка
При осмотре состояние пациентки удовлетворительное, АД на правой руке 180/120 мм рт.ст., на левой руке 160/120 мм рт.ст., частота сердечных сокращений 68 уд./мин, пульс на обеих руках 68 уд./мин.
По результатам эхокардиографии сократимость миокарда не нарушена, клапаны сердца интактны, гипертрофия миокарда не отмечена. Эндокринный генез АГ исключен. На электрокардиографии без отклонений от нормы.
По данным ультразвукового исследования почек отклонений нет. По результатам дуплексного сканирования почек и надпочечников диагностически значимых ультразвуковых изменений не выявлено. На дуплексном сканировании ПА: признаки гемодинамически значимого стеноза ППА (>65%) на уровне среднего сегмента. Кровоток при цветовом допплеровском картировании турбулентный, на уровне среднего и дистального сегментов значимое увеличение линейной скорости кровотока до 190 см/сек и 296 см/сек, соответственно. Левая ПА: без признаков гемодинамически значимого стенозирования в доступных визуализации сегментах.
В биохимическом анализе крови без отклонений от нормальных значений, креатинин составляет 56,0 мкмоль/л, скорость клубочковой фильтрации (по формуле CKD-EPI): 125 мл/мин/1,73 м², общий холестерин 4 ммоль/л, липопротеиды высокой плотности 1,75 ммоль/л, липопротеиды низкой плотности 2 ммоль/л, липопротеиды очень низкой плотности 0,22 ммоль/л.
В общем анализе крови: гемоглобин 114 г/л, эритроциты 4,64 10*12/л, гематокрит 35,3%.
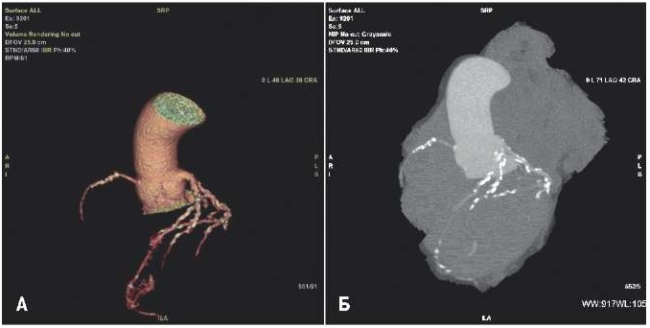
Выполнена ангиография ПА, на которой отмечается наличие ФМД по мультифокальному типу ППА с наличием 95% стеноза в среднем отделе c характерной для ФМД цепью из аневризматических мешочков ‒ симптом «нити бус», в левой ПА гемодинамически значимых стенозов не выявлено (рис. 2, 3).

Рис. 2. ФМД ППА с 95% стенозом в среднем отделе.

Рис. 3. Ангиография левой ПА без гемодинамически значимых стенозов.
Клинический диагноз. Основное заболевание: АГ, неконтролируемая АГ. Фоновое заболевание: ФМД ППА. Сопутствующие заболевания: Хроническая железодефицитная анемия легкой степени тяжести.
Дифференциальная диагностика
Диагностика ФМД ПА является сложной задачей, для решения которой необходимо учитывать результаты ангиографического исследования, анамнестические, клинические и лабораторные данные. Дифференциальную диагностику ФМД ПА проводят с атеросклеротическим поражением ПА, однако оно характерно для пациентов пожилого возраста и, как правило, имеет стеноз на коротком протяжении, без характерных структур по типу «нити бус».
Также дифференциальную диагностику могут проводить с воспалительными поражениями ПА — васкулитами, а именно с узелковым полиартериитом. Для данного заболевания характерна АГ, с выявлением стеноза ПА по результатам ультразвуковой допплерографии. На ангиографии могут выявляться аневризмы или окклюзии ПА, не обусловленные атеросклерозом. Узелковый полиартериит сопровождается снижением массы тела, слабостью, лихорадкой, хронической почечной недостаточностью, мышечно-скелетными изменениями и другими изменениями.
Медицинские вмешательства
Пациентке была выполнена баллонная ангиопластика ППА. Под контролем ультразвукового исследования под местной анестезией выполнен правый феморальный доступ, установлен интродьюсер размером 6F. Проводниковый катетер установлен в устье ППА. На контрольной ангиографии подтверждается 95% стеноз среднего отдела ППА с характерным симптомом «нити бус», слева артерия без гемодинамически значимого поражения (рис. 2, 3). Проводник проведен в дистальный отдел ППА. Для подтверждения ФМД было принято решение выполнить ВСУЗИ, по результатам которого подтверждается стенозированное поражение ПА неатеросклеротического характера с выраженным циркулярным фибротическим компонентом (рис. 4). Так же с помощью ВСУЗИ был рассчитан диаметр ПА и подобран оптимальный размер баллонного катетера для планируемой ангиопластики. Выполнена предилатация пораженного участка ППА баллоном высокого давления 3,5×20 мм инфляцией 18 атмосфер (рис. 5). На контрольном ВСУЗИ определяется нарушение целостности фиброзного тяжа (рис. 6). Выполнена аппликация зоны ФМД баллонным катетером с лекарственным покрытием 6×40 мм инфляцией 12 атмосфер. экспозицией 60 сек (рис. 7). На контрольной съемке хороший ангиографический результат, признаков диссекции нет (рис. 8). По результатам финального ВСУЗИ достигнуты целевые показатели раскрытия, хороший результат баллонной ангиопластики (рис. 9).

Рис. 4. А — участок артерии с ФМД, имеющий циркулярный фибротический тяж,
Б — площадь просвета дистальной зоны здорового участка.

Рис. 5. Баллонная ангиопластика ППА некомплаентным баллоном.

Рис. 6. Нарушение целостности фиброзного тяжа
после дилатации баллоном высокого давления на ВСУЗИ.

Рис. 7. Баллонная ангиопластика ППА баллоном с лекарственным покрытием.

Рис. 8. Результат ангиопластики ППА.

Рис. 9. ВСУЗИ после баллонной ангиопластики:
А — дебалкинг циркулярного фибротического стеноза, Б — здоровый участок.
Во время проведения операции пациентка находилась в сознании, активно жалоб не предъявляла, гемодинамические показатели оставались стабильными. Больная была выписана на 2-е сутки послеоперационного периода. АД на фоне продолженной антигипертензивной терапии стабилизировалось на уровне 120-130/75-85 мм рт.ст.
Динамика и исходы
У пациентов с ФМД через 1 мес. после реваскуляризации обычно отмечается нормализация АД, при которой возможно сокращение или полное прекращение гипотензивной терапии [7]. Поскольку рестенозы в основном происходят в первые 6 мес. [8], рекомендуется выполнять дуплексное сканирование ПА в течение этого периода времени. Если в течение 6 мес. нет отрицательной динамики, то в дальнейшем пациенты наблюдаются так же, как при ФМД без стенозирования ПА [7].
Через 2 нед. после вмешательства кардиологом по месту жительства полностью отменена антигипертензивная терапия в связи с снижением и нормализацией уровня АД, через 4 мес. после баллонной вазодилатации ППА у пациентки сохраняется АД на уровне 110-120/70-80 мм рт.ст. без приема антигипертензивной терапии. Выполнено контрольное дуплексное сканирование ПА. Левая ПА без гемодинамически значимых стенозов, ППА имеет неровности контуров в среднем отделе, линейная скорость кровотока в стволе ППА 82 см/сек (рис. 10).

Рис. 10. Дуплексное сканирование ППА.
Обсуждение
ФМД — редкое неатеросклеротическое и невоспалительное заболевание артерий, характеризующееся фиброзной или мышечной гиперплазией в одном и более слоях (интима, медия, адвентиция) стенки артерии [9]. Ранняя диагностика ФМД сложна. Это связано с несколькими факторами: не специфичностью симптоматики и с тем, что ФМД не участвует в дифференциальной диагностике, поскольку является редким заболеванием. Данные из реестра США показали среднее время между началом симптомов и постановкой диагноза ФМД 3,6±7,4 года [10]. Фактором задержки постановки диагноза являлось наличие АГ и назначение комбинированной медикаментозной терапии [10].
Контрастная агиография остается «золотым стандартом» в подтверждение диагноза ФМД [11]. Традиционная агиография используется для определения локализации и протяженности поражения ПА. Классическими агиографическими признаками ФМД ПА является чередование стенозов и дилатаций, симптом «нити бус» и аневризмы [12][13]. Симптом «нити бус» представляет собой цепь из аневризматических мешочков, похожих на бусы [13].
Помимо агиографии, дополнительным методом инвазивной диагностики является ВСУЗИ, которое предоставляет возможность дифференцировать ФМД от атеросклеротического поражения ПА, дает понимание о степени стеноза и повышает точность определения остаточного стеноза после баллонной ангиопластики. В данном клиническом случае результаты ВСУЗИ, а именно наличие циркулярного фибротического гиперэхогенного компонента в месте стеноза ППА, позволили подтвердить неатеросклеротический характер пораженного участка.
Согласно Европейскому консенсусу по диагностике и лечению ФМД у пациентов с АГ скрининг на наличие стеноза ПА, связанного с ФМД, рекомендуется проводить в любом из следующих случаев [7]:
- Возраст <30 лет, особенно у женщин,
- АГ степень 3 (180/110 мм рт.ст.), злокачественное течение,
- Резистентная АГ,
- Маленькая почка без уропатии в анамнезе,
- Абдоминальные шумы без явного атеросклероза,
- ФМД по меньшей мере в одном сосудистом бассейне.
ФМД является хроническим заболеванием, не имеющим патоморфологического медикаментозного лечения. План лечения для каждого пациента основывается на тяжести клинической картины, локализации и значимости поражения в сосудистом бассейне, а также от наличия аневризм и диссекций ПА.
Реваскуляризация почек рекомендована пациентам с гемодинамически значимым стенозом ПА, ишемии почки и неконтролируемой АГ [9]. Традиционная баллонная ангиопластика является методом выбора первой линии у пациентов с ФМД, однако, как показывает практика, рестеноз неизбежен, что ограничивает его применение. До настоящего времени, ни в одном рандомизированном исследовании не было представлено доказательных данных по лечению ФМД ПА баллонном с лекарственным покрытием. Баллон с лекарственным покрытием был разработан для предотвращения повторных рестенозов за счет наличия на своей поверхности антипролиферативного вещества (паклитакселя), имеющего доказательную эффективность в профилактике рестеноза у пациентов с поражением поверхностной бедренной артерии [14][15]. Представлены единичные случаи успешного лечения молодых пациентов с ФМД с использованием баллона с лекарственным покрытием [16]. Такой метод улучшил состояния пациентов с АГ в 60-90% [9][16]. Стентирование используется при осложнениях, связанных с транслюминальной баллонной ангиопластикой, а именно травме или разрыве артерии, когда невозможно устранить дефект, применив только баллонную ангиопластику [17]. Открытое хирургическое вмешательство рассматривают в первую очередь при макроаневризмах, при резистентности поражения интимы ПА к баллонной ангиопластике или при сложной анатомии поражения [17].
Восстановление просвета ПА с использованием баллонного катетера с лекарственным покрытием, а также модификация медикаментозной терапии, учитывая анамнез, поспособствовало улучшению качества жизни пациентки и показало свою эффективность и хороший отдаленный результат спустя 4 мес.
Рекомендации. Пациентке на момент выписки рекомендуется наблюдаться у кардиолога по месту жительства. Выполнение дуплексного сканирования ПА через 3 мес. с последующей консультацией кардиолога. Контроль общего самочувствия и АД. Постоянный прием ацетилсалициловой кислоты 100 мг 1 раз/сут., клопидогрел 75 мг 1 раз/сут. минимум 1 мес.
Заключение
Данный пример является иллюстрацией того, что правильный подход к лечению позволяет добиться максимально эффективного результата. Улучшение координации междисциплинарной команды позволит уменьшить время постановки верного диагноза, назначить правильную тактику наблюдения и лечения пациента. Стентирование не является методом выбора в лечении ФМД ПА. ВСУЗИ является дополнительным методом инвазивной диагностики, позволяющая дифференцировать ФМД от атеросклеротического поражения ПА. Оптимизация методов диагностики и лечения позволит достигнуть наиболее оптимальных результатов.
Информированное согласие. От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая, на использование медицинских данных в научных целях (дата подписания 26.12.2023).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Шукуров Ф.Б., Талиуридзе М.Т., Харлап М.С., Кардашова М.А., Федотова Н.П., Васильев Д.К., Фещенко Д.А., Шаноян А.С. Лечение фибромускулярной дисплазии почечной артерии посредством ангиопластики баллоном с лекарственным покрытием и внутрисосудистой визуализации: клинический случай. Российский кардиологический журнал. 2024;29(2S):5774. https://doi.org/10.15829/1560-4071-2024-5774. EDN: TNKKHL
Скопировать