Избыточная масса тела и ожирение при метаболическом синдроме
Аннотация
В настоящей статье проанализированы современные представления о патогенезе, диагностике и влиянии на прогноз избыточной массы тела при метаболическом синдроме. Приведен обзор современных возможностей диагностики, немедикаментозной и медикаментозной терапии избыточной массы тела, а также сердечно-сосудистых преимуществ препаратов, используемых для снижения массы тела.
Диагностика и лечение избыточной массы тела (ИзМТ) и ожирения у лиц с метаболическим синдромом (МС) проводится в соответствии с действующими клиническими рекомендациями1. Вместе с тем представляется целесообразным более подробно остановиться на ключевых особенностях ведения этого фенотипа пациентов.
Эпидемиология
Если ожирение рассматривать как основной и обязательный критерий МС, то естественно, что его частота встречаемости будет составлять 100%. Однако в последние годы стали выделять фенотип пациентов с МС без ИзМТ [1-3] и он составляет от 10 до 20% [4-6].
Особенности патогенеза
В самом упрощенном варианте развитие ожирения является результатом дисбаланса между поступлением энергии и энерготратами, но в реальности это очень сложный по патогенезу процесс [7], включающий в себя взаимодействие между генетическими и психологическими факторами и факторами окружающей среды [8]. Энергетический баланс обеспечивается комплексом сложных взаимосвязей между центральной нервной системой, жировой и мышечной тканью, кишечника, печени и поджелудочной железы.
Генетика
Вклад генетических факторов в развитие ожирения может составлять 40-70% [9][10] и связан с более 300 локусами хромосом [8], но при этом они обуславливают всего ~5% вариаций индекса массы тела (ИМТ) [11, 12].
Краткосрочная регуляция энергетического баланса
Гипоталамус играет важную роль в регуляции метаболизма [13], интегрируя сигналы о энергетических запасах и поступлении энергии через контроль потребления пищи, физической активности и основных базовых энергозатратах [14]. Краткосрочное пищевое поведение также контролируется структурами заднего мозга, где tractus solitarius получает информацию через афферентные пути nervus vagus, стимулируемые секретином и холецистокинином [15].
Аппетит стимулирующие нейроны в дугообразном ядре содержат нейропептид Y, стимулирующий Y рецепторы (Y1 и Y5), агути-связанный пептид, являющийся антагонистом активности MC3/4 рецепторов. Эти белки вместе с эндоканабиоидами являются стимуляторами аппетита. Грелин, преимущественно вырабатывающийся в желудке, также повышает аппетит.
Нейропептид Y играет важнейшую роль в поддержании энергетического гомеостаза [16] и является одним из наиболее мощных стимуляторов аппетита [17]. Нейропептид Y также продуцируется нейронами симпатической нервной системы и вызывает вазоконстрикцию, а также способствуют увеличению массы жировой ткани. Отрицательный энергетический баланс повышает уровень нейропептида Y в гипоталамусе, что увеличивает потребление пищи при уменьшении энерготрат за счет подавления симпатической активности. Кроме этого, изменение уровня нейропептида Y приводит к изменению настроения и тревожности [16][18].
Агути-связанный пептид. Агути-связанный пептид является стимулирующим аппетит нейропептидом, который влияет на те же нейроны, что и нейропептид Y. Они активируются при отрицательном энергетическом балансе (например, голодании) и при снижении уровня лептина и инсулина, оказывающих ингибирующее влияние на эти нейроны [19]. Активация агути-связанных нейронов приводит к повышенному потреблению пищи для восстановления дефицита поступления энергии [20] и при этом может формироваться механизм «вознаграждения» при потреблении пищи на фоне голодания [21][22].
Грелин. Самый высокий уровень грелина отмечается при голодании и непосредственно перед приемом пищи [23]. Грелин вырабатывается клетками желудочно-кишечного тракта (ЖКТ), их наибольшая плотность наблюдается в дне желудка [24][25]. В гипоталамусе грелин активирует те же нейроны, что и нейропептид Y и агути-связанный пептид [26] и стимулирует аппетит. Грелин также стимулирует выработку гормона роста [27]. Изменения рецепторов грелина могут быть связаны с генетическими мутациями [28-31]. Вместе с тем при ожирении часто отмечается снижение уровня грелина и его повышение при снижении веса [32]. При анорексии на фоне онкологической патологии введение грелина увеличивает потребление пищи [33]. Вероятно, стимуляция выработки грелина определяется не только ожирением, но и эндокринным статусом в целом.
Эндоканнабиноиды. Открытие эндоканнабиодной системы продемонстрировало ее важную роль в регуляции аппетита, пищевого поведения и регуляции энергетического баланса и массы тела [34]. CB1-рецепторы локализованы в мозге (преимущественно в гипоталамусе и лимбической системе) и регулируют поступление пищи [35]. Они также активируют метаболизм жиров в белой жировой ткани и глюкозы. CB2-рецепторы преимущественно представлены в иммунных клетках и играют важную роль в формировании иммунного ответа [36].
Секретин. Активация секретина через периферические (n. vagus) и центральные механизмы приводит у анорексигенному эффекту [37], активации термогенеза и липолизу бурой жировой ткани [37][38].
Холецистокинин. Холецистокинин («гормон сытости») вырабатывается в подвздошной и двенадцатиперстной кишке [39]. Стимулом его образования является наличие пищи в желудке, и он способствует прекращению приема пищи [40] через активацию афферентных нейронов и усиление активности nucleus tractus solitary [41]. Часть из этих нейронов заднего мозга влияет через парабрахиальное ядро (ключевое звено регуляции аппетита) на секрецию глюкагоноподобного пептида-1 [42].
Долгосрочная регуляция энергетического баланса
Ключевыми факторами долгосрочной регуляции энергетического баланса являются лептин и инсулин.
Лептин. Лептин — это адипокин, секретируемый белой жировой тканью. Его концентрация прямо пропорциональна количеству жировой ткани. Лептин регулирует чувство насыщения и энерготраты через стимуляцию проопиомеланокортина и подавление нейропептида Y/агути-связанного пептида в гипоталамусе. Нарушение продукции лептина может быть обусловлено мутациями его гена или изменениями родственных ему рецепторов, приводящими к гиперфагии и развитию лептинорезистентности. Возможно, что лептин в большей степени препятствует снижению жировых отложений, чем способствует их накоплению.
Инсулин. Уровень инсулина прямо коррелирует с массой жировой ткани. Его высокий уровень через механизм обратной связи с центральной нервной системой способствует снижению потребления пищи. При ожирении имеет место инсулинорезистентность и гиперинсулинемия, связанные с повышенным уровнем свободных жирных кислот и подавлением липолиза [43].
Инкретины. Инкретины (глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид-1 (ГПП-1)) — это пептиды, секретируемые энтеро-эндокринными клетками в ЖКТ в ответ на прием пищи, стимулирующий секрецию инсулина. Они обеспечивают феномен инкретинового эффекта, когда при пероральном приеме глюкозы секреция инсулина в 2-3 раза больше, чем при ее внутривенном введении [44]. ГИП стимулирует секрецию глюкагона, особенно при низком уровне глюкозы, в то время как ГПП-1 подавляет секрецию глюкагона, особенно при гипергликемии [44][45]. ГИП повышает инсулин стимулированный транспорт глюкозы, синтез жирных кислот и их включение в триглицериды [17]. ГПП-1 влияет на функцию многих органом и систем, снижает аппетит и потребление пищи, что приводит к снижению веса. ГИП и ГПП-1 быстро разрушаются ферментом дипептидилпептидазой 4 [46].
Амилин. Амилин является полипептидным гормоном, секретируемым параллельно с инсулином β-клетками поджелудочной железы [47]. Он также продуцируется в латеральном гипоталамусе и в синергии с леп- тином уменьшает потребление энергии [48]. Кроме того, амилин увеличивает энерготраты и влияет на пристрастия к определенной пищи («пищевой гедонизм») [49][50].
Роль белой жировой ткани
Белый жир — основа жировой ткани. Он бывает подкожным и висцеральным. Подкожный жир копится в так называемых «ловушках»: на животе, боках, ягодицах. Висцеральный окружает сердце и органы брюшной полости и при избытке сдавливает их, оказывая негативное влияние на их функции. Белая жировая ткань метаболически активна, продуцируя более 50 адипокинов (первыми были открыты адипонектин, лептин и резистин), влияющих на метаболический гомеостаз, липидный обмен, воспаление и иммунную функцию [51].
Снижение уровня адипонектина играет важную роль при ожирении в сочетании с коморбидной патологией [52]. Он обладает антиатеросклеротическим эффектом, усиливает окисление жирных кислот, подавляет продукцию глюкозы печенью [53]. Адипонектин способствует снижению веса, увеличивая энерготраты [54]. Противоположные адипонектину эффекты оказывает резистин, вероятнее всего за счет усиления инсулинорезистентности [55-57]. Роль других адипокинов [58] менее изучена, хотя уже продемонстрировано влияние хемерина, липокалина-2, васпина и оментина-1 на иммунитет и воспаление [58].
Роль бурой жировой ткани
Бурая жировая ткань играет важную роль в процессах термогенеза, стимулирует энерготраты, уменьшает инсулинорезистентность и способствует снижению веса [59-61]. Среди факторов, способствующих образованию бурой жировой ткани, помимо низкой температуры, необходимо выделить стимуляцию β3-адренорецепторов. Адипокины, продуцируемые бурой жировой тканью, оказывают кардиопротективное действие [62] и активируют липолиз [63].
Особенности течения
При анализе длительности существования ожирения (20 лет (очень длительное ожирение), 8 лет (длительное ожирение), 6 лет (недавнее ожирение) и 3 года (вновь возникшее ожирение)) наихудший метаболический профиль (инсулинорезистентность, повышение высокочувствительного С-реактивного белка (СРБ) и снижение липопротеинов высокой плотности) по сравнению с лицами без ожирения был при недавно возникшем ожирении и длительном ожирении [64].
Особенности диагностики
Антропометрия
ИМТ
Повышенным считается1 ИМТ ≥25 кг/м2.
Расчет показателя ИМТ (индекс Кетле, рассчитываемый по формуле: вес (кг): рост (м) = (кг/м2)), был предложен бельгийским математиком Адольфом Кетле в 1869г. Несомненными достоинствами этого показателя являются его абсолютная доступность, безопасность и практически нулевая стоимость [65] и использование при базовом обследовании практически всех пациентов. Однако опыт его применения при скрининге пациентов с ИзМТ и ожирением выявил снижение его диагностической и прогностической ценности у некоторых фенотипов пациентов (спортсмены с большой мышечной массой, при старческой астении) и этносов [66][67]. Но при этом показатель ИМТ остается самым часто используемым показателем при скрининге, диагностике и оценке метаболических и сердечно-сосудистых рисков (ССР) [68]. Комбинация показателя ИМТ с окружностью талии (ОТ), объёма бедер (ОБ), отношением ОТ/ОБ, процентом жировых отложений повышает его диагностическую и прогностическую ценность.
ОТ
Наличие абдоминального ожирения диагностируется при ОТ ≥80 см у женщин и ≥94 см у мужчин европейской расы.
ОТ определяется при измерении сантиметровой лентой (она плотно прилегает, но не сдавливает и человек не задерживает дыхание и не втягивает живот во время исследования) вокруг талии в самой узкой ее части. При этом, согласно различным рекомендациям, имеются различия в топографии определения ОТ: согласно Всемирной организации здравоохранения (ВОЗ), измерение рекомендуется проводить по средней точке между нижним краем последнего прощупываемого ребра и верхней частью гребня подвздошной кости [69], а по Inter ASIA International Collaboration on Cardiovascular Disease на 1 см выше пупка [70]. Измерение проводится на голое тело или через тонкую одежду при отсутствии метеоризма и спустя не менее часа после приема пищи.
Этот показатель позволяет легко диагностировать абдоминальное (центральное) ожирение, которое прямо коррелирует с выраженностью висцерального ожирения, повышением ССР и онкологического риска, МС, сахарного диабета (СД) 2 типа и коморбидной патологии [71-73].Определение ОТ рекомендовано для скрининга ожирения1, этот показатель более точен при диагностике абдоминального ожирения, чем показатели ИМТ и ОТ/ОБ [74]. На точность определения ОТ влияют рост (высокий и низкий) человека, выраженные мышцы брюшного пресса и беременность [75].
ОБ
Для мужчин с ростом 170-176 см ОБ в пределах 89-96 см считается нормальным, а для мужчин ростом от 170 до 192 см нормальный ОБ от 92 до 118 см. Увеличение ОБ >101,5 см у женщин при ИМТ >28 кг/м2 расценивается как наличие у них ожирения [38] и является фактором риска развития метаболических осложнений [76], сердечно-сосудистых заболеваний (ССЗ), ишемической болезни сердца (ИБС), СД 2 типа и преждевременной смерти [77][78]. В сочетании с ИМТ может быть методом скрининга ожирения. Для измерения ОБ необходимо обернуть сантиметровую ленту вокруг бедер по самой широкой части, учитывая выступающие точки ягодиц и живота. При наличии выступающего живота, при наложении ленты необходимо ее учитывать. Информативность показателя снижается у лиц с выраженными мышцами бедра.
Индекс ожирения тела (ИОТ)
ИОТ был предложен Bergman RN, et al. [79] и рассчитывается по формуле: ОТ (см)/рост (м)1,5-18 и чаще используется у латино- и афроамериканцев [80]. Считается, что ИОТ прямо коррелирует с уровнем мочевой кислоты, триглицеридов, глюкозы натощак и с другими антропометрическими показателями (ИМТ, ОТ, ОТ/ОБ) [81]. Его прогностическая ценность при ожирении ниже, чем у ИМТ и ОТ, но выше, чем у ОТ/ОБ [82]. Информативность показателя низкая при объеме жировых отложений <15% или при экстремальном ожирении [83].
ОТ/ОБ
Был предложен ВОЗ для определения абдоминального ожирения и более точного прогнозирования ССР [84], но из-за различных методик измерения ОТ недостаточно стандартизирован. По нормам ВОЗ ОТ/ОБ ≥0,90 у мужчин и ≥0,85 у женщин свидетельствует о наличии абдоминального ожирения [85]. Более «громоздкий» показатель ОТ/ОБ имеет те же недостатки, что и его отдельные составляющие [86], но он более информативен, чем ИМТ [87]. Считается, что ОТ/ОБ прямо коррелирует с уровнем мочевой кислоты, глюкозы натощак, уровнем артериального давления (АД) и нарушениями липидного обмена [87]. Имеющиеся данные свидетельствуют о высокой прогностической значимости этого показателя в отношении развития инфаркта миокарда [88] и обструктивного сонного апноэ (ОСА) [89].
Объем шеи (ОШ)
ОШ измеряется по основанию сантиметровой лентой таким образом, чтобы она проходила ниже Адамова яблока над яремной впадиной спереди и по основанию шеи сзади. У мужчин нормальный объем шеи ~40,5 см, а у женщин — ~34,2 см, но вариабельность данного показателя сильно зависит от типа телосложения. ОШ отражает выраженность подкожных и висцеральных жировых отложений верхней половины тела [90]. ОШ — хороший предиктор развития МС, СД 2 типа, сердечно-сосудистых осложнений, ОСА и гиповентиляционного синдрома [91, 92]. Показатель имеет существенные межрасовые различия.
Толщина кожной складки
Может определяться в разных местах: по методике Коровина толщина кожной складки измеряется на уровне III ребра (в норме 1-1,5 см) и параумбиликально, сбоку от прямой мышцы живота (в норме 1,5-2 см). Подлопаточная складка — в норме ее толщина не должна превышать 2 см, складка на животе у мужчин в норме до 1-2 см, у женщин — до 2-4 см.
В идеале для измерения использовать специальный прибор, называемый калипером [93], который сжимает складку кожи на определенных участках тела и через несколько секунд дает показатель толщины в миллиметрах. В реальной практике с помощью пальцев (большого и указательного или трех пальцев) захватывается кожно-жировая складка на выбранном участке тела перпендикулярно к поверхности кожи. Складка должна включать кожу и подкожный жир, не должна быть болезненной и не должна захватить только кожу или мышцы. Увеличение толщины кожной складки, особенно в области живота, может свидетельствовать о наличии избыточного веса или ожирения.
Индекс формы тела (ABSI) или индекс ожирения в области талии
Определяется по формуле: ИМТ2/3 × Рост1/2 и сильно коррелирует с МС, ССР и выраженностью абдоминального ожирения [73].
Для более детальной оценки распределения и количественной оценки жировых отложений используются показатели ОТ, ОБ, ОТ/ОБ и методы денситометрии, биоимпедансометрии, ультразвукового исследования (УЗИ), компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), двухэнергетической рентгеновской абсорбциометрии (DXA), позитронно-эмиссионной томографии (ПЭТ).
Биоимпедансометрия
Метод не является эталонным [94], но широко используется для оценки композиционного состава тела. Доступность обусловлена низкой стоимостью и простотой методики. В основе лежит измерение электрического сопротивления (импеданса) тканей, имеющих различную проводимость при прохождении через них переменного тока. Это позволяет оценить количество жировой и мышечной массы, внутри- и внеклеточной жидкости. Метод позволяет проводить анализ измене- ния жировой мышечной массы, общей воды в организме в динамики, в т.ч. у детей, подростков и спортсменов [94-96].
Гидростатическая денситометрия и плетизмография с вытеснением воздуха
Гидростатическая денситометрия (метод подводного взвешивания) основана на различиях плотности жировой и мышечной ткани. С использованием специальных формул после взвешивания пациента и оценки остаточного объема легких рассчитывается плотность тела и процентное содержание жира в организме. Метод не может быть использован в рутинной клинической практике в связи с его техническими сложностями (длительность исследования ~1 ч) и необходимостью погружения тела пациента в воду [97].
При воздушной плетизмографии объем тела оценивается по разнице между объемом воздуха в пустой камере и объемом воздуха и изменением давления воздуха после того, как в нее помещается человек. Метод позволяет измерить общую плотность тела, общее количество жира в организме. Время измерения составляет 5-8 мин, но требует специального оборудования, что ограничивает его использование в рутинной практике [98].
DXA
Метод DXA, основанный на особенностях взаимодействия рентгеновского излучения с различными тканями (костной, жировой и мышечной), дает возможность определить индекс жировой и безжировой массы, соотношение жира туловище/конечности и минеральную костную плотность (что активно используется для диагностики остеопороза). Проведения DXA позволяет более точно диагностировать и классифицировать ожирение по сравнению со стандартными антропометрическими измерениями [99]. Метод позволяет более точно диагностировать саркопению у лиц пожилого возраста и пациентов с СД 2 типа [100]. Метод позволяет быстро получить результаты, но имеет достаточно высокую стоимость.
УЗИ
УЗИ позволяет оценить количество подкожной жировой ткани или висцеральной жировой ткани и массу скелетных мышц. Проводят измерение расстояния между передней стенкой аорты и задней поверхностью прямых мышц живота на уровне 5 см ниже мечевидного отростка с последующей оценкой толщины подкожной жировой ткани и висцеральной жировой ткани, определяемой на этом же уровне, а также их соотношения. Данные, полученные этим методом, прямо коррелирует с данными о мышечной массе, полученными с использованием наиболее точных методов DXA, КТ и МРТ, но УЗИ является гораздо более простым, доступным и экономичным методом диагностики [101].
КТ
Метод основан на вычислении коэффициента ослабления рентгеновского излучения, проходящего через различные ткани тела человека. Для определения объема подкожной жировой ткани и висцеральной жировой ткани делают срезы на уровне поясничного отдела позвоночника (L1-L3), т.к. считается, что именно в этой области распределение жировой ткани наиболее точно коррелирует с ее распределением во всем организме [101]. Наряду с МРТ, метод считается «золотым стандартом» при оценке распределения и композиции жировой и мышечной тканей.
МРТ
Преимуществами метода являются высокая степень визуализации мягких тканей в сочетании с его доступностью и возможностью использования при более частом динамическом наблюдении в связи с отсутствием воздействия ионизирующим излучением. Метод позволяет различать и количественно оценить подкожно-жировую клетчатку и висцеральные жировые отложения в т.ч. в паренхиматозных органах [102].
Измерение площади сечения подкожной жировой клетчатки на уровне L3-L4 наиболее точно коррелирует с подкожной клетчаткой всего тела. Наиболее точно отражают количество абдоминальной жировой ткани срезы, проведенные на уровне 5-10 см выше L4-L5 или на уровне T12-L1 [103].
Выполнение МРТ на уровне поясничного отдела позвоночника позволяет дополнительно выявить пациентов с признаками ожирения по увеличению площади висцеральной жировой ткани, даже если они имели нормальные показатели ИМТ [104].
ПЭТ
Для проведения ПЭТ чаще всего используется 18F-фтордезоксиглюкоза, которая накапливается в тканях с высоким метаболизмом глюкозы. Ее накопление отслеживается при помощи ПЭТ-сканирования, в т.ч. в сочетании с КТ. Преимуществом ПЭТ является возможность оценки депо бурой жировой ткани (оценка ее плотности и метаболической активности), играющей важную роль в патогенезе ожирения. Сочетание ПЭТ и МРТ дает возможность более точно оценить объем бурой жировой ткани в конкретной области [105]. Недостатком использования ПЭТ является высокая стоимость.
При обследовании пациента с ИзМТ и ожирении необходимо обращать внимание на высокую частоту ассоциированных с ними заболеваний:
- пульмонологических — ОСА [106], бронхиальной астмы, синдрома Пиквика (гиповентиляция) [107] и предрасположенностью к респираторным инфекциям;
- кардиологических — ИБС [108], артериальной и легочной гипертензии, сердечной недостаточности с сохраненной фракцией выброса, кардиомиопатии;
- неврологических — инсульт/транзиторная ишемическая атака, идиопатической внутричерепной гипертензии, парестетической мералгии;
- гастроэнтерологических — патологии желчного пузыря (холецистит, холелитиаз), метаболически ассоциированная жировая болезнь печени, гастро-эзофагеальная рефлюксная болезнь;
- эндокринных — СД 2 типа;
- гинекологических — снижение фертильности, расстройства менструального цикла, гиперандрогения, поликистоз яичников;
- урологических — гипогонадизм (мужчины), стрес- совое недержание мочи;
- кожных — acanthosis nigricans, гирсутизм (женщины), целлюлит, опрелости, склонность к бактериальным и грибковым инфекциям;
- венозной системы — варикоз, лимфостаз, тромбоз глубоких вен;
- опорно-двигательной системы — остеоартрит, хроническая люмбалгия, варусная деформация шейки бедренной кости, смещение эпифиза головки бедренной кости, болезнь Блаунта (нарушение роста костей в области колена, приводящее к искривлению голени), болезнь Легга-Кальве-Пертеса (головка бедренной кости временно теряет кровоснабжение, что приводит к разрушению кости и воспалению);
- психических — депрессия, стигматизация.
Кроме этого, при обследовании пациента с ИзМТ и ожирением необходимо иметь повышенную онконастороженность в отношении как минимум 13 ви- дов новообразований, тесно ассоциированных с ними, которые обуславливают до 40% от всех случаев онкологических заболеваний. Имеются определённые гендерные различия в предрасположенности к конкретным формам новообразований при ожирении. Так, у мужчин повышен риск новообразований прямой кишки, предстательной железы, меланомы, а у женщин — эндометрия, желчного пузыря, молочной железы, поджелудочной железы, у обоих полов — пищевода, кишечника, почки, щитовидной железы, неходжинской лимфомы, миеломы [109][110]2.
Особенности лечения
Основными целями лечения являются предотвращение дальнейшего увеличения массы тела и развития осложнений путем поддержания метаболического здоровья пациента, и лечение сопутствующих заболеваний, если они уже имеются [111]. Снижение массы висцерального жира лежит в основе эффективной терапии. Показано, что для уменьшения площади висцерального жира на 1 см2 необходимо снизить массу тела на 4,7-6 кг [112]. Наличие или отсутствие сопутствующих заболеваний, течение которых напрямую ассоциировано с ИзМТ (СД 2 типа, неалкогольная жировая болезнь печени (НАЖБП), синдром обструктивного апноэ сна и т.д.), и их тяжесть определяют выбор терапии. У пациентов с ИзМТ и предиабетом рекомендовано снижение массы тела не менее 10% от исходной с целью профилактики развития СД 2 типа [113-115]. У пациентов с ИзМТ и СД 2 типа рекомендовано снижение массы тела не менее 5-15% от исходной, с целью скорейшего достижения целевого гликированного гемоглобина и/или снижения доз гипогликемических препаратов [113-116].
Пациентам с ИзМТ при ИМТ ≥27 кг/м2 при наличии факторов риска и/или коморбидных заболеваний может быть рекомендовано назначение медикаментозной терапии [117][118]. Снижение массы тела <3% у пациентов с СД и <5% у пациентов без СД от исходного или отсутствие уменьшения ОТ через 3 мес. медикаментозного лечения считается критерием неэффективности терапии. В качестве медикаментозной терапии ИзМТ в Российской Федерации могут использоваться следующие лекарственные препараты: тирзепатид, семаглутид, лираглутид, орлистат, сибутрамин.
Агонисты рецепторов человеческого ГПП-1 (арГПП-1) (семаглутид и лираглутид) и агонист рецепторов ГИП и ГПП-1 (арГПП-1/ГИП) (тирзепатид) регулируют аппетит с помощью усиления чувства наполнения желудка и насыщения, одновременно ослабляя чувство голода и уменьшая предполагаемое потребление пищи.
Тирзепатид показан к применению у взрослых в качестве дополнительной терапии при соблюдении диеты с пониженным содержанием калорий и увеличении физической активности для контроля массы тела, включая снижение и поддержание массы тела у взрослых людей с исходным ИМТ: >30 кг/м2 (ожирение); или >27 кг/м2 до <30 кг/м2 при наличии как минимум одного связанного с избыточным весом сопутствующего заболевания (например, артериальная гипертензия (АГ), дислипидемия, ОСА, ССЗ, предиабет или СД 2 типа). Начальная доза составляет 2,5 мг подкожно 1 раз в нед., с последующей стандартной титрацией (доза увеличивается каждые 4 нед. для улучшения желудочно-кишечной переносимости до достижения терапевтической — 10-15 мг в нед.).
Рандомизированное клиническое исследование SURMOUNT-1 показало, что применение тирзепатида у пациентов с ИзМТ и ожирением без СД 2 типа вызывает значительную дозозависимую потерю массы тела (-15,0% (95% доверительный интервал (ДИ): от -15,9 до -14,2) при еженедельных дозах тирзепатида 5 мг, -19,5% (95% ДИ: от -20,4 до -18,5) при дозах 10 мг и -20,9% (95% ДИ: от -21,8 до -19,9) при дозах 15 мг). Процент участников, у которых наблюдалось снижение веса на 5% или более, составил 85% (95% ДИ: 82-89), 89% (95% ДИ: 86-92) и 91% (95% ДИ: 88-94) при приеме 5 мг, 10 мг и 15 мг тирзепатида, соответственно, и 35% (95% ДИ: 30-39) при приеме плацебо. При этом 50% (95% ДИ: 46-54) и 57% (95% ДИ: 53-61) участников в группах 10 мг и 15 мг имели снижение веса тела на 20% или более по сравнению с 3% (95% ДИ: 1-5) в группе плацебо (P<0,001 для всех сравнений с плацебо) [119]. По сравнению с плацебо при применении тирзепатида наблюдалось значительное снижение ИМТ и ОТ, при этом средние значения составили -5,89 кг/м2 (от -8,97 до -2,81) и -12,31 см (от -13,93 до -10,68), соответственно [120]. При применении тирзепатида наблюдались улучшения всех кардиометаболических показателей (ОТ, систолическое и диастолическое АД, уровень инсулина натощак и уровень липидов).
Метаанализ сравнительных исследований тирзепатида и семаглутида показал, что средняя потеря массы тела составила -11,4% (от -15,3% до -8,27%) и -7,3% (от -8,3% до -6,08%), соответственно, средняя разница составила -4,84 кг (95% ДИ: от -6,21 до -3,47) в пользу тирзепатида [121].
У пациентов с СД 2 типа тирзепатид продемонстрировал положительное влияние на АД, СРБ и липидный профиль [122], а также значительное снижение уровня гликированного гемоглобина и улучшение гликемического контроля [123].
По данным ретроспективного когортного исследования, включившего данные о терапии 140308 пациентов с СД 2 типа [124], лечение тирзепатидом в сравнении с применением арГПП-1 было связано с более низкими рисками смертности от всех причин (скорректированное отношение рисков (скорОР) 0,58; 95% ДИ: 0,45-0,75), крупных неблагоприятных сердечно-сосудистых событий (скорОР 0,80; 95% ДИ: 0,71-0,91), совокупностью крупных неблагоприятных сердечно-сосудистых событий и смертности от всех причин (скорОР 0,76; 95% ДИ: 0,68-0,84), почечными событиями (скорОР 0,52; 95% ДИ: 0,37-0,73), острым повреждением почек (скорОР 0,78; 95% ДИ: 0,70-0,88) и серьезными нежелательными явлениями со стороны почек (скорОР 0,54; 95% ДИ: 0,44-0,67).
В исследовании SUMMIT у пациентов с СНсФВ и ожирением тирзепатид снижал сердечно-сосудистую смертность и количество госпитализаций [125]. Лечение тирзепатидом приводило к снижению систолического АД (предполагаемая разница в лечении (ETD) -5 мм рт.ст., 95% ДИ: от -7 до -3; P<0,001), уменьшало предполагаемый объем крови (ETD -0,58 л, 95% ДИ: от -0,63 до -0,52; P<0,001) и снижало уровни СРБ (ETD -37,2%, 95% ДИ: от -45,7 до -27,3; P<0,001). Эти изменения сопровождались увеличением расчетной скорости клубочковой фильтрации (ETD 2,90 мл/мин/1,73 м2 год 1, 95% ДИ: 0,94-4,86; P=0,004), уменьшением соотношения альбумина и креатинина в моче (ETD 24 нед., -25,0%, 95% ДИ: от -36 до -13%; P<0,001; 52 нед., -15%, 95% ДИ: от -28 до 0,1; P=0,051), снижением уровня N-концевого промозгового натрийуретического пептида (ETD 52 нед., -10,5%, 95% ДИ: от -20,7 до 1,0%; P=0,07) и снижение уровня тропонина Т (ETD 52 нед., -10,4%, 95% ДИ: от -16,7 до -3,6; P=0,003) [126].
В исследовании 2 фазы SYNERGY-NASH у пациентов с НАЖБП и умеренным или тяжёлым фиброзом лечение тирзепатидом в течение 52 нед. было более эффективным, чем плацебо, в отношении разрешения НАЖБП без усугубления фиброза. Процент участников, у которых наблюдалось улучшение по крайней мере на одну стадию фиброза без ухудшения НАЖБП, составил 30% в группе плацебо, 55% в группе тирзепатида 5 мг, 51% в группе тирзепатида 10 мг и 51% в группе тирзепатида 15 мг [127].
Семаглутид показан к применению у взрослых в дополнение к низкокалорийной диете и физической нагрузке для контроля массы тела, включая снижение и поддержание массы тела, у взрослых с ИМТ ≥27 кг/м2 при наличии по крайней мере одной сопутствующей патологии, связанной с ИзМТ, например дисгликемии (предиабет или СД 2 типа), АГ, дислипидемии, синдром обструктивного апноэ сна или ССЗ. Начальная доза составляет 0,25 мг подкожно 1 раз в нед., с последующей стандартной титрацией (доза увеличивается каждые 4 нед. для улучшения желудочно-кишечной переносимости до достижения терапевтической — 2,4 мг в сут.).
Метаанализ применения подкожного семаглутида 2,4 мг у пациентов с ИзМТ и ожирением без СД 2 типа показал, что по сравнению с плацебо семаглутид вызвал значительную дозозависимую потерю массы тела (средняя разница (MD): -10,09%; 95% ДИ: от -11,84 до -8,33; p<0,00001), большее снижение ИМТ (MD: -3,71 кг/м2; 95% ДИ: от -4,33 до -3,09; p<0,00001) и ОТ (MD: -8,28 см; 95% ДИ: от -9,51 до -7,04; p<0,00001), а также приводил к потере веса более чем на 5, 10, 15 и 20% у большей части пациентов. Кроме того, семаглутид продемонстрировал положительное влияние на АД, СРБ и липидный профиль [128], а также конверсию предиабета в СД 2 типа [129]. Аналогичная эффективность была продемонстрирована в метаанализе, включавшем как пациентов с СД 2 типа, так и без него [130]. Семаглутид 2,4 мг и лираглутид 3,0 мг являются препаратами выбора для снижения массы тела у пациентов с ИМТ ≥27 кг/м2 в сочетании с АГ [128, 131-133]. Применение семаглутида у пациентов с ИМТ ≥27 кг/м2 и НАЖБП ассоциировано со снижением уровней аланинаминотрансферазы (MD: 14,07 Ед/л (95% ДИ: от 19,39 до -8,75); p<0,001) и аспартатаминотрансферазы (MD: 6,89 Ед/л (95% ДИ: от 9,14 до -4,63); p<0,001). Также отмечено значительное снижение содержания жира в печени (MD: 4,97% (95% ДИ: от 6,65 до -3,29); p<0,001) и индекса фиброза печени (MD: 0,96 кПа (95% ДИ: от 1,87 до -0,04); p=0,04) [134].
арГПП-1, вероятно, оказывают незначительное влияние на течение ХБП и комплексные исходы со стороны почек [135].
Лираглутид — рекомендуется пациентам с ИМТ ≥27 кг/м2 при наличии факторов риска и/или коморбидных заболеваний; начальная доза составляет 0,6 мг подкожно 1 раз в сут., с последующей стандартной титрацией (доза увеличивается на 0,6 мг с интервалами не менее 1 нед. для улучшения желудочно-кишечной переносимости до достижения терапевтической — 3,0 мг в сут.) [136-138]. Лираглутид 3,0 мг обеспечивает эффективную и устойчивую потерю массы тела [139], однако менее выраженную, чем семаглутид 2,4 мг (по данным метаанализа, применение семаглутида 2,4 мг приводило к средней потере массы тела на 12,47 кг, лираглутида 3,0 мг -5,24 кг [140], приводя к снижению массы тела более, чем на 5% и 10% в 65,3% и 30,7% случаев для лираглутида 3 мг и 86,6% и 75,3% для семаглутида 2,4 мг, соответственно [141]).
Лираглутид 3,0 мг также положительно влияет на динамику кардиометаболических факторов риска на фоне снижения массы тела [131] и может рассматриваться как один из предпочтительных вариантов для пациентов с ИзМТ и наличием сопутствующих ССЗ в связи с доказанным [132][133] снижением ССР, значительным снижением риска развития СД 2 типа [142] и благоприятным профилем безопасности и переносимости. Лираглутид 3,0 мг положительно влияет на АД у пациентов с ИМТ ≥27 кг/м2 в сочетании с АГ [131-133], однако следует тщательно контролировать частоту сердечных сокращений (ЧСС) у пациентов, получающих лираглутид [136-138]. Для лираглутида 3,0 мг было показано снижение содержания жировой ткани в печени у пациентов с СД 2 типа и НАЖБП, однако влияние на печеночные ферменты в различных исследованиях оказалось нейтральным или слабоположительным [143-145].
Стоит отметить, что после прекращения терапии арГПП-1/ГИП восстановление массы тела пропорционально ее исходной потере. Пациенты, принимавшие лираглутид, набрали в среднем 2,20 кг (95% ДИ: 1,69-2,70, P<0,00001), пациенты, принимавшие семаглутид/тирзепатид, набрали 9,69 кг (95% ДИ: 5,78-13,60, P<0,00001) [146].
арГПП-1/ГИП противопоказаны при медуллярном раке щитовидной железы в анамнезе, в т.ч. семейном, множественной эндокринной неоплазии II ти- па, тяжелой депрессии, суицидальных мыслях или поведении, в т.ч. в анамнезе, почечной и печеночной недостаточности тяжелой степени, хронической сердечной недостаточности IV функционального класса (в соответствии с классификацией NYHA), у пациентов в возрасте ≥75 лет. Применение арГПП-1 у пациентов с воспалительными заболеваниями кишечника и диабетическим парезом желудка не рекомендуется, поскольку оно связано с транзиторными нежелательными реакциями со стороны ЖКТ, включая тошноту, рвоту и диарею. С осторожностью препараты применяют у пациентов с печеночной недостаточностью легкой и средней степени тяжести, заболеваниями щитовидной железы и наличием острого панкреатита в анамнезе.
Орлистат — препарат для лечения ожирения периферического действия, рекомендуется пациентам с ИМТ ≥28 кг/м2 при наличии коморбидных заболеваний в дозе 120 мг 3 раза в сут. во время еды или не позже 1 ч после приема пищи для снижения массы тела. Разрешенная максимальная длительность непрерывного лечения составляет 4 года [117][147][148]. Орлистат, будучи специфическим, длительно действующим ингибитором желудочно-кишечной липазы, оказывает терапевтический эффект в пределах ЖКТ и не обладает системными эффектами: препятствует расщеплению и последующему всасыванию жиров, поступающих с пищей (~30%), создавая тем самым дефицит энергии, что приводит к снижению массы тела в среднем на 3,06% (95% ДИ: 3,45-2,67) [118] или -3,07 кг (95% ДИ: от -3,76 до -2,37) [149]. Орлистат способствует также небольшому снижению общего холестерина, липопротеинов низкой плотности, триглицеридов и липопротеинов высокой плотности [150], причем независимо от степени снижения массы тела. Если прием пищи не состоялся или пища не содержит жира, то прием препарата можно пропустить. Применение орлистата у больных с ИзМТ позволяет существенно улучшить профиль факторов риска СД 2 типа, ССЗ и других заболеваний, ассоциированных с ИзМТ, что может благоприятно влиять на прогноз жизни у этой категории больных. Данных, позволяющих судить о влиянии орлистата на общую смертность или смертность от ССЗ, в настоящее время нет. Важным преимуществом препарата является его периферическое действие только в пределах ЖКТ и отсутствие системных эффектов. Орлистат противопоказан при острых панкреатитах и заболеваниях, сопровождающихся диареей, синдромом хронической мальабсорбции, холестазом. Орлистат повышает вероятность образования камней в желчном пузыре, однако рациональное потребление жиров не приводит к снижению моторики желчного пузыря. С учетом механизма действия, к числу побочных эффектов препарата относятся жирный стул, маслянистые выделения из прямой кишки, императивные позывы на дефекацию, учащение дефекации и недержание кала, боли в животе, повышенный метеоризм с некоторым количеством отделяемого. Выраженность и продолжительность побочных эффектов напрямую зависят от приверженности пациентов лечению и соблюдения рекомендаций по ограничению жиров в пище. Если рекомендованы поливитамины, их следует принимать не ранее чем через 2 ч после приема орлистата или перед сном.
Сибутрамин, сибутрамин + микрокристаллическая целлюлоза — препарат для лечения алиментарного ожирения с ИМТ 27 кг/м2 и более в сочетании с СД 2 типа и дислипидемией. Однако его негативное влияние на АД, ЧСС и риск развития сердечно-сосудистых осложнений делает его применение малоцелесообразным у большинства пациентов с ИзМТ, т.к. они уже имеют высокий риск развития сердечно-сосудистых осложнений [151]. Разрешенная максимальная длительность лечения составляет 1 год [117][152][153]. Лечение сибутрамином требует обязательного врачебного наблюдения. Контроль АД и пульса необходим у всех больных до начала лечения, далее с 1-го по 3-й мес. лечения — каждые 2 нед., с 4-го по 6-й мес. — ежемесячно, с 6-го по 12-й мес. — каждые 3 мес. Препарат отменяют при выявлении увеличения ЧСС в покое ≥10 уд./мин и/или повышении АД более чем на 10 мм рт.ст. во время двух визитов подряд, а также в случае, если оно при двух повторных измерениях превышает 140/90 мм рт.ст. при ранее компенсированной АГ. Препарат не может быть назначен пациентам с неконтролируемой АГ, ИБС, декомпенсацией хронической сердечной недостаточности, нарушением ритма сердца, цереброваскулярными заболеваниями (инсультом, транзиторными нарушениями мозгового кровообращения), окклюзионными заболеваниями периферических артерий, в возрасте старше 65 лет, при тяжелых поражениях печени и почек, которые могут встречаться при ожирении, в случае одновременного приема или спустя <2 нед. после отмены ингибиторов моноаминоксидазы или других препаратов, действующих на центральную нервную систему (в т.ч. антидепрессантов), при серь- езных нарушениях питания и психических заболеваниях, тиреотоксикозе, феохромоцитоме, закрытоугольной глаукоме, доброкачественной гиперплазии предстательной железы.
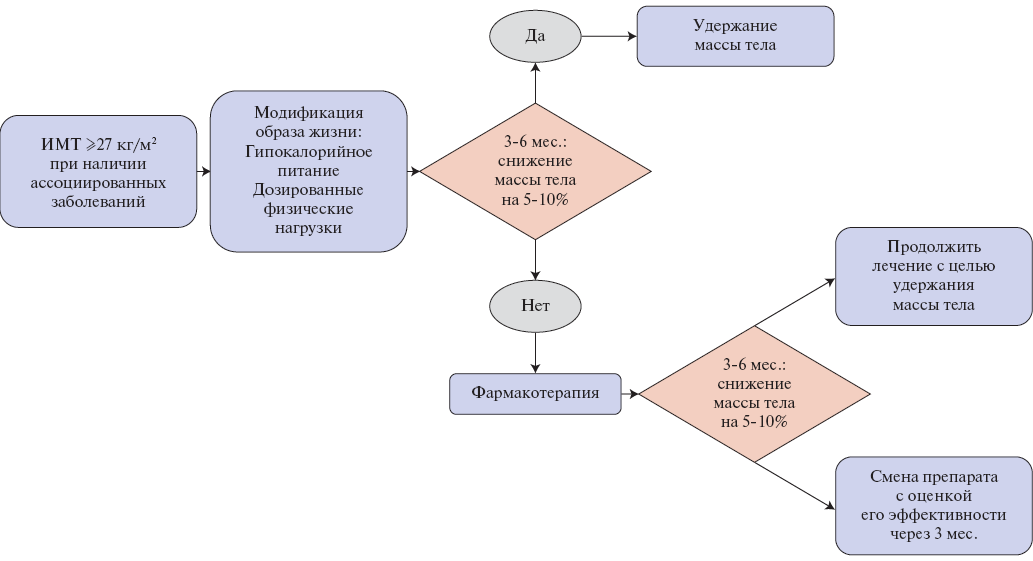
Алгоритмы фармакотерапии ИзМТ и выбора препаратов представлены в таблицах 1, 2 и рисунках 1, 2.
Таблица 1
Выбор препаратов для фармакотерапии ИзМТ в зависимости от коморбидной патологии [154]
|
Тирзепатид/Семаглутид/Лираглутид |
Орлистат |
Сибутрамин, Сибутрамин + МКЦ, Сибутрамин + метформин |
|
|
Артериальная гипертензия |
+ |
+ |
— |
|
ИБС, цереброваскулярная болезнь |
+ |
+ |
— |
|
Хроническая сердечная недостаточность |
+ |
— |
|
|
Хроническая болезнь почек |
+ |
— |
|
|
Предиабет/сахарный диабет 2 типа |
+ |
— |
|
|
МАЖБП |
+ |
+ |
— |
|
Панкреатиты |
+/- |
+ |
+ |
|
Медуллярный рак щитовидной железы |
— |
+ |
+ |
|
Желчнокаменная болезнь |
+/- |
+/- |
+ |
|
Холестаз |
+ |
— |
+ |
|
Заболевания ЖКТ, сопровождающиеся диареей |
+/- |
— |
+ |
Сокращения: ЖКТ — желудочно-кишечный тракт, ИБС — ишемическая болезнь сердца, МКЦ — микрокристаллическая целлюлоза, МАЖБП — метаболически ассоциированная жировая болезнь печени.
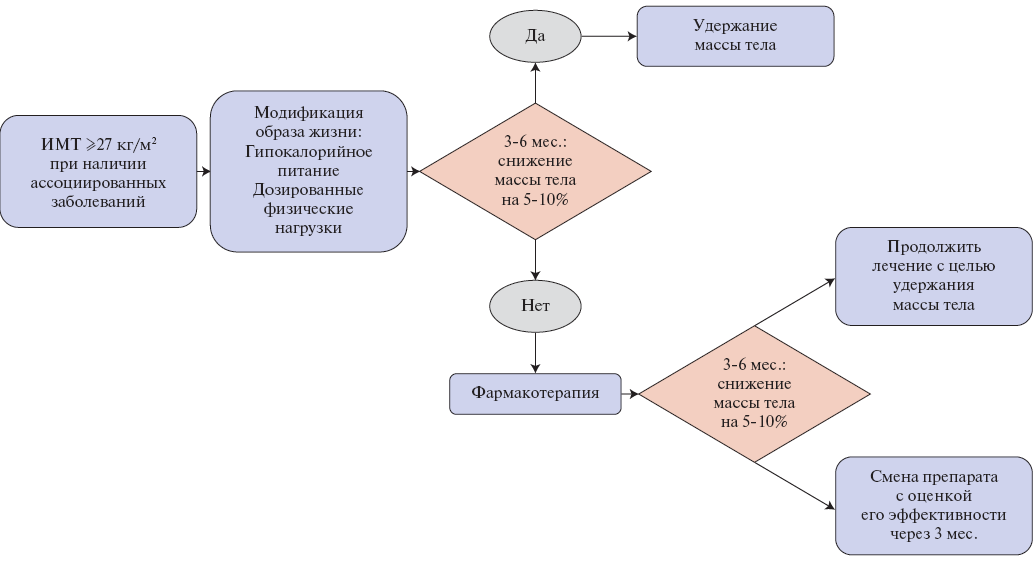
Рис. 1. Алгоритм медикаментозной терапии ИзМТ [154].
Сокращение: ИМТ — индекс массы тела.
Таблица 2
ССР и преимущества препаратов, используемых для снижения веса [155]
|
Препарат |
Комплексные СС исходы |
Смерть от СС заболеваний |
Нефатальный ИМ |
Нефатальный инсульт |
САД |
ДАД |
ЧСС |
ЛВП |
ЛНП |
ТГ |
СН |
вч-СРБ [156] |
|
Сибутрамин [157] |
↑↑ |
– |
↑↑ |
↑↑ |
↑↑* |
↑↑* |
↑↑ |
НД |
НД |
НД |
НД |
НД |
|
Орлистат |
НД |
НД |
НД |
НД |
↓ |
↓ |
НД |
↑ |
– |
– |
НД |
↓ |
|
Лираглутид 1,8 мг при СД 2 типа |
↓↓ |
↓↓ |
↓ |
↓ |
↓↓ |
↑↑ |
↑↑ |
– |
– |
– |
↓ |
↓↓ |
|
Лираглутид 3,0 мг для лечения ожирения |
– [132] |
НД [132] |
НД [132] |
НД [132] |
↓↓ |
↓↓ |
↑↑ |
↑↑ |
↓↓ |
↓↓ |
НД |
↓↓ |
|
Семаглутид |
↓↓ |
↓ |
↓ |
↓↓ |
↓↓ |
– |
↓↓ |
↓↓ |
↑↑ |
↑↑ |
↓ |
↓↓ [158] |
|
Тирзепатид |
ожидаются результаты РКИ при ожирении и СД 2 типа ↓↓ при СД 2 типа СНнФВ с ожирением [125] |
ожидаются результаты РКИ при ожирении и СД 2 типа ↓↓ при СД 2 типа СНнФВ с ожирением [125] |
ожидаются результаты РКИ при ожирении и СД 2 типа |
ожидаются результаты РКИ при ожирении и СД 2 типа |
↓↓ [119] |
↓↓ [119] |
↑↑ [119] |
↓↓ [119] |
↓↓ [119] |
↓↓ при СД 2 типа СНнФВ с ожирением [125] |
↓↓ [159] |
|
|
Эксенатид при СД 2 типа |
– |
↓ |
– |
↓ |
↓↓ |
↑↑ |
↑↑ |
НД |
↓↓ |
↓↓ |
↓ |
↓↓ [160] |
|
Дулагутид при СД 2 типа |
↓↓ |
↓ |
↓ |
↓↓ |
↓↓ |
– |
↑↑ |
↓↓ |
НД |
НД |
↓↓ |
↓↓ [161] |
|
Ликсисенатид при СД 2 типа |
↑ |
↓ |
↑ |
↑ |
↓↓ |
НД |
↑↑ |
НД |
НД |
НД |
↓ |
НД |
|
Метформин при СД 2 типа |
↓ |
↓ |
↓ |
↓↓ |
НД |
НД |
НД |
НД |
↓↓ |
↓↓ |
НД |
↓↓ [161] |
|
Ингибиторы НГЛТ-2 при СД 2 типа |
↓ |
↓↓ |
↓↓ |
↓↓ |
↓↓ |
↓↓ |
– |
– |
– |
– |
↓ |
↓↓ [161] |
Примечание: * — в РКИ SCOUT АД в группе сибутрамина снижалось в сравнении с исходным, но было выше, чем в группе плацебо: средние различия САД и ДАД между группами колебались от -0,3 до 1,2 мм рт.ст. и от 0,6 до 1,4 мм рт.ст., соответственно; ↓↓ — статистически значимое снижение; ↑↑ — статистически значимое повышение; ↓ или ↑ — незначимое изменение; «–» — указано/нет изменений; НД — данные не представлены.
Сокращения: вч-СРБ — высокочувствительный С-реактивный белок, ДАД — диастолическое артериальное давление, ИМ — инфаркт миокарда, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, НГЛТ-2 — натрий-глюкозный котранспортер 2 типа, РКИ — рандомизированные клинические исследования, САД — систолическое артериальное давление, СД — сахарный диабет, СН — сердечная недостаточность, СНнФВ — сердечная недостаточность с низкой фракцией выброса, СС — сердечно-сосудистый, ТГ — триглицериды, ЧСС — частота сердечных сокращений.
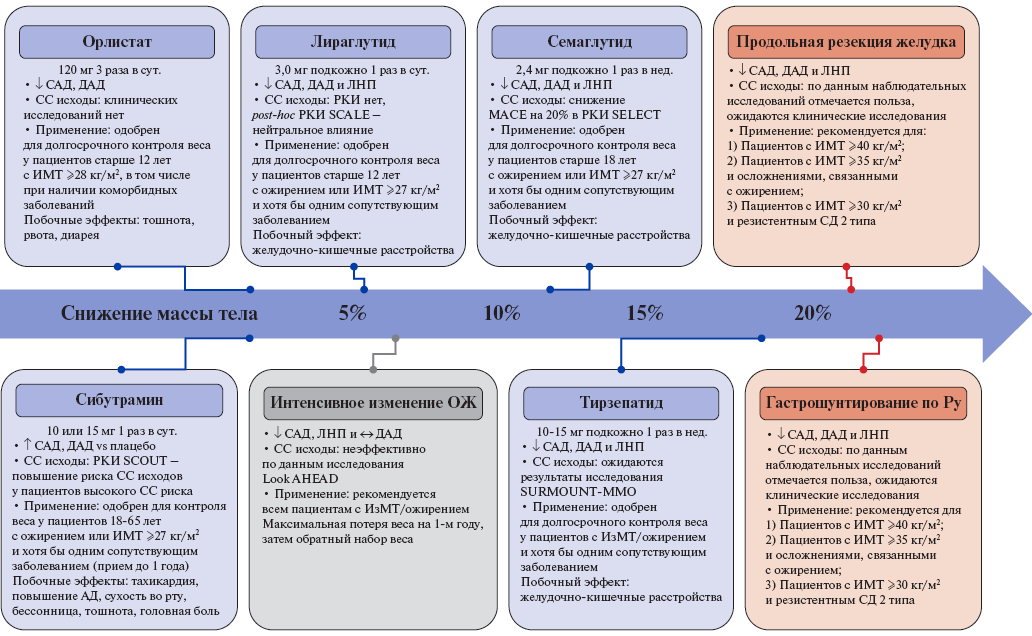
Рис. 2. Текущие данные о влиянии каждого вида вмешательства при ожирении на массу тела, факторы риска ССЗ и сердечно-сосудистые исходы, а также показания к применению этих вмешательств [162].
Сокращения: АД — артериальное давление, ДАД — диастолическое артериальное давление, ИзМТ — избыточная масса тела, ИМТ — индекс массы тела, ЛНП — липопротеины низкой плотности, ОЖ — ожирение, РКИ — рандомизированные клинические исследования, САД — систолическое артериальное давление, СД — сахарный диабет, СС — сердечно-сосудистый, MACE — крупные сердечно-сосудистые события.
1 Клинические рекомендации. Ожирение. 2024. https://cr.minzdrav.gov.ru/preview-cr/28_3.
2 National Cancer Institute. Obesity and Cancer. NCI. Available at https://www.cancer.gov/about-cancer/causes-prevention/risk/obesity/obesity-fact-sheet. Reviewed January 28, 2025; Accessed: May 23, 2025.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Недогода С.В., Цыганкова О.В. Избыточная масса тела и ожирение при метаболическом синдроме. Российский кардиологический журнал. 2025;30(1S):6535. https://doi.org/10.15829/1560-4071-2025-6535
Скопировать