Электрокардиостимуляция на пороге больших перемен: актуализация проблемы
Аннотация
Обзор накопленных к настоящему времени данных касательно физилогичности электрокардиостимуляции, обоснование новых методик, классификации о обсуждение нерешенных проблем в области стимуляции сердца
Всё новое — это хорошо забытое старое
Козьма Прутков, афоризмы
Одна из главных задач электростимуляции сердца состоит в достижении максимальной ее физиологичности. Под этим термином мы подразумеваем приближение к нативной функции проводящей системы сердца (ПСС). Основные функции и физиологические механизмы работы сердца, которые кардиостимулятор замещает, это:
— хронотропная функция,
— атриовентрикулярная синхронизация,
— межжелудочковая синхронизация,
— внутрижелудочковая синхронизация.
Поэтому на разных этапах развития технологии электрической стимуляции сердца появление функции частотной адаптации с использованием различных сенсоров физической активности в секвенциальной предсердно-желудочковой кардиостимуляции были прорывными в достижении физиологичности. Помимо технологий самих кардиостимуляторов, позиции электродов для стимуляции и детекции менялись не столь значимо. Стандартная апикальная позиция стала рутинной ввиду своей простоты и надежности желудочковой стимуляции.
Однако еще первые публикации начала XXв и исследования показали зависимость насосной функции сердца от последовательности и синхронности распространения возбуждения по предсердиям и желудочкам. Так, в работе C. Wiggers [1], известного американского физиолога, датированной 1925г, сообщается о нефизиологичности стимуляции верхушки правого желудочка (ПЖ) у млекопитающих. Причиной негативных эффектов апикальной стимуляции явилась диссинхрония — несинхронное сокращение сегментов левого желудочка (ЛЖ) с запаздыванием активации обычно задне-боковой стенки ЛЖ и развитием ряда гемодинамических и механических нарушений, таких как продление систолы и укорочение диастолы, дисфункция митрального клапана с развитием митральной недостаточности, развитие левостороннего пейсмекер-синдрома, приводящего к сокращению левого предсердия при закрытом митральном клапане, ухудшение систолической функции и наполнения желудочков. Диссинхронию легче всего идентифицировать по наличию расширения QRS и конфигурации блокады левой ножки пучка Гиса (БЛНПГ) на электрокардиограмме или по задержке внутрижелудочковой проводимости и продолжительности QRS ≥150 мс даже при отсутствии БЛНПГ [2]. Особенно чувствительными к развитию диссинхронии оказались пациенты со структурной патологией сердца, в первую очередь с кардиомиопатиями, у которых диссинхрония ЛЖ становится одной из основных причин развития и прогрессирования хронической сердечной недостаточности (ХСН).
C развитием кардиостимуляции был опубликован ряд работ, посвященных поиску наиболее оптимального положения электрода с точки зрения влияния распространения возбуждения на сократимость миокарда и сердечную гемодинамику [3-6]. Авторы делали попытки доказать, что левожелудочковая или многофокусная стимуляция являются более предпочтительными методиками, чем правожелудочковая стимуляция (ПЖС). Появление метода бивентрикулярной стимуляции — сердечной ресинхронизирующей терапии (БиВ-СРТ) в значительной мере позволило решить эту проблему.
Первой публикацией по сердечной ресинхронизирующей терапии (СРТ) явилась статья Cazeau S, et al., 1994 [7]. Авторы описали клинический случай четырехкамерной постоянной стимуляции сердца у пациента с терминальной сердечной недостаточностью (СН) (IV функционального класса по NYHA), БЛНПГ с длительностью QRS >200 мс и атриовентрикулярной (АВ) блокадой I степени. Пациенту был имплантирован электрокардиостимулятор в режиме DDD с эндокардиальными электродами в правых камерах сердца, коронарном синусе и торакоскопически имплантированным электродом для эпикардиальной левожелудочковой стимуляции. В результате проведения СРТ на госпитальном этапе отмечалось увеличение фракции выброса (ФВ) ЛЖ на 20-25%, а состояние пациента стало соответствовать II функциональному классу по NYHA.
Сегодня устранение диссинхронии сердца с помощью СРТ является клинически доказанным методом лечения ХСН [8, 9]. Под термином «СРТ» понимают стимуляцию ПЖ и ЛЖ, синхронизированную с предсердным ритмом, которая позволяет корригировать внутрисердечную активацию с целью минимизации механической диссинхронии сердца. Однако зависимость метода от анатомии русла коронарного синуса, высокий процент больных, не отвечающих на СРТ — нереспондеров, ограничивают использование метода.
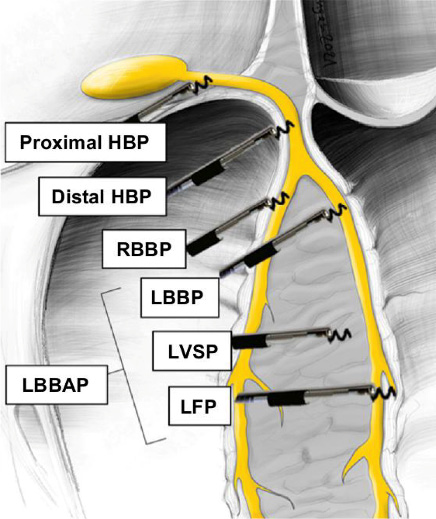
В то же время развитие технологии электродов с активной фиксацией, совершенствование метода имплантации с использованием специальных систем доставки позволило имплантировать электроды для стимуляции практически в любую точку эндокардиальной поверхности желудочков. Таким образом, появилась возможность стимуляции глубоких структур межжелудочковой перегородки с выходом стимулирующего полюса электрода под эндокард ЛЖ в области пучка Гиса и левой его ножки (ЛНПГ) (рис. 1). Прямая стимуляция ПСС (СПСС) дает преимущество максимально координированного сокращения ЛЖ за счет более высокой скорости распространения электрического возбуждения по сравнению с проведением по миокарду, как это происходит при стандартной стимуляции ЛЖ из коронарных вен сердца. Это хорошо видно при неинвазивном электрофизиологическом картировании (рис. 2).
Использование прямой стимуляции пучка Гиса (СПГ) имело ряд трудностей и ограничений: необходимость интактного проведения по дистальным отделам ПСС и риск его развития в отдаленном периоде, трудность имплантации и высокий риск дислокаций, высокие пороги стимуляции, особенно в отдаленном периоде, проблемы с сенсингом ввиду небольшой амплитуды желудочковой электрограммы и другие. Все это обусловило рост интереса к стимуляции ЛНПГ (СЛНПГ). В идеале, при достаточно простой технике имплантации мы достигаем прямой захват ЛНПГ, стабильные, низкие пороги при отдаленном наблюдении, и в результате получаем QRS типа БПНПГ со средней длительностью QRS 120 мс [12].

Рис. 1. Варианты стимуляции глубоких структур межжелудочковой перегородки [10].
Сокращения: Proximal HBP — проксимальный отдел пучка Гиса, Distal HBP — дистальный отдел пучка Гиса, RBBP (right bundle branch pacing) — стимуляция правой ножки пучка Гиса, LBBP (left bundle branch pacing) — стимуляция левой ножки пучка Гиса, LBBAP (left bundle branch area pacing) — cтимуляция области разветвления левой ножки пучка Гиса, LVSP (left ventricular septal pacing) — левожелудочковая стимуляция, LFP (left fascicular pacing) — cтимуляция фасцикулярной мышцы.

Рис. 2. Неинвазивные карты активации ЛЖ и ПЖ, записанные у одного и того же пациента с полной БЛНПГ при (А) собственном ритме (LBBB), (Б) селективной электрокардиостимуляции пучка Гиса и (В) бивентрикулярной электрокардиостимуляции.
Примечание: цветовая шкала (слева) показывает, что поздняя (синяя) активация, возникающая на боковой стенке ЛЖ во время спонтанной активности, отсутствует при СПГ, т. к. больше не наблюдается паттерн активации ЛНПГ; вместо этого виден нормальный физиологический желудочковый паттерн. Небольшие участки красного цвета, ранняя активация на ПЖ во время СПГ может отражать незначительную неселективность захвата или интерполяции шумового сигнала, ошибочно идентифицируемого как активация. Во время бивентрикулярной стимуляции волна возбуждения распространяется из мест ранней активации как в ПЖ, так и в ЛЖ [11]. Цветное изображение доступно в электронной версии журнала.
Рутинная стимуляция ПЖ
Кардиомиопатия, вызванная электрокардиостимуляцией (CИКМ — стимулятор-индуцированная кардиомиопатия), является потенциальным осложнением электрокардиостимуляции ПЖ. В разных исследованиях определение ее варьирует, а оптимальный подход к лечению остается неопределенным. Метаанализ с моделированием случайных эффектов был использован для оценки связи между потенциальными факторами риска и CИКМ [13]. В окончательный анализ были включены 26 исследований (6 проспективных), в которых приняли участие в общей сложности 57993 пациента (возраст 51-78 лет; 45% женщин). Общая распространенность CИКМ составила 12% (95% доверительный интервал: 11-14%). В ходе метаанализа ключевыми факторами риска развития CИКМ оказались: мужской пол, перенесенный инфаркт миокарда в анамнезе, хронические заболевания почек, фибрилляция предсердий, исходная ФВ ЛЖ, продолжительность QRS, процентная частота сердечных сокращений ПЖ и продолжительность QRS в динамике.
Таким образом, становится очевидно, что при рутинной стимуляции ПЖ для лечения брадиаритмий, CИКМ развивается в среднем у 10-20% пациентов за период наблюдения 3-4 года [13]. Остается открытым вопрос, каков процент развития кардиомиопатии в более отдаленные сроки?
Нарушения проведения по системе Гиса-Пуркинье
Одним из ключевых критериев выбора для СРТ является БЛНПГ, идентификация которой представляет значительные трудности из-за неоднородности уровней блокады проводимости. В частности, в случаях дистальной блокады ЛНПГ СПГ не приводит к сужению комплекса QRS, несмотря на успешное расположение электродов. Это ограничение может быть преодолено с помощью СЛНПГ, при которой электрод располагается более дистально [14]. Интересно выделение отдельной формы кардиомиопатии — кардиомиопатия, вызванная блокадой ЛНПГ [15], при которой стимуляция ПСС (СПСС) может стать «патогенетическим» методом лечения.
На сегодняшний день было предложено несколько стратегий СРТ, в т. ч. и с использованием СПСС. Эти стратегии могут обеспечить превосходные результаты для пациентов с особыми формами БЛНПГ [16]. Однако вариабельность уровня блокады проводимости и анатомические различия между сердцами пациентов затрудняют проведение комплексных сравнительных клинических испытаний для всех стратегий СРТ.
Многообещающий подход предполагает использование компьютерных моделей сердца для конкретного пациента, интегрирующих данные визуализации сердца с персонализированными моделями и методами машинного обучения. Такие модели продемонстрировали повышенную точность в прогнозировании результатов СРТ [17]. Предыдущие методики моделировали БЛНПГ без указания местоположения блока проводимости и были ориентированы исключительно на стандартную СРТ. Математическое моделирование открывает перспективы разработки новых электрографических критериев уровня блокады ЛНПГ [18][19] и прогнозирования эффекта различных подходов к СРТ.
Классификация методов электрокардиостимуляции. Стратегии СРТ
Вопрос классификации остается открытым. Следует отметить, что благодаря активному внедрению СПСС в современных рекомендациях, для традиционной СРТ как бивентрикулярной системы с правожелудочковым и установленным через коронарный синус левожелудочковым электродом принято обозначение BiV-CRT (БиВ-СРТ) в отличие от ресинхронизирующей терапии путем СПСС [20].
Учитывая наш опыт и информацию современной литературы, можем предложить к обсуждению следующую классификацию:
Стимуляция при лечении брадиаритмий:
— Стандартная ПЖС,
— СПГ,
— Стимуляция области ЛНПГ (СОЛНПГ):
- СЛНПГ,
- Стимуляция ветвей ЛНПГ (передней, септальной, задней).
Стимуляция с целью ресинхронизирующей терапии:
— Стандартная БиВ-СРТ,
— Ресинхронизация путем СПГ — Гис-СРТ,
— Ресинхронизация путем СОЛНПГ:
- Ресинхронизация путем СЛНПГ-СРТ,
- Ресинхронизация путем стимуляции ветвей ЛНПГ.
— Комбинированная ресинхронизация путем СПГ и ЛЖ — HOT-CRT,
— Комбинированная ресинхронизация путем стимуляции СОЛНПГ и ЛЖ — LOT-CRT.
Классификация несколько упрощена для детального обсуждения в специализированных изданиях и на научных форумах.
Сравнение методов кардиостимуляции
СПСС в сравнении со стандартной стимуляцией для лечения брадикардии
У пациентов с АВ-блокадой или другими показаниями к электрокардиостимуляции при брадикардии два метаанализа показали, что СПСС (включая как СПГ, так и СЛНПГ) была связана с сокращением продолжительности стимулированного интервала QRS (QRSp), известного предиктора сепсис-индуцированной кардиомиопатии (СИКМ), и лучшим сохранением ФВ ЛЖ по сравнению с ПЖС [21][22]. Кроме того, отмечались незначительные тенденции к снижению частоты случаев СИКМ, госпитализаций, связанных с СН, и смерти от всех причин в пользу СПСС, в то время как в другом наборе данных сообщалось о значительном снижении госпитализаций, связанных с СН. В небольшом рандомизированном контролируемом исследовании с перекрестным дизайном Kronborg MB, et al. было обнаружено, что СПСС превосходит ПЖС по первичной конечной точке ФВ ЛЖ после 12 мес. электрокардиостимуляции [23]. Патофизиологическим объяснением наблюдаемых преимуществ может быть продемонстрированное превосходство синхронности желудочков, а также увеличение перфузии миокарда и улучшение показателей работы миокарда по сравнению с ПЖС. Однако, как было показано в нескольких исследованиях, СПСС, по-видимому, эффективна не только для профилактики СИКМ, но и для лечения этого опасного состояния [24].
Особым показанием к СПСС и предметом первоначального описания является электрокардиостимуляция у пациентов с постоянной фибрилляцией предсердий перед плановой аблацией АВ-узла. В нескольких небольших исследованиях, включая одно рандомизированное контролируемое исследование, проведенное в 2006г, сообщалось, что СПСС ассоциирована с улучшением как функциональных показателей, так и качества жизни. Из-за близости целевых участков для СПГ и аблации АВ-соединения остается значительный риск осложнений, связанных с электродом для стимуляции или процедурных неудач при комбинировании обеих стратегий [25]. Это взаимодействие может быть преодолено с помощью СЛНПГ, которая столь же эффективна для сохранения ФВ ЛЖ по сравнению с СПГ, но связана с улучшением показателей успешности, параметров постоянной кардиостимуляции. СЛНПГ по сравнению с ПЖС неизменно ассоциировалась со значительным сужением QRS и улучшением резерва реполяризации-деполяризации как потенциальном предикторе снижения риска желудочковой аритмии у пациентов со СЛНПГ [26][27].
Сравнение СПСС и бивентрикулярной стимуляции для кардиоресинхронизации
В 2013г СПГ была предложена в качестве альтернативной стратегии СРТ у пациентов при невозможности установки электрода для стимуляции ЛЖ в коронарный синус, а уже четыре года спустя СПГ была применена в качестве основной стратегии СРТ [28]. С тех пор в большом количестве исследований сравнивались СПСС (включая как СПГ, СОЛНПГ и СЛНПГ) с БиВ-СРТ при различных показаниях. В опубликованных наблюдательных данных СПСС ассоциируется с более узким QRSp, улучшенным качеством жизни, ФВ ЛЖ и параметрами обратного ремоделирования по сравнению с БиВ-СРТ [29][30]. В крупнейшем на сегодняшний день метаанализе сообщалось о значительном преимуществе лечения СПСС у пациентов с относительным риском 0,63 для количества госпитализаций, связанных с СН и 0,75 для смертности от всех причин [31]. Между тем, научные данные, полученные в ходе нескольких обсервационных исследований, указывают на значительное преимущество СОЛНПГ по сравнению с БиВ у пациентов с показаниями к СРТ с точки зрения сокращения QRSp, обратного ремоделирования, клинических и эхокардиографических показателей, ответ на СРТ (и супер-ответ), а также более низкий риск развития СН [32-34]. Механизмы улучшения могут заключаться в улучшении времени бивентрикулярной активации, показателей электрической и механической диссинхронии, эффективности работы миокарда и значительного хронического обратного ремоделирования. Следует отметить, что комбинация СПСС с традиционным электродом, введенным через коронарный синус (HOT-CRT, LOT-CRT), может еще больше повысить частоту ответа в конкретных клинических ситуациях [35].
Таким образом, СПСС имеет ряд преимуществ по сравнению с традиционными подходами к стимуляции сердца. В то же время преодолены еще не все недостатки метода и изучены все особенности (табл. 1) [34].
Таблица 1
Сравнение СПГ и СОЛНПГ. Сильные и слабые стороны и неизвестные аспекты стратегий СПСС [36]
|
Точно |
Сомнительно |
Неизвестно |
|
|
СПГ (стимуляция пучка Гиса) |
Анатомические ориентиры и техника имплантации. Оценка QRS при захвате пучка Гиса ясна. Снижение риска госпитализации по сравнению с ПЖС. Рандомизированное сравнение с СРТ. Относительно безопасная экстракция |
Относительно длинная кривая обучения оператора. Дольше процедура имплантации и время флюороскопии по сравнению с СОЛНПГ. Выше острый порог. Позднее нарастание порога после имплантации. Возможно повреждение трикуспидального клапана |
Возрастание порога из-за вымывания стероида или анатомическое? Может ли дистальная СПГ обеспечить стабильный порог с эффектом ресинхронизации? Гибридная стратегия ЛЖ стимуляции лучше сочетания с СПГ или СОЛНПГ? |
|
СОЛНПГ (стимуляция области ЛНПГ) |
Короче время операции. Выше процент успеха, чем СПГ. Низкий стабильный порог стимуляции. Хороший сенсинг. Схожие результаты со СПГ и выше ПЖ стимуляции. Результаты показывают преимущество при показаниях к СРТ |
Затруднена оценка захвата ЛНПГ или только миокарда перегородки. Выше риск септальной перфорации, септального ИМ и дислокации. Большинство данных получено на неишемической когорте |
Будет ли достигнут захват ЛНПГ при большинстве имплантаций? Интрасептальная позиция также хороша, как ЛЖ септальная позиция? Как часто наблюдаются микродислокации при наблюдении? Каков риск экстракции в отдаленные сроки? |
Сокращения: ИМ — инфаркт миокарда, ЛЖ — левый желудочек, ЛНПГ — левая ножка пучка Гиса, ПЖ — правый желудочек, ПЖС — электрокардиостимуляция правого желудочка, СОЛНПГ — электрокардиостимуляция области левой ножки пучка Гиса, СПГ — электрокардиостимуляция пучка Гиса, СРТ — бивентрикулярная электрокардиостимуляция, сердечная ресинхронизирующая терапия.

Рис. 3. Сравнение успешности, длительности операции и рентгеновского времени для процедуры имплантации системы СОЛНПГ (LBBAP) по сравнению с бивентрикулярной стимуляцией БиВ-СРТ (BiVp) [20].

Рис. 4. Частота отдаленных осложнений, дислокации электродов, стимуляции диафрагмального нерва и инфекционных осложнений процедуры имплантации системы для СОЛНПГ (LBBAP) по сравнению с БиВ-СРТ (BiVp) [20].
Показания к СПСС
Использование СПСС возможно при любых стандартных показаниях к кардиостимуляции. Вероятнее всего оно показано при ожидаемом высоком проценте стимуляции (сочетание различных АВ-блокад, особенно в сочетании с дисфункцией ЛЖ), недостаточности трикуспидального клапана, связанной с электродами, как метод выбора при аблации АВ-узла, дисфункции ЛЖ, вызванной ПЖС, и других. Использование в качестве варианта ресинхронизирующей терапии возможно как в качестве первичной тактики, так и при отсутствии ответа на стандартную БиВ-СРТ. Подробно все варианты использования физиологической стимуляции сердца для предотвращения и смягчения последствий СН изложены в рекомендациях Всемирного общества сердечного ритма 2023г [20].
Обсуждая показания и готовность использования СПСС в качестве рутинной тактики, нужно оценивать метод, исходя из критериев «идеальной» операции: эффективность, простота и небольшое время операции (в т. ч. рентгеновское), безопасность, короткий «курс обучения» и низкие финансовые затраты. Так, при СПСС эффективность имплантации оказывается несколько меньше, чем при стандартной БиВ-СРТ. Возможно, это связано с меньшим опытом операторов, использованием различных электродов и систем доставки [37]. В то же время длительности операции флюороскопии оказалось достоверно меньшим (рис. 3). Операция достаточно безопасна, и частота осложнений не отличается от имплантации БиВ-СРТ, инфекционных осложнений наблюдается меньше (вероятно, это связано с меньшим временем операции и экспозиции раны), а такого осложнения, как стимуляция диафрагмального нерва, операция в принципе лишена (рис. 4).
Оценивать только интраоперационные финансовые затраты нужно в сравнении. Так, если использование специализированного электрода и системы доставки для СПСС эквивалентно расходам на стандартную БиВ-СРТ, то конечно же, стоимость операции кардиостимуляции при брадиаритмии окажется более высокой.
Таким образом, предварительные исследования на животных и людях показали, что как селективная СЛНПГ, так и неселективная септальная электрокардиостимуляция обеспечивают электрическую и механическую активацию ЛЖ на уровне, близком к физиологическому. Если это подтвердится в клинических исследованиях, то начнется новая эра упрощенного подхода с септальной электрокардиостимуляцией ЛЖ.
СПСС может рассматриваться в качестве начальной стратегии имплантации у пациентов как при лечении брадиаритмий, так и при СРТ ХСН после тщательного обсуждения потенциальных рисков и ожидаемых преимуществ, связанных с этим подходом. Современные инструменты и стратегии достижения СПСС развиваются, и поэтому ожидается улучшение результатов клинического использования метода.
Что является бесспорным, мы, безусловно, вступаем в новую эру кардиостимуляции.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Лебедев Д.С., Лебедева В.К. Электрокардиостимуляция на пороге больших перемен: актуализация проблемы. Российский кардиологический журнал. 2024;29(4S):6251. https://doi.org/10.15829/1560-4071-2024-6251. EDN: MVNVFP
Скопировать