Дефицит железа у больных с ишемической болезнью сердца
Значение железа как микроэлемента, необходимого для жизнедеятельности организма, не вызывает сомнений. Ионы железа принимают участие в транспорте кислорода и его хранении, клеточном дыхании в скелетных и сердечной мышцах, синтезе и распаде белков, липидов, углеводов, рибонуклеиновой и дезоксирибонуклеиновой кислот [1-3].
Ряд исследований продемонстрировали отрицательное влияние дефицита железа (ДЖ) на прогноз и течение хронической сердечной недостаточности (СН). Было показано, что коррекция ДЖ внутривенными препаратами железа улучшает прогноз, качество жизни и функциональную способность пациентов с ДЖ и СН, даже при отсутствии у них анемии [4-8]. Одной из наиболее частых причин развития СН является ишемическая болезнь сердца (ИБС). Распространённость пациентов с ИБС в вышеуказанных исследованиях составляла 39,4-65%, доля пациентов, перенесших инфаркт миокарда (ИМ), достигала 60% [4-8]. Несмотря на то, что ДЖ широко распространен у пациентов с ИБС [9-11], влияние ДЖ на течение ИБС, в частности у пациентов с ИМ, в полной мере не изучено, но можно предположить, что ДЖ способствует ухудшению течения ИБС и отрицательно влияет на прогноз данных пациентов. Однако для изучения данного вопроса требуются дальнейшие исследования. Целью настоящего обзора литературы является анализ опубликованных данных по влиянию ДЖ на функцию сердца, качество жизни и прогноз пациентов с ИБС.
Поиск и отбор публикаций
Поиск и отбор публикаций по исследованиям, касающихся ДЖ и ИБС, были проведены в двух базах данных: Кокрановская библиотека систематических обзоров (http://www.thecochranelibrary.com) и библиографическая база данных Medline (http:// www.ncbi.nlm.nih.gov/pubmed), а также путем введения поисковых запросов в поисковой системе Google Scholar с использованием поисковых запросов, ключевых слов (в т.ч. MeSH) и логических операторов. Английский и русский язык был установлен в качестве языкового ограничения. Последний поиск осуществлялся 22 мая 2022г. Ключевые слова в базе данных PubMed: ((Acute coronary syndrome) OR (myocardial infarction) OR (ischemic heart disease) AND (iron deficiency) OR (ferritin)). В поисковой системе Google Scholar выполнены поисковые запросы по следующим ключевым словам: ДЖ, ИБС, ИМ, острый коронарный синдром (ОКС), ферритин, прогноз, ремоделирование левого желудочка (ЛЖ), iron deficiency, myocardial infraction, acute coronary syndrome, ferritin. Проанализировано 359 статей, на основе которых был сформирован список из 29 репрезентативных публикаций, посвящённых теме данного обзора (табл. 1). Выделено 4 основных направления исследуемого вопроса: патофизиологические аспекты влияния ДЖ на сердце при ИБС, прогностическое значение ДЖ при ИБС, влияние ДЖ на качество жизни и функциональную способность пациентов с ИБС, влияние ДЖ и его коррекции на систолическую функцию и ремоделирование ЛЖ.
Таблица 1
Поиск и отбор публикаций

Патофизиологические аспекты влияния ДЖ на сердце
Из множества источников, описывающих роль ионов железа в функционировании кардиомиоцитов, нами были отобраны 12 работ, непосредственно касающихся патофизиологического влияния снижения уровня железа на функцию и структуру кардиомиоцитов в условиях гипоксии. Миокард нуждается в большом количестве энергии, продуцируемой в основном в митохондриях. Ионы железа необходимы для нормальной работы митохондрий. Почти треть всего железа кардиомиоцитов распределена в митохондриях [12]. Наиболее подробно метаболизм железа, влияние перегрузки железа на структуру и функцию кардиомиоцитов описаны в обзоре Ravingerov? T, et al. (2020) [13].
Мы не нашли исследований, свидетельствующих о положительном или нейтральном влиянии системного ДЖ на кардиомиоциты. Chang H-Ch, et al. (2016) на моделях мышей с ишемией миокарда in vivo с помощью гиперэкспрессии гена ABCB8 в кардиомиоците и использования хелатора железа (2,2’-бипиридина) снижали уровень митохондриального железа ниже исходного. Было продемонстрировано, что снижение железа в митохондриях защищает миокард от ишемического повреждения, уменьшая зону некроза, которая оценивалась с помощью эхокардиографии in vivo и проточной цитометрии in vitro [14].
В исследовании Hoes M, et al. (2018) было продемонстрировано снижение содержания железа в клетках сердца при системном ДЖ, даже в отсутствии анемии. Была показана неспособность кардиомиоцитов в условии ДЖ в достаточном объеме транспортировать и использовать кислород, что приводит к митохондриальной дисфункции, снижению числа митохондрий, изменению их структуры, снижению синтеза аденозинтрифосфата, переключению с процессов окисления жирных кислот на анаэробный гликолиз. ДЖ в кардиомиоците приводит к серьезному повреждению эндоплазматического ретикулума с образованием крупных перинуклеарных вакуолей. Данные изменения наблюдались уже через 4 дня нахождения кардиомиоцитов в условиях низкого содержания железа. При восполнении запасов железа восстанавливались синтез аденозинтрифосфата, митохондриальное дыхание и структура эндоплазматического ретикулума. Таким образом, было показано, что клеточные эффекты ДЖ обратимы [15].
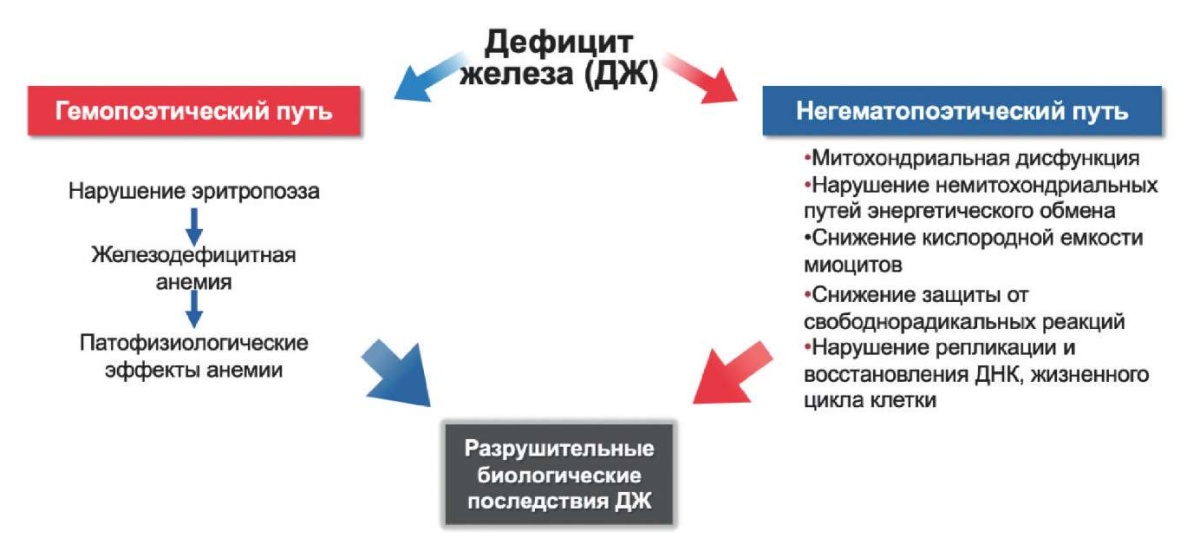
Снижение концентрации внутриклеточного железа ведет к ускорению апоптоза и снижению жизнеспособности кардиомиоцитов [16]. Два исследования, проведенных Dziegala M, et al. (2016) и Isoda M, et al. (2010) на моделях крыс, показали, что гипоксия ухудшает жизнеспособность кардиомиоцитов в условиях ДЖ сильнее, чем при избытке железа. В условиях острой ишемии и некроза миокарда уровень железа в кардиомиоците повышается как результат защитной реакции клетки [17][18]. У пациентов с ДЖ не наблюдается такого резкого повышения кардиального железа, в связи с чем при ИМ в условиях ДЖ кардиомиоциты подвержены выраженной атрофии и апоптозу [19]. Кроме того, макрофаги, накапливающиеся в миокарде при ИМ, поглощают железо и, как следствие, смещают свой иммунологический профиль в сторону противовоспалительного фенотипа [20]. В связи с чем можно предположить, что железо оказывает защитное иммуномодулирующее действие на макрофаги, приводящее к уменьшению зоны некроза и благотворному глобальному ремоделированию ЛЖ в случае ИМ [21] (рис. 1).

Рис. 1. Патофизиологические механизмы влияния ДЖ на сердце. Адаптировано из [7].
Сокращения: ДЖ — дефицит железа, ДНК — дезоксирибонуклеиновая кислота.
Наряду с изменениями в структуре клетки и функционировании органелл снижается и сократительная способность миокарда. В экспериментах in vitro установлено, что в условиях низкого содержания железа площадь и скорость сокращения кардиомиоцита снижается в 2 раза. После добавления трансферрин-связанного железа сократительная функция полностью восстанавливалась, однако релаксация кардиомиоцитов нормализовалась лишь частично. Эти данные свидетельствуют о том, что систолическая функция сердца может улучшаться при восполнении содержания железа, в то время как диастолическая функция имеет более продолжительные нарушения. Таким образом, низкие уровни внутриклеточного железа приводят к снижению систолической функции и стойкому нарушению диастолической функции, что продемонстрировано in vitro и подтверждено наблюдениями из клинической практики [22][23].
Прогностическое значение ДЖ при ИБС
Несмотря на большую распространенность ДЖ у пациентов с ИБС, влияние ДЖ на данную группу пациентов изучено недостаточно. Это может быть связано с тем, что диагностика ДЖ не входит в стандартный перечень обследований пациентов без анемии, особенно в острый период заболевания. Нами было проанализировано 11 исследований, демонстрирующих влияние ДЖ на развитие ИБС и прогноз пациентов с диагностированной ИБС, в частности с ИМ. Согласно представленным исследованиям, распространенность ДЖ у пациентов с ИБС варьирует в пределах 20-60% [9][11].
Данные двух ранее опубликованных работ показали связь повышенного уровня ферритина с риском возникновения ИМ. При изучении финской популяции в исследовании Salonen JT, et al. (1992), включающем 1931 пациента с ИБС в возрасте 42-60 лет, была продемонстрирована связь повышенного уровня ферритина плазмы с увеличением риска развития ИМ. Риск возникновения ИМ в группе пациентов с уровнем ферритина >200 мкг/л был в 2 раза выше, чем в группе с низким уровнем ферритина (отношение рисков (ОР) 2,2, 95% доверительный интервал (ДИ) 1,2-4,0, p<0,01) [24]. Haidari M, et al. (2001) выявили связь повышенной концентрации ферритина с риском преждевременного развития стенозов коронарных артерий (ОР 1,62, 95% ДИ 1,12-2,42, р<0,01). У пациентов при включении в исследование не было диагностировано инфекционно-воспалительных заболевании, а уровень С-реактивного белка был одинаково нормальным в обеих группах. Однако стоит отметить, что результаты были получены лишь в группе мужчин и без учета сывороточного железа и сатурации трансферрина [25].
В исследовании Mohammadifard N, et al. (2017) было показано, что регулярная донация крови снижает риск развития ишемических событий у доноров. Однако этот факт может быть связан с тем, что доноры крови ведут более здоровый образ жизни [26].
Вместе с тем исследования последнего десятилетия, напротив, свидетельствуют об отрицательном влиянии ДЖ на развитие ИБС. Так, два метаанализа с участием >290 тыс. человек выявили обратную связь количества железа в организме с развитием ИБС и сердечно-сосудистых осложнений. Нормальные показатели железа плазмы были ассоциированы со снижением риска развития ИБС на 20% и риском сердечно-сосудистых осложнений и смертности на 15% по сравнению с ДЖ (ОР 0,80, 95% ДИ 0,73-0,87 и ОР 0,85, 95% ДИ 0,73-0,99, соответственно) [27][28].
ДЖ оказывает значительное влияние на прогноз пациентов с ИБС. Нами было проанализировано 5 исследований, оценивающих влияние ДЖ на риск общей и сердечно-сосудистой смертности, частоту возникновения ОКС, в частности нефатального ИМ, как во время госпитализации, так и при более длительном наблюдении [9][11][29-31]. В ходе наблюдения за пациентами с установленным диагнозам ИБС (по результатам коронароангиографии у 2162 человек) в течение 10 лет установлена связь ДЖ со смертностью. Пациенты с ДЖ, независимо от наличия анемии, были подвержены более высокому риску сердечно-сосудистой и общей смертности (ОР 1,27, 95% ДИ 1,02-1,58) [29].
Достаточно часто встречающейся формой ИБС является ИМ, в связи с этим вопросы влияния ДЖ на ИБС зачастую рассматриваются в рамках ИМ. По данным Cosentino N, et al. (2019), распространенность ДЖ у пациентов с ИМ достигает 56% [11]. ДЖ увеличивал риск летальных исходов за 4,7 лет наблюдения у пациентов с ИМ на 54% (ОР 1,54, ДИ 1,032,30, p=0,035) [30]. По данным Zeller T, et al. (2018), включающим наблюдение за 836 пациентами в течение 4 лет после госпитализации по поводу ОКС, ДЖ влиял на прогноз пациентов с ИМ, увеличивая риск нефатального ИМ и сердечно-сосудистой смерти на 73% (р=0,04) [9].
ДЖ также влияет на риск смерти и сердечно-сосудистых осложнений пациентов с ИМ во время госпитализации. По данным Fujinaga H, et al. (2013) у пациентов с ДЖ чаще фиксировалась смерть во время госпитализации по поводу ИМ, по сравнению с пациентами с нормальным уровнем железа (6,5% vs 1,6%, p=0,03; ОР не рассчитывался) [31]. При этом по данным Cosentino N, et al. (2019) у пациентов с ДЖ наблюдалось двукратное снижение риска отрицательных исходов во время госпитализации по поводу ИМ (ОР 0,50, ДИ 0,27-0,93) [11] (табл. 2, рис. 2). В связи с тем, что время наблюдения за пациентами, фиксируемые конечные точки и критерии ДЖ в представленных исследованиях различались, проведение метаанализа не представлялось возможным. Обобщённые данные представлены в таблице 2.
Таблица 2
Влияние ДЖ на риск возникновения нефатального ИМ, общую и сердечно-сосудистую смертность пациентов с ИМ

Сокращения: ДЖ — дефицит железа, ДИ — доверительный интервал, ИМ — инфаркт миокарда, КНТЖ — коэффициент насыщения трансферрина железом, ОКС — острый коронарный синдром, ОР — отношение рисков.

Рис. 2. Влияние ДЖ на риск возникновения нефатального ИМ, общую и сердечно-сосудистую смертность пациентов с ИМ.
Сокращения: ДИ — доверительный интервал, ОР — отношение рисков.
Влияние ДЖ на качество жизни и функциональную способность. В приводившемся ранее исследовании Meron?o О, et al. (2017) у пациентов с ДЖ были зафиксированы меньшая дистанция в тесте 6 минутной ходьбы (277 vs 423 м, p=0,009), худшие результаты тридмил-теста (ОР 2,9, 95% ДИ 1,1-7,6, р=0,023) и выраженное снижение качества жизни через 30 дней после ОКС, по сравнению с пациентами без ДЖ (ОР 1,9, 95% ДИ 1,1-3,3, р<0,001) [10].
Влияние ДЖ и его коррекции на систолическую функцию и ремоделирование ЛЖ. Представленные ниже 4 исследования свидетельствуют об отрицательном влиянии ДЖ на структурные изменения сердца у пациентов с ИБС.
По данным Paeres AE, et al. (2018) пациенты с ИМ и уровнем ферритина <100 нг/мл через 30 дней после госпитализации имели более низкую фракцию выброса ЛЖ, по сравнению с пациентами с уровнем ферретина >100 нг/мл (51,6% и 55,5%, соответственно, p=0,04) [32]. По данным Huang CH, et al. (2019) уровень сывороточного железа был ниже у пациентов, у которых не наблюдалось восстановление систолической функции ЛЖ через 6 мес. после чрескожного коронарного вмешательства, проведенного в связи с ИМ (52,7 мг/дл vs 80,8 мг/дл, р=0,016) [23]. В работе Inserte J, et al. (2021) изучалось влияние ДЖ на ремоделирование миокарда ЛЖ у 141 пациента с впервые возникшем острым ИМ. У пациентов с ДЖ по результатам магнитно-резонансной томографии изначально наблюдалась большая зона некроза (22,8% vs 16,8% от массы ЛЖ, р=0,002). Через 6 мес. увеличение ЛЖ и его ремоделирование наблюдалось у 37,8% пациентов с ДЖ и лишь у 14,1% пациентов с нормальным уровнем железа (р=0,004). Полученные результаты были подтверждены авторами на модели ИМ у крыс [33]. Однако о более длительном влиянии ДЖ на фракцию выброса ЛЖ у пациентов с ИМ не сообщалось.
Мы нашли лишь 4 исследования, которые были направленны на изучение коррекции ДЖ при ИБС. По данным Белоусовой Н. С. и др. (2011) применение препаратов железа на фоне базисной терапии ИБС при ДЖ влияло на процессы ремоделирования миокарда у пациентов после перенесенного ИМ, способствуя значимому уменьшению индекса массы миокарда ЛЖ (103,4±18,4 г/м? до применения препаратов железа и 101,5±19,2 г/м? после, р<0,0001) и увеличению фракции выброса ЛЖ (60,8±5,4% и 67,5±5,2%, р<0,0001) [34].
В исследовании Paterec А, et al. (2021) внутривенное введение железа карбоксимальтозата (ЖКМ) через 30 мин после ИМ крысам с нормальным статусом железа не влияло на систолическую функцию ЛЖ и его ремоделирование, на риск возникновения аритмий, на риск смерти после ИМ и оказалось абсолютно безопасным. Авторы отмечают, что все крысы имели одинаковый нормальный статус железа и влияние применения ЖКМ при наличии ДЖ требует дальнейшего изучения [35].
В исследовании Wischmann P, et al. (2021) ЖКМ вводился мышам с железодефицитной анемией через 1 ч или 24 ч после острого миокардиального повреждения. Было установлено, что введение ЖКМ через 24 ч после ИМ значительно снижало ремоделирование ЛЖ, выражающегося в снижении конечного систолического объема, а также приводило к уменьшению площади поврежденного ишемией миокарда, линейные размеры которой определялись методами девитальной визуализации. Данные положительные эффекты не наблюдались в группе плацебо и в группе, которой ЖКМ вводился через 1 ч после ИМ. Таким образом, авторы делают вывод не только о необходимости введения ЖКМ при ИМ в условиях ДЖ, но и важности соблюдения временных интервалов [36].
В ранее упомянутой работе Inserte J, et al. (2021) применение диеты, насыщенной железом, или введение сахарата железа крысам с ДЖ снижали выраженность оксидативного стресса и приводили к уменьшению площади некроза [33].
Заключение
Проведен систематический анализ публикаций, касающихся влияния ДЖ на пациентов с ИБС. Выделены 4 основных направлений исследований:
- Патофизиологические аспекты влияния ДЖ на сердце в условиях ИБС;
- Прогностическое значение ДЖ при ИБС;
- Влияние ДЖ на качество жизни и функциональную способность пациентов с ИБС;
- Влияние ДЖ и его коррекции на систолическую функцию и ремоделирование ЛЖ.
Большинство исследований, проведенных к сегодняшнему дню, свидетельствуют о негативном влиянии ДЖ на структуру и функцию сердца, качество жизни и прогнозы пациентов с ИБС. Коррекция ДЖ уменьшала объем повреждения и некроза при ишемии и ИМ, улучшала систолическую функцию миокарда и переносимость физических нагрузок после ИМ. Вместе с тем имеющиеся данные немногочисленны, и проблема ДЖ у пациентов с различными формами ИБС требует дальнейшего изучения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Хастиева Д.Р., Хасанов Н.Р. Дефицит железа у больных с ишемической болезнью сердца. Российский кардиологический журнал. 2022;27(4S):4962. https://doi.org/10.15829/1560-4071-2022-4962
Скопировать