Циркадные ритмы сердечных тропонинов: механизмы и клиническое значение
Понятие о циркадных ритмах
Циркадные (циркадианные или суточные) ритмы (ЦР) — эволюционно выработанный консервативный механизм, позволяющим широкому кругу организмов (от цианобактерий до млекопитающих) предвидеть и адаптироваться к циклическим изменениям внешней среды, происходящим из-за вращения Земли вокруг своей оси (смены дня и ночи) [1][2]. С молекулярной точки зрения ЦР состоит из транскрипционно-трансляционных петель обратной связи основных активаторов, генов и белков, периодически экспрессирующихся практически в каждой клетке организма. Циркадная система самодостаточна, и, как следует из латинского названия (circa — около, dies — день), она колеблется с почти 24-часовым периодом [3].
Открытие ЦР приписывают французскому астроному и хронобиологу Жан-Жаку Де Мерану (1729г). Исследователь отметил, что оставленная в темноте мимоза закрывала и разворачивала свои листья вне зависимости от освещенности в соответствии со своими внутренними настройками на 24-часовой (суточный) ритм. В последние годы ЦР стали активно изучаться и были обнаружены практически у всех обитателей планеты. Благодаря развитию молекулярно-генетических технологий были открыты гены, ответственные за их регуляцию. В 1970г Benzer S и Konopka R в исследовании на дрозофилах выявили ген, регулирующий ЦР и назвали его period (сокращенно per). Мутации этого гена приводили к нарушению ЦР у подопытных мух. Огромный вклад в изучение молекулярно-генетических механизмов, определяющих ЦР живых организмов, внесли Hall J, Rosbash M и Young M, за что эти исследователи в 2017г были удостоены Нобелевской премии по физиологии и медицине [4][5][6][7].
ЦР имеют не только большую теоретическую ценность, но и важное практическое значение. Показано, что нарушение суточного ритма, вызванного, например, посменной (ночной) работой может привести к неблагоприятным последствиям для здоровья, а именно, повышению риска развития онкологических, метаболических, сердечно-сосудистых, нейродегенеративных и психических заболеваний [8][9][10][11].
ЦР имеют важное значение в лабораторной диагностике целого ряда заболеваний в связи с тем, что некоторые молекулы секретируются в определенные периоды суток, например, многие гормоны активнее секретируются в утренние часы. Кроме того, большое количество молекул (метаболитов) подвержено влиянию данных гормонов, в связи с чем их концентрации также отличаются в утренние и вечерние часы. Следовательно, для оптимальной диагностики врачиклиницисты должны учитывать время взятия биоматериала, а при вынужденном поступлении пациента (с ургентными состояниями) принимать во внимание возможные физиологические отклонения ряда лабораторных показателей с учетом естественных ЦР.
В последнее время появилась информация о существовании ЦР у сердечных тропонинов (СТ) — ключевых биомаркеров для диагностики ряда сердечнососудистых заболеваний (ССЗ), в частности, инфаркта миокарда (ИМ). В представленном обзоре мы проанализируем данные опубликованных к настоящему времени исследований, посвященных суточным ритмам СТ, и обсудим их возможные механизмы. Подобные работы в настоящее время отсутствуют.
Биология СТ
СТ долгое время считались строго внутриклеточными молекулами, а их обнаружение в сыворотке крови рассматривалось как один из ключевых признаков (критериев) диагноза ИМ [12][13]. Значительно возросшая чувствительность новых методов определения СТ (высоко- и ультрачувствительных) способствовала изменениям наших представлений об их биологии и диагностической ценности. Молекулы СТ в сыворотке крови циркулируют в виде гетерогенного пула: свободные одиночные молекулы СТ, бинарные и тройные комплексы (соединение нескольких СТ в единую молекулу). В состав диагностических иммунохимических наборов для определения СТ входят антитела к разным антигенным детерминантам молекулы СТ, что определяет разницу значений, в результате чего лабораторные показатели одного и того же пациента могут отличаться в несколько раз [14].
В кардиомиоците молекулы СТ располагаются в виде структурного пула (тропонинового комплекса) и цитоплазматического (свободного) пула. Молекулы СТ свободного пула являются основными источниками, вносящими вклад в рост концентрации СТ у здоровых пациентов и при обратимых/незначительных повреждениях клеток миокарда при развитии ургентных состояний, а также во время физических нагрузок или психоэмоциональных стрессов. Кроме того, цитоплазматический пул первым высвобождается при развитии ИМ, образуя первый пик концентрации, а второй пик концентрации СТ в сыворотке возникает при деградации структурного пула СТ.
Молекулы СТ присутствуют как в сыворотке/плазме крови, так и ряде других биологических жидкостей, образующихся в результате процессов фильтрации и секреции, в частности, в моче и ротовой жидкости [15][16][17][18]. Вместе с тем, молекулы СТ обладают относительно крупными размерами (и соответственно высокой молекулярной массой) по отношению к размеру пор почечного фильтра и обнаруживаются в моче далеко не у всех пациентов [19]. Вероятность обнаружения СТ в моче зависит от чувствительности используемого метода определения.
Циркадные ритмы СТ
Поиск клинических исследований осуществлялся по базе данных PubMed по следующим ключевым словам: circadian rhythm, diurnal rhythm, cardiac troponin, high-sensitivity troponin. Всего было найдено 10 оригинальных исследований, в которых изучались ЦР СТ. Первыми об их существовании сообщили Wu A и Vasile V [20][21][22].
Aakre K, et al. изучали еженедельные и 90-минутные биологические вариации концентрации СТ-Т и СТ-I при помощи высокочувствительных методов определения — Roche Diagnostics и Abbott Diagnostics, соответственно [23]. Взятие крови осуществлялось у здоровых добровольцев и пациентов с хронической болезнью почек (ХБП) с 90-минутными интервалами в течение 6-часового периода (с 8:30 до 14:30). Оказалось, что уровни СТ-Т (у здоровых лиц и пациентов с ХБП) и СТ-I (только в группе пациентов с ХБП) ежечасно снижались в среднем на 0,8-1,7%. Еженедельные различия в уровнях СТ-Т и СТ-I составили 8 и 15%, соответственно [23].
В нескольких исследованиях ЦР СТ были изучены более подробно — измерение уровня СТ у одних и тех же пациентов проводилось каждый час в течение суток, что позволяет значительно точнее установить факт наличия или отсутствия ЦР [24][25][26][27]. Клинические характеристики пациентов, участвующих в данных исследованиях, значительно различались (табл. 1).
Таблица 1
Исследования, посвященные изучению ЦР СТ
| № | Количество пациентов, участвующих в исследовании, и их базовая характеристика | Дизайн исследования | Основные выводы/результаты исследований | Источник |
| 1 | Здоровые (n=12) | Ежечасное определение СТ-I в течение 4 ч | Популяционно определенные референсные границы для СТ-I менее точны, чем
индивидуальные для конкретного пациента |
[20] |
| 2 | Здоровые (n=20) | Определение СТ-Т в 5 временных точках | СТ-Т показал большую суточную вариабельность по сравнению с СТ-I | [21] |
| 3 | Здоровые (n=20) | Определение СТ-Т в начале исследования и через 1, 2, 3 и 4 ч (т.е. всего 5 измерений) | Циркадная вариабельность уровня СТ-Т незначительна, но может оказаться значимой при проведении анализа. | [22] |
| 4 | Здоровые (n=24) | Определение СТ-Т и СТ-I осуществлялось ежечасно в течение 25 ч (от 8:0 до 8:30) | Для СТ-Т характерен ЦР с пиковой концентрацией утром и постепенным снижением концентрации в течение дня.
Для СТ-I циркадные колебания концентрации незначительны (не более 1 нг/л) |
[23] |
| 5 | Здоровые (n=20)
Пациенты с ХБП (диализ) (n=1S) |
Определение СТ-Т и СТ-I проводилось с 90-минутными интервалами в течение 6 ч (от момента первого измерения в 8:30 до последнего измерения в 14:30) | Для СТ-Т и СТ-I характерен ЦР с постепенным снижением концентрации в течение дня на 0,8-1,7% ежечасно | [24] |
| 6 | Пациенты с сахарным диабетом 2 типа без острых ССЗ (n=23) | Определение СТ-Т в серийных образцах венозной крови, которую отбирали в течение 11-часового периода (с 8:30 до 19:30) | Для СТ-Т характерен ЦР с пиковой концентрацией утром и постепенным снижением концентрации в течение дня | [25] |
| Пациенты с сахарным диабетом 2 типа без острых ССЗ (n=7) | Определение СТ-Т в серийных образцах крови, которую забирали ежечасно в течение 25 ч (от 8:30 утра до 8:30 утра следующего дня) | |||
| 7 | Пациент с ХПН | Ежечасное определение СТ-Т и СТ-I в сыворотке крови при помощи высокочувствительных методов | Для СТ-Т характерны статистически и клинически значимые ЦР, которые, ко всему прочему, могр повлиять на точность диагностики острого ИМ при использовании быстрых алгоритмов | [26] |
| 8 | Здоровые (n=17) | Изучить ЦР уровня тропонина среди абсолютно здоровых лиц в течение суток (с 08:00 до 08:00) | Максимальные значения СТ-Т были зарегистрированы в 6:00, а минимальные в 18:00 | [27] |
| 9 | Пациенты, поступившие в отделение неотложной помощи с подозрением на ИМ (n=2601) | Определение СТ-I при помощи четырех методов анализа. Сравнивались утренние и вечерние значения СТ-I сыворотки крови у одних и тех же пациентов | Циркадные вариации концентрации СТ-I статистически и клинически не значимы | [29] |
| 10 | Здоровые (n=35) | Определение СТ проводилось при помощи высокочувствительного метода в образцах крови, полученных утром (8:00-9:00) и через 1, 2, 3, и 7ч) | Для СТ-I характерен суточный ритм концентрации. Наиболее высокие концентрации были утром, а к вечеру снижались | [30] |
Сокращения: ИМ — инфаркт миокарда, ССЗ — сердечно-сосудистые заболевания, СТ — сердечные тропонины, СТ-Т — сердечный тропонин Т, СТ-I — сердечный тропонин I, ХБП — хроническая болезнь почек, ХПН — хроническая почечная недостаточность, ЦР — циркадные ритмы.
Fournier S, et al. изучали циркадные изменения СТ-Т с использованием косинор-метода (применяется при анализе волновых процессов и обработке хронобиологических данных) у 17 здоровых добровольцев (ср. возраст 25 лет) [27]. Участники за три дня до исследования придерживались определенного режима дня — специально разработанный рацион питания, приемы пищи в 8:30, 12:00 и 19:00, физическая активность в виде пеших прогулок в течение 10 мин до и после приема пищи, участников попросили лечь в постель в 21:00, а в 22:00 выключить свет. Качество их ЦР оценивалось путем измерения температуры тела (инфракрасный ушной термометр), сердечного ритма и артериального давления (два измерения каждый раз с помощью традиционной манжеты) перед каждым забором крови. Забор крови осуществлялся каждые 4 ч в течение суток. Концентрация СТ-Т в течение суток изменялась в диапазоне от 3 до 9 нг/л, при этом значений выше 99-го процентиля (14 нг/л) не наблюдалось. Пик концентрации приходился на 06:00, а максимальное снижение наблюдалось в 18:00. Это исследование продемонстрировало наличие ЦР концентрации СТ-Т с амплитудой вариации 20,5%.
Klinkenberg L, et al. изучали ЦР СТ у пациентов с сахарным диабетом 2 типа [24], а также у здоровых лиц [25]. Сравнивая оба этих исследования, можно отметить, что у пациентов с сахарным диабетом 2 типа циркадные колебания концентрации СТ-Т были несколько выше, чем у здоровых пациентов. Авторы пришли к выводу, что циркадные колебания концентрации СТ-Т могут повлиять на результаты, если уровень СТ-Т изучается в скрининговых программах, но вряд ли могут повлиять на точность диагностики ИМ при использовании рекомендуемых Европейским обществом кардиологов диагностических алгоритмов.
van der Linden N, et al. изучали ЦР СТ у пациентов с и без ХБП [28]. Авторы проводили почасовые изменения концентрации СТ-I у 36 испытуемых, половина из которых имела ХБП. Исходные концентрации СТ-I были недостоверно выше в группе с ХБП по сравнению с группой без ХБП (median [IQR] 6,8 (3,5- 9,2) ng/L vs 4,7 (2,8-6,9) ng/L; р=0,09).
Во всех упомянутых выше исследованиях ЦР присутствовали у СТ-Т, но не были статистически значимы для СТ-I [25][26][27]. Wildi K, et al. также не обнаружили ЦР СТ-I, характерных для СТ-Т [29]. Весьма примечательно, что в исследовании Klinkenberg L почасовые различия концентрации СТ-I составляли не более 1 нг/л [25], тогда как у пациентки с ХБП в исследовании van der Linden N они достигали 2,6 нг/л [26]. Сравнивая результаты данных исследований Klinkenberg L и van der Linden N [25][26], также отметим, что в последнем случае ЦР СТ-Т были гораздо более значимы и могли бы повлиять на точность диагностики ИМ (при использовании ранних алгоритмов диагностики 0-1 ч, и 0-3 ч). В связи с этим, можно предположить, что циркадные колебания концентраций как СТ-Т, так и СТ-I у пациентов в условиях ХБП гораздо более выражены, чем у здоровых индивидуумов.
В 2020г Zaninotto M, et al. уже при использовании высокочувствительного метода анализа обнаружили наличие ЦР концентрации СТ-I [30]. Примечательно, что ЦР СТ соответствуют ЦР другого биомаркера, используемого для постановки диагноза ИМ — МВкреатинфосфокиназы (КФК-МВ) [31].
Существует и другой (суррогатный) подход для изучения ЦР. Его цель — показать, присутствуют ли клинически значимые суточные изменения концентрации СТ-Т у пациентов в реальной клинической практике. Ross А, et al. анализировали пациентов, госпитализированных в отделение неотложной помощи с болью в груди, но не имевших ИМ или других состояний, которые могли повлиять на уровень СТ-Т в крови [32]. Периоды времени для забора крови были следующие: 00:00-03:59, 04:00-07:59, 08:00-11:59, 12:00-15:59, 16:00-19:59 и 20:00-23:59. Всего в исследование было включено 19460 пациентов (50% мужчин), средний возраст 54±16 лет. Пациенты, которые поступили ночью, оказались моложе, но схожи по другим характеристикам. Наивысшие средние значения концентрации СТ-Т при поступлении у мужчин (9,0 нг/л; 95% доверительный интервал (ДИ) 8,7-9,3) и у женщин (8,0 нг/л; 95% ДИ 7,8-8,2) были обнаружены в период 08:00-11:59 ч. После поправки на возраст и предполагаемую скорость клубочковой фильтрации (СКФ) достоверных ЦР изменений концентрации СТ-Т обнаружить не удалось.
Интересна идея сопоставления времени возникновения ИМ, а также его размера с ЦР СТ. Su?rez-Barrientos A, et al. ретроспективно проанализировали данные 811 пациентов с ИМ с подъемом сегмента ST (ИМпST), оценивая размер ИМ по пиковой концентрации КФК-МВ и СТ-I [33]. Авторы сравнивали их значения в четырех временных интервалах: 24:00-06:00; 06:00-12:00; 12:00-18:00; 18:00-24:00. Наибольшее число пациентов с ИМ поступило в период с 06:00 до 12:00 ч (269 пациентов). Пациенты с ИМ передней стенки ЛЖ чаще госпитализировались в период с 24:00 до 12:00. Первичное чрескожное коронарное вмешательство (ЧКВ) выполнялось несколько чаще у пациентов, поступавших в период с 24:00 до 06:00 (86% пациентов). Пик концентрации для обоих ферментов наблюдался в период с 06:00 до 12:00, а минимум с 12:00 до 18:00. Размер инфаркта был значительно больше у пациентов, госпитализированных в период перехода от темноты к свету (06:00-12:00), чем у пациентов с началом ИМпST в любое другое время суток (КФК-МВ: 1766,84 ед./л (95% ДИ 1554,34-2020,69) vs 1517,21 ед./л (95% ДИ 1382,41-1649,81); СТ-I: 66,65 нг/мл (95% ДИ 56,47-78,76) vs 53,65 нг/мл (95% ДИ 47,7-60,04).
Клиническая целесообразность рутинной аспирации тромба из коронарной артерии в настоящее время сомнительна. Между тем, согласно данным регистра Acute Myocardial Infarction in Switzerland
Plus, включившего в 2009-2014гг 3648 пациентов с ИМпST и первичным ЧКВ (аспирация была выполнена у 49% пациентов), эффективность аспирации оказалась наиболее эффективной в плане уменьшения размера ИМ в период с 06:00 до 17:59 ч [34].
Интересно, что ЦР были обнаружены и при развитии ИМ 4А типа — у пациентов, перенесших плановое ЧКВ. Fournier S, et al. проанализировали данные 1021 пациента в зависимости от времени проведения ЧКВ: утренняя группа (651 пациентов) 07:00-12:00 и дневная группа (370 пациентов) с 12:00 до 19:00. Частота развития перипроцедурного ИМ была статистически ниже в утренней группе по сравнению с дневной группой (20% vs 30%, p<0,001). Эта разница оставалась статистически значимой после коррекции по полу и возрасту (21% vs 29%, p=0,03). Согласно многофакторному анализу, проведение ЧКВ во второй половине дня независимо увеличивает риск развития перипроцедурного ИМ (отношение шансов 2,0; 95% ДИ 1,1-3,4; р=0,02) [35].
Возможные механизмы формирования ЦР СТ
Молекулы СТ, как показали недавние исследования, могут высвобождаться из кардиомиоцитов у абсолютно здоровых лиц, однако механизмы данного высвобождения пока окончательно неизвестны [14][18][36]. Недавние исследования показали, что даже незначительные колебания активности различных систем организма, в особенности, таких, как нейроэндокринная, система гемостаза и мочевыделительная система, могут влиять на уровень СТ в сыворотке крови. Поскольку данные системы имеют ЦР своей активности, то предположительно они могут обуславливать ЦР СТ. Рассмотрим данные механизмы подробнее.
Роль нейроэндокринной системы в высвобождении СТ. Нейроэндокринная система жизненно необходима для адекватной работы сердечно-сосудистой системы. Lazzarino А, et al. обнаружили, что повышение уровня кортизола, вследствие стрессовой стимуляции клубочковой зоны коркового вещества надпочечников, ассоциируется с показателями СТ-Т [37]. Незначительные физические нагрузки и введение добутамина, по данным Samaha E, et al., также приводили к некоторому росту уровня СТ в сыворотке крови [38]. Катехоламины, как известно, повышают потребность миокарда в кислороде и увеличивают частоту сердечных сокращений (ЧСС). Ben Yedder N, et al. обнаружили тесную корреляцию с уровнем СТ-Т (r=0,637, p<0,01). Кроме того, у лиц с положительным СТ-Т ЧСС во время пароксизма оказалась достоверно выше по сравнению с тропонин-отрицательными пациентами (190 уд./мин vs 170 уд./мин; p=0,008) [39].
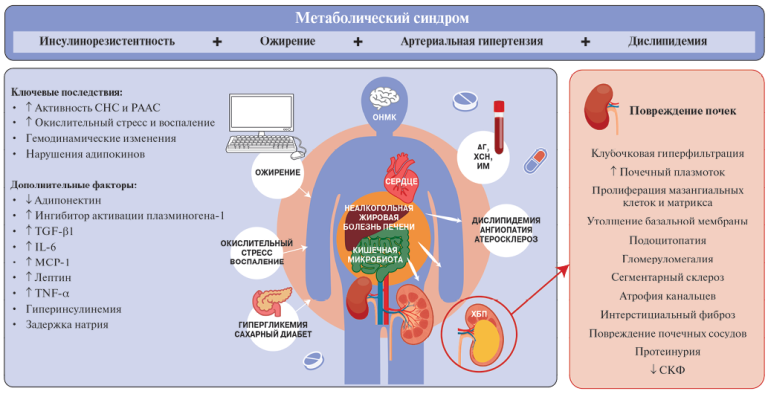
Механизм высвобождения молекул СТ в условиях резкого повышения ЧСС и тахиаритмий, предположительно, связан с нарушением равновесия между потребностью и доставкой кислорода и субстратов метаболизма (глюкозы, свободных жирных кислот, лактата и др.). В условиях высокой ЧСС миокард страдает от дефицита энергии и не может в полной мере обеспечить постоянство гомеостаза внутриклеточной среды. Дефицит кислорода приводит к переключению метаболических путей с аэробного на анаэробный, постепенному накоплению лактата и закислению внутриклеточной среды, в условиях которой активируются ферменты протеазы, расщепляющие внутриклеточные белки, в т.ч. входящие в состав биологических мембран, что в конечном итоге приводит к повышению их проницаемости и высвобождению молекул СТ [14][18][40][41]. Размер молекул СТ позволяет им проходить через относительно неповрежденные клеточные мембраны кардиомиоцитов. Кроме того, известно, что в цитозоле кардиомиоцитов располагается цитоплазматическая (свободная) фракция СТ, которая, по мнению ряда исследователей, высвобождается у здоровых лиц, а также при незначительных (обратимых) повреждениях кардиомиоцитов [14][18][42] (рис. 1).

Рис. 1. Локализация молекул СТ в кардиомиоцитах (цитоплазматический и структурный пул) и основные триггеры, вызывающие высвобождение цитоплазматической фракции.
Еще одним триггером высвобождения молекул СТ из миокарда могут быть тиреоидные гормоны (Т3, Т4). Активность клеток тиротропоцитов передней доли гипофиза повышается утром, что приводит к повышению уровня тиреотропного гормона, который, в свою очередь, активирует фолликулярные клетки щитовидной железы для выработки Т3 и Т4. Отмечено, что утром концентрация Т3 и Т4 в сыворотке крови пациентов превышает аналогичные вечерние показатели [43][44]. При этом более высокие уровни тиреоидных гормонов утром связаны с более тяжелой клинической картиной ССЗ (ишемической болезни сердца, артериальной гипертензии и фибрилляции предсердий) у этих пациентов [43][44]. Повышение уровня тиреоидных гормонов приводит к повышению ЧСС, и, как следствие, нарушению равновесия между потребностью и доставкой кислорода, что, по всей видимости, является причиной ЦР СТ (более высокой утренней концентрации СТ).
Роль системы гемостаза. Наряду с изменениями активности и функционирования нейроэндокринной системы, циркадные изменения активности системы гемостаза также могут быть ответственны за высвобождение СТ. Активность системы гемостаза изменяется в течение суток: например, в утренние часы, как правило, преобладают прокоагулянтные механизмы, способствующие изменению реологических свойств крови в сторону повышения вязкости [45][46]. Хорошо известно о наличии связи между высокой агрегационной способностью тромбоцитов утром и повышенным риском развития ИМ и внезапной смерти в этот период [46].
Кроме того, принимая во внимание роль ферментов системы гемостаза, в частности, тромбина, в специфическом расщеплении молекулы СТ-Т на два фрагмента [47][48], и, соответственно, изменении доступности антигенных детерминант для диагностических антител, входящих в состав иммунохимических наборов, можно выдвинуть предположение об участии данного механизма в формировании ЦР для некоторых тест-систем, антитела которых нацелены на искомые фрагменты молекулы СТ-Т.
Роль биохимических различий СТ в формировании ЦР. Для СТ-I, в отличие от СТ-Т, как показал ряд исследований, практически не характерны ЦР [28][29], однако причина тому окончательно не установлена. Для объяснения этих возможных различий обратимся к биохимическим особенностям молекул СТ-Т и СТ-I, которые могут лежать в основе различий в механизмах высвобождения и элиминации молекул СТ (табл. 2).
Таблица 2
Биохимические и лабораторные особенности молекул СТ
| Отличительные характеристики | СТ-Т | СТ-I |
| Специфичность для выявления повреждений кардиомиоцитов | Почти абсолютная(есть несколько исследований, в которых экспрессия СТ-Т была обнаружена в скелетных мышцах и стенках легочных и полых вен) | Абсолютная (экспрессия только в миокарде) |
| Молекулярная масса | 36 килодальтон | 24 килодальтон |
| Общее содержание СТ в мг на 1 г веса ткани миокарда | 10-11 мг/г миокарда | 4-6 мг/г миокарда |
| Объем цитоплазматической фракции СТ | 6-7% | 3-4% |
| Лабораторная диагностика | Практически стандартизованный (существует всего один производитель высокочувствительного метода определения СТ-Т) | Не стандартизованный (существует огромное количество производителей методов анализа умеренного и высокочувствительного СТ-I, которые дают
разные результаты при исследовании сыворотки крови одного и того же пациента) |
Сокращения: СТ — сердечные тропонины, СТ-Т — сердечный тропонин Т, СТ-I — сердечный тропонин I.
Наряду с многочисленными и важными сходствами молекул СТ-Т и СТ-I, включая высокую органную специфичность для сердца, высокую диагностическую точность и корреляцию со степенью повреждения миокарда, и прогностическую ценность при ИМ, между СТ-Т и СТ-I существует ряд весьма важных различий. Молекулярная масса и, соответственно, размеры молекулы СТ-I меньше, в связи с чем данный белок гораздо легче проходит через клеточную мембрану кардиомиоцитов. А общее содержание СТ-Т в миокарде и объем цитоплазматической (свободной фракции) СТ-Т практически в два раза выше, чем СТ-I (10-11 мг/г vs 4-6 мг/г и 6-7% vs 3-4%, соответственно) [29]. Принимая во внимание, что содержание СТ-Т в миокарде и объем цитоплазматической (“легковысвобождаемой”) фракции выше, можно предположить, что возможность высвобождения СТ-Т гораздо выше, чем у СТ-I, что может в определенной степени объяснять различия в степени циркадных колебаний.
Различия в способности проходить через почечный барьер также могут быть объяснением того, почему более выраженные циркадные изменения характерны для СТ-Т. В нескольких исследованиях показано, что у пациентов с ХБП уровень СТ-Т повышается чаще и достигает более высоких значений по сравнению с СТ-I [49].
Роль мочевыделительной системы в повышении концентрации и формировании ЦР СТ. Как сообщалось ранее, концентрация СТ в сыворотке крови зависит не только от высвобождения их из миокарда, но и от механизмов элиминации. Поэтому мы не случайно описывали возможности почечной фильтрации выше. Если сравнить исследования Klinkenberg L, et al. [24][25] и van der Linden N, et al [26], можно заметить, что у пациентов с нормальной функцией почек наблюдались менее выраженные циркадные изменения СТ-I, чем у пациентов с угнетенной функцией почек. Для СТ-Т также характерная данная тенденция: у пациентов с адекватной почечной фильтрацией (нормальной СКФ) циркадные колебания значительно более выражены.
Мочевыделительная система также в течение суток изменяет свою активность. Известно, что утренний диурез выше ночного, что свидетельствует о более высокой СКФ в утренние часы [50]. Примечательно, что факторы, вызывающие повышение СКФ, также вызывают повышение клиренса СТ — способность почек элиминировать СТ выше у пациентов с более высоким артериальным давлением [16].
Следовательно, ЦР мочевыделительной системы и факторов, оказывающих влияние на СКФ, также могут быть связаны с циркадными вариациями концентрации СТ в сыворотке крови.
Функция почек может играть существенную роль в различии ЦР СТ-Т и CТ-I в связи с тем, что снижение СКФ гораздо более тесно связано с повышением СТ-Т, нежели с концентрациями СТ-I [49].
Заключение
Рассматривая имеющиеся на данный момент публикации, можно утверждать о наличии ЦР СТ, причем более выраженных у СТ-Т. Уровень СТ-I, вероятно, не имеет циркадных вариаций или они незначительны. Суточная динамика СТ, по-видимому, может повлиять на диагностику, а что более важно — стратификацию риска при некоторых неотложных состояниях, протекающих с повреждением миокарда, когда уровень СТ повышается незначительно или умеренно. Вместе с тем, на точность диагностики ИМ ЦР СТ навряд ли смогут оказать существенное влияние. Следует учитывать, что большая часть пациентов с ИМ относится к старшей возрастной группе и имеет много сопутствующих заболеваний (например, ХБП). В этих случаях клиническое значение ЦР СТ может оказаться весомым.
Впрочем, в настоящее время мы только начинаем изучать ЦР СТ, а также факторы на них влияющие. Поэтому окончательные выводы можно будет сделать только после проведения масштабных исследований.
Отношения и деятельность: авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Чаулин А.М., Дуплякова П.Д., Дупляков Д.В. Циркадные ритмы сердечных тропонинов: механизмы и клиническое значение. Российский кардиологический журнал. 2020;25(3S):4061. https://doi.org/10.15829/1560-4071-2020-4061
Скопировать