Частота и прогностическое значение острого повреждение почек при тромбоэмболии лёгочной артерии по данным регистра СИРЕНА
Введение в практику эффективных диагностических и лечебных подходов, изложенных в современных клинических рекомендациях, позволило улучшить исходы тромбоэмболии легочной артерии (ТЭЛА) [1-3], между тем смертность при этом состоянии остается одной из самых высоких [4].
Острое повреждение почек (ОПП) нередко осложняет течение ургентных кардиоваскулярных заболеваний, оказывая неблагоприятное влияние на прогноз за счет повышения риска развития ишемических, тромботических осложнений, кровотечений, возникновения и прогрессирования хронической болезни почек (ХБП), увеличения летальности и смертности [5-13]. ОПП хорошо изучено при остром коронарном синдроме, декомпенсированной хронической сердечной недостаточности (СН), остром нарушении мозгового кровообращения (ОНМК) и диагностируется у каждого второго пациента кардиологических блоков интенсивной терапии [13-15].
Частота, тяжесть ОПП, его влияние на исходы при ТЭЛА изучены недостаточно, опубликованные данные представлены небольшим числом работ, где для диагностики редко используются современные критерии, изложенные в рекомендациях KDIGO (2012г) [16]. Основная часть исследований посвящена изучению частоты и прогностического влияния почечной дисфункции (ПД), которая определяется как скорость клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2 [16-19].
У пациентов с ТЭЛА нередко наблюдается повышение центрального венозного давления, макро- и/ или микроциркуляторная гипоперфузия почек, что позволяет ожидать высокую частоту ОПП [20-22]. Легочная эмболия (ЛЭ) является основанием к назначению антикоагулянтов, использование и дозирование которых зависит от состояния почечной функции, в этой связи диагностика ОПП имеет важное значение, но не всегда осуществляется на практике [23].
Многоцентровые регистрационные эпидемиологические программы позволяют объективно оценить распространенность заболеваний и их осложнений. На сегодняшний день данные по оценке ОПП при ТЭЛА представлены только в отношении популяции западной Европы в регистре RIETE [16]. Получение результатов многоцентрового проспективного исследования СИРЕНА дает возможность для такого анализа у российских пациентов.
Цель настоящей работы — оценка частоты, выраженности ОПП, его возможностей в реклассификации риска ранней смерти и связи с госпитальной летальностью у пациентов с ТЭЛА в российской популяции.
Материал и методы
Исследование является ретроспективным и базируется на материале, полученном в ходе Российского многоцентрового наблюдательного проспективного регистра СИРЕНА, обоснование и методология которого подробно описаны ранее [24]. Набор обследуемых осуществлялся в 20 центрах в российских городах: Биробиджан, Казань, Кемерово, Майкоп, Нижний Новгород, Пермь, Рязань, Самара, СанктПетербург, Сочи, Тверь, Томск, Ульяновск, Улан-Удэ. С апреля 2018г по аналогичный период 2019г в регистр последовательно включались госпитализированные взрослые пациенты при наличии признаков, позволяющих диагностировать ТЭЛА, а также умершие, у которых заболевание было выявлено на патологоанатомическом исследовании. Протокол исследования одобрен локальными этическими комитетами, а все больные подписали информированное согласие на участие в нем. У каждого включенного анализировались: анамнез, факторы риска венозных тромбоэмболий, симптомы, результаты методов исследования, терапия до и во время стационарного лечения, развившийся исход госпитализации и ее длительность.
В ряде предшествующих публикаций, касающихся регистрационной программы СИРЕНА, описывались только пациенты с прижизненной диагностикой ТЭЛА [24][25]. В представленной работе в анализ добавлены обследуемые с посмертным подтверждением диагноза.
В регистрационных картах больных не была предусмотрена фиксация данных о диурезе, а креатинин сыворотки крови (сКр) учитывался только один раз. Отсутствие этого параметра в базе данных являлось критерием исключения из исследования.
Диагностику ОПП осуществляли путем оценки имеющегося сКр относительно его базального значения, рассчитанного по формуле MDRD и соответствующего СКФ 75 мл/мин/1,73 м2, что допускается действующими клиническими рекомендациями KDIGO (2012г) [26].
ХБП фиксировалось исследователями в регистрационных картах при наличии в анамнезе по итогу анализа медицинской документации.
У всех обследуемых ретроспективно выполнена оценка риска ранней смерти. В случае персистирующей гипотензии и/или обструктивного шока — регистрировали высокий риск, в остальных случаях проводили расчет индекса тяжести ТЭЛА (PESI) и его упрощенного варианта (sPESI) с целью выявления среднего или низкого риска [27].
Статистический анализ материала выполнен с использованием программных комплексов STATISTICA_6.0 (StatSoft, Inc.) и MedCalc_11.6 (MedCalc Software bvba). Качественные данные представлены в формате абсолютных (n) и относительных (%) значений. Тип распределения количественных признаков определяли с использованием критерия Шапиро-Уилка. Если их распределение соответствовало нормальному, то данные отражали в виде M±SD (M — среднее арифметическое, SD — стандартное отклонение), если нет, то в виде Me (интерквартильный размах, ИКР) (Me — медиана, ИКР — интерквартильный размах: 25 процентиль — 75 процентиль). Сравнение двух групп несвязанных признаков при нормальном распределении осуществляли по критерию t Стьюдента, иначе использовали Mann-Whitney U test. В качестве метода сравнения двух групп по качественному признаку применяли ?2 Пирсона. Для оценки равенства медиан нескольких выборок использовали непараметрический метод Краскела-Уоллиса. С целью оценки связи между несколькими переменными и летальностью применяли регрессионный анализ Кокса. Для получения численного значения точности диагностического теста использовали ROC-анализ. Во всех случаях нулевая гипотеза отвергалась при р>0,05.
Результаты
Из 660 обследуемых с ТЭЛА, первоначально включенных в регистрационную программу СИРЕНА, 56 (8%) были исключены из-за отсутствия в базе данных значения сКр. Исследуемая когорта составила 604 пациента, в т.ч. мужчин — 293 (49%), женщин — 311 (51%). Средний возраст в анализируемой группе был 64±15 лет. У 555 (92%) обследуемых диагноз ЛЭ был установлен при жизни, у 49 (8%) — посмертно.
ОПП по базальному креатинину диагностировано у 223 (37%) пациентов, при этом первая стадия тяжести обнаружена у 146 (65%), вторая — у 55 (25%), третья — у 22 (10%) больных (рис. 1). ХБП в анамнезе зафиксирована у 61 (10%) обследуемого, при этом СКФ <60 мл/мин/1,73 м2 выявлена у 320 (53%) пациентов.
Анамнестическая и клиническая характеристика объектов исследования в зависимости от наличия острой дисфункции почек представлена в таблице 1. Обследуемые с ОПП были старше, среди них преобладали женщины, у них чаще имела место иммобилизация в предшествующие 12 мес. и наблюдались сопутствующие заболевания, прежде всего сердечнососудистые: ОНМК в анамнезе, постинфарктный кардиосклероз, артериальная гипертензия, СН, сахарный диабет, фибрилляция предсердий, ХБП, рак (табл. 1).
Результаты объективного осмотра, оценки риска смерти и данные, полученные в ходе лабораторных и инструментальных методов исследований, в зависимости от наличия ОПП по базальному креатинину, представлены в таблице 2. У обследуемых с ОПП реже встречались симптомы, заставляющие подозревать ЛЭ (одышка, кровохарканье, кашель, боль в грудной клетке), при этом объективные признаки в виде увеличения шейных вен, более низких цифр систолического и диастолического артериального давления, сатурации и более высокой частоты дыхания — наблюдались чаще (табл. 2). По результатам лабораторных методов исследования при наличии ОПП уровень гематокрита и СКФ были ниже, а лейкоцитов — выше (табл. 2). Эхокардиографическое исследование продемонстрировало у пациентов с острой дисфункцией почек более низкую фракцию выброса левого желудочка и более высокое систолическое давление в легочной артерии (табл. 2).
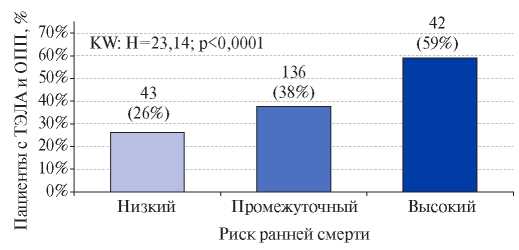
Проведение стратификации риска позволило выявить у 71 (12%) пациента высокую вероятность неблагоприятного исхода, у остальных 533 (88%) — невысокую. В последней группе дополнительно выполнен расчет индекса тяжести ТЭЛА, что позволило разделить ее на страты промежуточного и низкого риска: в первую вошли 364 (61%) пациента, во вторую — 164 (27%). Последующий анализ показал более высокий уровень PESI и sPESI при ОПП, чем при его отсутствии (табл. 2). Установлено, что с увеличением риска смерти частота острой дисфункции почек растет (рис. 2).
За время госпитализации умерло 107 (18%) пациентов. ОПП в группах с прижизненной и посмертной диагностикой ТЭЛА выявлялось со сходной частотой (37 (64%) и 30 (61%); p=0,75). Обследуемые с ОПП умирали чаще (67 (30%) и 40 (10%); p<0,0001), а число тех, кто умер, постепенно возрастало по мере увеличения его тяжести (рис. 3). ОПП прогнозировало госпитальную смерть с чувствительностью 63% и специфичностью 69% (AUC=0,66; р<0,001), ХБП — с чувствительностью 17% и специфичностью 91% (AUC=0,54; p=0,03).
Для изучения связи острой дисфункции почек с госпитальной летальностью в сравнении с известными маркерами неблагоприятного прогноза, оценка которых при ТЭЛА обязательна [27], выполнен многофакторный регрессионный анализ Кокса. Он продемонстрировал, что ОПП по базальному креатинину является предиктором смерти в стационаре (отношение шансов (ОШ) 3,66 (95% доверительный интервал (ДИ): 2,37-5,66; р<0,0001), независимо от наличия повышенного уровня тропонина (ОШ 1,31; 95% ДИ: 0,80-2,14; р=0,28) и дисфункции правого желудочка (ОШ 1,23; 95% ДИ: 0,74-2,04; р=0,42) (табл. 3).
Таблица 1
Анамнестическая и клиническая характеристика пациентов с ТЭЛА в зависимости от наличия ОПП по базальному креатинину

Сокращения: ОПП — острое повреждение почек, ТГВ — тромбоз глубоких вен, ТЭЛА — тромбоэмболия легочной артерии.
Таблица 2
Результаты объективного осмотра, данные, полученные в ходе лабораторных и инструментальных методов исследования, оценка риска смерти у пациентов с ТЭЛА в зависимости от наличия ОПП по базальному креатинину

Сокращения: ДАД — диастолическое артериальное давление, ЛА — легечная артерия, ОПП — острое повреждение почек, ПЖ — правый желудочек, ПП — правое предсердие, САД — систолическое артериальное давление, УЗДГ — ультразвуковая допплерография, ФВ ЛЖ — фракция выброса левого желудочка, ЧД — частота дыхания, ЧСС — частота сердечных сокращений, PESI — индекс тяжести тромбоэмболии легочной артерии, sPESI — упрощенный индекс тяжести тромбоэмболии легочной артерии.
Таблица 3
Оценка предикторов летальности у пациентов с ТЭЛА с помощью многофакторного регрессионного анализа Кокса

Примечание: Хи-квадрат модели 33,74, р<0,0001.
Сокращения: В — регрессионный коэффициент, SE — стандартная ошибка, ДИ — доверительный интервал.
Для оценки возможностей ОПП в реклассификации существующей системы стратификации риска неблагоприятного исхода обследуемых разделили на 6 групп: в первую группу вошли пациенты со sPESI 0 баллов без ОПП; во вторую — со sPESI 0 баллов и с развившимся ОПП; в третью — со sPESI ?1 балла без острого ухудшения функции почек; в четвертую — со sPESI ?1 балла и ОПП; соответственно, в пятую и шестую вошли пациенты высокого риска без и с наличием указанного осложнения. Последующий анализ продемонстрировал, что наличие ОПП вело к 2-3-х кратному увеличению летальности, причем в случае низкого риска это влияние носило характер тенденции, а при промежуточном и высоком риске — было достоверным (рис. 4).

Рис. 1. Частота (А) и тяжесть (Б) ОПП по базальному креатинину у пациентов с ТЭЛА.
Сокращения: ОПП — острое повреждение почек, ТЭЛА — тромбоэмболия легочной артерии.

Рис. 2. Частота ОПП по базальному креатинину у пациентов с ТЭЛА высокого, промежуточного и низкого риска ранней смерти.
Примечание: KW — сравнение трех групп с использованием метода Краскела-Уоллиса.
Сокращения: ОПП — острое повреждение почек, ТЭЛА — тромбоэмболия легочной артерии.

Рис. 3. Летальность у пациентов с ТЭЛА в зависимости от тяжести ОПП по базальному креатинину.
Примечание: KW — сравнение трех групп с использованием метода Краскела-Уоллиса.

Рис. 4. Летальность пациентов с ТЭЛА в группах низкого, промежуточного и высокого риска неблагоприятного исхода в зависимости от наличия ОПП по базальному креатинину.
Сокращения: ОПП — острое повреждение почек, ТЭЛА — тромбоэмболия легочной артерии, sPESI — упрощенный индекс тяжести тромбоэмболии легочной артерии.
Обсуждение
На данный момент опубликовано ~20 работ, в которых изучалось нарушение функции почек и его влияние на прогноз при ТЭЛА [28, 29]. Чаще всего авторы анализировали ПД [28][29], что объясняется простотой оценки и возможностью применения в ситуации, когда дефицит данных не позволяет дифференцировать ОПП и ХБП [18][30]. По итогу одного из самых крупных на сегодняшний момент обзоров литературы частота ПД при ТЭЛА варьирует от 12 до 72% [18]. В регистре СИРЕНА СКФ <60 мл/ мин/1,73 м2 выявлялась у каждого второго пациента российской популяции.
Частота ОПП при ТЭЛА изучена гораздо меньше и колеблется от 4,9 до 34%, что обусловлено применением разных диагностических подходов и отличиями анализируемых групп [16][30-34]. В ретроспективном популяционном когортном исследовании, выполненном на основе Тайваньской Национальной базы данных медицинского страхования и включавшем >7 тыс. пациентов, частота осложнения, оцениваемого по наличию кода МКБ-9 — N17 (острая почечная недостаточность), составила — 4,9% [31]. В проспективном исследовании, проведенном в клинике Страсбургского университета (~700 обследуемых), частота ОПП, диагностированного как повышение уровня сКр на 25% от исходного, составила — 18,8% [32]. Только в двух работах для верификации ОПП применялись современные критерии, изложенные в рекомендациях KDIGO (2012г): в первой из них — регистре RIETTE частота осложнения составила 29,5%, при этом оценивался креатинин при поступлении относительно его базального (расчетного) значения [16]; во второй — исследовании Филимоновой В.В. и др. (2021) острая дисфункция почек выявлена у 34% пациентов путем изучения сКр в динамике во время госпитализации [34].
До настоящего момента в мире существовал только один Западноевропейский многоцентровый регистр ТЭЛА — RIETTE, по итогам которого анализировалось ОПП, диагностированное на основании критериев KDIGO (2012г) [16]. В связи с завершением эпидемиологического исследования СИРЕНА удалось оценить частоту ОПП у пациентов российской популяции, которая оказалась несколько больше (37% vs 29,5%), что обусловлено разными критериями включения и исключения.
Таким образом, при ТЭЛА отмечается высокая частота ОПП, сопоставимая с показателями, характерными для ОНМК (14-33%) [14][35][36], острого коронарного синдрома (10-37%) [5][6][13][37] и декомпенсированной хронической СН (18-70%) [6][38][39]. Сердечно-сосудистые заболевания не относятся к состояниям, при которых ОПП имеет наибольшую инцидентность [40], но учитывая общее число госпитализаций, связанных с ургентной кардиоваскулярной патологией, очевидным выглядит предположение о их лидирующей роли в формировании пула пациентов, перенесших ОПП, что подчеркивает актуальность проблемы в кардиологии.
Развитие острой дисфункции почек при ТЭЛА обусловлено различными механизмами. Внезапное увеличение давления в малом круге кровообращения может вести к острой перегрузке правого желудочка, развитию трикуспидальной регургитации и повышению центрального венозного давления, что, в свою очередь, ведет к почечной гиперемии, увеличению интерстициального давления и отеку интерстиция почек [41]. Нарушение гемодинамики может вызывать развитие гипоксемии, снижение выброса левого желудочка и формирование персистирующей гипотензии или обструктивного шока, сопровождающихся макро- и микроциркуляторной гипоперфузией почек [20-22][42]. Среди других механизмов в развитии ОПП при ТЭЛА предполагается участие повышенной нейрогуморальной активации, внутривенного введения рентгеноконтрастных средств (РКС), кровотечений, онкологических заболеваний и недавних операций [43].
Учитывая, что основным методом диагностики ТЭЛА в настоящее время служит компьютерная томографическая легочная ангиография, сопровождающаяся внутривенным введением РКС, ряд исследователей относит все случаи ОПП к его контраст-индуцированному варианту (КИ-ОПП) с частотой 13% [33][44]. Однако такой подход противоречит рекомендациям KDIGO, Научного общества нефрологов России и Европейской ассоциации почек, которые требуют исключать все другие причины развития осложнения до постановки диагноза [26][45][46]. Роль РКС в развитии ОПП скорее преувеличена, а значение иных факторов — недооценено, о чем свидетельствуют результаты самого крупного на сегодняшний день метаанализа (>145 тыс. пациентов), по итогам которого установлено, что частота контраст-индуцированной нефропатии не зависела от внутривенного введения контраста при проведении компьютерной томографии [47]. Аналогичные данные получены Elias А, et al. (2021) при изучении 4565 пациентов с подозрением на ТЭЛА: частота ОПП при вентиляционно-перфузионной сцинтиграфии легких не отличалась от таковой при использовании томографической легочной ангиографии [48].
Учитывая разнообразие мнений о значении контраста в развитии ОПП, в 2020г Американским колледжем радиологии и Национальным фондом почек было выпущено совместное Положение по использованию РКС, вводимых внутривенно [49]. Предложено отказаться от традиционного термина контраст-индуцированной нефропатии и вместо него использовать другие определения: контраст-ассоциированное или постконтрастное ОПП, поскольку контраст чаще сопутствует осложнению, а не является его причиной [49]. Термин КИ-ОПП должен применяться в ситуации, когда альтернативные причины, кроме РКС, уже исключены [49]. Эксперты предполагают, что риск развития истинного КИ-ОПП меньше, чем считалось ранее и не превышает 2% при исходной СКФ >30 мл/мин/1,73 м2 [49].
В настоящее время установлено, что ПД при ТЭЛА ассоциирована с увеличением смертности, что подтверждено почти в 2-х десятках исследований и 3-х метаанализах [18][28][29]. Связь же нарушенной функции почек с летальностью носит противоречивый характер: в части работ она была обнаружена [30, 50], в других, в т.ч. в крупных многоцентровых исследованиях — нет [32][51]. Воздействие ОПП на неблагоприятные исходы при ТЭЛА изучено в меньшей степени. На данный момент только в 2 одноцентровых [33, 34] и 2 многоцентровых работах [16, 31] обнаружена связь острой дисфункции почек с увеличением госпитальной летальности и/или 30-дневной смертности. Что касается долгосрочного прогноза, то в единственном ретроспективном популяционном исследовании показано отсутствие связи ОПП с 3-х летней выживаемостью [31].
У пациентов с ЛЭ дисфункция почек может быть обусловлена предшествующей ХБП, ОПП de novo или ОПП на ХБП. До конца остается неясным, что оказывает большее неблагоприятное воздействие на прогноз при ТЭЛА: ОПП или ХБП. Выяснение этого факта осложнено тем, что эти состояния являются частями почечного континуума [52]: ХБП — ведущий фактор риска развития ОПП [40], ОПП, в свою очередь, увеличивает вероятность развития прогрессирования ХБП [10]. Кроме того, в рамках кардиоренальных взаимоотношений ХБП повышает риск развития ТЭЛА [17][53], а ОПП связано с ростом частоты повторных эпизодов ЛЭ [54]. По итогам метаанализа Xing X, et al. (2020), основанного на изучении 17 публикаций, ОПП было ассоциировано с 2-х кратным увеличением долгосрочной смертности после ТЭЛА, при этом связи ХБП с неблагоприятным исходом не установлено [29]. Близкие данные получены в метаанализе, выполненном Wang D, et al. (2020) (13 исследований, 35662 пациента), где обнаружено, что госпитальная летальность/30 дневная смертность оказались наибольшими при наличии острой дисфункции почек и тяжелой ПД (СКФ <30 мл/мин/1,73 м2), роль же СКФ <60 мл/мин/1,73 м2 была в 1,5-2 раза менее значима [28]. По итогам регистра СИРЕНА установлено, что ОПП прогнозировало смерть в стационаре у пациентов с ТЭЛА российской популяции, однако возможности ХБП, имевшей место в анамнезе у 10% обследованных — оказались хуже.
В настоящее время предполагается, что ОПП реализует свое отрицательное влияние на прогноз через повреждение других органов, развитие/прогрессирование СН, ускорение сердечно-сосудистого континуума за счет активации нейрогормональных, иммунологических и воспалительных патологических механизмов [21][55-57].
Согласно полученных нами данных частота ОПП растет по мере увеличения тяжести ЛЭ, при этом наличие осложнения реклассифицирует пациента в более высокую категорию риска смерти. Эти результаты демонстрируют важное значение ОПП как маркера тяжести состояния/летального исхода ТЭЛА, между тем, в действующих клинических рекомендациях состояние функции почек не учитывается в оценке риска ранней смерти [27], что указывает на необходимость пересмотра имеющегося подхода.
Представленное нами исследование имело определенные ограничения, поскольку было спланировано и выполнено на основе и после завершения регистра СИРЕНА. Среди них — отсутствие данных об уровне сКр у 8% обследованных, что привело к их исключению из анализа. У остальных пациентов в электронной базе присутствовало только одно значение параметра, что вынудило нас использовать в качестве исходного базальный креатинин, рассчитанный по формуле MDRD, исходя из СКФ 75 мл/мин/1,73 м2. Такой подход допускается клиническими рекомендациями KDIGO (2012г), но повышает вероятность ошибки при идентификации ОПП, затрудняет дифференциальную диагностику с ХБП, уменьшает точность стратификации тяжести и усложняет верификацию вариантов осложнения. К недостаткам, кроме того, следует отнести небольшую частоту зарегистрированной ХБП — всего 10%, которая наблюдалась, несмотря на пожилой средний возраст обследованных, где ее частота обычно превышает 30% [58]. На вероятную недооценку этого состояния указывает и высокая распространенность сопутствующих заболеваний, ассоциированных с развитием ХБП: артериальная гипертензия выявлялась у 2/3; сахарный диабет, сердечно-сосудистые заболевания у 1/3; ХСН, фибрилляция предсердий у 1/4 обследованных. Кроме того, 8% пациентов включались в регистр после смерти с диагнозом, установленным на патологоанатомическом исследовании, что увеличило число умерших и могло привести к переоценке связи ОПП с летальностью.
Заключение
37% пациентов с ТЭЛА российской популяции имеют ОПП, диагностированное по базальному креатинину. У 2/3 обследованных наблюдается 1 стадия ОПП. Частота ОПП растет по мере увеличения тяжести ТЭЛА. Наличие ОПП реклассифицирует пациентов в более высокую категорию риска смерти и связано со значительным увеличением госпитальной летальности.
Участники регистра: Биробиджан. Жукова Н.; Казань. Маянская С., Гильманов А., Ахундов Р., Сафина Э., Руднева Т., Салахутдинова Л., Ризатдинова Ф.; Кемерово. Барбараш О., Херасков В., Шмидт Е., Клименкова А., Неешпапа А.; Москва. Мерай И., Бабаева Л., Тетерина М., Романенко К., Арютина О., Бернс С., Эрлих А., Игнатенко О., Каллагов Д., Кузуб А., Клименко А., Стрельникова Ю., Веселов Г., Пичугина Т., Куренков Д., Кулаков В., Пиксина Г., Андреев Д., Батурина О., Чашкина М.; Нижний Новгород. Ботова С., Починка И., Юркова К., Королёва Л., Ковалёва Г., Злобина Д.; Пермь. Лапин О., Сыромятникова Л., Духанина Е., Панькова Е., Шкуратова И., Жуйкова Т., Качина И., Алиева Э.; Самара. Дупляков Д., Антимонова М., Муллова И., Черепанова Н., Лёксина А.; Санкт-Петербург. Черкашин М., Рыков И., Наперов Е.; Сочи. Зыков М., Бедикян А., Круберг Л., Селиванова Н., Мартиросян Е.; Рязань. Никулина Н., Тереховская Ю.; Тверь. Алексеев Д., Разыграев Р., Голубева М., Полевова И.; Томск. Рябов В., Васильцева О., Сыркина А., Лебедева М.; Улан-Удэ. Донирова О., Дониров Б., Булутова Н.; Ульяновск. Мензоров М., Филимонова В.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Мензоров М.В., Филимонова В.В., Эрлих А.Д., Барбараш О.Л., Бернс С.А., Шмидт Е.А., Дупляков Д.В. Частота и прогностическое значение острого повреждение почек при тромбоэмболии лёгочной артерии по данным регистра СИРЕНА. Российский кардиологический журнал. 2022;27(1S):4864. https://doi.org/10.15829/1560-4071-2022-4864
Скопировать