Биомаркеры ST2 и интерлейкин 33 в оценке кардиального воспаления, фиброза и прогноза пациентов с хронической сердечной недостаточностью
Хроническая сердечная недостаточность (ХСН) — это патология, которая охватывает >37,7 млн человек в мире [1]. Кроме повсеместной широкой распространённости, ХСН можно охарактеризовать как патологию, связанную с большими экономическими потерями из-за инвалидизирующего характера заболевания, высокой смертности пациентов, а также частой потребности в их госпитализации [2][3].
Несмотря на внедрение в практику новых лекарственных препаратов, доказавших свою эффективность в лечении пациентов с ХСН, таких как бета-адреноблокаторы (ББ), ингибиторы ангиотензинпревращающего фермента, продолжительность жизни больных растет медленными темпами. Так, в период с 2000 по 2012гг в Великобритании абсолютная 5-летняя выживаемость при ХСН увеличилась всего на 7,2% [4].
Достигнутые успехи в терапии ХСН стали возможными, в т.ч. благодаря накоплению знаний о патофизиологических процессах, лежащих в её основе. Широкое распространение получила нейрогормональная теория, объяснившая преимущественно течение ХСН со сниженной фракцией выброса (ФВ) левого желудочка. Однако недостаточный эффект нейрогормональных блокаторов для лечения пациентов с ХСН с сохранённой ФВ (ХСНсФВ), которая преобладает в общей структуре ХСН, указывает на существенную роль других патологических процессов в развитии данной формы заболевания [5]. Ожидаемая доля пациентов с ХСНсФВ на данный момент составляет 65% [6].
Помимо классической нейрогормональной теории патогенеза ХСН, была выдвинута теория хронического субклинического воспаления [7]. Было установлено, что повышенные уровни провоспалительных цитокинов являются предикторами неблагоприятного течения ХСН вне зависимости от степени сохранности ФВ [8][9]. Но и этот подход не позволяет исчерпывающе охарактеризовать процессы, лежащие в основе формирования ХСНсФВ. В последние годы активно изучается роль кардиального фиброза в развитии данной формы ХСН.
Кардиальный фиброз характеризуется интерстициальным накоплением белков фиброзного внеклеточного матрикса, включая коллагены, что приводит к изменению механических свойств сердечной ткани [10]. Исходом этого процесса является формирование диастолической и систолической дисфункций, которые в конечном итоге приводят к возникновению ХСН.
Перспективными биомаркерами для оценки указанных патологических процессов в сердечной мышце являются интерлейкин (ИЛ)-33 и стимулирующий фактора роста, экспрессируемый геном 2 (ST2).
Цель данного обзора — рассмотреть роль ИЛ-33, ST2 и их взаимодействия как биомаркеров кардиального воспаления и фиброза при ХСН.
Методология поиска источников
Поиск источников литературы проводился в базах данных PubMed, MedLine, Google Scholar, Science Direct, РИНЦ. Охват поиска включал статьи, опубликованные с 1989г по 2021г. Рассматривались англоязычные и русскоязычные источники. Поиск проводился по следующим ключевым словам: “сердечная недостаточность”, “биомаркеры”, “ST2”, “ИЛ-33”, “heart failure”, “biomarkers”, “IL-33” и их парным комбинациям.
Интерлейкин 33 и его функциональные свойства
В настоящее время активно изучается роль ИЛ33 и ST2 в патогенезе ряда хронических заболеваний, в т.ч. ХСН. ИЛ-33 был впервые описан в 1999г как белок DVS27, сверхэкспрессируемый при вазоспазме, вызванном субарахноидальным кровоизлиянием на модели собак [11]. В этом исследовании было выдвинуто предположение, что ген DVS27 кодирует ядерный белок, который может быть связан с воспалением. Позже, в 2003г, этот белок был охарактеризован на молекулярном уровне как ядерный фактор, экспрессируемый клетками эндотелия одного из типов венул [12]. Эндотелиальные клетки оказались способными к аномальной активации лимфоцитов, способствуя тем самым усилению и поддержанию хронического воспаления.
Schmitz J, et al. (2005) идентифицировали ИЛ33 у человека и мыши, определили его принадлежность семейству ИЛ-1 и изучили его свойства [13]. Было установлено, что ИЛ-33, подобно другим членам данного семейства, продуцируется в форме предшественника и может расщепляться каспазами. Очищенный ИЛ-33 in vitro или in vivo стимулировал выработку Th2-ассоциированных цитокинов (ИЛ-4, ИЛ-5 и ИЛ-13). Существенная экспрессия матричной рибонуклеиновой кислоты (мРНК) ИЛ-33 была зафиксирована в гладкомышечных клетках, фибробластах и эпителиальных клетках бронхов и бронхиол. В этой же работе было установлено сродство к ИЛ-33 рецептора ИЛ-1 — ST2, ранее считавшегося орфанным (прим. авт.: орфанный рецептор — рецептор, лиганд которого ещё не найден).
ИЛ-33 существует в двух формах: полноразмерный белок (flIL-33) и зрелый (mIL-33). Полноразмерная форма осуществляет регуляцию синтеза РНК в ядре клетки, зрелая форма служит внеклеточным цитокином после высвобождения в ответ на воспаление или некроз. ИЛ-33 пассивно высвобождается из поврежденных клеток в качестве тканевого барьерного компонента в ответ на воспалительные стимулы или повреждение клеток. Обе формы способны связываться и передавать сигналы через свой рецептор ST2. При этом mIL-33 имеет сродство к рецептору и биоактивность в 10 раз выше, чем flIL-33 [14].
Воспалительная микросреда может усугублять связанные с заболеванием функции ИЛ-33 за счет образования его высокоактивных зрелых форм. Было показано, что нейтрофильные сериновые протеазы, такие как катепсин G и эластаза, которые секретируются во время воспаления, регулируют активность ИЛ-33, расщепляя flIL-33 до биологически высокоактивных зрелых форм in vivo [15]. Регулирование биоактивности ИЛ-33 с помощью сериновых про теаз нейтрофилов может быть особенно важным при стерильном нейтрофильном воспалении, которое, как считается, вносит вклад в патогенез ряда острых и хронических заболеваний. В этой же работе было установлено, что расщепление каспазой-1 приводит к инактивации ИЛ-33, а не к активации, как было принято считать ранее.
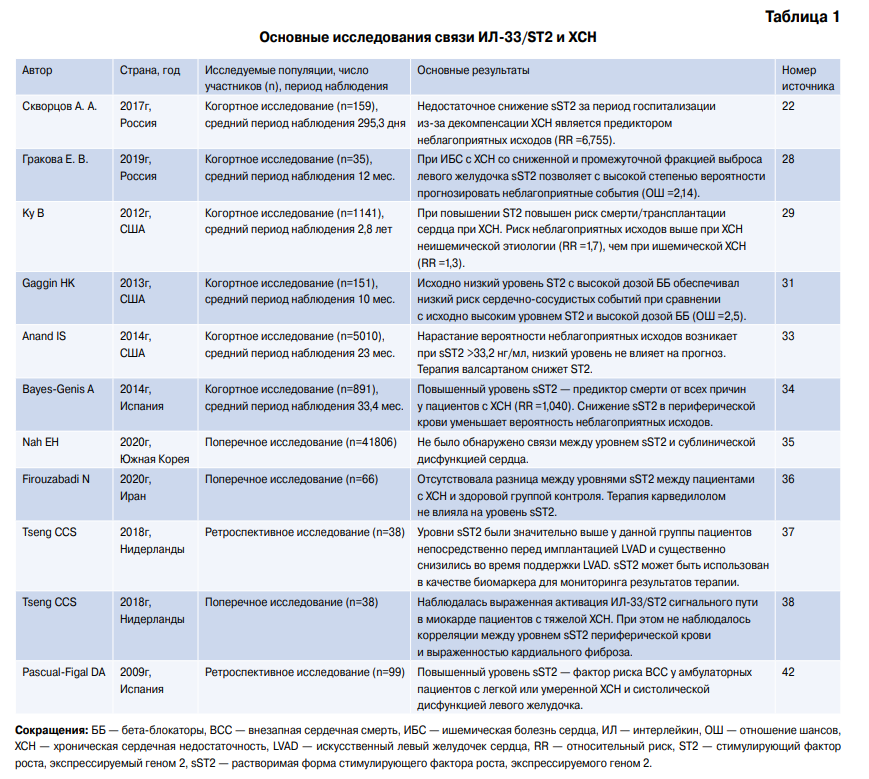
Таблица 1
Основные исследования связи ИЛ-33/ST2 и ХСН

Сокращения: ББ — бета-блокаторы, ВСС — внезапная сердечная смерть, ИБС — ишемическая болезнь сердца, ИЛ — интерлейкин, ОШ — отношение шансов, ХСН — хроническая сердечная недостаточность, LVAD — искусственный левый желудочек сердца, RR — относительный риск, ST2 — стимулирующий фактор роста, экспрессируемый геном 2, sST2 — растворимая форма стимулирующего фактора роста, экспрессируемого геном 2.
ST2 и его функциональные свойства
Рецептор ST2 был выделен на 10 лет раньше, чем его лиганд — ИЛ-33 [16]. Tominaga S (1989) сообщил о клоне комплементарной ДНК, который кодирует белок, очень сходный по последовательности с членами суперсемейства иммуноглобулинов. ST2 преимущественно экспрессируется иммунными клетками, участвующими во врожденном иммунитете, включая тучные клетки, врожденные лимфоидные клетки 2 типа (ILC2), макрофаги, дендритные клетки, эозинофилы, базофилы, естественные клетки-киллеры (NKклетки). Кроме того, ST2 экспрессируется клетками, участвующими в адаптивном иммунитете, такими как CD4+, CD8+ и Т-регуляторные клетки [17].
ST2 в своей трансмембранной форме экспрессируется главным образом на тучных клетках и клетках Th2 и связан с их важными функциями. Кроме трансмембранной формы, посредством альтернативного процессинга происходит формирование растворимой формы.
У человека существует четыре изоформы ST2, две из которых можно назвать основными: трансмембранная — ST2L и растворимая — sST2. Все четыре изоформы образуются из одного транскрипта, для каждой из которых существует уникальный промоутер, определяющий результат транскрипции. ИЛ-33 передает сигналы и запускает реакции через рецептор ST2L. Растворимая изоформа sST2 действует как рецептор-ловушка для свободного ИЛ-33, предотвращая передачу сигналов ST2/ИЛ-33 [18].
Связь ИЛ-33/ST2
Особенности взаимодействия ИЛ-33 и ST2 изучали Sanada S, et al. (2007). Ими было установлено, что ИЛ-33 представляет собой белок, индуцируемый биомеханическими триггерами и синтезируемый преимущественно сердечными фибробластами. Он является антагонистом ангиотензина II и фенилэфрина, что делает его способным подавлять гипертрофию миокарда. Авторы эксперимента создавали у мышей перегрузку миокарда давлением, при этом у части животных была заблокирована передача сигнала ИЛ-33/ST2. В этой группе наблюдали более выраженную гипертрофию и дилатацию левого желудочка, более выраженный фиброз и снижение выживаемости по сравнению с контрольной группой. По-видимому, взаимодействие ИЛ-33/ST2 активно на фоне перегрузки давлением. Кроме того, лечение рекомбинантным ИЛ-33 уменьшало гипертрофию и фиброз и улучшало выживаемость в контрольной группе, но не у особей с заблокированной передачей сигнала ИЛ-33/ST2. Это позволило отнести взаимодействие ИЛ-33/ST2 к механически активируемой кардиопротекторной паракринной системе [19]. В этом же исследовании было определено, что введение sST2 дозозависимо снижало антигипертрофический эффект ИЛ-33, что позволило рассматривать его как рецептор-ловушку.
В ряде клинических исследований была показана связь повышенного уровня sST2 и заболеваний, характеризующихся фиброзом [20][21]. Оба типа клеток — кардиомиоциты и фибробласты — ответственны за синтез ИЛ-33 и sST2, а уровни их экспрессии увеличиваются в ответ на миокардиальный стресс. Эта подтверждается тем, что неоднократно фиксировались высокие концентрации sST2 у пациентов с инфарктом миокарда и острой сердечной недостаточностью, коррелировавшие с параметрами величины инфаркта, сердечной дисфункции, гемодинамических и нейрогормональных нарушений [22][23]. В связи с этим имеются основания считать, что sST2 является биомаркером неблагоприятного исхода у пациентов с сердечно-сосудистыми заболеваниями [24].
Имеющиеся данные о взаимодействии ИЛ-33/ ST2 показали, что оно вовлечено во множество биологических процессов, таких как развитие и регуляция иммунного ответа, восстановление нормального гомеостаза тканей путем поддержания процесса заживления ран [25]. Однако сигнальный путь ИЛ-33/ ST2 может также приводить к потере баланса между процессами системного воспаления и регенерации тканей. В конечном итоге это приводит к ремоделированию, что является признаком фиброза.
Кроме данных об антифибротических и антигипертрофических эффектах, были получены сведения о влиянии ИЛ-33 на снижение апоптоза кардиомиоцитов [26]. ИЛ-33 дозозависимо снижал долю погибших вследствие гипоксии кардиомиоцитов. Его защитные свойства нейтрализовались при добавлении sST2, при этом сам sST2 не индуцировал апоптоз независимо от его выраженности, что подтверждало гипотезу о рецепторе-ловушке. Дополнительное антиапоптотическое свойство ИЛ-33 заключается в снижении уровня каспазы-3, активация которой играет одну из ключевых ролей в процессе апоптоза, и активации антиапоптотических факторов, таких как нуклеарный фактор ?B (NF-?B).
Более подробно процесс воздействия ИЛ-33 на фибробласты рассмотрели в своём эксперименте Zhu J и Carver W (2012) [27]. Они изолировали сердечные фибробласты крыс, которые затем инкубировали с различными концентрациями ИЛ-33, основываясь на ранее опубликованных сведениях. В течение 24 ч было зафиксировано значительное снижение миграционной способности сердечных фибробластов крыс после использования более высоких концентраций ИЛ-33. При этом ИЛ-33 не повлиял на экспрессию большинства интерстициальных коллагенов (I и III типа) при воздействии на изолированные сердечные фибробласты крыс.
Связь ИЛ-33/ST2 и ХСН
Имеются сведения о том, что повышенные уровни sST2 ассоциируются с неблагоприятными исходами при ряде сердечно-сосудистых заболеваний, в т.ч. и при ХСН [28]. Прогностическое значение растворимой формы ST2 было изучено Ky B, et al. (2012) [29], обследовавшими когорту из 1141 пациента с ХСН различной этиологии. Уровень ST2 определялся однократно. Было установлено, у пациентов с повышенным уровнем ST2 ХСН протекала более тяжело, и был также увеличен риск смерти или трансплантации сердца. Риск неблагоприятных исходов, связанный с повышением уровня ST2, оказался более выраженным у пациентов с неишемической этиологией ХСН (скорректированный относительный риск =1,7; 95% доверительный интервал 1,4-2,0; p<0,0001) по сравнению с пациентами с ишемическими причинами ХСН (скорректированный относительный риск =1,3; 95% доверительный интервал 1,0-1,6; p=0,024). Кроме того, совместное применение ST2 с N-терминальным предшественником натрийуретического пептида в модели было более эффективным инструментом для определения прогноза, чем использование данных биомаркеров в отдельности.
Так как повышение sST2 указывает на процессы ремоделирования миокарда, то возникает вопрос, изменяется ли этот параметр при применении антиремоделирующей терапии у пациентов с ХСН, а именно ББ, ингибиторов ангиотензинпревращающего фермента и антагонистов минералокортикоидных рецепторов (АМКР). Имеются данные, что увеличение дозы ББ напрямую связано с последующим снижением sST2 и изменением индексов ремоделирования желудочков [30]. Предпринимались попытки более подробной оценки зависимости уровней sST2 от дозировки ББ и их влияния на прогноз. В исследовании Gaggin HK, et al. (2013) оценивали исходные значения sST2 и конечную достигнутую дозировку ББ. Средняя частота сердечно-сосудистых событий была самой низкой для пациентов с низкими исходными значениями sST2, которые получали высокие дозы ББ. Промежуточный результат был получен у пациентов с низкими значениями sST2, у которых титрование ББ не было доведено до высоких доз, и пациентов с повышенными значениями sST2, получавших высокие дозы ББ. Самая высокая частота сердечно сосудистых событий наблюдалась у участников исследования с высокими исходными концентрациями sST2, получающих низкие дозы ББ. Возраст, пол, скорость клубочковой фильтрации и уровни N-терминального предшественника натрийуретического пептида не влияли на результаты определения прогноза [31]. Фактически, пациенты с самым высоким риском последующих сердечнососудистых событий были идентифицированы по повышенному исходному значению sST2, но максимальный контроль риска не был полностью реализован у тех, кто не получал достаточный дозы ББ. В этом же исследовании не было обнаружено взаимосвязи между терапией АМКР и значениями sST2. Однако в более ранних исследованиях было доказано снижение степени фиброза и улучшение сердечной функции, а следовательно, благоприятное влияние на прогноз при применении АМКР [32].
Anand IS, et al. (2014) изучали прогностическое значение изменений уровня sST2 под действием терапии валсартаном. Было получено, что выраженное нарастание вероятности неблагоприятных исходов начиналось с уровня sST2, превышающего 33,2 нг/мл. Исходные значения sST2 были выше у мужчин, чем у женщин, но при этом взаимосвязь между уровнем sST2 и исходами для пациентов обоих полов была одинакова. Отмечено, что в группе валсартана по сравнению с группой плацебо были более низкие значения sST2. Важным результатом исследования также является то, что повышение уровня указанного биомаркера в крови приводило к увеличению вероятности сердечно сосудистых событий, тогда как его снижение не влияло на прогноз [33].
Однако имеются наблюдения и об обратных эффектах, в которых снижение sST2 в периферической крови указывало на снижение вероятности неблагоприятных исходов, что свидетельствует о недостаточной изученности данной проблемы [34].
Неэффективность использования ST2 для определения субклинической дисфункции сердца у здоровых пациентов с нормальными результатами эхокардиографии была определена в исследовании Nah EH, et al. [35]. Авторы объясняют это вариабельностью причин незначительного повышения ST2 в организме, следовательно, анализ уровня рассматриваемого биомаркера у здорового человека крайне затруднителен. Подобные результаты были получены при исследовании небольшой группы пациентов с ранними формами ХСН (n=44) и отсутствием анамнеза декомпенсаций состояния [36]. Кроме того, все пациенты с ХСН были разделены на тех, кто получал ББ (карведилол), и тех, кто не получал ББ из-за наличий противопоказаний (n=19). По результатам исследования не было выявлено связи между кардиопротективным эффектом карведилола и уровнями ИЛ-33 и sST2 в сыворотке.
Tseng CCS, et al. (2016) оценили уровни sST2 у пациентов в терминальной стадии ХСН, а затем повторили исследование после имплантации искусственного левого желудочка сердца (LVAD). Уровни sST2 были значительно выше у данной группы пациентов непосредственно перед имплантацией LVAD (медиана 74,2 нг/мл) и существенно снизились во время поддержки LVAD до 29,5 нг/мл (p<0,001). Большинство пациентов достигло нормализации уровня sST2 спустя 3 мес. после имплантации LVAD. Исходный уровень sST2 не коррелировал ни с одним из протестированных клинических факторов (пол, этиология и продолжительность ХСН, функция правого желудочка и почек), что, по всей видимости, может быть объяснено степенью фиброза миокарда. Авторы сделали вывод о возможности использования sST2 в качестве биомаркера для мониторинга результатов терапии [37].
В более позднем исследовании Tseng CCS, et al. (2018) поставили задачу определить взаимосвязимежду фиброзом и передачей сигналов ИЛ-33/ST2 у пациентов с терминальной сердечной недостаточностью непосредственно перед имплантацией LVAD. Это было необходимо для прогнозирования обратного ремоделирования миокарда и в конечном итоге выявления пациентов, у которых может произойти восстановление сердечной функции после имплантации LVAD. Уровень мРНК sST2 сильно и положительно коррелировал с гистологической выраженностью фиброза (r=0,43, p=0,001) и уровнем мРНК трансформирующего ростового фактора бета-1 миокарда (r=0,54, p=0,001) — профибротической сигнальной молекулой. Сильные корреляции были также обнаружены между уровнями мРНК миокардиального ИЛ-33 и степенью фиброза (r=0,46, p=0,007) и профиброзными сигнальными белками фактора роста соединительной ткани и трансформирующего ростового фактора бета-1 (r=0,81, p<0,001 и r=0,84, p<0,001, соответственно). Однако значимой корреляции между степенью сердечного фиброза и уровнями sST2 в плазме при этом обнаружено не было (r=-0,19, p=0,264) [38]. Полученные в данном исследовании результаты могут трактоваться двояко. Во-первых, отсутствие связи фиброза с растворимым
ST2 в плазме свидетельствует о том, что уровни циркуляции в большей степени связаны с иными факторами, но не фиброзом сердца. Другое объяснение того, что sST2 в плазме и фиброз не коррелировали, может заключаться в том, что общий плохой статус пациентов с терминальной стадией ХСН является основным определяющим фактором уровней sST2. Возможно, у пациентов с менее тяжелой сердечной недостаточностью и без сопутствующих заболеваний, влияющих на ST2, уровни sST2 в плазме могут больше соответствовать степени сердечного фиброза.
Взаимосвязь уровней sST2 и вероятности внезапной сердечной смерти при ХСН
Предпринималась попытка определить, может ли sST2 применяться для идентификации пациентов с риском внезапной сердечной смерти (ВСС). На данный момент для этих целей принято опираться на ФВ левого желудочка, продолжительность комплекса QRS на электрокардиограмме и наличие неустойчивой желудочковой тахикардии [39]. Тем не менее механизм ВСС остаётся неясным, и необходимы дополнительные диагностические тесты для замены или дополнения существующих в настоящее время инструментов для лучшего прогнозирования этого осложнения у пациентов с ХСН. Ранее было обнаружено, что концентрация sST2 позволяет прогнозировать уровень смертности при остром коронарном синдроме [40], а также при долгосрочном наблюдении за пациентами после приступа острой сердечной недостаточности [41].
Результаты исследования Pascual-Figal DA, et al. (2009) показали, что повышенный сывороточный уровень sST2 был прогностическим фактором ВСС у амбулаторных пациентов с легкой или умеренной ХСН и систолической дисфункцией левого желудочка. Прогностическая ценность sST2 не зависела от других клинических переменных и, что важно, предоставляла дополнительную информацию при наличии данных об уровне N-терминального предшественника натрийуретического пептида. Независимыми предикторами летального исхода выступали также диаметр левого предсердия и скорость клубочковой фильтрации [42].
Заключение
К настоящему моменту имеющиеся данные указывают на то, что взаимодействие ИЛ-33/ST2 в определенной степени связано с кардиальным фиброзом и хроническим субклиническим воспалением. sST2 можно рассматривать в качестве прогностического биомаркера у пациентов с ХСН II-III функционального класса и использовать для контроля эффективности антиремоделирующей терапии, в т.ч. инвазивного лечения у пациентов с тяжёлой ХСН. Для групп риска среди здорового населения и пациентов с начальными и терминальными формами ХСН результаты исследований прогностического значения sST2 неоднозначны, что диктует необходимость проведения дополнительных исследований и определения границ эффективного использования указанных биомаркеров.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Драпкина О.М., Концевая А.В., Кравченко А.Я., Будневский А.В., Токмачев Р.Е., Черник Т.А. Биомаркеры ST2 и интерлейкин 33 в оценке кардиального воспаления, фиброза и прогноза пациентов с хронической сердечной недостаточностью. Российский кардиологический журнал. 2021;26(3S):4530. https://doi.org/10.15829/1560-4071-2021-4530
Скопировать