Ассоциация дефицита железа с развитием рецидивов фибрилляции предсердий после фармакологической кардиоверсии
Аннотация
Цель. Оценить ассоциацию дефицита железа (ДЖ) с развитием рецидивов фибрилляции предсердий (ФП) в течение 12 мес. у пациентов после фарма-кологической кардиоверсии амиодароном.
Материал и методы. В открытое проспективное одноцентровое исследование было включено 198 пациентов с неклапанной пароксизмальной ФП после успешной фармакологической кардиоверсии амиодароном. В 1 группу вошли 116 пациентов с ДЖ, во 2 группу — 82 пациента с нормальным статусом железа. Первичной конечной точкой исследования было развитие симптомных рецидивов ФП в течение 12 мес. после кардиоверсии, которую оценивали методом Каплана-Мейера. Различия показателей считали статистически значимыми при значении p<0,05. Результаты. В 1 группе у всех пациентов определялся абсолютный ДЖ, у 85,3% пациентов была установлена анемия. Группы не различались по основным клинико-демографическим показателям, сопутствующим заболеваниям и медикаментозной терапии. Вместе с тем пациенты 1 группы были старше (медиана 73 (64,8-79) года и 69 (63-75) лет, соответственно, р=0,008), имели большую массу миокарда левого желудочка (медиана 145 (115-176) г и 132,5 (118,2-145) г, соответственно, р=0,004). Для восстановления синусового ритма в 1 группе потребовалась меньшая доза амиодарона (медиана 450 (300-600) мг и 1000 (600-1200) мг, соответственно, р<0,001) и меньше времени от начала введения препарата до восстановления ритма (медиана 7 (3-10) и 12 (9-18) ч, соответственно, р<0,001). За 12 мес. наблюдения рецидивы ФП развились у 49 (42,2%) пациентов в 1 группе и у 16 (19,5%) пациентов во 2 группе (р=0,0008), отношение рисков 2,64 (95% доверительный интервал: 1,5-4,65) (р=0,0003). Заключение. ДЖ ассоциирован с увеличением числа симптомных рецидивов ФП у пациентов в течение 12 мес. после фармакологической кардиоверсии амиодароном.
Фибрилляция предсердий (ФП) относится к числу наиболее распространенных форм нарушения ритма сердца, достигая 2% в популяции [1][2]. К прогностически неблагоприятным последствиям ФП относятся кардиоэмболические осложнения, нередко связанные с пароксизмами ФП [2][3]. На сегодняшний день определены основные факторы риска развития ФП, в т.ч. артериальная гипертония, ишемическая болезнь сердца, сахарный диабет, клапанные пороки сердца, хроническая сердечная недостаточность (ХСН), нарушения функции щитовидной железы, возраст и другие факторы [2]. Важную роль играют апоптоз кардиомиоцитов и фиброз миокарда, нарушение в кардиомиоцитах регуляции ионов Na+ и Ca2+, электрическое ремоделирование миокарда, дисбаланс вегетативной регуляции сердца и воспаление [4][5]. В последние годы обсуждается возможная роль дефицита железа (ДЖ) в развитии ФП, однако чаще всего этот вопрос рассматривается в контексте анемии и ХСН [6]. В настоящее время хорошо известно об ухудшении прогноза пациентов с ХСН при наличии у них ДЖ [7-9]. Возможное взаимное влияние ХСН и ФП с участием ДЖ связывают с воспалением, сопровождающим как ХСН, так и ФП, повышением уровня гепсидина, снижением уровня ферропортина, ухудшением всасывания ионов Fe2+ в желудочно-кишечном тракте, нарушением эритропоэза, развитием функционального и абсолютного ДЖ, приводящего к анемии, которая, в свою очередь, ухудшает течение ХСН и ФП [6][10]. Непосредственная роль ДЖ в развитии и течении ФП, во влиянии на восстановление и удержание синусового ритма остается неясной. Учитывая широкую распространенность ДЖ в популяции и тяжесть осложнений ФП, изучение особенностей результатов фармакологической кардиоверсии и частоты развития повторных пароксизмов ФП у пациентов с ДЖ представляет существенный интерес.
Цель исследования: оценить ассоциацию ДЖ с развитием рецидивов ФП в течение 12 мес. у пациентов после фармакологической кардиоверсии амиодароном.
Материал и методы
В открытое наблюдательное проспективное одноцентровое исследование было включено 198 пациентов (медиана возраста 71 (63,2-77) год), в т.ч. 120 (60,6%) мужчин и 78 (39,4%) женщин, с пароксизмальной формой ФП, последовательно госпитализированных в отделение кардиологии МСЧ ПФУ (г. Казань) в период с 2019 по 2021гг в связи с развитием пароксизма. ФП была установлена по результатам электрокардиографического исследования (ЭКГ) согласно действующим рекомендациям Минздрава России (2020г) [2]. Критерии включения в исследование: возраст >18 лет, наличие пароксизмальной формы неклапанной ФП, длительность пароксизма ФП на момент госпитализации не более 48 ч, проведение успешной фармакологической кардиоверсии амиодароном, подписанное информированное согласие. В исследование не включались пациенты с уровнем гемоглобина <90 г/л, клапанной болезнью сердца, с гипертрофической и дилатационной кардиомиопатиями, перенесшие в течение 1 мес. острый коронарный синдром, клинически значимые кровотечения, сопровождавшиеся снижением уровня гемоглобина, в течение последних 6 мес. инсульт, пациенты с активным онкологическим заболеванием, В12-дефицитной и другими анемиями, кроме железодефицитной, пациенты не имеющие возможность наблюдаться в исследовании в течение 12 мес. Критерии исключения: развитие у пациента серьёзного сердечно-сосудистого события (сердечно-сосудистая смерть, нефатальный инфаркт миокарда (ИМ), нефатальный инсульт), отзыв пациентом информированного согласия.
У всех пациентов были собраны данные анамнеза, включая наличие симптомов ФП на момент осмотра и их длительность, перенесённые и сопутствующие заболевания, прием лекарственных препаратов, проведено физикальное исследование, зарегистрирована ЭКГ, проведена трансторакальная эхокардиография (ЭхоКГ), клинический и биохимический анализ крови. ДЖ устанавливался при снижении уровня ферритина плазмы <100 мкг/л (абсолютный ДЖ) или 100-299 мкг/л при коэффициенте насыщения трансферрина железом <20% (относительный ДЖ). Снижение уровня гемоглобина <130 г/л у мужчин и <120 г/л у женщин рассматривалось по критериям Всемирной организации здравоохранения в качестве диагностического признака анемии. В соответствии со статусом железа пациенты распределялись в группу ДЖ или в группу с нормальным уровнем железа.
Восстановление синусового ритма осуществлялось внутривенным введением амиодарона из расчёта 5 мкг/кг, при необходимости суточная доза могла составлять до 15 мкг/кг. Регистрировались доза амиодарона и время от начала его введения до восстановления синусового ритма. Согласно показаниям и действующим рекомендациям, пациентам давались рекомендации по модификации образа жизни и назначалась необходимая медикаментозная терапия. Пациентам с выявленным ДЖ назначались препараты сульфата железа.
Длительность наблюдения составила 12 мес. Плановые визиты пациентов после кардиоверсии происходили ежемесячно. На всех визитах регистрировалась ЭКГ, контролировалась и, в случае необходимости, проводилась коррекция лекарственной терапии. В течение всего периода наблюдения регистрировались случаи развития симптомных рецидивов ФП и неблагоприятных сердечно-сосудистых осложнений (сердечно-сосудистая смерть, нефатальный ИМ, нефатальный инсульт, госпитализация по поводу декомпенсации ХСН). Развившиеся в период наблюдения рецидивы ФП купировались амиодароном. Все пациенты завершили исследование. Первичной конечной точкой исследования было развитие рецидива ФП в течение 12 мес.
Статистический анализ проведён с использованием программы Statistica 13.3 (StatSoft. Inc). Количественные показатели оценивали на предмет соответствия нормальному распределению с применением критерия Шапиро-Уилка. При нормальном распределении полученные данные представлены в виде средних арифметических величин и их стандартных отклонений (M±?). При распределении, отличавшимся от нормального, результаты описывали при помощи значений медианы, 25% и 75% квартилей (Me [Q1; Q3]). Сравнение средних величин при нормальном распределении проводили с помощью t-критерия Стьюдента, в случаях отсутствия нормального распределения — использовали U-критерий Манна-Уитни. Статистическую значимость различий количественных показателей при ненормальном распределении оценивали с помощью критерия Краскела-Уоллиса. Связь между количественными показателями, имеющими нормальное распределение, определяли с помощью коэффициента корреляции Пирсона, при отсутствии нормального распределении — ранговой корреляции Спирмена. Сравнение номинальных данных проводили при помощи критерия ?2 Пирсона с поправкой Йейтса либо точного критерия Фишера. Развитие рецидивов ФП в группах исследования оценивали методом Каплана-Мейера и модели пропорциональных рисков Кокса, для сравнения использовали тест отношения правдоподобий. Различия показателей считали статистически значимыми при значении p<0,05.
Протокол исследования одобрен локальным этическим комитетом Казанского государственного медицинского университета.
Результаты
По результатам определения наличия ДЖ пациенты были распределены на 2 группы. В 1 группу вошли 116 пациентов с ДЖ, в т.ч. 41 (35,3%) мужчина и 75 (64,7%) женщин, 2 группу составили 82 пациента с нормальным статусом железа, в т.ч. 37 (45,1%) мужчин и 45 (54,9%) женщин. По клинико-демографическим характеристикам обе группы были в целом сопоставимы между собой, вместе с тем пациенты с ДЖ были старше (медиана возраста 73 (64,8-79) года и 69 (63-75) лет, соответственно, р=0,008). Не было различий по половому составу, частоте впервые выявленной и различной давности выявления ФП, индексу массы тела, уровню артериального давления и частоте большинства сопутствующих заболеваний. Оценивалась распространенность в группах артериальной гипертонии, ишемической болезни сердца, перенесенного ИМ и инсульта, ХСН, сахарного диабета, хронической обструктивной болезни легких. В 1 группе 8 (6,9%) пациентов ранее перенесли инсульт, во 2 группе не было пациентов с перенесенным инсультом в анамнезе (р=0,022). В 1 группе 12 (10,3%) пациентов и 9 (11%, р=0,927) пациентов во 2 группе страдали гипотиреозом (табл. 1).
До госпитализации 38 (32,8%) пациентов в 1 группе и 37 (45,1%) пациентов во 2 группе (р=0,106) получали прямые оральные антикоагулянты. Варфарин не получал ни один из включенных в исследование пациентов. Не было различий по частоте применения большинства других классов лекарственных препаратов, кроме блокаторов ренин-ангиотензин-альдостероновой системы и бета-блокаторов. В 1 группе пациенты реже получали ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II — 71 (61,2%) и 72 (87,8%) пациента, соответственно (р<0,001). Бета-блокаторы также реже получали пациенты в 1 группе — 21 (18,1%) пациент vs 29 (35,4%) пациентов во 2 группе (р=0,030).
Проведенные анализы крови продемонстрировали наличие у всех пациентов 1 группы абсолютного ДЖ и меньшие величины медианы числа эритроцитов, уровня гемоглобина, гематокрита, ферритина и трансферрина плазмы, коэффициента насыщения трансферрина железом и большую общую железосвязывающую способность сыворотки (табл. 2). В этой группе у 99 (85,3%) пациентов были выявлены признаки анемии легкой степени. Во 2 группе анемии не было ни у одного из пациентов. Однако во 2 группе наблюдалась более высокая медиана уровня мочевины плазмы крови по сравнению с 1 группой (6,4 (5,2-7,4) и 5,8 (4,8-7,0) ммоль/л, соответственно, р=0,035). Число лейкоцитов и тромбоцитов, уровни N-концевого промозгового натрийуретического пептида, глюкозы, креатинина, калия и тиреотропного гормона не различались между группами.
Проведенная при госпитализации ЭхоКГ позволила выявить большую массу миокарда левого желудочка (ММЛЖ) у пациентов 1 группы. Медиана ММЛЖ в 1 группе составила 145 (115-176) г, во 2 группе — 132,5 (118,2-145) г (р=0,004). Группы не различались по показателям объема левого предсердия, конечно-диастолического и конечно-систолического размеров левого желудочка, фракции выброса левого желудочка, систолического давления в легочной артерии и по частоте встречаемости диастолической дисфункции левого желудочка (табл. 3).
По результатам фармакологической кардиоверсии было установлено, что для восстановления синусового ритма в 1 группе потребовалась существенно меньшая доза амиодарона (медианы доз 450 (300-600) мг и 1000 (600-1200) мг, соответственно, р<0,001) и меньше времени от начала введения амиодарона до купирования пароксизма ФП по сравнению с 2 группой (медианы времени 7 (3-10) и 12 (9-18) ч, соответственно, р<0,001). После проведенной кардиоверсии все пациенты получали прямые оральные антикоагулянты, ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II, 88 (75,9%) пациентов в 1 группе и 67 (81,7%, р=0,420) пациентов во 2 группе получали бета-блокаторы. Антиаритмические препараты I, III и IV классов не применялись, за исключением амиодарона для купирования рецидивов ФП. Кроме того, некоторые пациенты получали антагонисты кальция, антагонисты минералокортикоидных рецепторов, статины, нитраты, бронхолитики, L-тироксин, сахароснижающие и другие препараты (основные классы лекарственных препаратов, назначавшихся пациентам в соответствии с индивидуальной клинической ситуацией, представлены в таблице 4).
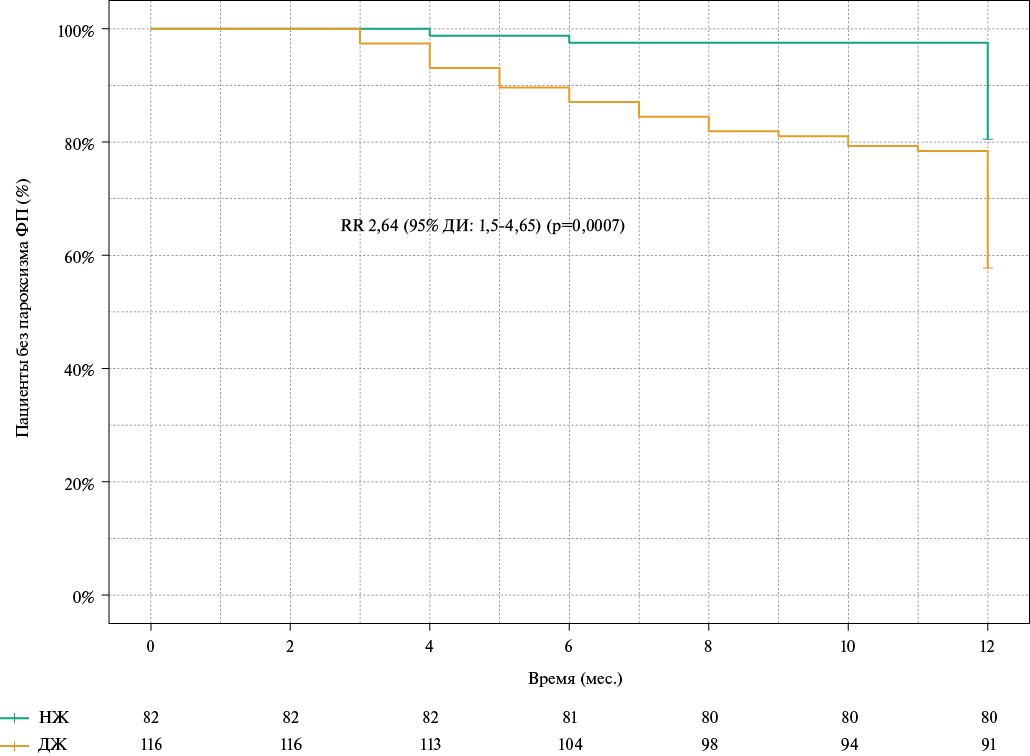
За 12 мес. наблюдения симптомные рецидивы ФП были зарегистрированы у 49 (42,2%) пациентов в 1 группе и у 16 (19,5%) пациентов во 2 группе (р=0,0008). Отношение рисков развития пароксизмов ФП у пациентов с ДЖ составило 2,64 (95% доверительный интервал: 1,5-4,65) (р=0,0003). Результаты анализа Каплана-Мейера представлены на рисунке 1. Учитывая различия между группами пациентов по возрасту и перенесенному инсульту, был проведен регрессионный анализ Кокса с включением возраста и инсульта в анамнезе в качестве поправочных ковариант. С учетом данных поправок, относительный риск развития рецидивов ФП у пациентов с ДЖ по сравнению с пациентами без ДЖ составил 3,08 (95% доверительный интервал: 1,74-5,47) раз (p<0,0001). За период наблюдения не наблюдалось случаев госпитализации по причине декомпенсации ХСН, сердечно-сосудистой смерти, нефатального ИМ или нефатального инсульта.
Таблица 1
Клинико-демографические характеристики пациентов
|
Показатель |
1 группа, n=116 |
2 группа, n=82 |
p |
|
Возраст, лет (Me [Q1; Q3]) |
73 (64,8-79) |
69 (63-75) |
0,008 |
|
Пол |
0,185 |
||
|
Ж, n (%) |
75 (64,7) |
45 (54,9) |
|
|
М, n (%) |
41 (35,3) |
37 (45,1) |
|
|
Впервые выявленная ФП, n (%) |
58 (50) |
36 (43,9) |
0,118 |
|
Анамнез ФП <1 года, n (%) |
15 (12,9) |
14 (17,1) |
0,450 |
|
Анамнез ФП >1 года, n (%) |
43 (37,1) |
33 (40,2) |
0,762 |
|
ИМТ, кг/м2 (Me [Q1; Q3]) |
26,0 (24,0-27,9) |
26,5 (24,5-28,9) |
0,318 |
|
САД, мм рт.ст. (Me [Q1; Q3]) |
140 (130-150) |
138,5 (120-145) |
0,305 |
|
ДАД, мм рт.ст. (Me [Q1; Q3]) |
80 (80-90) |
80 (80-90) |
0,844 |
|
АГ, n (%) |
116 (100) |
82 (100) |
– |
|
ИБС, n (%) |
36 (43,9) |
48 (41,4) |
0,771 |
|
ИМ, n (%) |
13 (11,2) |
18 (21,9) |
0,065 |
|
ХСН, n (%) |
75 (64,7) |
53 (64,6) |
0,807 |
|
ФК I, n (%) |
9 (12,0) |
8 (15,1) |
0,808 |
|
ФК II, n (%) |
64 (85,3) |
42 (79,2) |
0,509 |
|
ФК III, n (%) |
2 (2,7) |
3 (5,7) |
0,691 |
|
ФК IV, n (%) |
0 |
0 |
– |
|
СД, n (%) |
47 (40,5) |
30 (36,6) |
0,658 |
|
Инсульт, n (%) |
8 (6,9) |
0 (0) |
0,022 |
|
ХОБЛ, n (%) |
8 (6,9) |
1 (1,2) |
0,084 |
|
Гипотиреоз, n (%) |
12 (10,3) |
9 (11) |
0,927 |
Сокращения: АГ — артериальная гипертония, ДАД — диастолическое артериальное давление, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, САД — систолическое артериальное давление, СД — сахарный диабет, ФК — функциональный класс, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
Таблица 2
Результаты анализа крови пациентов
|
Показатель |
1 группа, n=116 (Me [Q1; Q3]) |
2 группа, n=82 (Me [Q1; Q3]) |
p |
|
Лейкоциты (?109/л) |
7 (5,8-8,3) |
7 (6,1-8,3) |
0,702 |
|
Тромбоциты (?109/л) |
270 (212,5-312) |
267 (203,2-300,5) |
0,404 |
|
Эритроциты (?1012/л) |
3,9 (3,6-4,3) |
4,6 (4,3-5,2) |
<0,0001 |
|
Гемоглобин, г/л |
107 (99,8-115) |
137 (130-143,8) |
<0,0001 |
|
Гематокрит, % |
33 (30,6-35,4) |
42 (39,9-44) |
<0,0001 |
|
ОЖСС, мкмоль/л |
101 (100,2-101,8) |
54,3 (48,7-57,9) |
<0,0001 |
|
Ферритин, нг/мл |
6,6 (5,8-7,3) |
57,5 (46-74,3) |
<0,0001 |
|
Трансферрин, г/л |
8 (7,9-8,1) |
3,3 (2,8-3,5) |
<0,0001 |
|
КНТЖ, % |
8,2 (7,6-8,9) |
37,3 (31,7-41,6) |
<0,0001 |
|
NT-proBNP, пг/мл |
284,0 (145,0-497,5) |
258,0 (136,0-507,5) |
0,737 |
|
Глюкоза, ммоль/л |
6,4 (5,3-7,9) |
6,3 (5,3-7,7) |
0,907 |
|
Креатинин, мкмоль/л |
68,4 (61,0-79,8) |
75,6 (61,2-84,1) |
0,1574 |
|
Мочевина, ммоль/л |
5,8 (4,8-7,0) |
6,4 (5,2-7,4) |
0,035 |
|
Калий, ммоль/л |
4,1 (4,0-4,4) |
4,2 (4,0-4,4) |
0,397 |
|
ТТГ, мЕд/л |
1,4 (0,8-3,0) |
2,0 (0,9-3,1) |
0,143 |
Сокращения: КНТЖ — коэффициент насыщения трансферрина железом, ОЖСС — общая железосвязывающая способность сыворотки, ТТГ — тиреотропный гормон, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 3
Данные ЭхоКГ
|
Показатель |
1 группа, n=116 |
2 группа, n=82 |
p |
|
ММЛЖ, г (Me [Q1; Q3]) |
145 (115-176) |
132,5 (118,2-145) |
0,004 |
|
ЛП, мл (Me [Q1; Q3]) |
72,5 (65-89) |
72 (62,2-77) |
0,103 |
|
ФВ, % (Me [Q1; Q3]) |
58 (56-61) |
58,5 (55-61) |
0,999 |
|
КДР, см (M±?) |
5,0±0,5 |
5,0±0,4 |
0,878 |
|
КСР, см (Me [Q1; Q3]) |
3,3 (3,2-3,7) |
3,3 (3,1-3,6) |
0,475 |
|
СДЛА, мм рт.ст. (Me [Q1; Q3]) |
32,5 (28-40) |
31,5 (28-37) |
0,143 |
|
Диастолическая дисфункция, n (%) |
79 (68,1) |
48 (58,5) |
0,179 |
Сокращения: КДР — конечно-диастолический размер, КСР — конечно-систолический размер, ЛП — левое предсердие, ММЛЖ — масса миокарда левого желудочка, СДЛА — систолическое давление в легочной артерии, ФВ — фракция выброса.
Таблица 4
Медикаментозная терапия в группах пациентов
|
Препараты |
1 группа, n=116, n (%) |
2 группа, n=82, n (%) |
p |
|
ПОАК |
116 (100) |
82 (100) |
– |
|
иАПФ/БРА |
116 (100) |
82 (100) |
– |
|
Бета-блокаторы |
88 (75,9) |
67 (81,7) |
0,420 |
|
АК |
12 (10,3) |
10 (12,2) |
0,859 |
|
АМКР |
1 (0,9) |
0 (0) |
0,862 |
|
Статины |
42 (36,2) |
35 (42,7) |
0,440 |
|
Нитраты |
21 (18,1) |
13 (15,9) |
0,707 |
|
L-тироксин |
12 (10,3) |
9 (11) |
0,927 |
|
Сахароснижающие препараты |
50 (43,1) |
29 (35,4) |
0,344 |
|
Бронхолитики |
7 (6,1) |
1 (1,2) |
0,185 |
Сокращения: АК — антагонисты кальция, АМКР — антагонисты минералокортикоидных рецепторов, БРА — блокаторы рецепторов ангиотензина II, иАПФ — ингибиторы ангиотензинпревращающего фермента, ПОАК — прямые оральные антикоагулянты.

Рис. 1. Развитие рецидивов ФП в 1 и 2 группах пациентов.
Сокращения: ДЖ — дефицит железа (1 группа), ДИ — доверительный интервал, НЖ — нормальный уровень железа (2 группа), ОР — отношение рисков, ФП — фибрилляция предсердий.
Обсуждение
В настоящее время накоплен достаточно большой объем информации о взаимном негативном влиянии ФП и ХСН на развитие и течение друг друга, формируя своего рода порочный круг [6]. Можно было бы предположить влияние ХСН на развитие пароксизмов ФП после кардиоверсии у пациентов с ДЖ. В нашем исследовании ХСН была установлена почти у 65% пациентов, однако не было различий в частоте ее встречаемости в обеих группах. Обе группы не различались между собой по основным характеристикам, за исключением тех параметров, которые обусловлены наличием ДЖ и его проявлений. В 1 группе у 85,3% пациентов была выявлена анемия, имеющая в своей основе ДЖ, что закономерно повлияло на снижение показателей количества эритроцитов, уровней гемоглобина и гематокрита в клиническом анализе крови. По имеющимся данным распространенность ДЖ увеличивается с возрастом [2], и в нашем исследовании в 1 группе пациенты были старше, чем во 2 группе. В обзоре Sutil-Vega M, et al. (2019) были представлены сведения о большей ММЛЖ у пациентов с ДЖ [11]. Аналогичные данные были получены при проведении ЭхоКГ у пациентов 1 группы. В свою очередь, выявленный нами меньший уровень мочевины у пациентов с ДЖ требует дальнейшего специального изучения функции почек у пациентов с различным статусом железа. Таким образом, можно говорить о достаточной сопоставимости между собой обеих групп нашего исследования по большинству параметров, не обусловленных широкой распространенностью анемии в 1 группе. Ключевым отличительным фактором было наличие или отсутствие ДЖ. ДЖ оказался ассоциированным с потребностью в меньшей дозе амиодарона и меньшим временем, необходимым для восстановления синусового ритма при проведении фармакологической кардиоверсии. Полученные результаты свидетельствуют о необходимости дальнейшего изучения влияния ДЖ на эффективность антиаритмической терапии. Лекарственная терапия, которую получали пациенты после кардиоверсии, не различалась в обеих группах исследования. Последующее наблюдение за пациентами в течение 12 мес. показало значительное различие в развитии рецидивов ФП. По результатам нашего исследования, ДЖ ассоциирован с учащением рецидивов ФП, более чем в 2,6 раза повышая риск их развития в течение 1 года после кардиоверсии. В настоящее время нет определенного объяснения установленной нами связи ДЖ с влиянием амиодарона на восстановление синусового ритма и с последующим развитием рецидивов ФП. В какой-то мере полученные результаты могут быть обусловлены влиянием ДЖ на снижение выработки аденозинтрифосфата, нарушение контроля клеточного Ca2+, развитие митохондриальной дисфункции и повреждения митохондриальной ДНК, окислительного и нитрозативного стресса, воспаления, вегетативной дисфункции, ускорение апоптоза кардиомиоцитов и ремоделирования миокарда [12][13]. Считается, что дисперсия зубца Р электрокардиограммы может рассматриваться в качестве простого и надежного маркера развития пароксизмов ФП [14]. Simsek Н, et al. (2010) показали связь ДЖ с увеличением дисперсии зубца Р и нарушением функции миокарда, что может способствовать развитию пароксизмов ФП [15]. Таким образом, целый ряд изменений в кардиомицах, обусловленных ДЖ, могут повлиять как на результаты кардиоверсии, так и на развитие повторных эпизодов ФП.
Определенным ограничением нашего исследования является небольшое количество включенных пациентов и оценка наличия ДЖ только при включении пациентов в исследование. Кроме того, в исследовании не применялись для длительной терапии антиаритмические препараты I, III и IV классов.
Заключение
Полученные нами результаты свидетельствуют об ассоциации ДЖ со снижением способности удержания синусового ритма и увеличением числа симптомных рецидивов ФП у пациентов в течение 12 мес. после фармакологической кардиоверсии амиодароном. Для определения роли ДЖ в качестве прогностического фактора эффективности кардиоверсии и развития пароксизмов ФП необходимы дальнейшие исследования на большей группе пациентов. Новые данные могут повлиять на существующие подходы к ведению пациентов с ФП.
По результатам открытого наблюдательного проспективного исследования, ДЖ ассоциирован с учащением рецидивов ФП в течение 1 года после фармакологической кардиоверсии амиодароном.
Фармакологическая кардиоверсия у пациентов с пароксизмом ФП и ДЖ требует меньших доз амиодарона и меньшего времени для восстановления синусового ритма.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Валеев М.Х., Хасанов Н.Р. Ассоциация дефицита железа с развитием рецидивов фибрилляции предсердий после фармакологической кардиоверсии. Российский кардиологический журнал. 2023;28(2S):5369. https://doi.org/10.15829/1560-4071-2023-5369
Скопировать