Методы анализа формы левого желудочка в оценке диссинхронии сокращения и прогнозе ее коррекции
Аннотация
В обзорной работе обсуждается важность анализа формы левого желудочка сердца для диагностики диссинхронии сердечного сокращения и оценки ее степени, прогноза успешности корректирующих мер. Последовательно рассматриваются различные способы оценки формы левого желудочка, начиная от распространенного в клинике индекса сферичности, переходя к более сложным и/или редким индексам, затем к авторским индексам функциональной геометрии левого желудочка, а также к методам геометрической морфометрии. Приводятся результаты, полученные с использованием анализа формы левого желудочка, в задачах диагностики и планирования лечения.
На сегодняшний день имеется большое количество свидетельств того, что сердечная мышца гетерогенна, и эта гетерогенность имеет различные масштабы от молекулярного до тканевого уровня, когда она включает целые сегменты камер сердца [1-3]. Скоординированная электромеханическая активность сердца происходит в условиях целого ряда градиентов, вдоль которых наблюдаются закономерные изменения электромеханических свойств кардиомиоцитов [4][5]. Так, имеется ярко выраженный трансмуральный градиент электрических характеристик кардиомиоцитов; градиент электрических свойств от верхушки сердца к его основанию [6]; трансмуральный градиент параметров сопряжения возбуждения с сокращением в кардиомиоцитах; трансмуральный градиент механических условий и свойств кардиомиоцитов, формирующий поле напряжений, возрастающее от эпикарда к эндокарду, а также продольный механический градиент от верхушки сердца к его основанию; градиенты деформации кардиомиоцитов, возрастающие от эпикарда к эндокарду и от основания желудочков к верхушке [3][7-9].
Такая тонко скоординированная в пространстве и во времени неоднородность сердечной мышцы обеспечивает достаточно богатую кинематику стенок камер сердца, что, в свою очередь, обеспечивает оптимизацию насосной функции сердца [10].
Глубокий интерес к изучению региональных особенностей механической функции камер сердца, в частности, левого желудочка (ЛЖ), возник в связи с патологией сердца, что дало толчок к развитию методов оценки региональных движений стенки ЛЖ и его формы [11-13]. Сначала для визуализации камер сердца с последующей качественной оценкой региональных особенностей движения стенок камер использовались рентгеноконтрастные методы, в частности, была осуществлена первая классификация локальных дисфункций стенок желудочков [14]. Качественная оценка страдала значительным субъективизмом и плохой воспроизводимостью, что повлекло дальнейшее развитие количественных оценок региональных особенностей движения стенок желудочков. Количественная оценка таких особенностей позволила показать, что индексы глобальной функции желудочков не способны отразить в полной мере тяжесть дисфункции стенок камер сердца вследствие компенсирующего влияния соседних регионов [14]. На сегодняшний день большим числом исследований подтверждено, что при многих сердечно-сосудистых заболеваниях (ССЗ) наблюдается патологическое изменение (ремоделирование) формы ЛЖ и/или диссинхрония (дискоординация) движений стенок камер сердца [15-20].
В настоящей статье рассмотрены работы, в которых исследовалась форма ЛЖ сердца, региональные особенности движения стенки ЛЖ в течение сердечного цикла и оценивалась их диагностическая значимость при патологическом ухудшении функции ЛЖ, либо при ее восстановлении в процессе лечения. В нашем исследовательском коллективе проводится обширное и целенаправленное изучение физиологической и патофизиологической значимости специфических особенностей региональной кинетики стенки ЛЖ и изменения формы ЛЖ в течение сердечного цикла, роли этих особенностей в насосной функции желудочка, а также разработка критериев оценки и прогнозирования патологического состояния ЛЖ с целью профилактики прогрессирования нарушений функции желудочка. Здесь мы подробнее остановимся на методах, используемых в наших исследованиях динамики формы ЛЖ: анализе функциональной геометрии и применении геометрической морфометрии (ГМ).
Анализ формы ЛЖ при диагностике сердечных патологий
Важность оценки формы камер сердца при диагностике сердечных патологий подтверждается многими исследованиями, где форма ЛЖ определена как важный маркер процессов ремоделирования у пациентов с митральной регургитацией, неишемической кардиомиопатией и инфарктом миокарда (ИМ), дилатационной кардиомиопатией (ДКМП), внезапной сердечной смертью [21-23]. В этих работах предложены не использовавшиеся ранее индексы формы ЛЖ, такие как индекс сферичности Гибсона, индекс заостренности верхушечной области ЛЖ, индекс сложности формы Фурье. В своих работах для описания формы мы также использовали классический индекс сферичности (отношение короткой оси ЛЖ к длинной), индекс сферичности Гибсона, индекс сложности формы Фурье (см. раздел «Функциональная геометрия»). Ambale-Venkatesh B, et al. [24] исследовали связь формы ЛЖ с развитием различных типов сердечно-сосудистых событий в большой многоэтнической популяции (5004 наблюдения), не имеющей ССЗ на исходном уровне. В частности, рассматривалась связь индексов сферичности, объема и размеров ЛЖ с развитием следующих событий: любое ССЗ; ишемическая болезнь сердца (ИБС); сердечная недостаточность (СН) и фибрилляция предсердий в течение 10-летнего периода наблюдения. Форма ЛЖ оценивалась по изображениям магнитно-резонансной томографии (МРТ) сердца по двум кадрам сердечного цикла, конечно-диастолическому и конечно-систолическому. Авторы разбили распределение индекса сферичности в популяции на 5 квантилей с шагом 0,2. Самая низкая сферичность (квантиль 0,2) была предиктором возникновения ИБС, ССЗ и СН в течение 10-летнего периода наблюдения. Экстремальная сферичность (квантиль 0,8) была сильным предиктором инцидентной СН и фибрилляции предсердий.
Balaban G, et al. [18] оценивали форму ЛЖ у пациентов с ДКМП (156 наблюдений) в связи с риском развития будущих аритмий. Поиск прогностических маркеров проводился на основе трехмерной реконструкции анатомии ЛЖ, полученной на основе конечно-диастолического изображения МРТ. «Аритмическая» форма ЛЖ идентифицировала пациентов, достигших составной аритмической конечной точки, включающей внезапную сердечную смерть, предотвращенную внезапную сердечную смерть или устойчивую желудочковую тахикардию. Характерной формой ЛЖ для развития аритмического события являлся параболоидный продольный профиль с относительно широким основанием.
Обратим внимание, что указанные работы были сосредоточены на оценке статической формы ЛЖ, и не учитывали информации о ее изменении в течение сердечного цикла.
Функциональная геометрия ЛЖ
Особенности динамического изменения конфигурации ЛЖ во время сердечного цикла мы называем «функциональной геометрией» ЛЖ. Термин «функциональная геометрия» был впервые предложен член-корр. В. С. Мархасиным [25] и подчеркивал связь между особенностями динамического изменения формы, регионального движения стенки ЛЖ и глобальной функцией.
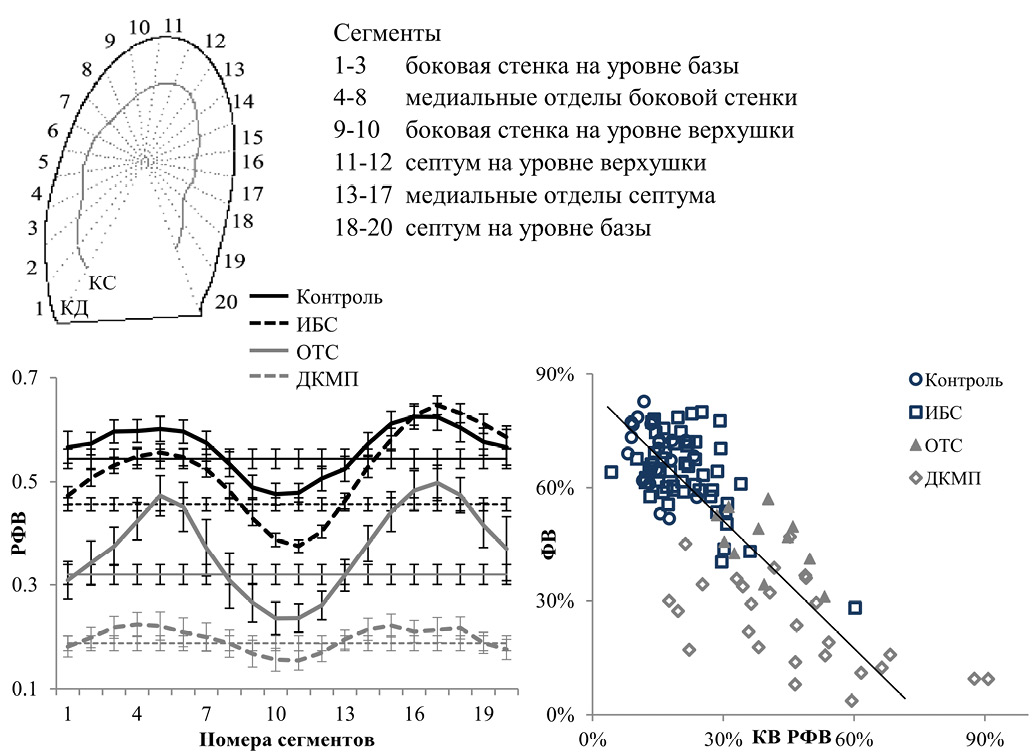
Для анализа региональной кинетики стенки ЛЖ мы использовали 2D изображения сердца в течение сократительного цикла, полученные с помощью эхокардиографии (ЭхоКГ). На последовательных кадрах, соответствующих сердечному циклу от конечной диастолы до последующей конечной диастолы, выделяются эндокардиальные контуры ЛЖ. Далее область ЛЖ, ограниченная конечно-диастолическим контуром, разбивается на несколько секторов (например, мы использовали 20 секторов) с равной площадью и центром в центре масс контура. Каждый последующий контур ЛЖ в течение сократительного цикла совмещается с конечно-диастолическим по центру масс, так что можно оценить изменение размеров сектора в течение сердечного цикла (рис. 1 А). Региональная кинетика стенки ЛЖ оценивается при помощи изменения площади соответствующего сектора в течение сердечного цикла, в частности, рассчитывается «региональная фракция выброса» (ФВ) как отношение разности между площадью сектора в конечную диастолу и минимальной площадью этого сектора в течение сердечного цикла, к величине конечно-диастолической площади сектора (рис. 1 В). Отметим, что время достижения минимальной площади сектора (региональной конечной систолы) может не совпадать со временем глобальной конечной систолы. Такое несовпадение отражает временной асинхронизм движения стенки ЛЖ в сократительном цикле, который также можно оценить количественно. В роли количественных индексов пространственной и временной неоднородности движения стенки ЛЖ мы использовали коэффициент вариабельности региональной ФВ (рис. 1 С) и отклонения времени максимального регионального сокращения от времени конечной систолы [26].
Необходимо подчеркнуть, что вычисление описанных выше характеристик регионального движения стенки ЛЖ невозможно без анализа изображений ЛЖ в течение всего сократительного цикла, а не только двух фиксированных моментов времени — конечной диастолы и конечной систолы, — которые традиционно использовались в методиках оценки региональной функции, существовавших на момент разработки методов функциональной геометрии.
Кроме этого, в качестве характеристик функциональной геометрии мы также рассматривали индексы, описывающие форму ЛЖ, в частности, индекс сферичности как отношение короткой оси ЛЖ к длинной; индекс сферичности Гибсона как отношение площади сечения ЛЖ внутри его контура к площади круга, периметр которого равен длине контура; индекс конусности, который отражает степень заостренности верхушечной области и говорит о близости формы ЛЖ к эллипсу или окружности; а также индекс сложности формы (индекс Фурье), который рассчитывается на основе приближения рядом Фурье кривой контура ЛЖ и показывает, насколько форма ЛЖ сложна по сравнению с окружностью.
В наших работах [26-30] представлены результаты исследования функциональной геометрии ЛЖ в группах здоровых волонтеров и пациентов с сердечно-сосудистой патологией с различной степенью выраженности нарушений сократительной функции сердца и геометрического ремоделирования ЛЖ. Было проведено сравнение данных следующих групп: 1) здоровые добровольцы без признаков ССЗ (контроль); 2) пациенты с ИБС, направляемые на операцию стентирования, имеющие сохраненную ФВ ЛЖ, которая статистически значимо не отличалась от группы здоровых добровольцев; 3) пациенты с ДКМП до и после сердечной ресинхронизационной терапии в ранний послеоперационный период; 4) пациенты после ортотопической трансплантации сердца (ОТС) в ранний и отдаленный послеоперационные периоды.
Исследования были направлены на установление особенностей функциональной геометрии ЛЖ при миокардиальных заболеваниях с разной степенью нарушения систолической функции ЛЖ. Проверялась гипотеза о связи показателей функциональной геометрии ЛЖ с характеристиками сократительной функции пациентов. Во всех рассматриваемых группах была выявлена существенная отрицательная корреляционная связь между индексом неоднородности индивидуальных региональных ФВ ЛЖ и глобальной ФВ ЛЖ, указывающая на то, что неоднородность региональной кинетики стенки ЛЖ является важным детерминантом насосной и сократительной функции сердца (рис. 1).
Обнаружено значимое увеличение и пространственного индекса неоднородности (вариабельности региональной ФВ), и индекса асинхронизма (вариабельности времени региональной систолы) движения стенки желудочка у больных ИБС с сохраненной ФВ ЛЖ, несмотря на отсутствие видимых аномалий движения стенки ЛЖ при ультразвуковом исследовании. Более того, линейный дискриминационный анализ не позволял разделить набор клинических данных в группе ИБС с контрольной группой при использовании только стандартных показателей ЭхоКГ, точность классификации составила 13% (рис. 2). В то же время разработанные нами количественные показатели функциональной геометрии ЛЖ оказались более чувствительными к ИБС по сравнению со стандартными методами оценки насосной функции при ультразвуковом исследовании и позволили с 100% точностью разделить данные пациентов с ИБС и контрольных пациентов [30] (рис. 2).
Характеристики функциональной геометрии ЛЖ сердца у больных ДКМП до сердечной ресинхронизирующей терапии (СРТ) существенно отличаются от контроля [27]. На фоне существенного снижения глобальной ФВ ЛЖ (<35%) наблюдалось также снижение региональных ФВ и усиление пространственной (ДКМП: 46±3%, здоровые добровольцы 13±1%, p<0,01) и временной неоднородности движения стенки (ДКМП: 37±2%, здоровые добровольцы 12±1%, p<0,01) в сердечном цикле по сравнению со здоровыми добровольцами. Интересно отметить, что в группе ДКМП средние значения региональных ФВ практически не отличались между секторами (min 15±6% и max 22±8%, p>0,05), по сравнению с выраженными различиями между сокращениями срединных и верхушечных отделов в группе здоровых добровольцев (min 47±6% и max 62±8%, p<0,01). Однако при этом вариабельность сокращения секторов ЛЖ в каждом сердце (индекс неоднородности) оказалась значительно выше в группе ДКМП (ДКМП: 46±3%, здоровые добровольцы 13±1%, p<0,01). Эти результаты свидетельствуют о наличии глубокой дискоординации движения стенки ЛЖ у пациентов с тяжелой систолической дисфункцией по сравнению с контролем. Все индексы формы ЛЖ указывали на более сферическую форму ЛЖ у пациентов с ДКМП. При этом в отличие от контрольной группы, у больных ДКМП индексы формы практически не менялись в течение сердечного цикла. Этот факт указывает на потерю при патологии способности динамического изменения конфигурации ЛЖ, которая имеет место в нормальном сердце и вносит вклад в обеспечение эффективного сердечного выброса.
У пациентов после имплантации СРТ устройств наблюдается существенная рекоординация движения стенки ЛЖ, которая сопровождается снижением индексов неоднородности и асинхронизма регионального сокращения и появлением динамики изменения индексов формы в течение сердечного цикла [27]. Полученные результаты позволяют предположить, что улучшение центральной гемодинамики у больных ДКМП в результате ресинхронизации активации и сокращения желудочков достигается в т. ч. за счет частичного восстановления функциональной геометрии ЛЖ.
Интересные результаты о предиктивном потенциале показателей функциональной геометрии ЛЖ были нами получены при исследовании состояния систолической функции ЛЖ в течение длительного периода времени после ОТС [28][30]. Выявлены особенности региональной кинетики стенки ЛЖ у пациентов с трансплантированным сердцем при благоприятном течении и при остром отторжении аллотрансплантата в посттрансплантационном периоде. Клиническая картина отторжения трансплантата, подтвержденная результатами эндомиокардиальной биопсии, сопровождалась изменениями кинетики стенки ЛЖ по сравнению с ее характером в группе сравнения, причем степень отклонений от исходных показателей находилась в прямой зависимости от степени тяжести отторжения. В связи с этим нами выдвинута гипотеза, что нарушение функциональной геометрии ЛЖ, в особенности увеличение индексов пространственной и временной неоднородности движения стенки ЛЖ, у пациентов с трансплантированным сердцем может быть основой для неинвазивной диагностики дисфункции трансплантата.
Для проверки гипотезы мы использовали ретроспективные данные, полученные у пациентов без патологии и с умеренно и сильно выраженной систолической дисфункцией ЛЖ, и использовали их как обучающие данные для классификации степени систолической дисфункции у пациентов [28][30]. Для построения классификационных моделей группа здоровых добровольцев без признаков ССЗ рассматривалась как обучающая подвыборка субъектов с нормальной систолической функцией (NSF, normal systolic function) ЛЖ. Вторая группа с умеренно сниженной систолической функцией (MSD, mild systolic dysfunction) ЛЖ и сохраненной ФВ (>50%) была представлена 52 пациентами, страдающими ИБС. В третью группу с тяжелой систолической дисфункцией (SSD, severe systolic dysfunction) ЛЖ (ФВ ЛЖ <35%) вошли 25 пациентов с ДКМП.
Используя линейный дискриминантный анализ, были построены три модели классификации: первая модель обучена на данных из стандартного протокола ЭхоКГ и показала точность классификации 13% для NSF, 96% для MSD и 100% для SSD (рис. 2). Видно, что эта модель не смогла разделить группы NSF и MSD. Когда в дополнение к стандартным эхокардиографическим параметрам были включены характеристики глобальной продольной деформации, оцененной методом спекл-трекинг, качество классификации улучшилось, показав точность 45% для NSF, 90% для MSD и 100% для SSD. Но эта модель также не смогла аккуратно разделить группу MSD от группы NSF (рис. 2). Третья модель, построенная на характеристиках функциональной геометрии ЛЖ, классифицировала данные из всех трех групп с точностью 100% (рис. 2). Эта модель четко разделила данные между группами NSF и MSD.
Далее обученные классификаторы использовались для прогноза ухудшения состояния аллотрансплантата у пациентов после ОТС [28][30]. В частности, для прогноза острого отторжения в послеоперационный период до 2 лет после ОТС (105 наблюдений, 38 из которых с острым отторжением трансплантата) и прогноза увеличения степени хронической СН (ХСН) у пациентов в период, превышающий 2 года после ОТС (67 наблюдений, из них: 27 — II функциональный класс (ФК) ХСН, 25 — III или IV ФК ХСН и 15 наблюдений, у которых в течение месяца наблюдалось прогрессирование ХСН, т. е. увеличение ФК).
Модель, обученная на стандартных эхокардиографических данных, и модель, обученная с учетом глобальной продольной деформации, классифицировали 21% и 24% случаев острого отторжения как SSD, и остальные случаи как MSD, соответственно (рис. 3). Таким образом, эти две модели не смогли разделить данные между группой отторжения аллографа и другими случаями ОТС. В то же время модель, обученная на данных функциональной геометрии ЛЖ, классифицировала 90% случаев с острым отторжением как SSD (рис. 3), показав высокую точность стратификации данных и высокую мощность прогнозирования ухудшения состояния пациентов при остром отторжении аллографа.
Все модели продемонстрировали высокую точность разделения данных между классами по классификации ФК ХСН. 96% случаев пациентов II ФК были отнесены к группе MSD, 92% случаев пациентов класса III и IV ФК — к группе SSD. Наибольшую точность в 100% продемонстрировала модель, обученная на данных функциональной геометрии ЛЖ (рис. 3). Затем мы классифицировали данные 15 пациентов, которые были обследованы в течение месяца до ухудшения их состояния и подтвердили прогрессирование ХСН с реклассификацией в больший класс ХСН. Модели, обученные на стандартных эхокардиографических характеристиках и глобальной продольной деформации, классифицировали только 1 из 15 случаев как SSD, тогда как остальные данные были классифицированы как MSD. Напротив, модель, обученная на данных функциональной геометрии, классифицировала 14 из 15 случаев как SSD, прогнозируя прогрессирование ХСН до наступления неблагоприятных исходов (рис. 3). Таким образом, характеристики функциональной геометрии ЛЖ показали высокую предсказательную способность для диагностики острого отторжения и развития СН у пациентов с трансплантированным сердцем.
Результаты наших исследований демонстрируют связь между функциональной геометрией ЛЖ и его насосной функцией и показывают роль изменения формы и степени неоднородности движения стенки в патогенезе сердечной дисфункции. Важно, что характеристики функциональной геометрии позволяют ранее выявить ухудшение систолической функции ЛЖ, еще до снижения глобальных индексов насосной функции ЛЖ, регистрируемых стандартными методами ЭхоК Г.
Необходимо упомянуть, что в настоящее время для оценки локальной деформации миокарда желудочков в течение сердечного цикла существуют аппаратные методики с использованием ультразвуковых изображений, в частности, эхокардиографическая методика слежения пятна (speckle tracking), которая обрабатывает динамические изменения изображения ЛЖ в течение всего сердечного цикла. Это позволяет провести количественную оценку глобальной и региональной систолической и диастолической функции сердца [31]. Важность анализа полной информации о деформации ЛЖ в течение сократительного цикла подтверждается в работе Taha К, et al. [32]. Авторы анализировали кривые локальной деформации (еchocardiographic deformation curves) миокарда в течение сердечного цикла. С помощью нейронной сети были обнаружены диагностические признаки деформации в диастолическую фазу цикла для субъектов с генетически высоким риском развития ДКМП. В то же время пиковые значения деформации не имели диагностической ценности для этой когорты пациентов. В ряде работ оценка неоднородности региональных деформаций миокарда показала высокий потенциал в определении фенотипов механической диссинхронии желудочков сердца и прогнозе успешности ее коррекции при помощи СРТ [33][34]. Однако к настоящему времени все еще не получено достаточного объема доказательств для включения показателей механической диссинхронии в текущие рекомендации по отбору пациентов. Следует отметить, что применение данной проприетарной методики, реализуемой непосредственно в ультразвуковых аппаратах, затруднено для исследовательских целей условиями приобретения специального программного обеспечения и его использования.

Рис. 1. Анализ региональной кинетики стенки ЛЖ [26].
Примечание: A. Метод секторов. Показаны совмещенные по центру масс конечно-диастолический и конечно-систолический контуры ЛЖ, внутренняя область ЛЖ разбивается на секторы равной площадью. В. Зависимость средней величины РФВ от пространственного положения участка стенки ЛЖ (толстые линии) по сравнению с двумерной оценкой глобальной ФВ (тонкие линии). С. Линейная регрессия между глобальной ФВ ЛЖ и величиной коэффициента вариации региональной ФВ (КВ РФВ). Значимая связь (r=0,73; r2=0,52; p<0,01; ФВ=0,65-0,74*КВ РФВ) установлена для объединенной совокупности данных, полученных для всех исследуемых групп.
Сокращения: ДКМП — дилатационная кардиомиопатия, ИБС — ишемическая болезнь сердца, КВ — коэффициент вариации, КД — конечная диастола, КС — конечная систола, ЛЖ — левый желудочек, ОТС — ортотопическая трансплантация сердца, РФВ — региональная фракция выброса, ФВ — фракция выброса

Рис. 2. Классификационные модели [30].
Примечание: А. Модель, обученная на стандартном ЭхоКГ протоколе. B. Модель, обученная на стандартном ЭхоКГ протоколе и глобальной продольной деформации. C. Модель, обученная на параметрах функциональной геометрии ЛЖ. По осям значения дискриминантных функций, полученные с помощью линейного дискриминантного анализа.
Сокращения: ЛЖ — левый желудочек, ЭхоКГ — эхокардиография, MSD — умеренная систолическая дисфункция (mild systolic dysfunction), NSF — нормальная систолическая функция (normal systolic function), SSD — тяжелая систолическая дисфункция (severe systolic dysfunction).

Рис. 3. Классификация пациентов после ОТС [30].
Примечание: верхний блок: Острое отторжение аллотрансплантата. Нижний блок: Прогрессирование ХСН. А. Модель, обученная на стандартном ЭхоКГ протоколе. B. Модель, обученная на стандартном ЭхоКГ протоколе и глобальной продольной деформации. C. Модель, обученная на параметрах функциональной геометрии ЛЖ.
Сокращения: ЛЖ — левый желудочек, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография, MSD — умеренная систолическая дисфункция (mild systolic dysfunction), NSF — нормальная систолическая функция (normal systolic function), SSD — тяжелая систолическая дисфункция (severe systolic dysfunction).
Методы геометрической морфометрии ЛЖ
Анализируя результаты, полученные методами функциональной геометрии, мы пришли к выводу, что детальное изучение формы ЛЖ и ее изменения в течение сердечного цикла может дать понимание физиологической и патофизиологической значимости вклада особенностей изменения формы ЛЖ в сердечном цикле в его механическую функцию, что, в свою очередь, позволит использовать характеристики формы для ранней диагностики механической дисфункции. Поэтому наряду с оценкой показателей функциональной геометрии ЛЖ, в частности, интегративных индексов формы ЛЖ, в основном отражающих близость или удаленность формы ЛЖ от сферы, мы решили также применить более общий подход для количественного анализа формы ЛЖ и ее динамического изменения в течение сердечного цикла — методы ГМ. Данный подход активно развивался с конца 1970-х годов, ранняя история описана в работе Bookstein FL, 1994, а для изучения методов можно рассмотреть книги Dryden and Mardia 2016 и Bookstein FL, 2018. Цель ГМ не отличается от целей классической морфометрии: оценка сходства и закономерностей изменчивости биологических объектов с помощью морфологической информации. Однако исходные данные для классической и ГМ имеют принципиально различные математические свойства. Так, для классического подхода используемые характеристики являются измерениями размера изучаемого объекта, в частности, расстояния, площади и углы. Недостатком использования многих измерений размера является то, что большинство из них будут сильно коррелировать между собой, в результате, имеется малое число независимых переменных среди множества измерений.
ГМ использует координаты ориентиров на поверхности изучаемого объекта, в которых содержится пространственная информация, отсутствующая в традиционной морфометрии. На изучаемых объектах систематическим образом расставляются ориентиры, которыми могут быть точки, соответствующие анатомическим особенностям объекта. Например, на эхокардиографическом изображении сердца в четырехкамерной проекции мы можем обозначить точки соединения стенок ЛЖ с митральным клапаном (рис. 4). Ориентиры можно выставлять и по математическим правилам: мы можем обозначить верхушку ЛЖ как точку локального минимума на эндокардиальном контуре, затем расставить на равном расстоянии друг от друга определенное количество точек, которые будут находиться на участке от точки соединения с митральным клапаном до верхушки. Ориентиры без анатомической интерпретации усложняют дальнейший анализ, однако далеко не всегда мы можем найти на объекте достаточное количество анатомических ориентиров. Данные для каждого индивидуума состоят из конфигурации ориентиров, которые имеют смысл только в совокупности с другими такими же координатами и при условии их соответствующего совмещения в пространстве. Преимущество данного подхода состоит в возможности широкого анализа формы объекта без потери ковариационных взаимоотношений между положением разных его частей в пространстве [35].
Прежде чем анализировать форму объекта, надо дать этому понятию определение. В ГМ формой называется информация, содержащаяся в конфигурации, не зависящая от положения, масштаба и ориентации конфигурации в окружающем пространстве. На практике это означает, что для изучения набора конфигураций мы должны зафиксировать для них одно положение, масштаб и поворот. Для этого используется алгоритм обобщенного прокрустового анализа, который находит среднюю форму для набора конфигураций, затем переносит, масштабирует и поворачивает все конфигурации к этой средней форме. При условии достаточной близости полученных форм друг к другу (это условие очень часто выполняется на практике) можно использовать методы многомерной статистики для дальнейшего анализа.
Многомерные статистические методы могут использоваться для проверки статистических гипотез о факторах, которые влияют на форму, и для визуализации их эффектов. Например, в качестве фактора может выступать возраст индивида в биологических исследованиях. Для обобщения вариации данных, снижения размерности и визуализации широко используют метод главных компонент (PCA, principal component analysis). Он формирует новые признаки (компоненты), являющиеся линейной комбинацией исходных, удаляя взаимную корреляцию между компонентами и заключая в первых нескольких компонентах максимально возможную долю дисперсии исходных данных. Каждая компонента PCA является собственным вектором ковариационной матрицы переменных формы. Первая компонента учитывает максимальную вариацию в данных, каждая последующая компонента максимальную вариацию данных за вычетом предыдущих компонент. Такое преобразование позволяет оставить в рассмотрении несколько первых компонент, которые суммарно объясняют основную долю вариации в данных. Полученные компоненты используют для кластеризации объектов, сравнения групп объектов и визуализации их схожести или отличий, чтобы визуализировать разницу между средней формой в популяции и отклонение формы индивидуума от среднего значения в популяции.
На данный момент методы ГМ широко используются в биологии, антропологии, эволюционной и популяционной экологии, археологии, истории архитектуры. Среди возможных вариантов анализа могут быть: тест на различие средних форм между группами, визуализация подтвержденных различий между формами. Например, Laparie M, et al. [36] исследовали изменения морфологии крыла красноголовой мухи при миграции в субантарктическом архипелаге. С помощью ГМ авторы сравнивали форму крыла между разными популяциями (фактор популяции) и в разные моменты времени (фактор времени), и продемонстрировали, что крылья мух претерпевали значительные изменения формы в процессе адаптации к окружающей среде, и эти траектории этих изменений отличались в разных популяциях. Hennessy RJ, et al. [37] искали отличия в форме лица пациентов с диагнозом биполярное расстройство от контрольной группы. С помощью ГМ также может быть изучено влияние количественных факторов. Например, Klingenberg CP [38] подробно разбирает методы исследования связи формы и размера на измерениях черепов крыс, произведенных в разном возрасте.
Исследования, использующие методы ГМ для оценки формы камер сердца, редки. Нами найдены лишь работы итальянской группы исследователей Piras P, et al. [39-41]. Самые ранние работы об использовании методов ГМ для кардиологических данных начинаются с 2014г, их исследования продолжаются и по сегодняшний день. Так, был предложен метод оценки движения ЛЖ с использованием модифицированного набора инструментов ГМ для изучения не только формы ЛЖ, но также и ориентации его траектории во времени [39].
Piras P, et al. [40] использовали данные МРТ сердца из базы данных Cardiac Atlas Project для построения классификатора, разделяющего асимптоматичных волонтеров (n=300) и пациентов с ИМ (n=300). Для каждого субъекта были извлечены 1089 ориентиров для эндокардиальной и эпикардиальных поверхностей в каждый момент времени. Затем была выполнена нормализация по времени, в результате которой каждый сердечный цикл был представлен 30 формами, с конечной диастолой в первой форме, и конечной систолой в одиннадцатой. С помощью метода главных компонент авторы выразили каждую форму через 10 главных компонент формы. Классификатор (метод опорных векторов), основанный на 10 компонентах формы эндокардиальной поверхности ЛЖ в каждый момент времени, позволил отличить пациентов с ИМ с точностью 94%.
Аналогичным образом по данным 3D-ЭхоКГ был построен классификатор, позволяющий отличить здоровую контрольную группу (n=82) от пациентов с диагнозом гипертрофическая кардиомиопатия (n=21) и субъектов без манифестации заболевания, но являющихся носителями мутации в генах саркомерных белков (n=11) [41]. Метод опорных векторов, основанный на полученных признаках, достиг точности 91%.
В собственных исследованиях мы использовали методы ГМ для анализа формы ЛЖ пациентов с ХСН, прошедших имплантацию устройства СРТ [42]. В частности, мы провели пилотное исследование и оценили прогностическую способность дооперационных признаков формы ЛЖ и его деформации в сердечном цикле, полученных методами ГМ, для оценки эффективности СРТ через 6 мес. после имплантации ресинхронизирующего устройства. Критерием ответа на СРТ являлось увеличение ФВ ЛЖ более, чем на 5%, и снижение конечно-систолического объема ЛЖ более, чем на 15%, спустя 6 мес. после операции. Пациенты, ответившие на СРТ, были отнесены к группе респондеров (n=13), остальные — к группе нереспондеров (n=13). С помощью процедур ГМ и PCA были выделены 5 главных компонент формы ЛЖ. Были найдены статистические различия в деформациях формы ЛЖ в конечную систолу и в мезодиастолу сердечного цикла между респондерами и нереспондерами (рис. 5). Точность классификации на рассматриваемой когорте составила 92% (при кросс-проверке 88,5%). Важно отметить, что по дооперационным клиническим характеристикам, входящим в стандартные протоколы исследования пациентов до СРТ, не было выявлено значимых различий между пациентами, ответившими и не ответившими на терапию.
Как показывают результаты наших исследований, параметры формы ЛЖ и ее изменения в течение сердечного цикла обладают диагностической ценностью для раннего выявления ухудшения систолической функции сердца, прогноза прогрессирования заболевания у больных ХСН, также могут быть полезны для стратификации пациентов на процедуры имплантации устройства СРТ.

Рис. 4. Ориентиры расставленные на эндокардиальном контуре ЛЖ из эхокардиографического изображения.

Рис. 5. Сравнение в течение сердечного цикла значений компонент формы респондеров (зеленая линия) и нереспондеров (красная линия) на СРТ [42].
Примечание: изображены средние значения вместе с 95% доверительными интервалами. Широкими линиями на горизонтальной оси подчеркнуты моменты времени, в которые группы статистически значимо отличаются. Цветное изображение доступно в электронной версии журнала.
Заключение
Рассмотренные работы подтверждают интерес и актуальность исследования формы ЛЖ и ее динамики в течение сердечного цикла при различных состояниях сердечно-сосудистой системы. Опираясь на собственный опыт и на результаты других исследователей в этой области, мы видим, что динамическое изменение конфигурации ЛЖ в сердечном цикле тесно связано с его механической функцией. Полученные результаты свидетельствуют о перспективе применения предложенных методов для оценки изменения формы ЛЖ в течение сердечного цикла в контексте ранней диагностики сердечных патологий. Динамические характеристики формы ЛЖ обладают предсказательной способностью, позволяют выявить ранее ухудшение систолической функции до снижения глобальных индексов насосной функции ЛЖ. Также они демонстрируют высокий потенциал в прогнозе успешности коррекции механической диссинхронии желудочков сердца при помощи СРТ.
На наш взгляд, оценка особенностей изменения формы камер сердца во время сердечного цикла может стать новым стандартом клинического исследования состояния ЛЖ, облегчающим раннюю диагностику и лечение сердечных патологий, в т. ч. полезным инструментом для скрининговых исследований. В связи с этим остается большое поле для исследования формы ЛЖ в сердечном цикле при различных ССЗ, и уточнения имеющихся результатов на больших когортах пациентов.
Благодарности. Авторы выражают благодарность А. В. Белоусовой за прочтение текста и полезные советы по его улучшению.
Отношения и деятельность. Выполнено при поддержке грантом РНФ № 24-15-00335.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Рокеах Р.О., Чумарная Т.В., Соловьёва О.Э. Методы анализа формы левого желудочка в оценке диссинхронии сокращения и прогнозе ее коррекции. Российский кардиологический журнал. 2024;29(4S):6189. https://doi.org/10.15829/1560-4071-2024-6189. EDN: RILJYK
Скопировать