Клинический случай хирургического лечения новорожденного с критической коарктацией аорты с применением паллиативного стентирования
Аннотация
Введение. Коарктация аорты (КоАо) — это врожденное выраженное сужение перешейка аорты, которое, в свою очередь, часто сопровождается нарушением перфузии внутренних органов или даже кардиогенным шоком. У новорожденных при критической КоАо в случае закрытия открытого артериального протока (ОАП) клиническое состояние пациентов с данным врожденным пороком сердца (ВПС) резко ухудшается и приводит к развитию полиорганной недостаточности. В данной группе детей летальность составляет от 30 до 50% младенческой смертности от ВПС. Данный клинический случай демонстрирует положительный эффект паллиативного стентирования суженного участка аорты, что позволило безопасно выполнить радикальную коррекцию ВПС.
Описание случая. Мальчик Д. возрастом 9 дней с массой тела 3,5 кг, длиной тела 53 см поступил в клинику с диагнозом ВПС: Критическая КоАо. Дефект межпредсердной перегородки вторичного типа. ОАП-зависимость. Синдром полиорганной недостаточности. В ходе проведенного консилиума, с учетом тяжелого коморбидного фона в виде синдрома полиорганной недостаточности, высокого риска развития некротического энтероколита, было принято решение о поэтапной коррекции ВПС: паллиативное рентгенэндоваскулярное стентирование критической КоАо первым этапом, и после стабилизации общего состоянии ребенка проведение радикальной хирургической коррекции порока, что и было успешно проведено.
Заключение. Процедуру стентирования критической КоАо можно использовать как «мост» к радикальной хирургической коррекции порока у новорожденных детей при полиорганной недостаточности. Данное паллиативное вмешательство помогает стабилизировать ребенка на период до 3 нед. и более безопасно выполнить радикальную хирургическую коррекцию КоАо.
Коарктация аорты (КоАо) — врожденное выраженное сужение перешейка аорты, которое, в свою очередь, часто сопровождается нарушением перфузии внутренних органов или даже кардиогенным шоком. Распространенность коарктации 0,2-0,6 на 1 тыс. родившихся живыми, частота составляет 5-8% среди всех врожденных пороков сердца (ВПС) [1]. Действительно, КоАо является одним из наиболее часто встречающихся ВПС с дуктус-зависимым кровотоком, приводящим к развитию критических состояний примерно в 64% случаев. Критическое состояние новорожденного с КоАо характеризуется острым дефицитом сердечного выброса, быстрым прогрессированием сердечной недостаточности, кислородным голоданием тканей с развитием декомпенсированного метаболического ацидоза и нарушением функции жизненно важных органов [2].
Частота летальных исходов зависит от функционирования открытого артериального протока (ОАП). В случае закрытия ОАП клиническое состояние пациентов с данным ВПС резко ухудшается и приводит к развитию полиорганной недостаточности [3, 4]. В данной группе детей летальность составляет от 30 до 50% младенческой смертности от ВПС [5]. Введение высоких доз простагландина Е1 не всегда может быть эффективным для реканализации ОАП [6]. И в таком случае экстренное хирургическое вмешательство является единственным методом спасения новорожденного. Но при декомпенсированном состоянии ребенка риск радикальной коррекции порока очень высок, и тогда предпочтительна поэтапная коррекция порока с применением паллиативного рентгенэндоваскулярного вмешательства в объеме стентирования критической КоАо.
Описание случая
Мальчик Д. возрастом 9 дней с массой тела 3,5 кг, длиной тела 53 см поступил в клинику с диагнозом ВПС: Критическая КоАо. Дефект межпредсердной перегородки вторичного типа. ОАП-зависимость.
Из анамнеза известно, что после рождения состояние ребенка было расценено как удовлетворительное, ребенок был выписан из роддома на пятые сутки жизни. На седьмые сутки жизни мамой отмечена вялость ребенка, отказ от грудного вскармливания, наблюдался цианоз носогубного треугольника, выраженное беспокойство, а также вздутие живота. Бригадой скорой медицинской помощи ребенок экстренно госпитализирован в отделение реанимации и интенсивной терапии новорожденных Областной больницы. При поступлении общее состояние тяжелое за счет выраженной дыхательной недостаточности, недостаточности кровообращения, угнетения центральной нервной системы, насыщение артериальной крови кислородом (SpO2) не превышало 75%, ребенок в экстренном порядке переведен на искусственную вентиляцию легких (ИВЛ). При обследовании по данным трансторакальной эхокардиографии (ЭхоКГ) выявлена критическая КоАо, в лечении назначен алпростадил в дозе 50 нг/кг/мин. При измерении артериального давления на руке 87/49 мм рт.ст.,
SpO2 — 90%, на ноге давление не определялось, SpO2 — 80%. Ребенок консультирован кардиохирургом, рекомендован экстренный перевод в реанимационное отделение Кардиоцентра.
При поступлении в Кардиоцентр общее состояние крайне тяжелое обусловлено сердечной недостаточностью, артериальной гипертонией (при измерении артериального давления на верхних конечностях), гипоперфузией органов, кровоснабжаемых из артериальных ветвей дистальнее КоАо, дыхательной недостаточностью, кардиогенным синдромом малого сердечного выброса. Из-за выраженной дыхательной недостаточности ребенок находился на ИВЛ. Сатурация на руках 91%, на ногах 87%. При аускультации сердца тоны ритмичные, приглушенные, систолический шум во всех точках, частота сердечных сокращений 166 уд./мин. Артериальное давление на правой руке 92/68 мм рт.ст., на правой ноге 58/33 мм рт.ст., пульс на бедренных артериях резко ослаблен. Живот напряженный, печень плотная, ниже реберной дуги на 4 см. У ребенка наблюдалась анурия, мочеиспускание только по катетеру Фоллея, скорость клубочковой фильтрации снижена до 44,907 мл/мин/1,73 м2. По данным биохимического анализа крови у ребенка повышены значения аспартатаминотрансферазы до 842 ед/л (в 24 раза превышает референсные значения), аланинаминотрансфераза до 608 ед/л (в 13 раз превышает референсные значения), имеется выраженная гипербилирубинемия за счет непрямой фракции до 191,3 мкмоль/л, желтушность кожных покровов, отсутствие стула.
По данным ультразвукового исследования органов брюшной полости имеются признаки пареза кишечника. По данным электрокардиограммы ритм синусовый. По данным трансторакальной ЭхоКГ: фракция выброса левого желудочка 55%, конечно-диастолический объем 8 мл, конечно-систолический объем 4 мл, левое предсердие 1,5 см, восходящий отдел аорты 0,8 см; дуга аорты 0,8 см; перешеек аорты имеет выраженное сужение просвета до 0,2 см; максимальный градиент давления (P max) на перешейке 52 мм рт.ст., ОАП 0,3 см — сброс двунаправленный. По данным мультиспиральной компьютерной томографии: на уровне отхождения брахицефального ствола аорта 8×6,5 мм, от уровня отхождения левой общей сонной артерии дуга аорты диаметром до 4 мм. На уровне перешейка диаметр локально сужен до 2,5 мм, далее диаметр нисходящей части аорты до 7,5 мм.
В ходе проведенного консилиума, с учетом тяжелого коморбидного фона в виде полиорганной недостаточности, высокого риска развития некротического энтероколита, было принято решение о поэтапной коррекции ВПС: паллиативная рентгенэндоваскулярная ангиопластика со стентированием критической КоАо первым этапом, и после стабилизации общего состоянии ребенка проведение радикальной хирургической коррекции порока.
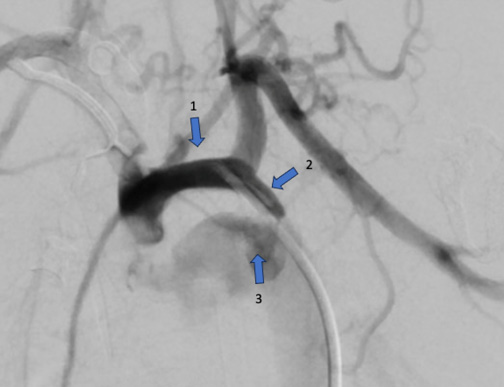
В условиях катетеризационной лаборатории пунктирована общая бедренная артерия справа. По проводнику в артерию установлен интродьюсер с внутренним просветом 4 F (1,32 мм). Выполнена аортография при помощи катетера pigtail с визуализацией КоАо и функционирующим ОАП. Диаметр дуги аорты до отхождения левой подключичной артерии 4,25 мм, зоны сужения 2-2,5 мм, ниже сужения диаметр аорты 8,18 мм, ОАП 4,5 мм (рис. 1).
В область корня аорты заведен коронарный проводник высокой поддержки (support), по нему позиционирован коронарный баллонный катетер диаметром 3,0 мм, длиной 15 мм. Выполнена баллонная ангиопластика давлением 18 атм. Далее проведена замена на коронарном проводнике баллонного катетера на коронарный стент с лекарственным покрытием диаметром 4,0 мм, длиной 12 мм, который имплантирован давлением 20 атм с получением диаметра стента 4,38 мм. Важно отметить, что с учетом массы тела новорожденного ребенка (3,5 кг) и диаметра общих бедренных артерий, не превышающих 1,5-2 мм, имплантация стента проводилась без использования проводникового катетера, и, соответственно, без возможности введения рентгенконтрастного вещества для контроля точности позиционирования стента. Навигация осуществлялась посредством рентген-ориентира на костные структуры (ребра и позвоночник) в стабильной левой косой проекции без изменения высоты операционного стола и положения на нем ребенка.
После выполненного вмешательства проведена контрольная аортография с визуализацией имплантированного стента и прямая тензиометрия: давление в восходящей аорте 41/29 мм рт.ст., среднее давление 29 мм рт.ст., в дуге аорты 38/22, среднее давление 28 мм рт.ст., в зоне стента и нисходящей аорте 33/22, среднее 27 мм рт.ст. Максимальный градиент давления 8 мм рт.ст. Ангиографически отмечено полное расправление имплантированного стента, признаков экстравазации контрастного вещества и диссекции не выявлено (рис. 2).
Интродьюсер из общей бедренной артерии был удален, выполнен гемостаз мануальной компрессией. Наложена асептическая давящая повязка с дозированной компрессией и сохраненным дистальным кровотоком по правой нижней конечности. Пациент переведен в отделение реанимации со стабильной гемодинамикой, без инотропной поддержки кардиотоническими препаратами.
Ребенок был экстубирован через 5 ч после поступления из операционной в отделение реанимации. По данным трансторакальной ЭхоКГ фракция выброса левого желудочка возросла до 63%, максимальный градиент на перешейке аорты снизился в 3 раза, и составил 18 мм рт.ст. В динамике уменьшилась желтушность кожных покровов, печень уменьшилась до нормальных значений, снизились трансаминазы до нормативных значений. Перистальтика кишечника активная, постепенно удалось перейти от парентерального питания на энтеральное. Состояние ребенка стабилизировалось, на девятые сутки отсутствовали противопоказания для проведения радикальной коррекции ВПС в условиях искусственного кровообращения.
На девятые сутки после проведения стентирования ребенку выполняется радикальная коррекция КоАо, доступом через срединную стернотомию. Визуально увеличены правые камеры сердца. Перед основным этапом оперативного вмешательства тщательно мобилизовалась аорта и брахиоцефальные сосуды для минимизации натяжения тканей. Восходящий отдел аорты 7 мм, дуга аорты 6 мм, перешеек аорты 6 мм, ОАП 4 мм. Канюлирована восходящая аорта и полые вены по стандартной методике. Тотчас после начала искусственного кровообращения ОАП отвязан, пересечен, пульмональный конец прошит. Мобилизована нисходящая аорта. После достижения заданной температуры тела 26 С, пережата аорта, антеградная кардиоплегия раствором «Кустадиол» в корень аорты. Пережаты нисходящий отдел аорты, левая общая сонная артерия и правая подключичная артерия. Канюля из восходящей аорты проведена в брахиоцефальную артерию, начата селективная перфузия головного мозга. Перешеек аорты пересечен, в просвете стент, который за 9 дней не успел врасти в эндотелий и удалился без особых усилий (рис. 3). Дуктальная ткань сосуда иссечена до здоровых тканей аорты. По малой кривизне дуга аорты рассечена до средней трети восходящего отдела аорты. Выполнен анастомоз губы дистального отдела дуги аорты и нисходящей аорты на 1/3 окружности. Затем выполнена пластика дуги аорты заплатой из ксеноперикарда. После завершения анастомоза канюля переведена в восходящий отдел аорты, последовательно сняты зажимы с нисходящего отдела аорты, правой подключичной артерии и левой общей сонной артерии, восстановлена перфузия всего организма, начато согревание. Время антеградной перфузии головного мозга составило 25 мин. Правым атриотомным доступом ревизована межпредсердная перегородка, имеется дефект 10×10 мм, который был ушит. Восстановлена целостность правого предсердия. После профилактики воздушной эмболии открыта аорта, сердечная деятельность восстановилась самостоятельно. После стабилизации гемодинамики и согревания больного остановлено искусственное кровообращение (рис. 4), модифицированная ультрафильтрация, деканюляция. Тщательный гемостаз. Послойное ушивание раны. Продолжительность искусственного кровообращения составила 95 мин, продолжительность окклюзии аорты составила 44 мин.
Ребенок с операционной доставлен в отделение реанимации и интенсивной терапии на ИВЛ, с синусовым ритмом. Спустя 98 ч после окончания оперативного вмешательства ребенок был экстубирован и переведен на самостоятельное дыхание. На третьи сутки удалость отойти от кардиотонической поддержки. По данным ЭхоКГ пиковый градиент давления на перешейке аорты составил 7 мм рт.ст., фракция выброса восстановилась до 73%. Клинически у ребенка отмечалась стабильная гемодинамика, он был переведен в палату на 6 послеоперационные сутки после проведения радикальной коррекции ВПС. Функция желудочно-кишечного тракта восстановилась, ребенок на самостоятельном питании. Аускультативно перистальтика хорошая, стул регулярный, самостоятельный. Темпы диуреза сохранны, скорость клубочковой фильтрации нормализовалась. Купирована желтушность кожных покровов, печень сократилась до +1,5 см из-под края рёберной дуги (при поступлении +5 см). На 15 сутки после проведения радикальной коррекции порока ребенок в стабильном состоянии выписывается из стационара без признаков полиорганной недостаточности и без инфекционного статуса.

Рис. 1. Аортография с измерением размеров аорты. 1 — дуга аорты, 2 — перешеек аорты, 3 — ОАП.

Рис. 2. Конечный результат. Стрелкой обозначен имплантированный стент.

Рис. 3. Эксплантированный стент из суженного участка аорты.

Рис. 4. Конечный результат операции. Стрелкой обозначена заплата из ксеноперикарда на дуге аорты.
Обсуждение
Неудовлетворительные результаты первичных кардиохирургических операций у новорожденных с критической КоАо стали основанием для внедрения двухэтапного подхода к хирургическому лечению, главный смысл которого сводился к тому, чтобы при помощи паллиативных рентгенэндоваскулярных процедур (баллонной ангиопластики и стентирования зоны КоАо) стабилизировать состояние и позволить ребенку достичь клинического статуса, при котором радикальная хирургическая коррекция может быть выполнена с меньшими рисками неблагоприятных исходов [7].
Нет сомнения, что критическая КоАо негативно влияет как на функцию левого желудочка, так и на организм новорожденного в целом, из-за уменьшения периферической перфузии [8]. Таким пациентам для поддержания ОАП назначают простагландины, но не всегда получается достичь желаемого эффекта и ОАП может закрыться. В таких случаях наблюдается резкое ухудшение состояния пациента и необходимо экстренное оперативное вмешательство. Но из-за полиорганной недостаточности риск радикальной коррекции остается высоким [9]. У таких пациентов возможно применить поэтапную коррекцию порока со стентированием суженого участка аорты первым этапом и после стабилизации общего состояния выполнить радикальную коррекцию порока. Стентирование суженного участка аорты является общепринятым методом лечения КоАо у детей с массой тела более 15-20 кг, подростков и взрослых [10]. В исследовании, проведенном в НМИЦ им. Мешалкина, было показано, что летальность при первичной хирургической коррекции критической КоАо у детей составила 38,8%, в то время как в группе комбинированной коррекции порока не превышала 10% [4]. По литературным данным оптимальные сроки открытой хирургической коррекции ВПС после стентирования зоны КоАо составляют 2-3 нед., за это время происходит восстановление гемодинамики, почечной функции и общих компенсаторных функций ребенка [10].
Представленный нами случай подчеркивает важность предпринятой тактики поэтапной коррекции КоА с применением стентирования суженного участка аорты первым этапом, что позволило в дальнейшем безопасно и успешно выполнить радикальную коррекцию порока.
Заключение
Процедуру стентирования критической КоАо можно использовать как «мост» к радикальной хирургической коррекции порока у новорожденных детей при полиорганной недостаточности. Данное паллиативное вмешательство помогает стабилизировать ребенка в течение периода до 3 нед. и в последующем более безопасно выполнить радикальную хирургическую коррекцию КоАо.
Информированное согласие от законного представителя пациента на использование медицинских данных в научных целях получено.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Ляпин А.А., Шушпанников П.А., Халивопуло И.К., Тарасов Р.С. Клинический случай хирургического лечения новорожденного с критической коарктацией аорты с применением паллиативного стентирования. Российский кардиологический журнал. 2024;29(3S):6029. https://doi.org/10.15829/15604071-2024-6029. EDN: GJGVEK
Скопировать