Хронический миокардит как причина рецидивирующих эпизодов желудочковой тахикардии и дилатационной кардиомиопатии, потребовавшей трансплантации сердца
Аннотация
Представляем клиническое описание пациентки с рецидивирующими резистентными к лечению эпизодами желудочковой тахикардии, которые впервые возникли в дебюте миокардита и оставались единственными проявлениями заболевания на протяжении нескольких лет. При динамическом наблюдении у больной была диагностирована дилатационная кардиомиопатия, потребовавшая трансплантации сердца.
Желудочковые нарушения ритма (частая желудочковая эктопия, желудочковые тахикардии (ЖТ)) являются состояниями, которые ассоциированы с увеличением риска внезапной сердечной смерти [1]. Наиболее часто (90% случаев) ЖТ возникают на фоне структурной патологии сердца, когда формируются условия для образования аритмогенного субстрата (например, у больных с ранее перенесенным инфарктом миокарда или врожденными пороками сердца). Однако при некоторых заболеваниях миокарда (например, при миокардите, аритмогенных и дилатационных кардиомиопатиях (ДКМП)) нарушения ритма, особенно ЖТ, могут предшествовать структурным изменениям, что затрудняет диагностику и лечение [2][3].
В данной публикации представлено описание клинического случая пациентки с хроническим миокардитом, первым и единственным проявлением которого в течение нескольких лет являлась рецидивирующая резистентная к медикаментозной терапии и катетерной аблации ЖТ. При динамическом наблюдении отмечалось прогрессирование до ДКМП, потребовавшей трансплантации сердца после 20 лет течения болезни. При патоморфологическом исследовании эксплантированного сердца были выявлены признаки диффузного миокардита, а также дилатация желудочков сердца.
Описание случая
Пациентка 1953 г.р., без вредных привычек, с неотягощенным семейным анамнезом, контролируемой артериальной гипертонией. Обзор основных событий клинического случая с указанием медикаментозной терапии представлен на рисунке 1.

Рис. 1. Хронология событий клинического случая.
Сокращения:
БЛНПГ — блокада левой ножки пучка Гиса,
БПНПГ — блокада правой ножки пучка Гиса,
ВПС — врожденный порок сердца,
ДМПП — дефект межпредсердной перегородки,
ЖТ — желудочковая тахикардия,
ЖЭ — желудочковые экстрасистолы,
ЖЭС — желудочковая экстрасистолия,
ЗСЛЖ — задняя стенка левого желудочка,
ИКД — имплантируемый кардиовертер-дефибриллятор,
КАГ — коронароангиография,
КДО — конечный диастолический объем,
КСО — конечный систолический объем,
ЛА — легочная артерия,
ЛЖ — левый желудочек,
ЛП — левое предсердие,
МЖП — межжелудочковая перегородка,
МСКТ-КА — мультиспиральная компьютерная томография коронарных артерий,
ОКС — острый коронарный синдром,
ПЖ — правый желудочек,
РЧА — радиочастотная аблация,
СДЛА — систолическое давление в легочной артерии,
ФВ — фракция выброса,
ХМ — холтеровское мониторирование,
ЭКГ — электрокардиограмма,
Эндо-ЭФИ — эндоваскулярное электрофизиологическое исследование,
ЭхоКГ — эхокардиография.
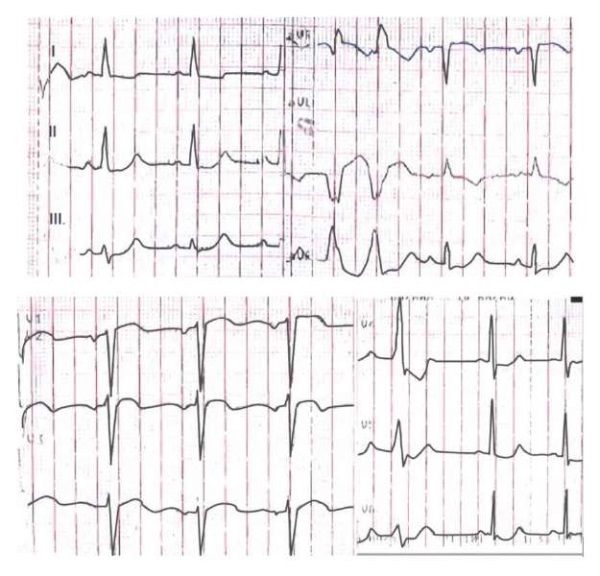
В 1999г в возрасте 47 лет у пациентки, ранее считавшей себя здоровой, впервые возник приступ сердцебиения, спровоцированный физической и эмоциональной нагрузкой. На электрокардиограмме была выявлена мономорфная желудочковая экстрасистолия (рис. 2) и ЖТ с морфологией блокады правой ножки пучка Гиса (рис. 3). При трансторакальной эхокардиографии (ЭхоКГ) был обнаружен дефект межпредсердной перегородки (ДМПП) 9 мм, другие морфофункциональные изменения отсутствовали. Изменений в лабораторных исследованиях (электролиты, гормоны щитовидной железы, воспалительные маркеры) выявлено не было. В дальнейшем эпизоды ЖТ становились более частыми, наблюдалось увеличение выраженности симптомов. Проводилась неоднократная смена антиаритмических препаратов (амиодарон, новокаинамид, соталол, лаппаконитина гидробромид (аллапинин), диэтиламинопропионилэтоксикарбониламинофенотиазин (этацизин), бисопролол) с минимальным эффектом. В 2006г при повторной ЭхоКГ были выявлены признаки легочной гипертензии, дилатация правых отделов сердца и умеренное снижение фракции выброса (ФВ) левого желудочка (ЛЖ) (48%, диффузный гипокинез). При коронарографии гемодинамически значимых изменений выявлено не было. Пациентке было проведено эндоваскулярное электрофизиологическое исследование с радиочастотной аблацией (РЧА) доминирующего аритмогенного фокуса (выходной отдел ЛЖ в области правого синуса Вальсальвы) без существенного интраоперационного эффекта ввиду предполагаемой субэпикардиальной локализации очага. На следующий день было выполнено ушивание ДМПП. После вмешательства при ЭхоКГ было отмечено полное обратное ремоделирование сердца. Однако у пациентки продолжали рецидивировать симптомные эпизоды ЖТ с умеренным эффектом от антиаритмической терапии (амиодарон 200 мг 2 раза/сут.).

Рис. 2. Электрокардиограмма (25 мм/с, 10 мм/мВ):
синусовый ритм с частотой сердечных сокращений 75 уд./мин,
отклонение электрической оси сердца влево,
частая желудочковая экстрасистолия.
Неспецифические изменения реполяризации
(депрессия сегмента ST в отведениях II, III, aVF, V4-V6,
отрицательный зубец T в aVL, двухфазный зубец T в I, V1-V3).

Рис. 3. Электрокардиограмма во время эпизода ЖТ (25 мм/с, 10 мм/мВ):
мономорфная тахикардия с широкими комплексами
и блокадой правой ножки пучка Гиса с частотой 166 уд./мин.
В 2009г была выполнена повторная РЧА аритмогенного субстрата в задне-септальной области правого желудочка (ПЖ), вновь без значимого эффекта. Тогда же при ЭхоКГ выявлена дилатация ЛЖ со снижением ФВ ЛЖ до 36% (диффузный гипокинез), при сцинтиграфии миокарда в покое были обнаружены признаки диффузного снижения перфузии миокарда ЛЖ. В том же году пациентке был имплантирован двухкамерный кардиовертер-дефибриллятор (ИКД), в последующем отмечались многократные обоснованные срабатывания устройства. Проведена замена амиодарона на комбинацию бисопролола 2,5 мг 2 раза/сут. с аллапинином 25 мг 3 раза/сут. – с минимальным эффектом. Через год была назначена терапия: соталол 80 мг 2 раза/сут., периндоприл 2,5 мг в сут., спиронолактон 25 мг в сут. Далее в связи с сохраняющимися рецидивами ЖТ со срабатыванием ИКД проводилась последовательная смена следующих антиаритмических препаратов и их комбинаций: соталол 80 мг 2 раза сут. ? метопролола тартрат 50 мг 2 раза/сут. ? соталол 80 мг 3 раза/сут. ? этацизин 50 мг 2 раза/сут. ? соталол 80 мг 3 раза/сут. ? соталол + аллапинин (дозы неизвестны) ? амиодарон 400 мг 3 раза/сут. + пропранолол 40 мг 2 раза/сут. ? соталол 160 мг 3 раза/сут.
В 2012г впервые при ЭхоКГ были обнаружены признаки некомпактного миокарда ЛЖ (НМЛЖ), ФВ ЛЖ была умеренно снижена (42%). Мультиспиральная компьютерная томография коронарных артерий (МСКТ-КА) выявила увеличение трабекулярности ЛЖ и несколько жировых очагов в миокарде ПЖ. В крови определялся повышенный уровень антимиокардиальных антител, при этом вирусные и дополнительные иммунные тесты были отрицательными. На основании данных обследования были сформулированы следующие диагностические концепции: аритмогенная кардиомиопатия ПЖ, хронический миокардит и НМЛЖ. Был рекомендован прием следующих препаратов: соталол 40 мг 3 раза/сут., амиодарон 200 мг 2 раза/сут., лизиноприл 15 мг в сут., ацетилсалициловая кислота 100 мг в сут., амлодипин 2,5 мг в сут., гидроксихлорохин 200 мг в сут. На этом фоне эпизоды ЖТ продолжали рецидивировать, неоднократно требовались повторные госпитализации.
В 2016г во время очередной РЧА были индуцированы ЖТ трех различных морфологий (рис. 4).

Рис. 4. Электрофизиологическое исследование:
ЖТ с тремя различными морфологиями (150 мм/с).
(A) ЖТ с верхней осью и морфологией БЛНПГ.
(B) ЖТ с нижней осью и морфологией БПНПГ.
(C) ЖТ с нижней осью и морфологией БЛНПГ.
Сокращения:
БЛНПГ – блокада левой ножки пучка Гиса,
БПНПГ – блокада правой ножки пучка Гиса.
В 2018г пациентка поступила в наш стационар с подозрением на острый коронарный синдром. По результатам коронароангиографии и определения тропонина в динамике данных за инфаркт миокарда получено не было. При ЭхоКГ сократительная функция миокарда нарушена не была (ФВ ЛЖ 50%). Во время госпитализации у пациентки регистрировались многократные эпизоды ЖТ («электрический шторм»), потребовавшие не менее десяти электрических кардиоверсий. При холтеровском мониторировании на фоне ранее назначенной терапии соталолом 160 мг 2 раза/сут., помимо эпизодов мономорфной ЖТ, наблюдались эпизоды полиморфной ЖТ по типу пируэт на фоне удлинения интервала QTc (461-517 мс), что потребовало отмены препарата. Других потенциально обратимых причин дестабилизации состояния больной выявлено не было. Критическое истощение заряда батареи ИКД потребовало перевода пациентки в другой стационар для реимплантации устройства. Несмотря на неоднократные попытки коррекции антиаритмической терапии (амиодарон ? амиодарон + метопролола сукцинат ? соталол + аллапинин), эндоваскулярную радиочастотную денервацию почечных артерий и очередную РЧА аритмогенного фокуса ЛЖ, а также спинальную анестезию ропивакаином в последующем вновь наблюдалось развитие «электрического шторма» с эпизодами остановки кровообращения и множественными обоснованными срабатываниями ИКД.
Учитывая неэффективность проводимой терапии, пациентка была переведена для выполнения трансплантации сердца. При ЭхоКГ перед трансплантацией – ФВ ЛЖ 33% (без зон нарушения локальной сократимости), конечный диастолический объем 205 мл, конечный систолический объем 101 мл, межжелудочковая перегородка 9 мм, задняя стенка ЛЖ 8 мм, ПЖ 39 мм, систолическое давление в легочной артерии 60 мм рт.ст. В качестве моста перед трансплантацией ввиду терминального состояния пациентки была выполнена постановка бивентрикулярного обхода желудочков сердца, дополненного мембранным оксигенатором. В январе 2019г пациентке была выполнена ортотопическая трансплантация сердца.
При макроскопическом патологоанатомическом исследовании сердца отмечались дилатация обоих желудочков, начальные явления атеросклероза коронарных артерий. При гистологическом исследовании были обнаружены диффузный отек и диффузно-очаговая воспалительная инфильтрация интерстиция, состоящая из лимфоцитов, нейтрофилов, макрофагов, единичных плазмоцитов; диффузный склероз интерстиция, периваскулярное разрастание соединительной ткани, липоматоз ПЖ. Признаков фиброзно-жирового замещения миокарда, свойственного аритмогенной кардиомиопатии, выявлено не было. Данных за НМЛЖ также получено не было.
Согласно результатам плановых обследований после трансплантации (последнее в 2022г), нарушение функции сердечного трансплантата, стенотическое поражение коронарных артерий отсутствовали. На фоне иммуносупрессивной терапии (такролимус, микофенолата мофетил) наблюдалось развитие распространенного остеопороза тяжелого течения.
Обсуждение
ЖТ может возникать как при наличии, так и при отсутствии явного структурного заболевания сердца, определяя широкий спектр дифференциальных диагнозов [1]. Анализ данного клин ического случая представляет значительные затруднения в связи с длительным течением заболевания (приблизительно 20 лет), наблюдением пациентки в различных лечебных учреждения, существенными изменениями, связанными с подходами к диагностике и лечению за представленный период.
В первую очередь после проведения коронароангиографии была исключена ишемическая болезнь сердца как возможная причина желудочковой экстрасистолии/ЖТ. На основании результатов проведенных лабораторных обследований были также исключены потенциально обратимые причины (электролитные и эндокринные расстройства). Связь ДМПП и аритмии представлялась маловероятной, поскольку ЖТ прогрессировала после хирургической коррекции порока сердца и полного обратного ремоделирования сердца. Идиопатическая ЖТ была исключена ввиду последующего снижения систолической функции и ремоделирования ЛЖ, а также увеличения комплексности желудочковой аритмии.
На основании дополнительных диагностических данных (жировые очаги в миокарде ПЖ по данным МСКТ-КА [1][4], признаки НМЛЖ по данным ЭхоКГ [5][6], снижение перфузии миокарда по данным сцинтиграфии [2][3][5], повышенный уровень антимиокардиальных антител) была выдвинута гипотеза о смешанном генезе ЖТ в рамках аритмогенной кардиомиопатии ПЖ, НМЛЖ и хронического миокардита. Однако при гистологическом исследовании эксплантированного сердца был подтвержден только миокардит, признаки ДКМП. При анализе ЭхоКГ изменений за весь период наблюдения обращают на себя внимание существенные колебания показателей систолической функции ЛЖ. Так, в 2009г ФВ составляла 36%, в 2018г – 50%, а в 2019г – вновь снизилась до 33%. Динамика данного показателя, вероятно, может отображать волнообразный характер хронического воспаления миокарда, кроме того, на систолическую функцию ЛЖ могли влиять преходящие желудочковые нарушения ритма, увеличение бремени которых могло способствовать систолической дисфункции.
Отдельного внимания заслуживает медикаментозная терапия, назначаемая пациентке в разные годы. Использовались антиаритмические препараты и их комбинации с высоким проаритмогенным потенциалом, что противоречит как актуальным [1], так и ранее опубликованным клиническим рекомендациям [7]. В частности, назначались соталол + амиодарон, соталол + аллапинин на фоне выраженных структурно-функциональных изменений ЛЖ. Можно предположить, что их назначение отчасти было продиктовано резистентным характером желудочковых аритмий и носило характер «терапии отчаяния». Также обращает внимание несвоевременное назначение болезнь-модифицирующей терапии при верификации в 2009г сердечной недостаточности с низкой ФВ ЛЖ.
Диагностика миокардита сложна из-за большого разнообразия клинических проявлений [1-3]. В некоторых случаях ЖТ может быть единственным симптомом, требующим дифференциальной диагностики. Представленные в литературе описания случаев миокардита, манифестирующих злокачественными желудочковыми аритмиями, касаются в основном острых фульминантных форм миокардита, в частности гигантоклеточного варианта [8-13]. В нашем случае желудочковые нарушения ритма были первым проявлением хронического миокардита.
Воспаление миокарда может носить как инфекционный, так и неинфекционный характер [2v3], но в 50% случаев причину установить не удается. В нашем случае генез миокардита также верифицировать не удалось. В связи с отсутствием специфических для миокардита клинических признаков его следует подозревать у всех пациентов с желудочковыми аритмиями, особенно у молодых пациентов без кардиологического анамнеза. В представленном случае повышенный уровень антимиокардиальных антител и сниженная перфузия миокарда по данным сцинтиграфии свидетельствовали в пользу миокардита, однако специфичность этих результатов низкая [2][3]. Наиболее надежным неинвазивным методом диагностики миокардита является магнитно-резонансная томография (МРТ) сердца, в представленном случае пациентке на ранних этапах проведение МРТ не предлагалось, а в дальнейшем ситуация усугубилась имплантацией пациентке ИКД, несовместимого с МРТ. Золотым стандартом диагностики миокардита считается эндомиокардиальная биопсия, однако в связи с инвазивностью, риском осложнений и вариабельностью интерпретации результатов, её выполняют достаточно редко. Действующие рекомендации Европейского общества кардиологов [2] и Американского общества кардиологов [5] существенно различаются в отношении показаний к биопсии. У нашей пациентки эндомиокардиальную биопсию не проводили.
По своему течению миокардит может быть острым, подострым или хроническим, а также проявляться очаговым или диффузным поражением миокарда [2][3]. Согласно имеющейся литературе, у 30% пациентов с подтвержденным биопсией миокардитом может произойти прогрессирование до ДКМП, что сопряжено с неблагоприятным прогнозом [5][14]. У представленной пациентки персистирующее диффузное воспаление миокарда, выявленное при патогистологическом исследовании сердца, вероятно, является основной причиной ДКМП. Таким образом, в отношении этого случая можно использовать термин «воспалительная кардиомиопатия» [14]. По данным анамнеза и дальнейшего обследования других причин (инфильтративных, эндокринных или системных заболеваний) ДКМП установлено не было. Однако нельзя исключить вклад частой желудочковой аритмии, а также генетических факторов в ремоделирование сердца [1-3][5][15].
Таким образом, в отсутствие патогномоничных признаков и симптомов, а также идеального метода диагностики, воспалительное заболевание миокарда следует заподозрить как потенциальную причину ЖТ, резистентной к терапии, даже у пациентов без дилатации сердца. Несмотря на все использованные высокотехнологичные методы лечения, течение заболевания осложнилось развитием терминальной сердечной недостаточности, для спасения жизни пациентки потребовалась трансплантация сердца. Миокардит был подтвержден только при гистологическом исследовании эксплантированного сердца.
Заявление о получении информированного добровольного согласия у пациента
Согласие на использование информации в научных целях получено.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Ставцева Ю.В., Тетерина М.А., Убайдуллаева Д.А., Воробьев А.С., Мерай И., Кобалава Ж.Д. Хронический миокардит как причина рецидивирующих эпизодов желудочковой тахикардии и дилатационной кардиомиопатии, потребовавшей трансплантации сердца. Российский кардиологический журнал. 2023;28(3S):5392. https://doi.org/10.15829/1560-4071-20235392. EDN: IBBGDG
Скопировать