Почечная дисфункция у пациентов с тромбоэмболией лёгочной артерии по данным регистра СИРЕНА
Тромбоэмболия лёгочной артерии (ТЭЛА) является одним из наиболее распространенных ургентных сердечно-сосудистых заболеваний (ССЗ) [1]. Несмотря на значительные успехи, достигнутые в диагностике и лечении заболевания, сохраняется высокая частота неблагоприятных исходов [2][3].
В настоящее время у пациентов с острыми ССЗ большое внимание уделяется вопросам кардиоренальных взаимоотношений, что обусловлено повышенным риском развития и/или прогрессирования почечной дисфункции (ПД) [4-8] и ее неблагоприятным влиянием на прогноз [4][5][9]. Указанные взаимодействия описаны у пациентов с острым коронарным синдромом (ОКС) и сердечной недостаточностью и изложены в концепциях кардиоренальных синдромов и кардиоренального континуума [10][11]. Распространенность нарушения функции почек и ее прогностическое влияние при ТЭЛА изучены недостаточно, а имеющиеся данные ограничены небольшим числом исследований, преимущественно ретроспективных [12]. Оценка почечной функции у пациентов с ТЭЛА, учитывая применение антикоагулянтов, доза и кратность введения которых зависят от клиренса креатинина, носит обязательный характер, однако врачами нередко игнорируется [13]. Частота ПД при легочной эмболии, по имеющимся на сегодняшний момент данным, значительно варьирует, достигая 72% [14]. Принимая во внимание, что нарушение почечной функции увеличивает риск развития венозных тромбоэмболий (ВТЭ) [12][15], распространённость ее ожидается высокой.
Одним из способов снижения госпитальной летальности и смертности у пациентов с ТЭЛА является ранняя стратификация риска смерти. Предполагается, что оценка почечной функции при легочной эмболии, по аналогии с ОКС, где значение креатинина сыворотки крови служит одним из параметров оценки риска неблагоприятного исхода (шкала GRACE), позволит улучшить прогностические возможности существующего подхода.
В Российской Федерации до настоящего момента отсутствовали специальные многоцентровые регистрационные эпидемиологические программы (регистры) ТЭЛА, которые позволили бы объективно оценить, в т.ч., распространенность ПД у пациентов российской популяции. Получение результатов Российского многоцентрового регистра ТЭЛА “СИРЕНА” дает возможность для такого анализа.
Цель настоящей работы оценка частоты, выраженности и прогностического значения ПД у пациентов с ТЭЛА российской популяции. Определить значение ПД как маркера, улучшающего прогнозирующую способность имеющихся систем стратификации риска.
Материал и методы
Настоящая работа выполнялась ретроспективно и основана на данных Российского многоцентрового наблюдательного проспективного регистра “СИРЕНА”, который проводился в 20 стационарах 15 городов России (Биробиджан, Казань, Кемерово, Майкоп, Нижний Новгород, Пермь, Рязань, Самара, Санкт-Петербург, Сочи, Тверь, Томск, Ульяновск, Улан-Удэ). Особенности организации и проведения регистра подробно описаны в предшествующих публикациях [16]. В регистр включались все последовательно госпитализированные взрослые пациенты, у которых выявлены признаки, позволяющие диагностировать ТЭЛА, а также умершие в стационаре, у которых диагноз установлен при проведении патологоанатомического исследования. Набор пациентов осуществлялся с апреля 2018г по апрель 2019г. Протокол исследования был одобрен на заседаниях локальных этических комитетов. Все прижизненно включенные обследуемые дали информированное согласие на участие в регистре. У каждого пациента учитывались многочисленные параметры: демографические данные, симптомы при поступлении, факторы риска (ФР) ВТЭ, предшествующее госпитализации медикаментозное лечение, результаты методов исследования, терапевтическое ведение, осложнения и исход госпитализации.
В предыдущих статьях представлены данные, касающиеся обследуемых с прижизненной диагностикой ТЭЛА [16]. В настоящей работе в анализ добавлены пациенты с посмертно установленным диагнозом. Поскольку в статье рассматриваются вопросы, связанные с ПД, в изучаемую когорту вошли только те обследуемые, у кого в базе данных был зарегистрирован уровень креатинина сыворотки крови. Функция почек оценивалась по скорости клубочковой фильтрации (СКФ), рассчитанной по формуле CKD-EPI [17]. Принимая во внимание ограничения регистра СИРЕНА, когда за весь период госпитализации в базе данных фиксировалось только одно значение креатинина, затруднительно было дифференцировать хроническую болезнь почек (ХБП) от острого повреждения почек (ОПП) и можно говорить лишь о наличии ПД, которую диагностировали при СКФ <60 мл/мин/1,73 м2.
Стратификация риска ранней (госпитальной или 30-дневной) смерти осуществлялась в соответствии с действующими клиническими Рекомендациями Европейского общества кардиологов (2019) [18]. Высокий риск летального исхода определялся при наличии персистирующей гипотензии и/или обструктивного шока при поступлении [18]. У остальных пациентов на основе клинических и демографических характеристик рассчитывали индекс тяжести ТЭЛА (PESI) и упрощенный индекс тяжести (sPESI) [18].
Проводилась оценка продолжительности госпитального периода. Осуществлялся анализ госпитальной летальности. Учитывались неблагоприятные события, развившиеся в течение стационарного этапа лечения.
Статистическая обработка материала проводилась с помощью программ STATISTICA 6.0 (StatSoft, Inc (США)) и MedCalc 11.6 (MedCalc Software bvba (Belgium)). Выбор вида распределения количественных данных осуществлялся по критерию ШапироУилка. В случае приближенно нормального распределения данные представлены в виде M±SD, где M — среднее арифметическое, SD — стандартное отклонение. В противном случае данные представлены в виде Me (ИКР), где Me — медиана, ИКР — интерквартильный размах: 25 процентиль — 75 процентиль. Качественные переменные описаны абсолютными (n) и относительными (%) значениями. Достоверность различий между двумя группами несвязанных переменных при нормальном распределении определяли по критерию t Стьюдента, в противном случае использовали Mann-Whitney U test. Для сравнения двух групп по качественному признаку использовали ?2 Пирсона. Для сравнения трех групп и более по одному независимому признаку использовали ранговый анализ вариаций по Краскелу-Уоллису. Для прогнозирования вероятности развития события выполняли регрессионный анализ в модели пропроционального риска Кокса. Для оценки точности диагностического метода применяли ROC-анализ. Во всех случаях нулевая гипотеза отвергалась при р<0,05.
Результаты
Всего в российский регистр ТЭЛА “СИРЕНА” было включено 660 пациентов. В последствии 56 обследуемых были исключены из анализа в связи с отсутствием данных об уровне креатинина сыворотки крови. В итоге исследуемая когорта составила 604 пациента, из которых мужчин было 293 (49%), женщин — 311 (51%), средний возраст — 64±15 лет.
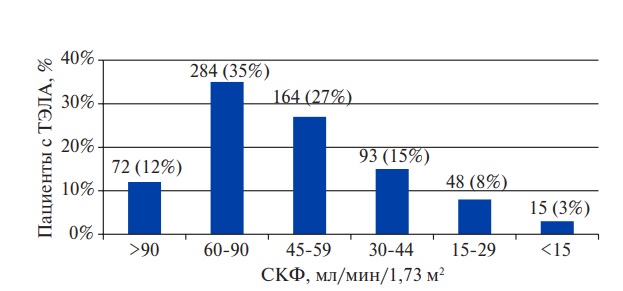
ПД выявлена у 320 (53%) обследуемых, при этом тяжелое нарушение функции почек (СКФ <30 мл/мин/1,73 м2) отмечалось у каждого десятого (рис. 1). ХБП в анамнезе была зарегистрирована только у 61 (10%) пациента.

Рис. 1. Распределение пациентов с ТЭЛА в зависимости от уровня СКФ.
Сокращения: СКФ — скорость клубочковой фильтрации, ТЭЛА — тромбоэмболия легочной артерии.
Исходная демографическая и клиническая характеристика, в зависимости от наличия ПД, представлена в таблице 1, результаты объективного осмотра, лабораторных, инструментальных методов исследования и оценки индексов тяжести ТЭЛА — в таблице 2, госпитальная летальность и неблагоприятные события во время госпитализации — в таблице 3.
Среди пациентов с нарушенной функцией почек преобладали лица мужского пола, они были старше, чаще имели в анамнезе заболевания, которые по большей части являются ФР ВТЭ (ССЗ, инфаркт миокарда, инсульт/транзиторная ишемическая атака, артериальная гипертензия, хроническая сердечная недостаточность, фибрилляция предсердий, сахарный диабет, ХБП, хроническая обструктивная болезнь легких, рак) (табл. 1).
Таблица 1
Общая характеристика, анамнез, ФР и клинические признаки у пациентов с ТЭЛА в зависимости от наличия ПД

Сокращения: АГ — артериальная гипертензия, ИМ — инфаркт миокарда, ПД — почечная дисфункция, СД — сахарный диабет, ССЗ — сердечно-сосудистые заболевания, ТГВ — тромбоз глубоких вен, ТИА — транзиторная ишемическая атака, ТЭЛА — тромбоэмболия легочной артерии, ХСН — хроническая сердечная недостаточность, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких.
В группе обследованных с ПД симптомы заболевания в виде кровохарканья, кашля, боли в грудной клетке встречались реже, при этом объективные признаки (цианоз, увеличение шейных вен) наблюдались чаще (табл. 1). В случае нарушенной функции почек выявлялся более низкий уровень диастолического артериального давления, сатурации и более высокая частота дыхания (табл. 2). В общем анализе крови у пациентов с ПД уровень гематокрита и тромбоцитов был ниже, а лейкоцитов — выше (табл. 2). По данным эхокардиографии в группе обследованных с нарушенной функцией почек отмечался более низкий уровень фракции выброса левого желудочка и более высокий — систолического давления в легочной артерии (табл. 2).
Таблица 2
Результаты объективного осмотра, лабораторных, инструментальных методов исследования и оценки индексов тяжести у пациентов с ТЭЛА в зависимости от наличия ПД

Сокращения: АД — артериальное давление, ИАГ — инвазивная ангиография, КТА — компьютерная томографическая ангиография, ПД — почечная дисфункция, ПЖ — правый желудочек, ПП — правое предсердие, РКС — рентгеноконтрастные средства, ТЭЛА — тромбоэмболия легочной артерии, УЗДГ — ультразвуковая допплерография, ФВ — фракция выброса, ЧД — частота дыхания, ЧСС — частота сердечных сокращений, PESI — индекс тяжести тромбоэмболии легочной артерии, sPESI — упрощенный индекс тяжести тромбоэмболии легочной артерии.
Компьютерная томографическая ангиография для подтверждения ТЭЛА была выполнена у 501 (83%) пациента. Сцинтиграфия лёгких и ангиография легочной артерии применялись в обоих случаях у 5 обследуемых (по 0,8%). У пациентов с ПД методы, связанные с введением рентгеноконтрастных средств (РКС), использовались реже, при этом посмертная диагностика осуществлялась чаще (табл. 2).
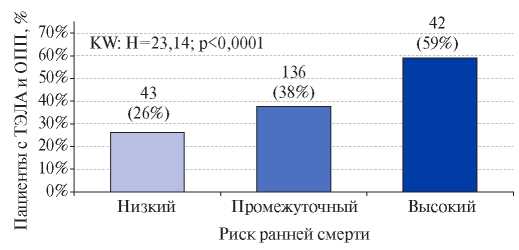
71 (12%) из 604 пациентов с ТЭЛА имел высокий риск летального исхода, который определялся на основании наличия гипотензии и/или шока при поступлении. У остальных обследуемых с целью оценки риска смерти проводился расчет PESI и sPESI. Их уровень в случае ПД был достоверно больше, чем при ее отсутствии (табл. 2). Пациенты невысокого риска в зависимости от значения sPESI были разделены на группы промежуточного и низкого риска: в первую вошли 364 (61%), во вторую — 164 (27%) обследованных. Чем выше у пациентов с ТЭЛА был риск смерти, тем чаще диагностировалась ПД (рис. 2).

Рис. 2. Частота ПД у пациентов с ТЭЛА, в зависимости от риска смерти.
Сокращения: ПД — почечная дисфункция, ТЭЛА — тромбоэмболия легочной артерии.
В период госпитализации умерло 107 (18%) пациентов, при этом в группе высокого риска смерти — 32%, промежуточного — 20%, низкого — 7% (KruskalWallis: H=23,47; р<0,001). Уровень СКФ у умерших был ниже, чем у выживших (41,9 (27,1-58,3) и 61,1 (49,2-79,2) мл/мин/1,73 м2; соответственно, р<0,001), при этом число тех, кто умер, ступенчато возрастало по мере ее падения (рис. 3). ПД у умерших диагностировалась чаще (табл. 3), при этом значение СКФ ?50 мл/мин/1,73 м2, идентифицированное с помощью ROC-анализа, надежно прогнозировало госпитальную смерть с чувствительностью 67% и специфичностью 72% (AUC=0,72; р<0,001).

Рис. 3. Госпитальная летальность пациентов с ТЭЛА в зависимости от уровня СКФ.
Сокращение: СКФ — скорость клубочковой фильтрации.
С целью уточнения возможностей ПД в реклассификации риска смерти обследуемых невысокого риска разделили на 4 группы: в первую группу вошли пациенты со sPESI 0 баллов и без нарушения функции почек; во вторую — со sPESI 0 баллов и ПД; в третью — со sPESI ?1 балла и без нарушения функции почек; в четвертую — со sPESI ?1 балла и ПД. В случае sPESI 0 и при sPESI ?1 балла наличие нарушенной функции почек вело к не менее чем 2-х кратному увеличению летальности, а самый высокий ее уровень наблюдался в четвертой группе (рис. 4). Многофакторный регрессионный анализ Кокса подтвердил, что ПД является предиктором госпитальной летальности (отношение рисков (ОР) 3,41 (95% доверительный интервал (ДИ): 2,15-5,41; р<0,001), независимо от наличия таких известных реклассификаторов риска смерти, как повышенный тропонин (ОР 1,31 (95% ДИ: 0,80-2,14; р=0,28)) и дисфункция правого желудочка (ОР 1,23 (95% ДИ: 0,74-2,04; р=0,42)) (табл. 3).

Рис. 4. Госпитальная летальность пациентов с ТЭЛА в зависимости от значения sPESI и наличия ПД.
Примечание: * — p<0,05 — достоверность различий c группой пациентов без ПД.
Сокращения: ПД — почечная дисфункция, PESI — индекс тяжести тромбоэмболии легочной артерии, sPESI — упрощенный индекс тяжести тромбоэмболии легочной артерии.
В период госпитализации у 222 (37%) пациентов с ТЭЛА развились неблагоприятные события в виде шока, кровотечений, пневмонии, острой сердечной недостаточности (ОСН) и других более редких состояний. Частота указанных событий в целом не зависела от функции почек, однако ОСН у обследуемых с ПД наблюдалась чаще (табл. 3).
Таблица 3
Летальность и неблагоприятные события в стационаре у пациентов с ТЭЛА в зависимости от наличия ПД

Сокращение: ПД — почечная дисфункция
Таблица 4
Результаты многофакторного регрессионного анализа Кокса для оценки ФР госпитальной летальности у пациентов с ТЭЛА

Примечание: Хи-квадрат модели 34-97, р<0,001.
Сокращения: В — регрессионный коэффициент, SE — стандартная ошибка, ДИ — доверительный интервал.
Обсуждение
В представленной работе мы оценивали ПД у пациентов с ТЭЛА, под которой понимали СКФ <60 мл/ мин/1,73 м2. Указанный подход нередко используется, когда требуется выявить нарушение функции почек и изучить его влияние на прогноз, но недостаточно данных для того, чтобы дифференцировать ОПП от ХБП [14][19][20]. Действительно, отсутствие информации об уровне креатинина сыворотки крови перед индексным событием у экстренно госпитализированных пациентов является признанной проблемой [12]. Использование в этой ситуации расчетного креатинина (соответствующего СКФ 75 мл/мин/1,73 м2 по формуле MDRD) в качестве исходного (базального) для диагностики повреждения почек не считается надежным методом, поскольку существует вероятность двунаправленной ошибки идентификации частоты и тяжести нарушения функции почек: недооценка, либо переоценка как ОПП, так и ХБП. В контексте анализа вариантов ПД следует обратить внимание на то, что часто невозможно установить, какое состояние было раньше: острая сердечно-сосудистая патология или острое ухудшение функции почек, поскольку каждое из них может потенцировать развитие другого [21][22].
Данные о ПД при ТЭЛА ограничены несколькими исследованиями [12], при этом частота указанного состояния, по итогам самого крупного на сегодняшний момент обзора литературы, колеблется от 12 до 72% [14]. Столь большой диапазон значений объясняется различиями в характеристиках обследуемых групп пациентов (возраст, раса, пол, сопутствующие заболевания и т.д.) и использованием разных формул для оценки СКФ [14][20]. По данным представленного нами Российского регистра, ПД выявлена у каждого второго обследуемого, что оказалось сопоставимо с данными проспективных исследований Kostrubiec M, et al. (2012) [23] и Ouatu A, et al. (2015) [24], где СКФ <60 мл/мин/1,73 м2 имела место в 48% и 37% случаев, соответственно. У пациентов с легочной эмболией нарушение функции почек может быть связано с предшествующей ХБП, в т.ч. не диагностированной ранее, и ОПП как “de novo”, так и в виде ОПП на ХБП. У пациентов с ХБП ВТЭ наблюдаются чаще, чем в популяции в целом [12][15]. Результаты анализа 32 млн выписных эпикризов из госпиталей, охваченных базой данных NIS (Nationwide Inbatient Sample), продемонстрировали, что риск развития ТЭЛА увеличивается по мере нарастания тяжести ПД [15]. Заболеваемость легочной эмболией растет с возрастом [18], который, по данным крупных регистров, составляет в среднем 68 лет [3].
У пациентов с ТЭЛА высокая частота сопутствующих заболеваний, которые сами по себе ассоциированы с нарушением функции почек [4]. В представленном нами исследовании артериальная гипертензия имелась в анамнезе у 2/3 пациентов, сахарный диабет — у 32%, ССЗ — у 27%, инсульт/транзиторная ишемическая атака — у 12%, сердечная недостаточность — у 25% и фибрилляция предсердий — у 23%. Учитывая, что признаки снижения СКФ и/или повреждения почек выявляются у 13% людей в популяции, а в возрасте старше 60 лет — у каждого третьего [25], следует ожидать высокой частоты ХБП при ТЭЛА. По нашим данным ХБП имела место в анамнезе всего у 10% пациентов, однако этот факт скорее демонстрирует недостаточную выявляемость, чем реальную ситуацию.
По итогам немногочисленных работ, в основном ретроспективных, частота ОПП у пациентов с ТЭЛА колеблется от 5 до 30% [23][26][27]. По данным исследования, где диагностика осуществлялась по критериям KDIGO (2012), указанное осложнение было выявлено у 29,5% больных [27]. Среди механизмов, ведущих к развитию ОПП при легочной эмболии, выделяют: почечную макро- и микроциркуляторную гипоперфузию, почечную венозную гипертензию и повышенную нейрогуморальную активацию [18][23][28]. Кроме того, повреждение почек может быть обусловлено внутривенным введением РКС во время выполнения компьютерной томографической ангиографии, которая в настоящее время является основным методом диагностики ТЭЛА. Ряд исследователей все случаи развития ОПП относят к контраст-индуцированному его варианту с частотой до 24% [29], однако указанный подход противоречит рекомендациям, которые требуют исключать другие причины развития осложнения [5]. Последние данные демонстрируют, что риск развития ОПП после введения РКС явно меньше, чем предполагалось ранее, и не превышает 2% при исходной СКФ >30 мл/мин/1,73 м2 [30].
ПД является важным прогностическим фактором у пациентов с ССЗ и связана с повышенной заболеваемостью и смертностью [4][31]. В настоящее время установлено, что снижение почечной функции при ТЭЛА ассоциировано с увеличением 30-, 90-, 180-дневной и 1-, 2-х летней смертности, причем указанные данные получены не только в отдельных ретроспективных или проспективных работах [24][32], но и в крупных многоцентровых исследованиях [33] и метаанализах [34][35]. Публикации, касающиеся связи ПД и госпитальной летальности у пациентов с легочной эмболией, единичны и носят противоречивый характер. Ретроспективный анализ Keller K, et al. (2017) продемонстрировал отсутствие связи между уровнем креатинина и смертью в стационаре [36]. Аналогичные данные получены Fabbian F, et al. (2013) в работе, основанной на анализе 24 тыс. случаев ТЭЛА [37]. По итогам крупного метаанализа, снижение функции почек вело к увеличению госпитальной летальности/30-дневной смертности, при этом указанная связь была обнаружена только для ОПП, но не для ХБП [34]. В представленном нами регистре СИРЕНА ПД у умерших диагностировалась чаще, при этом значение СКФ ?50 мл/мин/1,73 м2 надежно прогнозировало госпитальную летальность. Вероятно, получению подобного результата способствовало то, что в работу допускалось включение умерших в стационаре пациентов, у которых ТЭЛА диагностировалась посмертно, что увеличило число летальных исходов.
При острых ССЗ ПД является важным ФР неблагоприятного исхода и входит в состав шкал, оценивающих прогноз: GRACE при ОКС, MAGIC — при ОСН. Индекс тяжести PESI, используемый для стратификации риска ранней смерти у пациентов с ТЭЛА, не содержит параметров, характеризующих функцию почек. В настоящее время с целью преодолеть ограниченную точность системы оценки неблагоприятного исхода при легочной эмболии, разработаны реклассификаторы, доказавшие свою прогностическую ценность: дисфункция правого желудочка, маркеры повреждения миокарда и гемодинамического стресса [18]. В представленном нами исследовании ПД оказалась предиктором госпитальной смерти, независимо от повышенного уровня тропонина и наличия дисфункции правого желудочка. СКФ <60 мл/мин/1,73 м2 была ассоциирована с более чем 2-х кратным увеличением летальности, которое наблюдалось как при низком (sPESI 0 баллов), так и при промежуточном (sPESI ?1 балла) индексе тяжести ТЭЛА, что демонстрирует дополнительные возможности ПД в идентификации пациентов с высокой вероятностью неблагоприятного исхода. Следует подчеркнуть, что в отличие от сложных подходов к стратификации риска смерти, оценка почечной функции с использованием расчетной СКФ имеет значимые преимущества: она доступна, проста в использовании и воспроизводима.
Механизмы, посредством которых ПД влияет на клинический исход, скорее многофакторные и включают эндотелиальную дисфункцию, системное воспаление, повышенный риск кровотечений/тромбоэмболических осложнений и ограничения в использовании методов лечения [19]. Нарушение функции почек, вероятно, является интегрированным маркером высокого риска, отражающим наличие не только предшествующей ХБП или вновь развившейся ОПП, но и сопутствующих заболеваний, поскольку имеет тенденцию сочетаться с другими сердечно-сосудистыми ФР.
Ограничением настоящей работы является ее ретроспективный характер, обусловленный тем, что цель была сформулирована после окончания регистра. Кроме того, дизайн исследования СИРЕНА подразумевал фиксацию в базе данных только одного значения креатинина сыворотки крови с отсутствием информации о его динамике и догоспитальном уровне. Это не позволило оценить базовую функцию почек, дифференцировать ХБП от ОПП и привело к вынужденному использованию термина ПД. Частота ХБП в анамнезе, указанная исследователями, вероятно, недооценена, что связано с экстренным характером госпитализации и отсутствием амбулаторной медицинской документации. В исследование было включено 8% пациентов с посмертной постановкой диагноза ТЭЛА, что привело к увеличению относительного числа умерших и могло повлиять на результаты оценки прогностического значения ПД.
Заключение
У пациентов с ТЭЛА российской популяции наблюдается высокая частота ПД, которая диагностируется у каждого 2-го пациента и в 10% случаев является тяжелой. Наличие ПД связано со значительным увеличением госпитальной летальности, причем риск смерти возрастает по мере снижения СКФ. Добавление ПД, оцененной как снижение расчетной СКФ <60 мл/мин/1,73 м2, к упрощенному индексу тяжести ТЭЛА (sPESI) улучшает стратификацию риска и позволяет идентифицировать группу пациентов с высоким риском госпитальной смерти.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Мензоров М.В., Филимонова В.В., Эрлих А.Д., Барбараш О.Л., Бернс С.А., Шмидт Е.А., Дупляков Д.В. Почечная дисфункция у пациентов с тромбоэмболией лёгочной артерии по данным регистра СИРЕНА. Российский кардиологический журнал. 2021;26(2S):4422. https://doi.org/10.15829/1560-4071-2021-4422
Скопировать