Транслюминальная баллонная ангиопластика и стентирование коронарных артерий после ранее перенесенной ортотопической трансплантации сердца. Клинический случай
Аннотация
Введение. На сегодняшний день хроническая сердечная недостаточность (ХСН) является наиболее частым закономерным исходом вовремя не диагностированных и своевременно не излеченных нозологических форм. Несмотря на достижения в области фармакотерапии сердечно-сосудистых заболеваний, операция ортотопической трансплантации сердца является общепризнанным золотым стандартом лечения терминальной сердечной недостаточности.
Краткое описание. В клиническом случае представлен пациент 55 лет, поступивший ГБУЗ «Кардиологический диспансер» МЗ Кабардино-Балкарской Республики с клинической картиной острого коронарного синдрома без подъема сегмента ST. Ранее в 2017г пациенту была выполнена ортотопическая трансплантация сердца (ОТТС) по поводу терминальной стадии недостаточности кровообращения вследствие дилатационной кардиомиопатии. Через 2,5 года после оперативного вмешательства была зарегистрирована артериальной гипертония и 5 лет клинические проявления ХСН. В 2024г при проведении коронароангиографии выявлен субтотальный стеноз 95% в среднем сегменте передней нисходящей артерии. Интраоперационно консилиумом был оценен риск и принято решение о хирургической эндоваскулярной коррекции стеноза. Послеоперационный период протекал без осложнений.
Дискуссия. Представленное клиническое наблюдение является примером своевременной диагностики болезни коронарных артерий пересаженного сердца и успешной транслюминальной баллонной ангиопластики и стентирования передней нисходящей артерии ОТТС.
Трансплантация сердца превратилась из базовой экспериментальной модели и чуда в медицине человека в ожидаемый выбор в лечении терминальной стадии хронической сердечной недостаточности (ХСН) [1]. На фоне увеличения общего количества трансплантаций сердца в нашей стране отмечается существенное снижение периоперационной смертности и улучшение выживаемости в отдаленном периоде [2]. На сегодняшний день общая выживаемость через 10, 15 и 20 лет составляет 50,2%, 30,1% и 17,2%, соответственно [3-5]. Основной причиной смерти после трансплантации сердца является острое отторжение трансплантата, сердечная недостаточность, болезни коронарных артерий пересаженного сердца (БКАПС) (васкулопатия трансплантата), инфекции, почечная недостаточность, онкологические заболевания 1 [4][6]. Местное и системное воспаление вызывает повреждение эндотелия, что, в свою очередь, увеличивает пролиферацию гладкомышечных клеток и уменьшает калибр просвета сосудов, что приводит к развитию васкулопатии сердечного аллотрансплантата (ВСА) [7]. БКАПС являются одной из главных причин повреждения донорского сердца и в силу отсутствия афферентной иннервации протекают без болевой симптоматики [6]. Денервация сердца клинически важна, поскольку она объясняет, почему у реципиентов не возникает стенокардии из-за ишемии, но могут наблюдаться брадикардия и гипотония, связанные с инфарктом нижней стенки после трансплантации [8]. Наличие гемодинамически значимых стенозов в коронарных артериях у пациентов после трансплантации сердца является независимым предиктором высокой летальности в отдаленном периоде наблюдения. Рентгенэндоваскулярное вмешательство является методом выбора при выявлении у пациентов с острым коронарным синдромом (ОКС) после ранее выполненной пересадки сердца. Инвазивная и неинвазивная диагностика позволяет своевременно поставить диагноз пациенту с безболевой формой ишемии миокарда [9]. Дополнительное внутрисосудистое ультразвуковое исследование коронарных артерий повышает чувствительность и специфичность рентгеноангиографического исследования как в выявлении исходных изменений в донорском сердце, так и для ранней диагностики ВСА. Выявление увеличения толщины интимы коронарных артерий >0,5 мм в течение 1-го года после трансплантации сердца свидетельствует о высоком риске смерти или развитии гемодинамически значимых сужений просвета артерий трансплантата в течение следующих 5 лет1. Несмотря на широкое применение стентов и ангиопластики при БКАПС, данных об эффективности таких вмешательств при ортотопической трансплантации сердца (ОТТС) недостаточно. Зарубежные авторы сообщают о результатах лечения тех пациентов в их учреждении, которые перенесли чрескожное коронарное вмешательство и стентирование на поздней стадии трансплантации. За 12-летний период 106 взрослым пациентам была проведена ОТТС в их учреждении. Общее среднее время до обнаружения рестеноза как при стентированных, так и при ангиопластикированных поражениях составило 5,2 мес. Авторы приходят к выводу, что транслюминальная баллонная ангиопластика и стентирование на поздних этапах трансплантации связаны со значительной частотой рестеноза, и у таких пациентов необходимо рассмотреть более ранние или альтернативные вмешательства с использованием катетера [10].
В работе описан клинический случай развития БКАПС в отдаленном периоде, дальнейшая тактика ведения пациента.
Учитывая изложенное, сформулирована цель статьи: привлечь внимание врачей к ранней диагностике одного из осложнений после ОТТС — развития ВСА.
Клинический случай
Пациент А. 55 лет 1 февраля 2024г обратился в приемное отделение ГБУЗ «Кардиологического диспансера» МЗ Кабардино-Балкарской Республики с жалобами: на жжение за грудиной, возникающее как правило на фоне повышения цифр артериального давления (АД), при физической нагрузке, проходящее в покое самостоятельно в течение 7-10 мин, чувство «нехватки воздуха» с затрудненным вдохом при умеренной физической нагрузке, повышение АД до 170/100 мм рт.ст., перебои в работе сердца.
Из анамнеза заболевания: в 2017г после перенесенного гриппа впервые появились одышка инспираторного характера при малейшей нагрузке, в покое при длительном горизонтальном положении, учащенное, беспорядочное сердцебиение, обследован в кардиологическом диспансере. Выявлена при эхокардиографии (ЭхоКГ) дилатация полостей левого желудочка (ЛЖ), снижение фракции выброса (ФВ), нарушение ритма и проводимости сердца — постоянная форма фибрилляции предсердий, неполная блокада левой ножки пучка Гиса, выставлен диагноз дилатационной кардиомиопатии. В декабре 2017г находился на стационарном лечении в НИИ СП им. Н. В. Склифосовского с диагнозом: дилатационная кардиомиопатия. При поступлении была проведена коронароангиография (КАГ), поражения коронарных сосудов не выявлено. При ЭхоКГ: ЛЖ: конечно-диастолический размер 6,6 см, конечно-систолический размер 5,9 см, конечно-диастолический объем (КДО) 233 мл, конечно-систолический объем 177 мл; левое предсердие (ЛП): 4,7 см, объем 130 мл; правое предсердие объем 90 мл, правый желудочек (ПЖ) 3,6 см, низкая ФВ — 21%, выраженная систолическая дисфункция, выраженная диастолическая дисфункция, митральная недостаточность 3 степени, трикуспидальная недостаточность 1 степени, признаки умеренной легочной гипертензии; Сцинтиграфия миокарда: на томосцинтиграммах визуализация миокарда увеличенного ЛЖ (КДО 270 мл) с незначительным снижением перфузии верхушки и диафрагмальной стенки. Диффузный гипокинез и диссоциированные очаги патологической асинхронии — 120 мсек по 17 сегментам. ФВ 20%. ПЖ увеличен незначительно (КДО ПЖ 160 мл). ФВ ПЖ 18%. Межжелудочковая асинхрония 80 мсек. Первый-левый.
14.11.2017 в возрасте 47 лет выполнена ОТТС. Ранний послеоперационный период осложнился перикардиальной эффузией с признаками тампонады, а также явлениями реактивного панкреатита. На электрокардиографии (ЭКГ): синусовая тахикардия 91 в минуту. Блокада правой ножки пучка Гиса (БПНПГ); при ЭхоКГ корень аорты 3,0 см; ЛП 3,5 см; конечно-диастолический размер 4,5 см; конечно-систолический размер 3,1 см; КДО 96 мл; конечно-систолический объем 39 мл; ФВ 60%; правое предсердие 4,0×4,3 см, ПЖ 2,5 см, межжелудочковая перегородка (МЖП) 1,1 см, З ст. 1,0 см, локальная сократимость не изменена. Створки аортального клапана не уплотнены, регургитация 0-1 ст., Митральный клапан: створки не изменены. Регургитация 0-1 ст. Трикуспидальный клапан: не изменен. Регургитация 0-1 ст. систолическое давление в легочной артерии — 17 мм рт.ст.; при сцинтиграфии миокарда — визуализируется миокард с незначительным снижением перфузии базальных отделов. Гипокинез МЖП. ФВ ЛЖ 73%. ПЖ увеличен незначительно (КДО ПЖ 150 мл), ФВ ПЖ 44%. Межжелудочковая асинхрония 0 мсек. При сравнении отложенных через 4 ч изображений отмечено незначительное, патологическое ускорение клиренса радиофармпрепарата из МЖП и боковой стенки. При выписке рекомендована терапия: такролимус по 3,0 мг 2 раза/сут.; метилпреднизолон 4 мг 1 раз/сут.; микофеноловая кислота 720 мг 2 раза/сут.; ацетилсалициловая кислота (АСК) в кишечнорастворимой оболочке 100 мг/сут., валганцикловир 450 мг 1 раз/сут. до 6 мес. после трансплантации сердца с переходом на ацикловир 200 мг 1 раз/сут. до 1 года, периндоприл 5 мг 1 раз/сут. при повышении АД >140/90 мм рт.ст., бисептол 480 мг 1 раз/сут. в течение года, розувастатин 10 мг 1 раз/сут. В последующие годы наблюдался амбулаторно по месту жительства, проводились общеклинические лабораторные и инструментальные методы исследования, концентрация такролимуса не проводилась по техническим причинам. Состояние пациента оставалось удовлетворительным, в связи с низкой комплаентностью госпитализаций для проведения эндомиокардиальной биопсии и КАГ не было, а также пациент не выезжал в центр трансплантологии. Помимо иммуносупрессивных препаратов иную рекомендованную терапию не принимал. В 2019г пациента вновь стала беспокоить инспираторная одышка при нагрузке, учащенное сердцебиение при ходьбе до 350-400 м. С 2020г отмечает подъемы АД, зафиксированы максимальные цифры 180/100 мм рт.ст. В 2022г госпитализирован в ГБУЗ «Кардиологический диспансер» г. Нальчика с подозрением на декомпенсацию ХСН. При поступлении реципиенту сердца было предложено проведение КАГ, пациент отказался. На ЭКГ без динамики в сравнении с 2017г: синусовая тахикардия 100 уд./мин, полная БПНПГ. При ЭхоКГ уплотнение стенок аорты, створок аортального, митрального клапана, ЛП 45,6 мм, масса миокарда ЛЖ 203 г, индекс сферичности 0,54, относительная толщина стенок 0,42. Е/А — 1,49, митральная регургитация 1 степени, трикуспидальная регургитация 1 степени, легочная регургитация 1 степени, свободное эхо-пространство в полости перикарда по ПЖ 6,8 мм, ФВ 64%, участки гипокинезии/акинезии не выявлены. Сократительная функция ЛЖ и ПЖ не снижена. Была выявлена диастолическая дисфункция ЛЖ по рестриктивному типу, которая требовала наблюдения в динамике для исключения ухудшения функции сердечного трансплантата. При холтеровском мониторировании ЭКГ ишемические изменения ST-T не обнаружены, зарегистрировано небольшое количество наджелудочковых экстрасистол. При рентгенографии органов грудной клетки — застойные явления в легких 1 ст. В лабораторных анализах выявлено содержание общий холестерин 4,7 ммоль/л, холестерин липопротеидов низкой плотности 1,29 ммоль/л, индекс атерогенности 1,4 ЕД, билирубин 15,0 ммоль, аланинаминотрансфераза 44,0 ед./л, аспартатаминотрансфераза 43,0 ед./л, креатинин 104 ммоль/л, мочевина 5,0 ммоль/л, С-реактивный белок 2,6 г/л, калий 4,9 ммоль/л, магний 0,7 ммоль/л, кальций 2,3 ммоль/л, натрий 138 ммоль/л, КФК-МВ 14 ед./л, железо 18,4 мкмоль/л, в общем анализе крови без патологии. Уровень натрийуретического пептида в динамике не определялся по техническим причинам. Нагрузочные пробы отрицательные. Инвазивная диагностика сердечного трансплантанта не была проведена. С учетом жалоб, наличия застойных явлений в легких при рентгенографии органов грудной клетки, теста 6-минутной ходьбы выставлен диагноз ХСН. При выписке недостаточность кровообращения компенсирована. В последующие годы пациент продолжал принимать только иммуносупрессоры. Настоящее ухудшение состояния с начала декабря 2023г, когда отметил усиление одышки инспираторного характера при ускорении шага, появление отеков нижних конечностей, дестабилизацию цифр АД. За неделю до госпитализации стали беспокоить кратковременные жгучие боли за грудиной, возникающие, как правило, на фоне повышения цифр АД, при физической нагрузке, проходящие в покое самостоятельно в течение 7-10 мин. Обратился в «Кардиологический диспансер» г. Нальчика.
Соматическая патология: ожирение III степени, индекс массы тела (ИМТ) 40,3 кг/м2, хронический бронхит, хронический панкреатит, мочекаменная болезнь, хронический пиелонефрит.
Результаты физикального осмотра: состояние пациента средней степени тяжести, пастозность голеней и стоп, при аускультации в легких везикулярное дыхание, единичные влажные хрипы в нижних отделах с обеих сторон, частота дыхательных движений 22 в минуту, перкуторно границы сердца расширены влево на 2 см; аускультативно тоны сердца ясные, ритмичные, патологических шумов не определяется; тест с 6-минутной ходьбой — пройдено 190 м, что соответствует 3 функциональному классу (ФК) ХСН.
Предварительный диагноз (диагноз при поступлении)
Основное заболевание: Состояние после ОТТС по поводу дилатационной кардиомиопатии от 14.11.2017.
Артериальная гипертония (АГ) 3 степень, риск сердечно-сосудистых осложнений IV.
Осложнение заболевания: ХСН 2 «А» стадия, III ФК с сохранной ФВ.
Сопутствующие заболевания: Ожирение III степени, ИМТ 40,3 кг/м2. Хронический бронхит, ремиссия. Хронический панкреатит, ремиссия. МКБ. Хронический пиелонефрит, ремиссия.
Отсутствие ишемических изменений на ЭКГ и отрицательный результат тропонинового теста не позволили при первичном осмотре выставить диагноз ОКС.
Больному при госпитализации в стационар было предложено проведение КАГ, от которой пациент отказался (рис. 1).
Диагностическая оценка. Пациенту были проведены стандартные биохимические обследования, из которых обращает на себя внимание повышение холестерина липопротеидов низкой плотности до 3,59 ммоль/л, триглицеридов до 1,84 ммоль/л, индекса атерогенности до 3,4 ЕД, тропонина I <0,01 нг/мл при поступлении, через 6, 12 и 24 ч (референсные значения <0,01 нг/мл). Определение уровня натрийуретического пептида не проведено по техническим причинам.
ЭКГ от 01.02.2024 без динамики в сравнении с архивными ЭКГ: ритм синусовая тахикардия с частота сердечных сокращений — 100 уд./мин, полная БПНПГ.
ЭхоКГ 01.02.2024: состояние после трансплантации сердца. Уплотнение стенок аорты, створок аортального, митрального клапанов с очагами кальциноза; митральная регургитация 1 степени; трикуспидальная регургитация 1 степени; легочная регургитация 1 степени; расширение полости ЛП 45,9 (37,9×54,8) мм; концентрическая гипертрофия миокарда ЛЖ, толщина МЖП 11,5 мм; нарушение диастолической функции ЛЖ. Свободное эхо-пространство в полости перикарда 6,9 мм по всему периметру. ФВ ПЖ и ЛЖ не снижена. Зон гипо-, акинезии не выявлено.
Рентгенография органов грудной клетки от 05.02.2024 — Rg-признаки умеренной кардиомегалии, аортосклероза. Состояние после стернотомии.
При холтеровском мониторировании ЭКГ от 02.02.2024 ишемических изменений не обнаружено. Несмотря на частые ложно-отрицательные результаты стресс-ЭхоКГ у пациентов с денервированным сердцем, было принято решение провести неинвазивную диагностику для верификации БКАПС. Стресс-ЭхоКГ: проба положительная, соответствует 2 ФК стенокардии. Данные ЭКГ: депрессия с ST до 1 мм V4-V6 отведениях. Данные ЭхоКГ: гипокинез передней, боковой стенки ЛЖ.
На основании жалоб, анамнеза, результатов лабораторно-инструментальных методов обследования выставлен клинический диагноз:
Основное заболевание: БКАПС.
Состояние после ОТТС по поводу дилатационной кардиомиопатии от 14.11.2017.
Фоновое заболевание: Гипертоническая болезнь III стадия, 3 степень, риск сердечно-сосудистых осложнений IV. Контролируемая (целевые значения <120/80 мм рт.ст. достигнуты).
Осложнения заболевания: ХСН с сохранной ФВ ЛЖ 2 «А» стадия, III ФК.
Сопутствующие заболевания: Ожирение III степени, ИМТ 40,3 кг/м2. Хронический бронхит, ремиссия. Хронический панкреатит, ремиссия. Мочекаменная болезнь. Хронический пиелонефрит, ремиссия.
Медицинские вмешательства. При поступлении пациенту назначена терапия: бисопролол 2,5 мг/сут., телмисартан 80 мг/сут., спиронолактон 25 мг/сут., торасемид 10 мг/сут. с последующей отменой при устранении отечного синдрома, АСК (кишечнорастворимая форма) 75 мг/сут., розувастатин 20 мг/сут.
В связи с наличием положительных результатов нагрузочной пробы, с пациентом повторно проведена беседа о проведении КАГ с намерением выполнить реваскуляризацию миокарда, получено информированное согласие. Была выполнена отложенная КАГ через 24 ч.
Протокол КАГ: Тип кровоснабжения: правый.
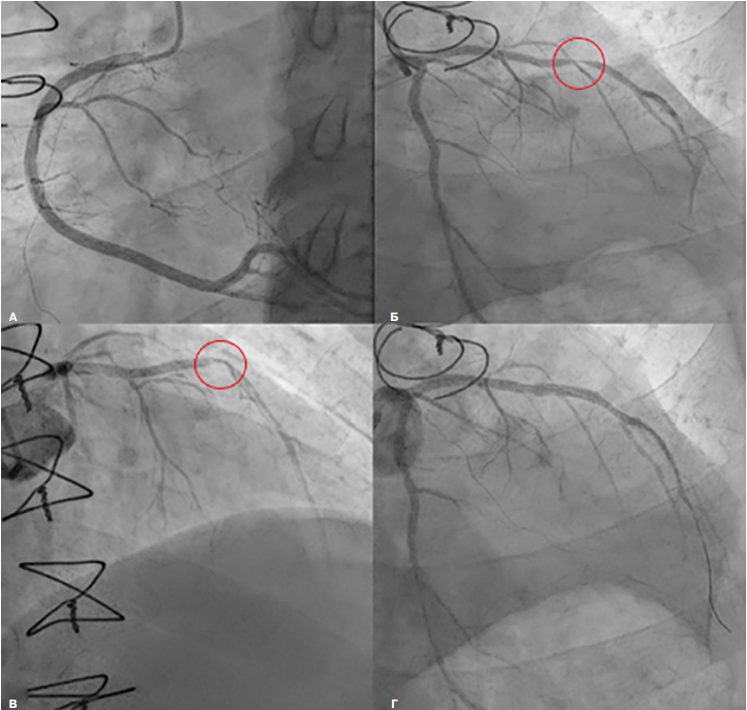
Ствол левой коронарной артерии (ЛКА): без значимых изменений; передняя нисходящая артерия (ПНА): проходима, в проксимальном сегменте контуры ровные, в среднем сегменте субтотальный стеноз 95%, далее контуры ровные. Огибающая артерия: проходима, контуры ровные; правая коронарная артерия: проходима, контуры ровные.
Гепарин 10 тыс. ЕД, клопидогрел 600 мг.
Стентирование ПНА. В устье ЛКА установлен Гайд-катетер EBU 3.5-6 Fr. Коронарный проводник проведен за зону стеноза в дистальные отделы ПНА. В зону стеноза имплантирован стент с лекарственным покрытием Synergy 3×16 мм. давлением 12 атм. Контрольная ангиография: кровоток по артерии TIMI 3, признаков диссекции, дистальной эмболизации артерии нет.
Из системы ЛКА последовательно удалены баллонный катетер, коронарный проводник и гайд-катетер. Интродьюссер удален на месте (рис. 2).
Динамика и исходы. После оперативного вмешательства пациент находился под наблюдением в условиях отделения реанимации и интенсивной терапии. На 2 сут. после чрескожного коронарного вмешательства переведен в плановое отделение. В послеоперационном периоде состояние больного оставалось стабильным: приступы стенокардии не рецидивировали, повысилась толерантность к физическим нагрузкам, освоена ходьба 1500 м/сут., частота сердечных сокращений 76 уд./мин, АД 120/80 мм рт.ст., недостаточность кровообращения компенсирована. При повторной ЭхоКГ от 13.02.2024 в динамике: незначительное эхо-пространство в полости перикарда до 4 мм, в остальном без динамики. Выписан на 18 сут. нахождения в стационаре на амбулаторный этап в удовлетворительном состоянии. Местные органы здравоохранения должны проинформировать центр трансплантации в связи с хирургическим вмешательством.

Рис. 1. Пациент А., 55 лет: хронология течения болезни, ключевые события и прогноз.
Сокращения: ГБ — гипертоническая болезнь, ОКС — острый коронарный синдром, ОРВИ — острая респираторная вирусная инфекция, ТЛБАП — транслюминальная баллонная ангиопластика, ФК — функциональный класс, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность.

Рис. 2. КАГ. А — правая коронарная артерия; Б, В — стеноз в среднем сегмента ПНА; Г — ПНА после стентирования в среднем сегменте.
Обсуждение
У пациентов с донорским сердцем развивается ряд осложнений, таких как АГ, сердечная недостаточность, БКАПС, инфекции, почечная недостаточность, онкологические заболевания1 [7][11]. Распространенность АГ спустя 5 лет после трансплантации сердца может достигать 95%. Ее развитие в первую очередь связано с приемом препаратов такролимуса или циклоспорина. Длительный прием глюкокортикоидов также сопровождается повышением уровней АД. Помимо иммуносупрессивной терапии, причинами развития АГ после трансплантации сердца являются нарушение барорефлексов (повышение активности) и прогрессирование ригидности аорты и периферических артерий1.
В представленном клиническом наблюдении на фоне иммуносупрессивной терапии подъемы АД пациент начал отмечать через 3 года после трансплантации сердца. Больной не был привержен к терапии, помимо иммуносупрессивных препаратов другую терапию не принимал, что способствовало раннему развитию сердечно-сосудистых осложнений. Через 5 лет после оперативного вмешательства пациент был госпитализирован в ГБУЗ «Кардиологический диспансер» с клиникой декомпенсации ХСН. Считаем, целесообразным было в более ранние сроки определение уровня натрийуретического пептида в динамике после перенесенной пересадки сердца для выявления и оценки тяжести недостаточности кровообращения. Наличие отрицательной динамики показателей диастолической функции ЛЖ, как одного из чувствительных критериев наличия ишемии миокарда, может использоваться для назначения внеплановой КАГ и своевременного начала мер профилактики факторов риска. Основываясь на активации и агрегации тромбоцитов при ВСА, Asleh R, et al. пришли к выводу, что раннее применение АСК после трансплантации сердца может задержать прогрессирование ВСА, а также снизить смертность и дисфункцию трансплантата, связанную с ней [12]. Назначение ингибиторов ГМГ-КоА-редуктазы (статинов) на фоне иммуносупрессивной терапии приводит к достоверному снижению частоты развития нежелательных событий и частоты выявляемого прогрессирования васкулопатии коронарных артерий в течение 3 лет после трансплантации; не сопровождается развитием побочных действий и изменением концентрации такролимуса в крови. Статины показаны всем пациентам после трансплантации сердца (взрослым и детям)1 [2][13]. Анализ медицинской документации стационарного и амбулаторного звена показал, что у пациента имелись факторы риска развития сердечно-сосудистых заболеваний, такие как артериальная гипертензия, ожирение, отягощенная наследственность, дислипидемия. Были назначены статины (розувастатин 10 мг), АСК 100 мг, ингибиторы ангиотензинпревращающего фермента (периндоприл 8 мг), спиронолактон 25 мг.
Как было сказано ранее, рекомендованные препараты пациент не принимал в полном объеме и, как следствие, через 7 лет появление клинической картины ОКС без подъема с ST, подтвержденной неинвазивными и инвазивными методами диагностики. При КАГ выявлен локальный субтотальный стеноз ПНА 95%, другие коронарные артерии интактные, в связи с чем выбрана двойная антитромботическая терапия — АСК 100 мг, клопидогрел 75 мг 1 раз/сут. на 12 мес.
Заключение
Представленный клинический случай ярко демонстрирует развитие ВСА. При отсутствии первичной и вторичной профилактики сердечно-сосудистых заболеваний у пациента в ранний период после ОТТС возобновилась клиника АГ и ХСН, а также через 7 лет стали беспокоить боли стенокардитического характера, что послужило поводом более углубленной диагностики, в ходе которой был выявлен субтотальный стеноз ПНА. Данное осложнение потребовало хирургической коррекции, в связи с чем было выполнено стентирование ПНА. Учитывая высокую частоту развития рестенозов и вероятность развития новых очагов поражения у реципиентов сердца, особенно после проведения баллонной ангиопластики, повторную КАГ следует проводить не позже, чем через 6-12 мес. после процедуры ангиопластики.
Информированное согласие: от пациента было получено письменное добровольное информированное согласие на публикацию результатов обследования и лечения (дата подписания 12.02.2024).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Акопов Г. А., Анискевич Г. В., Барбараш О. Л. и др. Трансплантация сердца, наличие трансплантированного сердца, отмирание и отторжение трансплантата сердца. Клинические рекомендации РФ 2023. Профессиональная ассоциация: Общероссийская общественная организация трансплантологов «Российское трансплантологическое общество».
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Бапинаев А.А., Бапинаева А.А., Тхабисимова И.К., Коготижев А.Р. Транслюминальная баллонная ангиопластика и стентирование коронарных артерий после ранее перенесенной ортотопической трансплантации сердца. Клинический случай. Российский кардиологический журнал. 2024;29(3S):5981. https://doi.org/10.15829/1560-4071-2024-5981. EDN: DCGJNM
Скопировать