Стимуляция левой ножки пучка Гиса. Технические аспекты. Доказательная база для применения в качестве альтернативы ресинхронизирующей терапии и традиционной электрокардиостимуляции
Аннотация
Стимуляция левой ножки пучка Гиса — новый вид электрокардиостимуляции, один из вариантов физиологической стимуляции сердца, при котором стимулом возбуждается проводящая система сердца. Он имеет преимущества у пациентов с брадикардиями и с сердечной недостаточностью. Однако данный вид лечения вызывает у ряда докторов ряд вопросов. Возникает недопонимание технических аспектов процедуры имплантации, а также остаются неясными аспекты доказательной базы данного метода ввиду малого количества крупных исследований в мировой литературе, а также отсутствия данного вида лечения в отечественных клинических рекомендациях. В данной статье группой авторов решено отразить решение вышеперечисленных проблем в клинической практике, а именно: отразить технические аспекты стимуляции левой ножки пучка Гиса, и показать преимущества данного вида лечения в виде альтернативы ресинхронизирующей терапии и традиционной электрокардиостимуляции.
На сегодняшний день в клинической практике чаще применяется не стимуляция пучка Гиса (СПГ), а усовершенствованная методика — имплантация в область левой ножки пучка Гиса (ЛНПГ). Исследования [1][2] демонстрируют преимущества новой методики над имплантацией в пучок Гиса. Эти преимущества обусловлены анатомическими особенностями [3]: пучок Гиса — маленькая структура, которая располагается в толще фиброзной части межжелудочковой перегородки (МЖП), что обуславливает недостатки имплантации в эту область: относительные высокие пороги стимуляции, низкая чувствительность к R волне из-за большого количества фиброзной ткани и малого количества кардиомиоцитов, возможная гиперчувствительность потенциала пучка Гиса или предсердного сигнала [4]. Также возможно потенциальное развитие более дистальной блокады в проводящей системе: при подузловой форме атриовентрикулярной (АВ) блокады успех имплантации в пучок Гиса составляет 76%, а в ЛНПГ — 97,8% [5]. Вышеперечисленные факты дают предпосылки к ограничению методики СПГ.
В отличие от пучка Гиса, ЛНПГ представляет собой обширную, веерообразную сеть волокон проводящей системы, располагающуюся под субэндокардом левого желудочка (ЛЖ) (рис. 1). Эти волокна окружены со всех сторон миокардом, а не фиброзной тканью. Чаще всего левая ножка имеет 3 ветви — переднюю, заднюю и септальная, однако анатомия может сильно варьироваться. Таким образом, ЛНПГ представляет более «широкую» цель для имплантации электрода, а окруженность миокардом обуславливает хороший сенсинг и, как правило, низкие пороги стимуляции. При имплантации электрода в область пучка Гиса порог стимуляции проводящей системы (СПС) у 27,6% пациентов >2,5 В, потеря захвата пучка Гиса у 7,6% пациентов [6], а при стимуляции левой ножки <1% [5].
Первый опыт имплантации в область ЛНПГ был описан в 2017г группой исследователей из Китая [7]. Стимуляция ЛНПГ (СЛНПГ) возникла как альтернативная методика для обеспечения максимально физиологичной активации ЛЖ, особенно у пациентов с инфранодальной АВ блокадой и блокадой ЛНПГ (БЛНПГ) [8]. При этом по степени синхронизации СЛНПГ не уступает СПГ [9].
Определение СЛНПГ
СЛНПГ подразумевает собой прямой захват ЛНПГ (ствола ЛНПГ или её ветвей). При этом обычно наблюдаются удовлетворительные параметры стимуляции (порог стимуляции <1,0 В при длительности стимула 0,4 мс). Имплантация электрода осуществляется через правый желудочек (ПЖ), через МЖП [10]. Ход имплантации описан ниже и разделен на следующие этапы: I — сосудистый доступ, II — позиционирование электрода в субэндокардиальную часть МЖП со стороны ЛЖ (в область ЛНПГ), III — подтверждение захвата ЛНПГ.
- Подготовительные этапы, необходимое оборудование, сосудистый доступ
Для выполнения данной процедуры необходимо следующее оборудование:
1) Рентгеновская установка с возможностью выставления проекций RAO 30 и LAO 30;
2) Регистрация 12 отведений электрокардиограммы в онлайн режиме и в режиме просмотра для проведения измерений;
3) Анализатор (Pacing system analyzer) с возможностью оценки чувствительности, порога стимуляции и импеданса;
4) Электрофизиологическая система для подключения катетеров для временной стимуляции или записи внутрисердечных сигналов (табл. 1);
5) Электроды и система доставки не в единственном экземпляре.
Так как методика предполагает вкручивание через толщу МЖП, необходимо знать толщину её базальной части и наличие в ней фиброзных изменений, которые могут значительно затруднить прохождение через толщу МЖП. Желудочковая страхующая стимуляция рекомендована до начала имплантации в левую ножку пациентов с БЛНПГ, поскольку полная АВ блокада может возникнуть в течение процедуры, из-за транзиторной блокады правой ножки пучка Гиса (БПНПГ) во время манипуляций доставочной системой. Для этого можно использовать либо имплантируемый электрод, который позже будет репозиционирован в предсердие, либо электрод для проведения электрофизиологического исследования, позиционированный другим доступом.
Для имплантации в проводящую систему используются безстилетные электроды (чаще всего — Medtronic SelectSecure™ MRI SureScan™ Model 3830), но могут использоваться и стандартные электроды с внутренним стилетом (табл. 2).
Также важной составляющей является система доставки, они могу быть разной длины и с различной конфигурацией изгиба. Важной конструктивной особенностью современных систем доставки является наличие септального изгиба, который упрощает позиционирование электрода перпендикулярно МЖП (рис. 2). У пациентов с показаниями к ресинхронизирующей терапии часто отмечается выраженная дилатация правого предсердия, что может затруднить позиционирование инструмента. В таких случаях для дополнительной поддержки может быть использована методика «sheath in sheath», которая придаст жесткости всей конструкции (рис. 3).
Строго рекомендуется заведение системы доставки через внешний интродьюсер для предотвращения её перегибания, что может значительно затруднить процесс вкручивания электрода из-за создания дополнительного внутреннего трения (рис. 4).
- Позиционирование электрода
После осуществления сосудистого доступа система доставки на проводнике заводится в ПЖ, после чего в неё заводится электрод. Спираль электрода должна немного выходить из системы доставки.
Определение точки входа электрода в МЖП
Для понимания анатомии рекомендуется сначала зарегистрировать потенциал пучка Гиса или путём ангиографии обозначить кольцо трехстворчатого клапана (рис. 5).
Место первичного позиционирования электрода находится в МЖП, чаще всего на 1-1,5 см апикальнее места регистрации потенциала пучка Гиса по вымышленной линии, проведённой до верхушки ПЖ (или на границе проксимальной средней трети). Позиционирование системы доставки проводится в правой косой проекции (RAO 30) (рис. 6).
В данной позиции морфология стимулированного комплекса QRS до фиксации имеет характерную морфологию по типу буквы «W» с зазубриной в отведении V1. При наличии R волны в отведениях aVR и aVL комплексы будут иметь разную противоположную направленность (рис. 7).
Вкручивание электрода в МЖП
Доставочное устройство ротируется против часовой стрелки, с целью перпендикулярного положения к области базальной части МЖП. Данный маневр позволяет обеспечить поддержку электрода для фиксации в толще перегородки. Вкручивание электрода выполняется двумя руками под контролем флюороскопии. С продвижением электрода сквозь толщу перегородки ожидается: 1) смена паттерна активации с БЛНПГ до БПНПГ, 2) сначала увеличение, а потом уменьшение монополярного импеданса; 3) смена положения электрода в толще МЖП, в сравнении с начальным положением электрода; 4) сначала увеличение, а потом снижение амплитуды монополярного сигнала с кончика электрода. В момент вкручивания также могут наблюдаться механически вызванные эктопические комплексы.
При избыточном вкручивании электрода в МЖП может произойти её перфорация и выход электрода в полость ЛЖ. Перфорация МЖП интраоперационно по данным исследований случается у 14,1% пациентов [11].
Критерии диагностики перфорации МЖП:
- Итоговое снижение униполярного импеданса <450 Ом;
- Одномоментное снижение более, чем на 100 Ом;
- Также перфорация перегородки сопровождается снижением амплитуды R волны (и изменение морфологии сигнала — от «R» до «Q» или «RS» и увеличением порогов стимуляции) (рис. 8).
При выявлении перфорации заново позиционировать электрод ввиду того, что простая тракция электрода в пределах сформированного канала в отдаленном периоде приведёт к дислокации.
Также для оценки позиции электрода может быть использована ангиография для визуализации МЖП. Толщина перегородки пациента известна из данных предоперационного обследования, а размеры электродов известны (рис. 9).
III. Оценка критериев стимуляции левой ножки
Морфология стимулированного комплекса QRS по типу БПНПГ
Морфология стимулированного комплекса QRS является важным критерием того, что электрод достиг проводящей системы. При вкручивании электрода морфология будет постепенно меняться от БЛНПГ до БПНПГ (рис. 10). Ширина стимулированного комплекса не является абсолютным критерием и зависит от скорости проведения по миокарду и типа стимуляции, но чаще всего составляет <140 мс.
Идентификация потенциала ЛНПГ
У пациентов с собственным ритмом без блокады ЛНПГ во время процедуры может детектироваться потенциал ЛНПГ с кончика электрода, время до потенциала желудочкового сигнала составляет 20-30 мс. Однако у пациентов с БЛНПГ или полной АВ блокадой потенциал ЛНПГ может быть фиксирован только во время восстановления проводимости по ЛНПГ. Более того, важно не просто зарегистрировать этот потенциал, а подтвердить электрофизиологически его захват стимулом.
Время активации стимулированного ЛЖ
Время активации стимулированного комплекса ЛЖ (left ventricle activation time, LVAT, синоним — RWPT — R-wave peak time) измеряется как интервал от спайки стимуляции, до пика R волны в левых грудных отведениях (чаще всего V6). Целевыми значениями являются: <75 мс для пациентов узким комплексом QRS и <85 мс — для пациентов с БЛНПГ. Этот параметр для СЛНПГ будет меньше, чем при СПГ на 10 мс. Поэтому если в начале процедуры была проведена СПГ с коррекцией проведения по ЛНПГ и было измерено время активации стимулированного комплекса ЛЖ, при достижении СЛНПГ этот параметр должен быть на 10 мс меньше.
Определение селективной и неселективной стимуляции
Селективная СЛНПГ охватывает только ЛНПГ. Как прямой признак селективной СЛНПГ, может быть продемонстрирован с помощью отдельного артефакта на униполярной электрограмме. Захват как ЛНПГ, так и локального септального миокарда приводит к неселективной СЛНПГ без локальной электрограммы, также морфология электрокардиограммы немного отличается от селективной.
Межпиковый интервал V1-V6
Ещё один критерий подтверждения захвата проводящей системы — измерение межпикового интервала в отведениях V1-V6 (от пика R волны в V6 до второго R зубца в отведении V1 при достижении морфологии БПНПГ). Он должен составлять >44 мс. Данный параметр позволяет объективизировать морфологию комплекса QRS, подтвердить, что ЛЖ действительно активируется через проводящую систему, а вслед за ним — правый (рис. 11) [12].
После подтверждения захвата проводящей системы можно приступать к удалению системы доставки. При выведении доставки в правое предсердие электрод выводится слегка вперед в правое предсердие для создания достаточной петли. Производится повторное измерение параметров стимуляции. Адекватная петля позволит избежать перфорации и смещения электрода, после удаления доставляющего устройства. Предоперационная оценка МЖП путём эхокардиографии или магнитно-резонансной томографии может помочь диагностировать такие состояния, как некомпактность миокарда желудочков, утолщение МЖП, либо гипокинезию и акинезию. Интерпретация этих данных позволяет нивелировать имплантацию электрода в данную область. Потенциально существует риск повреждения септальных ветвей передней межжелудочковой артерии, диагностически данное состояние диагностируется методом введения контраста в систему доставки. Следует размещать электрод ниже и кзади во избежание повреждения артериального русла.
СЛНПГ осуществима в клинической практике. Данная методика требует определённого оснащения и опыта оперирующего хирурга. Электроды в раннем послеоперационном периоде имеют адекватные параметры стимуляции. Для накопления информации о безопасности и эффективности методики требуется проведение многоцентровых рандомизированных исследований о СПС, а также экстракции данных электродов. Не исключается, что эволюция доставочных систем и электродов позволит стандартизировать методику, улучшить технику имплантации, а также повысится эффективность операций в отдаленном периоде, что в конечном счете скажется на улучшении качества жизни пациентов в послеоперационном периоде [10].

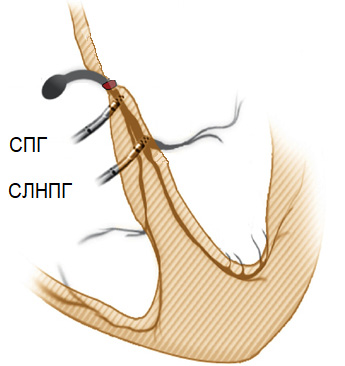
Рис. 1. СПГ и СЛНПГ [27].
Примечание: на изображении схематически отображена позиция электрода при разных типах стимуляции проводящей системы.
Сокращения: СПГ — стимуляция пучка Гиса, СЛНПГ — стимуляция левой ножки пучка Гиса.
Таблица 1
Рекомендуемые настройки электрофизиологической системы
|
Метка |
Тип |
Входы (+/-) |
Усиление |
Высокие частоты |
Низкие частоты |
|
Фильтрованный сигнал |
биполярный |
6/5 |
10,000 |
30,00 Гц |
500 Гц |
|
Нефильтрованный сигнал |
биполярный |
6/5 |
5,000 |
0,50 Гц |
500 Гц |
Таблица 2
Сравнительная характеристика различных электродов для имплантации в проводящую систему сердца [13]
|
Электрод без внутреннего стилета |
Электрод со стилетом |
|
|
Потенциальные преимущества |
• меньший диаметр электрода (4,1 Fr) позволяет электроду быть менее подверженным кинетическим движениям МЖП; • изодиаметричный дизайн способствует пенетрации электрода вглубь перегородки; • фиксированная спираль — ретракция невозможна; • в случае неуспешной имплантации в ЛНПГ, имплантация в пучок Гиса технически проще |
• больший диаметр (>5,5 Fr) и жесткость обеспечивают большую маневренность при вкручивании вглубь перегородки; • больший диаметр системы доставки обеспечивает лучшую поддержку; • при дислокации возможна репозиция электрода классическим способом |
|
Потенциальные недостатки |
• отсутствие стилета и меньший диаметр приводят к меньшей жесткости и, соответственно, маневренности электрода; • система доставки меньшего диаметра создаёт меньшую поддержку электроду; • для репозиции электрода необходим новый сосудистый доступ |
• при вкручивании возможна ретракция спирали; • при репозиции выше риск повреждения спирали; • больший диаметр системы доставки потенциально может быть причиной большего объёма коллатерального повреждения (ткани МЖП, интерференция с клапаном и т. д.) |
Сокращения: ЛНПГ — левая ножка пучка Гиса, МЖП — межжелудочковая перегородка.

Рис. 2. Представлены системы доставки и электроды различных производителей [28].

Рис. 3. Различные варианты формирования системы доставки, в т. ч. с использованием методики «sheath in sheath» (B—E) [29].

Рис. 4. Заведение системы доставки через внешний интродьюсер. Архив авторов.

Рис. 5. Выполнение ангиографии через систему доставки для определения позиции кольца трикуспидального клапана [30].

Рис. 6. Выбор точки фиксации для электрода.
Примечание: A. HB — пучок Гиса (His bundle), LBBA — область левой ножки (left bundle branch area), RV apex — верхушка правого желудочка [13]. B, C. Точками отмечены возможные места для позиционирования электрода при имплантации. Для удобства МЖП разделена на сектора [31].

Рис. 7. Варианты морфологии стимулированного комплекса QRS в месте фиксации [13].

Рис. 8. Изменение морфологии монополярного сигнала в процессе вкручивания электрода [28].
Сокращение: ЛЖ — левый желудочек.

Рис. 9. Выполнение ангиографии для оценки глубины проникновения электрода в толщу МЖП [32].

Рис. 10. Постепенное (слева-направо) изменение морфологии стимулированного комплекса [13].

Рис. 11. Методика измерения межпикового интервала при имплантации электрода в область ЛНПГ [12].
Механизм коррекции проведения по ЛНПГ
Ещё в 70-х годах прошлого века было показано, что стимуляция дистальных волокон пучка Гиса с большой амплитудой приводила к сужению комплекса QRS у пациентов с БЛПНГ (рис. 12) [13].
Это показало, что БЛНПГ может находиться на проксимальном уровне в проводящей системе сердца — внутри пучка Гиса или в основном стволе левой ножи. Более того, современные данные показывают, что чаще всего имеет место быть такой проксимальный тип нарушения проводимости [14]. Это означает, что большинству пациентов с БЛНПГ путём СПС можно скорректировать нарушение проведения по ЛНПГ, при этом электрод должен быть позиционирован дистальнее места блокады (рис. 13). Путём подбора АВ задержки можно выбрать такой интервал, при котором ПЖ будет активироваться спонтанно через правую ножку, а стимуляция левой ножки будет приводить к одновременному возбуждению ПЖ и ЛЖ.

Рис. 12. Стимуляция дистальных (distal) участков пучка Гиса с использованием внутрисердечного электрода позволяет достичь сужения комплекса QRS и коррекции проведения по ЛНПГ.
Примечание: А — нативный комплекс. B — стимуляция проксимальных (Proximal) и дистальных (Distal) участков пучка Гиса [33].

Рис. 13. Схематически изображена позиция электрода дистальнее места блокады в ЛНПГ [33].
СЛНПГ для лечения брадиаритмий
Как верхушечная, так и септальная стимуляция ПЖ приводят к асинхронному сокращению желудочков, что, в свою очередь, приводит к нарушению перфузии миокарда, развитию митральной и трикуспидальной регургитации, повышает риск развития фибрилляции предсердий и систолической дисфункции ЛЖ. Кардиомиопатия, индуцированная стимуляцией ПЖ, развивается примерно у 12% пациентов [15][16]. Факторами риска для развития кардиомиопатии, ассоциированной со стимуляцией, являются [17]: сниженная фракция выброса (ФВ) ЛЖ, широкий нативный комплекс QRS, большой процент желудочковой стимуляции, ширина стимулированного QRS, мужской пол, инфаркт миокарда в анамнезе, хроническая болезнь почек, фибрилляция предсердий.
В связи с этим актуальные клинические рекомендации продвигают концепцию минимизации желудочковой стимуляции во всех случаях, где это возможно [18]. Другой путь уменьшения вероятности развития дисфункции ЛЖ — максимальная физиологичность проводимой стимуляции путем разработки новых методов, которые могли бы уменьшить внутрижелудочковую и АВ диссинхронию за счет обеспечения более физиологического паттерна электрической активации желудочков с целью поддержания сократительной функции и уменьшения клинических осложнений, связанных с высоким процентом стимуляции ПЖ. Концептуальные преимущества СПС по сравнению с традиционной правожелудочковой стимуляцией проявляются ввиду уменьшения ширины стимулированного комплекса QRS, по морфологии близкого к нативному или более узкому.
На сегодняшний день 2 наиболее современных международных согласительных документа описывают показания к СЛНПГ:
1) 2023 HRS/APHRS/LAHRS Guideline on Cardiac Physiologic Pacing for the Avoidance and Mitigation of Heart Failure [19].
2) 2023 EHRA clinical consensus statement on conduction system pacing implantation: endorsed by the Asia Pacific Heart Rhythm Society (APHRS), Canadian Heart Rhythm Society (CHRS), and Latin American Heart Rhythm Society (LAHRS) [13].
Пациентам, у которых на фоне большого процента (>40% или даже >20%) желудочковой стимуляции отмечается снижение ФВ (кардиомиопатия, ассоциированная со стимуляцией) и прогрессирование сердечной недостаточности (СН), рекомендовано: имплантация бивентрикулярного устройства (БиВ) (добавление левожелудочкового электрода) (1-B, NR (non randomized) или СПС (2a-B, NR). Следует отметить, что в имеющихся исследованиях отмечается тренд в пользу СПС по динамике функционального класса (ФК) СН и уменьшению митральной регургитации по сравнению с БиВ стимуляцией [20].
Основываясь на имеющихся данных, у пациентов с показаниями к имплантации постоянного электрокардиостимулятора (ПЭКС) с ФВ ЛЖ 36-50% с большим ожидаемым процентом желудочковой стимуляции, рекомендована имплантация БиВ или СПС (2a, B-R (randomized) БиВ; B-NR СПС), а нормальной ФВ ЛЖ с большим ожидаемым процентом желудочковой стимуляции, рекомендована имплантация БиВ или СПС, но уже с меньшим классом показаний и уровнем доказательности (2b, B-NR).
Существуют исследования, доказывающие профилактическое действие при имплантации электрода в область проводящей системы. Согласно исследованию, у таких пациентов за 6 мес. наблюдения даже отмечалась положительная динамика по ФВ ЛЖ [21].
Наибольшее преимущество от данной методики получат пациенты, нуждающиеся в желудочковой стимуляции. А пациентам без необходимости в желудочковой стимуляции на сегодняшний день предпочтительной тактикой является имплантация стандартного электрода:
- У пациентов с показаниями к имплантации ПЭКС с ФВ ЛЖ >35% с небольшим ожидаемым процентом желудочковой стимуляции, рекомендована имплантация стандартного правожелудочкового электрода и минимизация правожелудочковой стимуляции (2a, B-R);
- У пациентов с показаниями к имплантации ПЭКС и нормальной ФВ ЛЖ с небольшим ожидаемым процентом желудочковой стимуляции, имплантация электрода в ЛНПГ может быть рассмотрена как альтернатива правожелудочковой стимуляции (2b, C-LD);
- У пациентов с показаниями к имплантации ПЭКС и ФВ ЛЖ 36-50% с небольшим ожидаемым процентом желудочковой стимуляции, можно рассмотреть СПС (2b, C-LD (limited data);
- У пациентов с показаниями к имплантации ПЭКС и нормальной ФВ ЛЖ с небольшим ожидаемым процентом желудочковой стимуляции, БиВ не показана (3, B-R).
Обращает на себя внимание, что впервые в клинических рекомендациях СПС имеет более высокий класс показаний, чем БиВ стимуляция, что обусловлено необходимостью имплантации 1 желудочкового электрода, а не двух. Проводится большое количество исследований, посвященных различным аспектам применения стимуляции левой ножки у пациентов с нарушениями АВ проводимости. Вот наиболее крупные из них: OptimPacing, LEAP-CAR, PROTECT-HF.
Ещё одна категория пациентов, нуждающихся в постоянной стимуляции — пациенты, которым показана аблация АВ соединения, поскольку эти пациенты полностью зависимы от ЭКС. У пациентов с интактным проведением по системе Гиса-Пуркинье (узким комплексом QRS) как правожелудочковая, так и БиВ стимуляция будут приводить к развитию диссинхронии. У пациентов с ФП, у которых планируется проведение аблации АВ соединения, СПГ (или ЛНПГ) может быть целесообразна для улучшения или сохранения ФВ ЛЖ и улучшения ФК СН (2b C-LD). Для БиВ стимуляции — 2a B-R. Однако имеются исследования [22], которые показывают преимущество СПС в этом вопросе, поэтому, возможно, скоро мы увидим изменения в этом пункте рекомендаций в пользу СПС.
Согласно крупнейшему на сегодняшний день многоцентровому исследованию MELOS, успех имплантации в ЛНПГ у пациентов с АВ блокадами составил 92,4%. Дислокация электрода была зарегистрирована у 1,5% пациентов, перфорация МЖП во время процедуры у 3,7%, рост порогов стимуляции у 0,7% пациентов [23].
СЛНПГ для ресинхронизирующей терапии
В связи с тем, что БиВ ресинхронизирующая терапия имеет обширную доказательную базу и применяется более 25 лет, она рекомендована в рамках первой линии для пациентов с показаниями к ресинхронизирующей терапии. СПС для этой цели имеет более низкий класс показаний.
СПГ или ЛНПГ целесообразна, если при БиВ ресинхронизирующей терапии не удаётся достигнуть удовлетворительного результата из-за анатомических особенностей (2a C-LD) в качестве второй линии терапии. В качестве первой линии — (2b C-LD) у пациентов с ФК СН по NYHA II-IV, синусовым ритмом и QRS >150 мс.
Также в рамках профилактики развития кардиомиопатии, вызванной БЛНПГ, предлагается профилактически имплантировать электрод в проводящую систему и корригировать БЛНПГ, однако данный подход не распространён и имеет невысокую доказательную базу.
Более того, при ФВ ЛЖ 36-50%, СПС может быть рассмотрена для поддержания или улучшения ФВ ЛЖ (2b C-LD).
Важной особенностью является правильный отбор пациентов. Для СПС лучше всего подходят пациенты с «типичной» БЛНПГ с не ишемическим генезом кардиомиопатии и отсутствием рубцовых изменений в МЖП. Для пациентов с «нетипичной» морфологией ПЛНПГ и, вероятно, наличием неспецифического нарушения внутрижелудочковой проводимости СПС показана только в рамках второй линии терапии, если не удалось имплантировать БиВ систему, причём комплекс QRS должен быть >150 мс.
Два основных рандомизированных исследования, посвященных сравнению эффективности БиВ CRT и СПС — LEVEL-AT [24] и LBBP-RESYNC [25]. Это небольшие исследования со сроком наблюдения в 6 мес., которые показали, что эффективность СПС в данной категории пациентов не только не хуже, но и может превосходить БиВ стимуляцию по динамике ФВ ЛЖ. Безусловно, необходимо ждать результатов более крупных исследований, которые проводятся в настоящий момент: PROTECT-SYNC, Left vs Left.
Также возможно сочетание двух методик: БиВ симуляции и СПС [26]. Такой подход обозначают термином LOT-CRT (left bundle pacing optimized cardiac resynchronization therapy). Такой подход позволяет добиться максимально возможного на сегодняшний сужения комплекса QRS и скорости активации ЛЖ, однако требует заведения сердце большего количества электродов и, как правило, применяется у пациентов, у которых оказалась не так эффективна одна из методик. Решение о первичной имплантации такого количества электродов может быть принято у пациентов с комбинированным нарушением внутрижелудочковой проводимости: ЛНПГ и замедлением проведения по миокарду ЛЖ.
Заключение
В статье отражены технические аспекты СЛНПГ и показаны преимущества данного вида лечения в виде альтернативы ресинхронизирующей терапии и традиционной электрокардиостимуляции.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Приходько Н.А., Замудряков С.С., Лебедев Д.С., Иваницкий Э.А. Стимуляция левой ножки пучка Гиса. Технические аспекты. Доказательная база для применения в качестве альтернативы ресинхронизирующей терапии и традиционной электрокардиостимуляции. Российский кардиологический журнал. 2024;29(4S):6201. https://doi.org/10.15829/1560-4071-2024-6201. EDN: FHLMWD
Скопировать