Роль исследований реальной клинической практики в доказательной кардиологии
Современная кардиология в значительной степени является точной наукой, и выбор тактики ведения пациента должен базироваться на знании результатов исследований, проведенных с использованием основополагающих принципов доказательной медицины (ДМ). Недостаточная информированность врачей о современных подходах к обследованию и лечению пациентов негативно отражается на их состоянии и долгосрочном прогнозе. Кардиология как наука, основанная на доказательствах, в настоящее время развивается наиболее активно, опережая другие области медицины, и все достижения, полученные с использованием данной научной стратегии, должны применяться в реальной клинической практике.
Понятие “доказательная медицина” было предложено в 1990г учеными из университета McMaster University (г. Торонто, Канада) и означает технологию сбора, анализа, обобщения и интерпретации медицинской информации, позволяющей принимать научно доказанные решения относительно профилактики, диагностики и терапии различных заболеваний [1]. Однако попытки научного обоснования процесса лечения предпринимались достаточно давно, и датой рождения ДМ большинство исследователей считают 1830г, когда французский врач Пьер Луи (Pierre Louis) усомнился в эффективности кровопускания при лечении острой пневмонии и на основе клинических наблюдений доказал, что данный вид вмешательства оказывает лишь незначительный эффект [2]. В результате использование кровопускания, применявшегося на протяжении столетий, было постепенно прекращено. К этому времени были разработаны и основные принципы статистической обработки биологических данных, а Жюль Гавар (Jules Gavarret) в 1840г первым применил их в медицине. Он подчеркивал, что вывод о преимуществе одного метода лечения перед другим должен вытекать из результатов, полученных в процессе наблюдения за достаточным количеством пациентов, лечившихся по сравниваемым методикам, при этом различие в эффективности должно превышать определенную пороговую величину, которая зависит от числа наблюдений [2]. Таким образом, Ж. Гавар фактически разработал статистический метод, на котором до настоящего времени основывается ДМ.
Конец XIXв и начало ХХв отмечены активным развитием научного подхода к экспериментальному подтверждению исходной исследовательской гипотезы. Работы К. Бернара (1813-1878), И.М. Сеченова (1829-1905), И. П. Павлова (1849-1936) свидетельствуют об изучении различных физиологических и метаболических процессов посредством тщательно спланированных экспериментов на животных. В медицинских клиниках стали открываться исследовательские лаборатории, в которых врачи могли проводить параклинические испытания. В 1898г И. Фибигер (1867-1928) выполнил работу, в ходе которой сравнивались результаты лечения дифтерии в двух группах больных — получавших и не получавших терапевтическую сыворотку. В то время данная работа осталась незамеченной, однако сейчас историки считают ее первым примером сравнительного испытания в медицине. И только еще через 50 лет (1948г) были опубликованы результаты контролируемого исследования, посвященного изучению эффекта стрептомицина у больных туберкулезом, которое соответствовало методологическим стандартам рандомизации и статистического анализа, действующим в настоящее время [3].
Середина XXв ознаменовалась появлением целого ряда новых методов лечения различных заболеваний, разработчики которых обычно обосновывали целесообразность их внедрения только тем, что эффективность нового метода вытекает из существующих знаний о патогенезе болезни. Однако впоследствии было показано, что часть этих методов лечения бесполезна, а некоторые из них даже опасны. Самые драматичные последствия были зарегистрированы для вещества талидомид — небарбитуратного седативного средства, которое в конце 1950-х годов вывела на рынок Западной Германии компания Chemie Gr?nenthal. Данный препарат наиболее широко применялся у беременных женщин в качестве противорвотного средства при утренней тошноте, и объем его продаж измерялся тоннами — только за 1960г было продано 14,6 тонн талидомида. По различным подсчетам, данное лекарственное средство стало причиной тяжелых аномалий внутриутробного развития у 8-12 тыс. детей, при этом 40% младенцев умерли в течение первого года жизни. Кроме того, было зафиксировано и увеличение числа выкидышей. Разработчики талидомида вывели его в широкую клиническую практику, выполнив исследования лишь на лабораторных животных (мышах). Однако последующие испытания установили, что реакция на лекарственные средства у различных видов животных проявляется по-разному. Например, мыши оказались менее чувствительны к талидомиду, чем приматы или кролики [4-6].
История с талидомидом серьезно повлияла на отношение к тестированию лекарств. Фармацевтические компании начали изучать действие препаратов in vitro, а также увеличили число видов животных для проверки влияния лекарственных субстанций на организм. Кроме того, была окончательно установлена необходимость следующего этапа тестирования — оценки эффективности и безопасности препаратов у людей в специально спланированных клинических исследованиях (КИ) с включением достаточного числа пациентов. Контролируемые испытания с применением рандомизации приобрели статус “золотого стандарта” исследований, посвященных оценке действия терапевтических вмешательств. В последние годы многие методологические аспекты проведения рандомизированных контролируемых исследований (РКИ) значительно усовершенствовались, и в первую очередь это относится к методам статистического анализа полученных данных.
В настоящее время процесс создания и изучения лекарственных средств представляет собой длительный многоступенчатый процесс. На начальных этапах разработки проводятся так называемые доклинические исследования — химические, физические, биологические, микробиологические, фармакологические, токсикологические и другие испытания in vitro и/или на лабораторных животных. Целью этих этапов является получение данных об эффективности и безопасности препаратов, однако они не дают достоверной информации о действии изучаемых субстанций в организме человека, т.к. фармакокинетические характеристики и реакция органов и систем на лекарства у лабораторных животных и человека отличаются. Поэтому следующим обязательным этапом изучения препарата является проведение клинических испытаний у человека, которые длятся, как правило, в течение нескольких лет. Выделяют четыре основные фазы клинического исследования:
- Фаза I — первые испытания лекарственного средства на людях, как правило — на здоровых добровольцах, при этом их число составляет несколько десятков. Эта фаза оценивает фармакокинетические и фармакодинамические характеристики, переносимость, безопасность, наличие терапевтического действия, а иногда и первоначальные показатели эффективности у людей.
- Фаза II изучает эффективность и безопасность препарата у пациентов с конкретным заболеванием без сопутствующей патологии, а также определяет терапевтический уровень дозирования. На данном этапе количество пациентов исчисляется, как правило, сотнями.
- Фаза III — клинические испытания проводятся, как правило, в многочисленных научно-исследовательских центрах различных стран на больших группах пациентов (тысячи испытуемых) различного возраста, с разнообразной сопутствующей патологией. Исследования фазы III являются рандомизированными контролируемыми, и в них изучаются все аспекты лечения, включая оценку показателя риск/ польза. По их итогам часто принимается решение о регистрации или отказе в регистрации лекарственного препарата, вследствие чего РКИ III фазы нередко называют “регистрационными”. Кроме того, на основании результатов РКИ III фазы создается инструкция по применению конкретного лекарственного препарата, а также могут быть изменены клинические рекомендации по ведению пациентов соответствующего профиля.
- Фаза IV — клинические исследования, которые проводятся уже после внедрения препарата в широкую клиническую практику. Испытания этой фазы также называют “постмаркетинговыми”, и они преследуют несколько целей — дополнительное изучение препаратов в популяциях пациентов, малопредставленных в рандомизированных исследованиях; определение распространенности и особенностей течения заболевания, демонстрация пользы нового препарата с точки зрения экономики здравоохранения; выявление ранее неизвестных побочных эффектов и факторов риска, которые могут послужить гипотезой для проведения последующих РКИ; оценка соответствия лечения в реальной практике клиническим рекомендациям. Соответственно, безопасность и эффективность лекарственного средства могут периодически пересматриваться на основании новых клинических данных по его пострегистрационному применению [7].
Обязательным требованием к проведению любого КИ является соблюдение основополагающих этических принципов Хельсинкской Декларации, Правил GCP (Good Clinical Practice, Надлежащая Клиническая Практика) и действующих нормативных требований [8]. Неуклонно должен соблюдаться принцип приоритета прав, безопасности и здоровья испытуемого над интересами науки и общества. Испытуемый может быть включен в КИ только на основании добровольного информированного согласия, полученного после детального ознакомления с материалами исследования, а также прекратить участие в клиническом исследовании в любой момент, отозвав свое согласие.
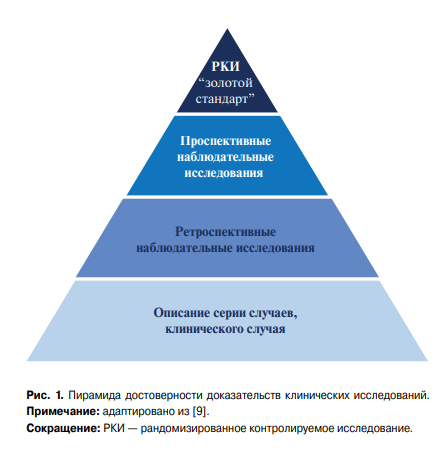
На различных этапах изучения лекарственных препаратов применяются КИ различных дизайнов — для III фазы используются, как правило, РКИ, в то время как для IV фазы — наблюдательные КИ, среди которых выделяют когортные исследования, исследования случай-контроль, кроссекционные исследования. Регистрационные и постмаркетинговые испытания имеют различные цели, используют разные подходы к формированию групп пациентов и методы статистической обработки полученных данных и, следовательно, характеризуются различной степенью доказанности полученных результатов. Для визуализации роли КИ различного дизайна в ДМ используется пирамида доказательств (рис. 1), из которой следует, что в настоящее время инструментом получения максимальной степени доказательств считается РКИ, т.к. реальную эффективность лечения можно оценить только при использовании рандомизации [9]. Данная процедура обеспечивает равномерное распределение пациентов на группы вмешательства и контроля по известным параметрам и, следовательно, позволяет минимизировать влияние вмешивающихся факторов и систематические ошибки. В итоге вследствие рандомизации происходит сравнение сопоставимых по основным клиническим характеристикам групп больных, которые имеют известные различия лишь по факту приема изучаемого препарата. Кроме того, заслепление назначенного лечения, которое, как правило, используется в дизайне РКИ, снижает предвзятость при последующем анализе данных. Таким образом, РКИ устанавливают наличие причинно-следственных связей между применяемым препаратом и развитием исходов. Однако у РКИ есть и ряд недостатков — например, они не позволяют выявить отсроченные и редкие побочные эффекты изучаемых препаратов и установить последствия их длительного использования. Кроме того, в РКИ редко включается >10 тыс. человек, а их длительность обычно составляет <5 лет. РКИ могут значительно различаться между собой по качеству вследствие различий по мощности, выбору препарата сравнения, оценки исходов, использования различных статистических методов расчета, определения первичных и вторичных конечных точек, общего протокола исследования. Также необходимо помнить, что результаты конкретного РКИ применимы к тем больным, которые наиболее приближены по характеристикам к пациентам, принимавшим в нем участие, а экстраполяция итогов РКИ на более широкую популяцию пациентов имеет ограничения с точки зрения ДМ.
Следовательно, необходимо дальнейшее изучение лекарственных препаратов в повседневной клинической практике с целью дополнения недостающих данных об их эффективности и безопасности. Грамотно спланированные наблюдательные КИ имеют большое значение для клинической медицины, т.к. включают многочисленную и репрезентативную, т.е. соответствующую реальной клинической практике и разнородную по своим характеристикам, популяцию пациентов, оценивают больший спектрклинических исходов и действие препарата в редких подгруппах пациентов, которые обычно исключаются из РКИ и позволяют выявить дополнительные эффекты исследуемого препарата, неотмеченные в РКИ, но имеющие потенциально важное клиническое значение. Тем не менее наблюдательные исследования имеют существенные методологические ограничения для сравнения стратегий лечения. Кроме того, они имеют разную степень внутренней валидности вследствие исходных различий в источниках данных, базовых характеристиках пациентов в методологии исследования и алгоритмах оценки исходов. Отсутствие рандомизации может приводить к наличию систематических различий между группами как по известным, так и по неизвестным параметрам. Таким образом, все перечисленные выше обстоятельства могут оказывать существенное влияние на результаты КИ и сопровождаться возникновением систематических ошибок. Важно отметить, что исследования реальной клинической практики не могут подменять собой результаты РКИ при принятии решений о назначении тех или иных препаратов и не имеют силы опровергать или подтверждать данные РКИ.
В первую очередь необходимо обращать внимание на такую характеристику дизайна КИ, как тип наблюдения за пациентами — проспективный или ретроспективный (исторический), т.к. этот параметр является важнейшим фактором, влияющим на степень доказанности результатов. Среди исследований реальной клинической практики наиболее высоким уровнем доказанности обладают проспективные наблюдательные исследования. Пациенты последовательно набираются в сравниваемые группы в соответствии с критериями, изложенными в протоколе конкретного КИ. Далее группы наблюдаются в течение определенного времени, после чего фиксируются исходы, которые наступают после включения пациентов в исследование. Заранее планируются алгоритмы оценки переменных и конечных точек, а также статистические подходы к выявлению и анализу полученных данных, что обеспечивает надежность полученных результатов. Все это делает результаты наиболее точными и приближает их качество к РКИ. Ретроспективный дизайн допускает возможность применения различных методов статистической обработки, которые выбраны уже после наступления исходов и окончания набора данных, что значительно снижает достоверность полученных результатов.
Однако в реальной клинической практике наиболее распространены ретроспективные наблюдательные исследования, анализы баз данных и регистры, которые позволяют изучить большие популяции в различные, в т.ч. и очень длительные, сроки. Тем не менее значительным недостатком таких исследований является наличие выраженных смещающих факторов. Например, в настоящее время широко распространены наблюдательные КИ, которые представляют собой анализ баз данных страховых заявок. Однако информация такого рода не является наблюдением за пациентом или историей его болезни, содержащей необходимые клинические данные. Страховые заявки — это финансовые документы, которые подаются в страховую компанию для получения денежного возмещения за полученные пациентом лекарственные препараты. Для этих документов характерны ошибки в кодировании, влияние “человеческого фактора”, пропуски важных данных о пациенте при заполнении. Кроме того, исказить результаты итогового анализа могут такие факторы, как различия в режиме назначения лекарственных средств в инструкции по применению, предпочтения конкретного врача при назначении препаратов, сопутствующие заболевания пациентов и многое другое. В такой ситуации вычленить действие конкретного лекарственного препарата представляется возможным далеко не всегда. По сравнению с проспективными наблюдательными КИ, ретроспективные КИ имеют больший риск систематических ошибок. И даже использование различных статистических методик “псевдорандомизаций”, а также использование многочисленных выборок пациентов не может нивелировать эти недостатки. Именно поэтому ретроспективные наблюдательные КИ имеют низкий уровень доказательности в клинических рекомендациях и не могут быть основанием для принятия решения при выборе терапии (рис. 1).

Рис. 1. Пирамида достоверности доказательств клинических исследований.
Примечание: адаптировано из [9].
Сокращение: РКИ — рандомизированное контролируемое исследование.
Определенный интерес, безусловно, представляют и описательные исследования — т.е. представление клинического случая или серии случаев. Как правило, такие работы публикуются, когда врачисследователь встречается с одним или несколькими редкими примерами какого-либо заболевания или состояния. При этом данные исследования представляют в основном практический, а не научный интерес. Сильные и слабые стороны КИ различного дизайна представлены в таблице 1.
Таблица 1
Достоинства и недостатки различных дизайнов с точки зрения ДМ

Проследить весь спектр КИ с позиций ДМ можно на примере изучения прямых оральных антикоагулянтов (ПОАК), многолетний опыт применения которых позволил накопить большой объем данных о возможностях их использования в различных клинических ситуациях. В настоящее время ПОАК используются по целому ряду показаний — профилактика венозных тромбоэмболических осложнений (ТЭО) при проведении ортопедических хирургических вмешательств, профилактика инсульта и системных ТЭО у пациентов с фибрилляцией предсердий (ФП), лечение тромбоза глубоких вен и/или тромбоэмболии легочной артерии и профилактика их рецидива, а для ривароксабана одобрен еще ряд показаний — профилактика смерти вследствие сердечно-сосудистых причин, инфаркта миокарда и тромбоза стента у пациентов после острого коронарного синдрома; профилактика инсульта, инфаркта миокарда и смерти вследствие сердечно-сосудистых причин, а также профилактика острой ишемии конечностей и общей смертности у пациентов с ишемической болезнью сердца или заболеванием периферических артерий.
И перед регистрацией каждого из этих показаний были проведены как доклинические исследования, так и РКИ I-III фаз. Например, одобрение использования ПОАК дабигатрана этексилата, апиксабана и ривароксабана у пациентов с ФП было получено после успешного окончания РКИ III фазы RE-LY, ARISTOTLE и ROCKET AF, соответственно [10-12]. Тем не менее эти РКИ имеют между собой важные различия, касающиеся дизайна, определения конечных точек, характеристик пациентов. Так, популяция больных, включенных в исследовании ROCKET AF, характеризовалась наиболее высоким риском ТЭО и кровотечений, а также была наиболее “возрастной” и коморбидной, в то время как пациенты, включенные в РКИ RE-LY и ARISTOTLE, были менее тяжелыми. Этот момент является чрезвычайно важным, т.к. именно характеристики популяции пациентов и определяют степень внешней валидности исследования [13], и в дальнейшем, по итогам проведении регистра РЕКВАЗА, было показано, что популяция РКИ ROCKET AF в наибольшей мере соответствует среднестатистическим
характеристикам российской популяции больных с ФП [14]. Кроме того, в РКИ RE-LY не использовалось ослепление при сравнении дабигатрана этексилата и антагониста витамина К (АВК) варфарина, в то время как РКИ ROCKET AF и ARISTOTLE применялся двойной слепой метод, который является привычным стандартом для РКИ.
Еще одним примером значимых различий в дизайне вышеназванных РКИ было то, что в РКИ ROCKET AF пациенты с хронической болезнью почек (ХБП) (клиренс креатинина <50 мл/мин) исходно выделялись в отдельную группу и получали ривароксабан в сниженной дозировке — 15 мг/сут., в то время как в РКИ RE-LY и ARISTOTLE наличие у пациента ХБП не являлось определяющим в выборе дозировки. Так, в РКИ RE-LY больные рандомизировались в группы приема дабигатрана этексилата в дозах 110 мг 2 раза/сут. или 150 мг 2 раза/сут. в соотношении 1:1, без учета почечной функции. В РКИ ARISTOTLE для снижения дозы апиксабана необходимо было наличие у больного двух критериев из следующих трех: уровень сывороточного креатинина ?133 мкмоль, масса тела ?60 кг, возраст ?80 лет [9]. Таким образом, только ривароксабан изучался в проспективно изученной сниженной (почечной) дозе в РКИ у пациентов с ФП и ХБП, а полученные результаты по его эффективности и безопасности позволили одобрить к применению сниженную дозировку. Представленные данные еще раз подтверждают тот факт, что прямое сравнение результатов различных РКИ с ПОАК невозможно и, соответственно, не может служить основанием для вывода о преимуществах какого-либо из ПОАК.
Ранее уже было указано, что результаты конкретного РКИ могут быть применимы только для той популяции пациентов, которая в нем изучалась, и простое распространение данных, полученных в РКИ, на более широкий контингент больных не является корректным. Соответственно, изучение ПОАК в повседневной клинической практике продолжается с 2010г, что позволяет дополнить знания об их эффективности и безопасности. С этих позиций значительную доказательную базу у пациентов с ФП имеет ривароксабан, с которым выполнено большее количество наблюдательных проспективных КИ. Примером грамотно спланированного и проведенного наблюдательного КИ является исследование XANTUS POOLED с участием 11121 пациента из 47 стран мира [15]. Наблюдение проводилось с интервалами ~3 мес. в течение 1 года. Первичной конечной точкой являлись сообщения о нежелательных явлениях (с отдельным учетом серьезных), включающих и частоту больших кровотечений по определению Международного общества по тромбозу и гемостазу, а также общую смертность. В качестве вторичных конечных точек рассматривали ТЭО и небольшие кровотечения. Сообщения о неблагоприятных исходах оценивались централизованно специально созданным независимым комитетом специалистов. Кроме того, проводился выборочный аудит качества оценки и первичных данных. Средняя длительность лечения составила 329 сут., и за этот срок у 96,1% больных не развился ни один из исходов: большие кровотечения, инсульт, системные эмболии или смерть. Достаточно низкой была и частота больших кровотечений (1,7 на 100 человеко-лет), включая желудочно-кишечные (0,7 на 100 человеко-лет) и внутричерепные (0,4 на 100 человеко-лет). Низкой была и частота инсульта (0,9 на 100 человеко-лет), включая ишемический (0,2%) и геморрагический (0,6%). В целом умерло 187 человек (1,9 на 100 человеко-лет), преимущественно вследствие декомпенсации сердечной недостаточности и злокачественных новообразований.
В итоге частота неблагоприятных исходов и различных осложнений в КИ XANTUS была сопоставима с такими же показателями в РКИ ROCKET-AF, при этом частота ишемического инсульта, больших кровотечений (в первую очередь — желудочно-кишечных) оказалась ниже. Однако прямое сравнение этих результатов невозможно, т.к. популяции этих исследований значительно отличались — в КИ XANTUS пациенты имели в целом более низкий риск неблагоприятных событий. Кроме того, различными были и подходы к учету неблагоприятных исходов. Однако очевидно, что основные показатели безопасности и эффективности ривароксабана при ФП в повседневной врачебной практике не противоречат итогам РКИ ROCKET AF, ставшего основанием для одобрения препарата к широкому практическому использованию.
КИ SAFIR-AC — еще один пример крупного проспективного наблюдательного КИ, выполненного в достаточно специфичной группе пациентов с ФП — в возрасте 80 лет и старше (средний возраст: 86,0 лет; включая 23% пациентов в возрасте 90 лет и старше) [16]. Ценность этого исследования заключается в том, что ранее безопасность антикоагулянтной терапии в РКИ ПОАК у гериатрических пациентов была изучена недостаточно: в рандомизированных регистрационных исследованиях пациентов старше 80 лет было всего ~15%, пациентов старше 90 лет <1%, и появление отдельно спланированного наблюдательного исследования высокого качества позволяет дополнить данные РКИ по малопредставленной популяции пациентов старческого возраста. На сегодняшний день это единственное проспективное исследование безопасности ПОАК у пациентов гериатрической возрастной группы, и подобные данные отсутствуют у других ПОАК. Исследование SAFIR AС проводилось в 33 гериатрических центрах Франции и включало 995 пациентов, получавших ривароксабан, и 908 пациентов, получавших АВК. Длительность наблюдения составила 1 год. Целью данного КИ была оценка риска развития кровотечений на фоне приема ривароксабана в сравнении с АВК. По сравнению с АВК в группе ривароксабана риск большого кровотечения был ниже на 47% (отношение рисков (ОР) 0,53; 95% доверительный интервал (ДИ) 0,37-0,75), также была выявлена тенденция к снижению риска внутримозгового кровоизлияния на 52% (ОР 0,38; 95% ДИ 0,18-0,82), смертельных кровотечений на 58% (ОР 0,42; ДИ 0,18-09,99), при сопоставимом риске ишемического инсульта (ОР 0,76; 95% ДИ 0,32-1,80) и смерти от любых причин (ОР 1,05; 95% ДИ 0,82-1,34) с тенденцией к снижению риска.
Заключение
Внедрение принципов ДМ в практическое здравоохранение дает врачам возможность использовать в своей повседневной практике терапевтические подходы, которые доказали свою эффективность в специально спланированных РКИ. При этом необходимо оценивать возможность использования лекарственного препарата у конкретного пациента в соответствии с дизайном проведенных КИ и строго следовать инструкции по его применению. Решения о выборе препарата должны основываться на критическом подходе к качеству имеющихся данных эффективности и безопасности, полученных в популяции, наиболее приближенной к пациенту. Кроме того, врачам следует регулярно проводить анализ доступной научной информации, обращая особое внимание на ее качество. Преимущества, недостатки, ограничения и методологические сложности, связанные с наблюдательными исследованиями, должны тщательно анализироваться при интерпретации их результатов. При этом соответствие итогов исследований реальной клинической практики выводам регистрационных испытаний свидетельствует о высокой воспроизводимости терапевтического эффекта лекарственного препарата.
Отношения и деятельность. Публикация подготовлена при поддержке ОА “Байер” (PP-M_RIV-RU-0051-1).
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Павлова Т.В. Роль исследований реальной клинической практики в доказательной кардиологии. Российский кардиологический журнал. 2021;26(3S):4636. https://doi.org/10.15829/1560-4071-2021-4636
Скопировать