Принципы диагностики сердечной недостаточности с сохраненной фракцией выброса
Аннотация
Низкоинтенсивное системное воспаление, миокардиальный стресс и фиброз внеклеточного матрикса приводят к сердечной недостаточности с сохраненной фракцией выброса (СНсФВ). Для выявления СНсФВ рекомендованы диагностический алгоритм HFA-PEFF и шкала H2FPEF. Низкое соответствие результатов их применения служит причиной совершенствования способов диагностики СНсФВ. Современная инструментальная диагностика этого синдрома включает оценку давления заполнения левого желудочка при проведении диастолического стресс-теста. Перспективным может быть фазовый анализ деформации левого предсердия при эхокардиографии покоя для заключения об увеличении среднего давления в левом предсердии. Исследовательский интерес растет в отношении биомаркеров, участвующих в регуляции синтеза коллагена. В совокупности инструментальная и лабораторная диагностика помогают составить комплексную характеристику последовательного морфофункционального ремоделирования сердца, увеличивая возможности выявления СНсФВ.
Цель обзора — рассмотреть роль современных аспектов инструментальной и лабораторной диагностики сердечной недостаточности (СН) с сохраненной фракцией выброса (СНсФВ).
Методология поиска
Проведен поиск в базе данных PubMed по представленным ключевым словам: «heart failure with preserved ejection fraction», «left ventricular diastolic function», «left atrial strain», «diastolic stress test», «biomarkers» за период с 1 января 2010г по 1 апреля 2023г. По результатам анализировано 270 источников литературы (согласительные документы, метаанализы, обзоры литературы, статьи, клинические случаи), из которых 50 включены в обзор.
Результаты
Эпидемиология СНсФВ
Среди пациентов с клиническими проявлениями хронической СН 45% страдают от СНсФВ [1]. Рост заболеваемости СНсФВ регистрируется с 1990г [2]. Более чем у 30% пациентов наблюдается снижение фракции выброса (ФВ) левого желудочка (ЛЖ) до значений <50% (<10% из них переносят инфаркт миокарда) [1]. 5-летняя смертность составляет 13%, основные ее причины — внезапная сердечная смерть и смерть ввиду декомпенсации сердечной деятельности [3][4].
Рекомендованные способы диагностики СНсФВ
На пути диагностики СНсФВ в первую очередь следует использовать традиционный метод оценки сократительной функции — ФВ ЛЖ [5]. Следующий шаг (при ФВ ЛЖ ?50%) — оценка диастолической функции (ДФ) левых отделов сердца. Ввиду сложности акта диастолы нет ни одного рекомендованного параметра, который бы мог использоваться самостоятельно — вне комплексного анализа — для маркирования диастолической дисфункции (ДД).
Известно, что для больных СНсФВ характерны гипертрофия ЛЖ, ДД с повышением давления заполнения (ДЗ) ЛЖ, дилатация левого предсердия (ЛП), легочная гипертензия и дисфункция правого желудочка (ПЖ). Таким образом, происходит последовательное функциональное и морфологическое ремоделирование сначала левых, затем — правых отделов сердца [6]. Обновление рекомендаций ASE/EACVI по оценке ДФ от 2016г привело к более точной классификации ДД в сравнении с оригинальными рекомендациями ASE/EACVI 2009г [7][8]. Однако даже при следовании алгоритмам действующих рекомендаций у части пациентов (~20%) ДФ остается неопределенной, что существенно затрудняет диагностику СНсФВ [7].
Клинико-функциональные способы диагностики СНсФВ валидированы несколько лет назад. В 2019г Европейским обществом кардиологов (European Society of Cardiology, ESC) предложен диагностический алгоритм HFA-PEFF, который ориентирован на функциональный статус пациента. Так, необъясненная одышка при физической нагрузке (ФН) предполагает проведение трансторакальной эхокардиографии (ЭхоКГ) в покое и обязательное определение уровня натрийуретических пептидов (brain natriuretic peptide, BNP)/N-концевого промозгового натрийуретического пептида (NT-proBNP) — маркеров миокардиального стресса (секретируются ЛЖ при растяжении миокарда ввиду увеличения пост- или преднагрузки на левые отделы сердца). Промежуточная вероятность СНсФВ подводит к проведению диастолического стресс-теста (ДСТ) [5]. Шкала H2FPEF (предложена клиникой Mayo, США, 2018г) фокусирована на клинической характеристике больного с определением традиционных признаков ДД по данным ЭхоКГ (табл. 1) [9]. Из изложенных критериев СНсФВ доминирующей возможной причиной указывается ожирение, преобладающим следствием — фибрилляция предсердий (ФП). Однако ввиду низкого соответствия результатов применения HFA-PEFF и H2FPEF возникает необходимость совершенствования способов диагностики СНсФВ [10].
Таблица 1
Диагностика ДФ и нарушения диастолического резерва
при проведении ЭхоКГ
|
Параметр |
Референсное значение |
Интерпретация |
Источник |
|
Трансторакальная ЭхоКГ в покое |
|||
|
e’lateral, см/с |
<10 |
Угнетение релаксации боковой стенки ЛЖ |
EACVI 2016 |
|
e’ septal, см/с |
<7 |
Угнетение релаксации МЖП |
EACVI 2016 |
|
иоЛП, мл/м? |
>34 |
Дилатация полости ЛП |
EACVI 2016 |
|
Скорость ТР, м/с |
>2,8 |
Легочная гипертензия |
EACVI 2016 |
|
Е/e’average |
>14 |
Повышение ДЗ ЛЖ |
EACVI 2016 |
|
LASr, % |
<23 |
Снижение комплаентности ЛП к ЛЖ |
Morris DA, et al. [17] |
|
LASI |
>0,26 |
Увеличение диастолической жесткости ЛП |
Kim D, et al. [20] |
|
Стресс-ЭхоКГ с горизонтальной ВЭМП |
|||
|
Е/e’average |
?15 |
Повышение ДЗ ЛЖ |
ESC 2019 |
|
Скорость ТР, м/с |
>3,4 |
Повышение гемодинамической нагрузки на правые отделы сердца |
ESC 2019 |
|
Е/e’average |
>14 |
Повышение ДЗ ЛЖ |
EACVI/ASE 2017 |
|
Е/e’septal |
>15 |
Повышение ДЗ ЛЖ |
EACVI/ASE 2017 |
|
Е/e’average (восстановительный период) |
>13 |
Повышение ДЗ ЛЖ |
EACVI/ASE 2017 |
|
Скорость ТР, м/с |
>3,1 |
Повышение гемодинамической нагрузки на правые отделы сердца |
EACVI/ASE 2017 |
|
DFRI |
<13,5 |
Угнетение релаксации ЛЖ |
Gibby C, et al. [29] |
Сокращения:
ВЭМП — велоэргометрическая проба,
ДЗ — давление заполнения,
иоЛП — индекс объема левого предсердия,
ЛЖ — левый желудочек,
ЛП — левое предсердие,
МЖП — межжелудочковая перегородка,
ТР — трикуспидальная регургитация,
ЭхоКГ — эхокардиография,
DFRI — диастолический функциональный резерв (diastolic functional reserve),
Е/e’average — отношение скорости раннего наполнения
левого желудочка (трансмитральный поток)
к средней скорости движения кольца митрального клапана,
Е/e’septal — отношение скорости раннего наполнения
левого желудочка (трансмитральный поток)
к скорости движения латеральной части кольца митрального клапана,
e’lateral — скорость движения латеральной части кольца митрального клапана
при использовании тканевой допплерографии,
e’septal — скорость движения медиальной части кольца митрального клапана
при использовании тканевой допплерографии,
LASI — индекс жесткости левого предсердия (left atrial stiffness index),
LASr — деформация резервуарной фазы (left atrial reservoir strain).
Фокус на ЭхоКГ: морфофункциональный и гемодинамический статус
Перспективы трансторакальной ЭхоКГ покоя
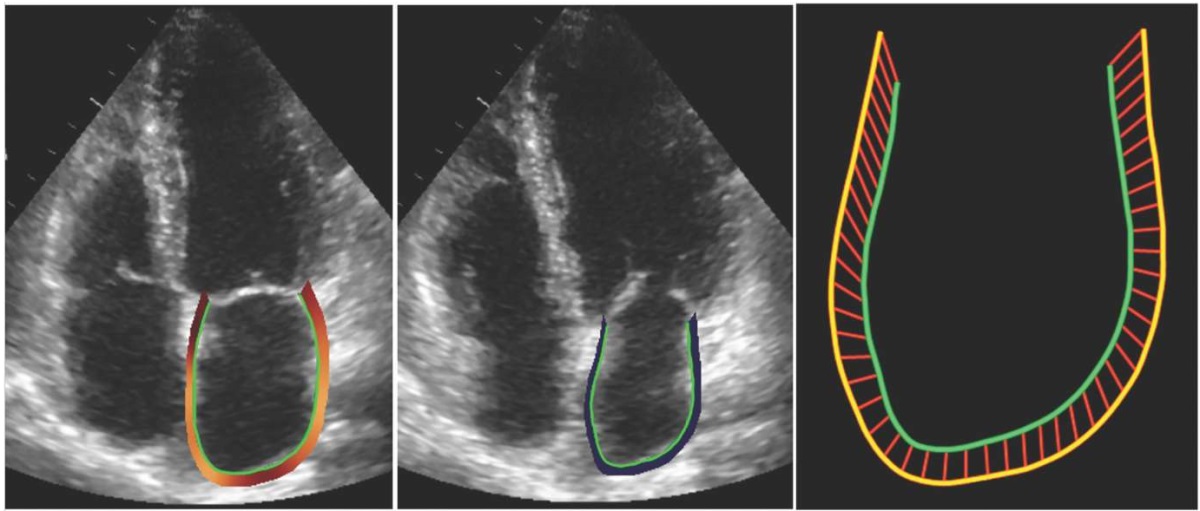
Требуется понимать, что ключевое звено алгоритма инструментальной диагностики СНсФВ — это выявление повышения среднего давления ЛП [11]. Фазы сердечного цикла определяют для ЛП функции, во многом приоритетно не зависящие от самого ЛП. Сначала ЛП (во время сокращения ЛЖ) служит резервуаром для легочного венозного потока. Затем для того же потока ЛП становится каналом (кондуитом), способствуя наполнению ЛЖ (ранняя диастола). Впоследствии миокард ЛП сокращается, увеличивая наполнение ЛЖ (поздняя диастола) [12]. При использовании метода отслеживания движения пятен (Speckle Tracking Echo, STE) (рис. 1) доступен количественный анализ каждой фазы, получен диапазон значений нормы [13]. Учитывая, что фазовая деформация ЛП (left atrial strain, LAS) подвергается изменениям по мере прогрессирования ДД, использование STE для диагностики СНсФВ представляется актуальным [14].

Рис. 1. Выделение контура ЛП для фазового анализа LAS.
Примечание: 4-камерная позиция апикального доступа с акцентом на ЛП.
Слева — окончание изоволюметрического расслабления ЛЖ;
в центре — окончание сокращения ЛП;
справа — динамика движения стенок ЛП
(желтый контур — наибольший объем, зеленый контур — наименьший объем).
Цветное изображение доступно в электронной версии журнала.
Сокращение:
ЛП — левое предсердие,
ЛЖ — левый желудочек,
LAS — left atrial strain (деформация левого предсердия).
Крайне важно отметить, что в сравнении с отношением E/e’ (ключевой признак повышения ДЗ ЛЖ и выявления СНсФВ) деформация резервуарной фазы (left atrial reservoir strain, LASr) при ЭхоКГ покоя имеет большую корреляцию со значением ДЗ ЛЖ, измеренным инвазивно, вне зависимости от ФВ ЛЖ [15]. Поэтому следует выделить, что при нормальном среднем давлении в ЛП большая часть его наполнения приходится именно на резервуарную фазу. Однако с увеличением давления происходит смещение наполнения ЛП в кондуитную фазу — значение LASr уменьшается [11]. Поэтому эту фазу можно считать определяющей в диагностике СНсФВ (рис. 2). Стоит принимать во внимание, что в отличие от глобальной продольной деформации ЛЖ (global longitudinal strain, GLS), которая отражает укорочение миокарда ЛЖ и описывает его сократительную функцию, LASr выражает удлинение миокарда ЛП. Таким образом, LASr можно использовать в качестве концептуальной меры соответствия (комплаентности) ЛП к ЛЖ [16].

Рис. 2. Фазовый анализ LAS.
Примечание: белая линия — усредненная (average) фазовая
деформация ЛП во время сердечного цикла;
линии синего, красного и голубого цвета — сегментарная деформация ЛП
(межпредсердной перегородки, крыши, свободной стенки ЛП соответственно —
при использовании 4-камерной позиции апикального доступа).
Цифрами зеленого цвета указаны фазы ЛП, описывающие его функцию:
1 — фаза резервуара (включает изоволюметрическое сокращение,
изгнание, изоволюметрическое расслабление),
2 — фаза кондуита (соответствует открытию митрального клапана, диастазису),
3 — фаза сокращения (описывает сокращение ЛП,
продолжается до закрытия митрального клапана).
Аббревиатурами желтого цвета указан фазовый анализ LAS.
Цветное изображение доступно в электронной версии журнала.
Сокращения:
ЛП – левое предсердие,
LAS – left atrial strain (деформация левого предсердия),
LASr – left atrial reservoir strain
(деформация резервуарной фазы левого предсердия),
LAScd – left atrial conduit strain
(деформация кондуитной фазы левого предсердия),
LASc – left atrial сontraction strain
(деформация сократительной фазы левого предсердия).
Среди пациентов с неопределенной ДФ до 70% пациентов имеют нормальный объем ЛП. У 50% из них выявляется снижение LASr. При добавлении оценки LASr к алгоритму ASE/EACVI 2016г частота выявления ДД увеличивается на 70% [17]. Замена оценки объема ЛП на LASr обеспечивает снижение неопределенной ДФ на 75% [18]. Крайне важно указать, что в диагностике СНсФВ угнетение LASr ниже референсного значения согласуется с результатами ДСТ и функциональным классом СН по классификации NYHA [17][19]. А индекс жесткости ЛП (left atrial stiffness index, LASI) — отношение E/e’ к LASr — имеет тесные корреляции не только с гемодинамическими показателями левых и правых отделов сердца, но и с концентрацией BNP [20].
Снижение LASr ниже референсного значения [17] маркирует «миопатию ЛП» — клинически недооцениваемую электромеханическую дисфункцию ЛП, приводящую к ФП и декомпенсации СНсФВ (табл. 1) [16][21]. В предсказании возникновения ФП (преобладающее следствие СНсФВ при использовании шкалы H2FPEF) при нормальном объеме ЛП более значима оценка LASr, при увеличении объема ЛП — GLS [22]. Угнетение LASr также ассоциировано с ремоделированием легочной сосудистой сети (выражается в повышении легочного сосудистого сопротивления) и, как следствие, с сократительной дисфункцией ПЖ — снижением деформации свободной стенки ПЖ (right ventricle free wall strain, RV FWS) [23]. Вместе с этим у больных СНсФВ при оценке GLS, LAS и RV FWS именно угнетение LASr показало наибольшую связь с неблагоприятными клиническими исходами (госпитализация ввиду СН или смерть) [23].
Из изложенного следует, что при применении STE в диагностике СНсФВ именно анализ LASr может привести к своевременным терапевтическим вмешательствам (в дополнение к HFA-PEFF и H2FPEF) [24]. А в цепочке связанных структур, действующих последовательно и комплексно, функциональная связь ЛЖ и ЛП (LASI) может являться ключевым компонентом континуума ремоделирования левых отделов сердца (табл. 1).
Возможности ДСТ при проведении стресс-ЭхоКГ
Моделирование условий возникновения одышки особенно актуально для поиска ее причины. Поэтому в рамках стресс-ЭхоКГ с комплексной оценкой состояния сердца и применением велоэргометрической пробы проводится ДСТ [25-27].
Краеугольным камнем диагностики СНсФВ считается снижение диастолического резерва (ДД с повышением ДЗ ЛЖ во время ДСТ) [5][26][27]. Неинвазивный признак повышения ДЗ ЛЖ — это увеличение отношения Е/е’ (рис. 3). Для вычисления Е/е’ обязательно определение гемодинамической и морфодинамической характеристик ЛЖ без участия ЛП. Для этого фиксируются ранние диастолические скорости: импульсно-волновая допплерография (pulsed wave Doppler, PWD) используется для регистрации пика Е антеградного трансмитрального потока (отражает наполнение ЛЖ), PWD в сочетании с тканевой допплерографией (tissue Doppler imaging, TDI) — для регистрации пика e’ движения кольца митрального клапана (описывает растяжение ЛЖ) [26][27].

Рис. 3. Выявление нарушения диастолического резерва
при проведении ДСТ у пациента с исходной ДД
(тип I — нарушение релаксации).
Примечание: происходит увеличение скорости пика Е трансмитрального потока,
использование PWD (от 42 см/с до 105 см/с) (верхняя панель);
скорость пика e’ изменяется незначительно, применение PWD
в сочетании с TDI (от 5 см/с до 6 см/с),
E/e’ исходно — 8,4; E/e’ на пике ФН — 17,5 (средняя панель).
Зафиксировано увеличение скорости ТР с 2,6 м/с до 3,4 м/с,
CWD в сочетании с цветовым картированием (нижняя панель).
Сокращения:
ДСТ — диастолический стресс-тест,
ТР — трикуспидальная регургитация,
ФН — физическая нагрузка,
CWD — continuous wave Doppler (постоянно-волновая допплерография),
PWD — pulsed wave Doppler (импульсно-волновая допплерография),
TDI — tissue Doppler imaging (тканевая допплерография).
При ФН депонированная в венах нижних конечностей кровь устремляется к правым, а затем — левым отделам сердца. Увеличение венозного возврата сопровождается ростом конечного диастолического объема ЛЖ. Реализация механизма Франка-Старлинга приводит к поддержанию необходимого в новых условиях минутного объема сердца. При частоте сердечных сокращений выше 100-120 уд./мин минутный объем сердца поддерживается уже благодаря гиперкинезии миокарда ЛЖ — реализации эффекта Треппе-Боудича [28]. При СНсФВ ввиду неспособности миокарда ЛЖ растягиваться для увеличения конечного диастолического объема ЛЖ (низкая амплитуда e’ при ДСТ) растет ДЗ ЛЖ (высокая амплитуда Е при ДСТ). Превышение референсных значений для отношения Е/е’ считают снижением диастолического резерва, диагностируют СНсФВ (табл. 1) [5][26][27].
Полезным для применения признаком неспособности миокарда ЛЖ к достаточному растяжению может служить угнетение диастолического функционального резерва (diastolic functional reserve, DFRI). При использовании TDI (?e’ ? e’покой) этот дополнительный признак помогает в диагностике СНсФВ, его снижение ассоциировано с низкой толерантностью к ФН (табл. 1) [29].
Важным (но необязательным для положительной пробы) компонентом СНсФВ является увеличение систолического давления легочной артерии, которое отражает повышенную гемодинамическую нагрузку на правые отделы сердца (вне рамок физиологического диапазона), легочную гипертензию при ФН и объясняет одышку (табл. 1). Стоит отметить, что увеличение систолического давления легочной артерии без повышения Е/е’ не считается признаком СНсФВ [5].
На финальном шаге выявления СНсФВ в рамках диагностического алгоритма HFA-PEFF предлагается (при безуспешности предыдущих шагов) катетеризация правых отделов сердца — инвазивная оценка давления заклинивания легочной артерии (ДЗЛА) [5]. Повышение ДЗЛА во время стресс-теста (при его нормальном значении в покое) связано с большей 10-летней смертностью [30]. Следует обратить внимание, что ДЗЛА только косвенно отражает давление в ЛП и конечное диастолическое давление в ЛЖ (баллон диагностического катетера дилатируют в ветвях легочной артерии — регистрируют давление, передаваемое от ЛП через систему легочных капилляров) [30].
Фокус на биомаркеры: метавоспаление, миокардиальный стресс, фиброз
Принципы инициации и развития СНсФВ
Иммунное воспаление, миокардиальный стресс и фиброз внеклеточного матрикса тесно взаимосвязаны в контексте инициации и развития СНсФВ [31].
Провоспалительные цитокины — это сигнальные молекулы, стимулирующие миграцию иммунокомпетентных клеток. Ключевыми цитокинами поддержания системного хронического низкоинтенсивного воспаления (метавоспаление) можно считать фактор некроза опухоли-? (tumor necrosis
factor-?, TNF-?), интерлейкин (interleukin, IL)-6 и IL-1?. Избыточная продукция TNF-? и IL-6 характерна для метаболической кардиомиопатии (ожирение, резистентность тканей к инсулину, сахарный диабет 2 типа) [32, 33], артериальной гипертонии и хронической болезни почек [34][35]. При атерогенезе высокое локальное высвобождение IL-1? (в т.ч. его аутоиндукция) также приводит к увеличению концентрации IL-6 (последний считается системным медиатором воспаления) [36].
Циркуляция провоспалительных цитокинов в коронарном микроваскулярном русле (в частности, TNF-? и IL-6) провоцирует субэндотелиальную миграцию циркулирующих моноцитов [31]. При их участии эндотелиальными клетками чрезмерно продуцируются активные формы кислорода, снижается доступность оксида азота (nitric oxide, NO) для гладкомышечных клеток, что способствует потере эндотелий-зависимой вазодилатации — развивается эндотелиальная микроваскулярная дисфункция (coronary microvascular dysfunction, CMD) [31][37]. Оксидативный стресс также приводит к дефициту сигнального пути NO — cGMP — PKG, способствуя угнетению способности релаксации кардиомиоцитов, развитию концентрического ремоделирования ЛЖ и, что особенно важно в контексте выявления СНсФВ, формированию ДД [31][38][39]. В этой связи следует выделить результат мультицентрового клинического исследования PROMIS-HFpEF (2018г): у 75% пациентов с СНсФВ была инструментально подтверждена CMD (снижение коронарного резерва кровотока <2,5). Обнаружена связь СMD с периферической эндотелиальной дисфункцией, указывающая на системный характер метавоспаления [40].
Среди лабораторных признаков иммунного воспаления С-реактивный белок и регулирующий его секрецию IL-6 могут стать маркерами инициации СНсФВ, вероятно, ввиду связи их концентрации с метаболическим синдромом и ФП [41][42]. Однако для выявления СНсФВ только маркеров метавоспаления недостаточно.
Рассматривая метаболическую кардиомиопатию как вероятную причину СНсФВ, важно указать на «парадокс ожирения»: при увеличении индекса массы тела концентрация маркеров миокардиального стресса — BNP/NT-proBNP — становится ниже [43]. BNP/NT-proBNP традиционно используются для выявления СНсФВ (диагностический алгоритм HFA-PEFF), хотя их концентрация растет при угнетении ФВ ЛЖ [44]. Этого недостатка лишен медиатор миокардиального фиброза галектин-3 (Galektin-3, Gal-3), концентрация которого, напротив, наиболее высокая у больных СНсФВ [45][46]. Избыточному фиброзу миокарда (характеризуется увеличением объема внеклеточного матрикса преимущественно за счет коллагена) способствуют фибробласты [47]. Их дифференциация в миофибробласты стимулируется макрофагами (моноциты, совершившие миграцию в ткань ввиду иммунного воспаления) [48]. Периваскулярный фиброз связан с развитием CMD, интерстициальный — с формированием ДД [31][38]. Поэтому растет исследовательский интерес к биомаркерам, участвующим в регуляции синтеза коллагена.
В контексте развития СНсФВ крайне важно провести параллель между инструментальными и лабораторными способами ее диагностики [39]. Нужно отметить положительную корреляцию отношения Е/e’ (признак повышения ДЗ ЛЖ при проведении ЭхоКГ) с концентрацией маркеров фиброза: Gal-3, растворимой формой стимулирующего фактора роста 2 типа (soluble suppression of tumorigenesis-2, sST2) и фактором дифференцировки роста-15 (growth differentiation factor-15, GDF-15) [44][49]. Другими словами, высвобождение биомаркеров, характеризующих избыточный миокардиальный фиброз, происходит в условиях миокардиального стресса — это подтверждается при инструментально-лабораторной диагностике СНсФВ.
Следует обратить внимание на возможность фенотипирования СНсФВ при использовании указанных биомаркеров: концентрация GDF-15 увеличивается при ишемическом повреждении миокарда, Gal-3 — при сахарном диабете 2 типа [44]. Вероятно, допустимо дифференцировать варианты воспаления: стерильное/индуцированное метаболическим риском [50]. В свою очередь, sST2 может быть использован в качестве показателя прогрессирования СН — его концентрация растет при повышении гемодинамической нагрузки на правые отделы сердца [44].
Заключение
Таким образом, диагностике СНсФВ следует быть последовательной и комплексной: основанной на выделении ключевых звеньев ее инициации и развития с обязательным применением инструментальной (ЭхоКГ покоя, ДСТ) и лабораторной характеристик поражения сердца (рис. 4).

Рис. 4. Предлагаемый алгоритм диагностики СНсФВ.
Примечание: шаг 1 — применение рекомендованных алгоритма HFA-PEFF и шкалы H2FPEF (перечислены признаки предполагаемой СНсФВ). Шаг 2 — использование современных способов инструментальной и лабораторной диагностики СНсФВ в состоянии покоя. Шаг 3 — проведение ДСТ в рамках стресс-ЭхоКГ с комп лексной гемодинамической и морфодинамической оценкой сердца.* — угнетение глобальной продольной деформации левого желудочка (global longitudinal strain, GLS).
Сокращения:
ДСТ — диастолический стресс-тест,
ЛЖ — левый желудочек,
ЛП — левое предсердие,
НУП — натрийуретические пептиды,
СНсФВ — сердечная недостаточность с сохраненной фракцией выброса,
ЭхоКГ — эхокардиография,
LAS — left atrial strain (деформация левого предсердия),
LASI — индекс жесткости левого предсердия
(left atrial stiffness index),
LASr — деформация резервуарной фазы
(left atrial reservoir strain),
Gal-3 — галектин-3 (Galektin-3),
GDF-15 — фактор дифференцировки роста-15
(growth differentiation factor-15),
sST2 — растворимая форма стимулирующего фактора роста 2 типа
(soluble suppression of tumorigenesis-2).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Широков Н.Е., Ярославская Е.И., Криночкин Д.В., Мусихина Н.А., Гизатулина Т.П., Енина Т.Н., Петелина Т.И., Солдатова А.М., Самойлова Е.П., Погорелов Н.О., Гапон Л.И. Принципы диагностики сердечной недостаточности с сохраненной фракцией выброса. Российский кардиологический журнал. 2023;28(3S):5448. https://doi.org/10.15829/1560-4071-2023-5448. EDN: JCREUS
Скопировать