Новые биологические маркёры диагностики и прогнозирования риска смерти у пациентов с тромбоэмболией лёгочной артерии
Одна из форм проявления венозных тромбоэмболических осложнений (ВТЭО) — тромбоэмболия лёгочной артерии (ТЭЛА) — занимает третье место в структуре причин смерти среди всех сердечно-сосудистых заболеваний, уступая инфаркту миокарда и инсульту. Ежегодно в мире регистрируется от 39 до 115 случаев ТЭЛА на 100 тыс. населения [1]. Именно поэтому особое значение имеет своевременная и максимально ранняя диагностика ВТЭО, что будет способствовать улучшению как краткосрочных, так и долгосрочных прогнозов пациентов.
Диагностирование ТЭЛА при первом контакте с медицинским персоналом может быть затруднено из-за наличия неспецифических признаков и симптомов, таких как кашель, одышка, тахипноэ, кровохарканье, боли в грудной клетке, которые можно наблюдать и при целом ряде других заболеваний [2]. Помимо оценки функции правого желудочка (ПЖ) методами трансторакальной эхокардиографии (ЭхоКГ) и компьютерной томографической ангиографии (КТ-ангиография), в обследовании и стратификации риска у пациентов с ТЭЛА нашли своё применение следующие биологические маркёры — D-димер, N-концевой фрагмент натрийуретического пептида типа B (NT-proBNP) и тропонин I [3].
Например, D-димер используется в клинической практике для диагностики острых ВТЭО и прогнозирования риска развития их рецидивов. D-димер является продуктом расщепления фибринового сгустка плазмином. При этом он обладает высокой чувствительностью — отрицательный результат позволяет уверенно исключить ТЭЛА у больных с низкой и средней её вероятностью с точностью до 97%. Однако D-димер обладает низкой специфичностью в диагностике ТЭЛА, что обусловлено его повышением при многих физиологических и патологических состояниях (беременность, онкология, воспалительные процессы и другие) [4].
NT-proBNP — пептидный гормон, который продуцируется кардиомиоцитами желудочков сердца. При перегрузке ПЖ давлением происходит перерастяжение и повреждение миокарда, что ведет к высвобождению данного гормона и тропонина I. Уровень натрийуретических пептидов и тропонина I в плазме крови отражает тяжесть дисфункции ПЖ при острой ТЭЛА [5, 6].
Сердечный тропонин I, как и NT-proBNP, является важным предиктором внутрибольничной или 30-дневной смертности [7]. В метаанализе, проведённом Bajaj A, et al., повышенный уровень тропонина I был в значительной степени связан с повышенным риском краткосрочной смертности (отношение шансов (ОШ) 4,80; доверительный интервал (ДИ) 95%, 3,25-7,08), смертности, связанной с ТЭЛА (ОШ 3,80; ДИ 95% 2,74-5,27), и серьезных нежелательных явлений (ОШ 3,65; ДИ 95% 2,41-5,53) [8].
Учитывая недостаточную специфичность вышеперечисленных лабораторных параметров, существует насущная необходимость в поиске новых биомаркеров, способных повысить качество выявления и стратификации ВТЭО, в т.ч. ТЭЛА. Диагностический и прогностический тест для верификации ТЭЛА должен быть точным, безопасным, легкодоступным и недорогим, а также воспроизводимым и неинвазивным [9, 10]. Однако в настоящее время ни один из использующихся диагностических тестов не отвечает всем этим критериям, вследствие чего целесообразным является дальнейший поиск соответствующих маркёров. В нашем обзоре представлены доступные к настоящему моменту литературные данные по новейшим лабораторным показателям, которые характеризуют дисфункцию ПЖ, развивающуюся вследствие ТЭЛА, и имеют доказательную базу в отношении стратификации риска смерти у этой категории больных.
Цитоплазматический белок, связывающий жирные кислоты сердечного типа (H-FABP)
H-FABP является цитоплазматическим белком массой 15 кДа, высокоэкспрессируемым в клетках с активным липидным обменом. Он облегчает внутриклеточный транспорт длинноцепочечных жирных кислот, содержится преимущественно в миокарде (~0,5 мг/г), в небольшом количестве присутствует в мозге и в поперечнополосатой мышечной ткани скелетной мускулатуры. H-FABP поступает в кровоток через 2 ч после повреждения миокарда, достигает концентрации через 6-8 ч и возвращается к норме в течение 24-36 ч после предшествующей ишемии миокарда. По результатам исследования Kaczynskaya A, et al., цитоплазматический белок превосходил сердечный тропонин I, NT-proBNP и миоглобин в прогнозе 30-дневной смертности, связанной с ТЭЛА. В данном исследовании у 77 пациентов с подтверждённым диагнозом ТЭЛА (средний возраст 65,3±16 лет) оценивался уровень миоглобина, сердечного тропонина I, NT-proBNP и H-FABP. Анализ соотношения рисков показал, что концентрации H-FABP, миоглобина, сердечного тропонина I и NT-proBNP в плазме крови коррелировали с 30-дневным летальным исходом. Согласно представленному многофакторному анализу, предиктивная способность H-FABP, измеренного при поступлении, оказалась даже выше, чем у миоглобина, сердечного тропонина I и NT-proBNP [11].
Подобные данные были получены и в исследовании Bajaj А, et al., которые опубликовали результат метаанализа 15 объёмных исследований, выявивших прямую связь повышенного уровня H-FABP и риска 30-дневных осложнений, таких как необходимость в проведении тромболитической терапии, эндотрахеальной интубации, катехоламиновой поддержки при гипотонии, рецидив ТЭЛА и смертность. Чувствительность и специфичность H-FABP при этом составляли 71% и 74% при прогнозировании 30-дневных осложнений и 90% и 70% при прогнозировании 30-дневной смертности, соответственно [12].
В другом метаанализе, проведённом Dellas C, et al., представлен вывод по результатам обследования 1680 пациентов с ТЭЛА, которым определялся уровень данного белка. Авторы пришли к выводу, что концентрация H-FABP ?6 нг/мл была ассоциирована с неблагоприятным краткосрочным исходом (ОШ 17,7; ДИ 95% 6,0-51,9) и смертностью от всех причин (ОШ 32,9; ДИ 95% 8,8-123,2) [13]. Вследствие представленных данных цитоплазматический белок упоминается как биологический маркер миокардиального повреждения в рекомендациях Европейского общества кардиологов (European Society of Cardiology — ESC) по диагностике и ведению пациентов с ТЭЛА в версиях 2014 и 2019гг [3, 14]. Таким образом, H-FABP является ранним маркёром повреждения миокарда и, следовательно, с помощью H-FABP можно получить дополнительную прогностическую информацию об острой ТЭЛА.
Фактор роста и дифференцировки-15 (GDF-15)
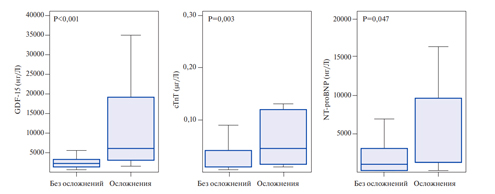
Фактор роста и дифференцировки-15, также известный как макрофагингибирующий цитокин-1, представляет собой белок из суперсемейства трансформирующего ростового фактора-бета, который синтезируется в миокарде после ишемического и реперфузионного повреждения, а также при перегрузке ПЖ давлением. Циркулирующие уровни GDF-15 имеют прогностическую значимость у пациентов с острым коронарным синдромом и сердечной недостаточностью [15]. Lankeit M, et al. представили результаты исследования, в котором оценивалась значимость GDF-15 при прогнозировании исходов ТЭЛА. Регрессионная модель Кокса установила почти 3-кратное увеличение риска смерти у пациентов с повышенными уровнями GDF-15. С помощью многомерного логистического регрессионного анализа, в который были включены клинические характеристики, лабораторные показатели (тропонин T и NT proBNP) и ЭхоКГ-данные, GDF-15 предстал в качестве независимого предиктора 30-дневных осложнений (р=0,033). Он также показал более высокие уровни чувствительности и специфичности (рис. 1, 2) — площадь под кривой (AUC) для GDF15 составила 0,84 (ДИ 95% 0,76-0,90) по сравнению с 0,72 (ДИ 95% 0,63-0,80) для сердечного тропонина T и 0,65 (ДИ 95% 0,56-0,73) для NT-proBNP. Таким образом, показатель GDF-15 в совокупности с тропонином I, NT-proBNP и ЭхоКГ-признаками дисфункции ПЖ позволяет повысить достоверность оценки прогноза. По результатам данного исследования, исходные уровни GDF-15 были определены как независимые предикторы долгосрочной смертности (р<0,001). Исходя из вышеизложенного, авторы исследования делают вывод, что GDF-15 можно рассмотреть как новый многообещающий биомаркер для стратификации риска смерти ТЭЛА [16]. Тем не менее, для включения GDF-15 в перечень обследований больных с ТЭЛА требуются дальнейшие исследования в области применения данного биологического маркера.

Рис. 1. Прогностическая чувствительность и специфичность фактора дифференцировки роста (GDF-15), сердечного тропонина Т (cTnT) и N-концевого фрагмента натрийуретического пептида типа В (NT-proBNP). Графики, показывающие прогностическую чувствительность и специфичность уровней GDF-15, cTnT и NT-proBNP при поступлении в связи с 30-дневными осложнениями.

Рис. 2. Исходные уровни биомаркеров у пациентов с серьезными осложнениями в отличие от пациентов с неосложненным 30-дневным исходом. Уровни GDF-15, cTnT и NT-proBNP выражены в виде бокса (25-й перцентиль, медиана и 75-й перцентиль) и вискера (10 и 90 перцентили).
Сокращение: cTnT — сердечный тропонин Т.
Копептин
Копептин является С-концевой частью провазопрессина и представляет собой гликозилированный полипептид, который состоит из 39 аминокислот и содержит богатый лейцином основной сегмент. Значимость копептина изучалась в отношении таких острых состояний, как пневмония, сепсис, сердечная недостаточность, инфекции нижних дыхательных путей, заболевания желудочно-кишечного тракта и ишемический инсульт [17]. Nickel NP, et al. обнаружили, что уровень копептина повышен у пациентов с лёгочной артериальной гипертензией (ЛАГ) [18]. Уровни сывороточного копептина оценивали в ретроспективной когорте из 92 пациентов с ЛАГ, не получавших лечения, и во второй проспективной когорте из 15 пациентов с ЛАГ, получавших лечение сразу после постановки диагноза. Сопоставление полученных результатов показало, что уровни циркулирующего копептина были повышены у не лечившихся пациентов с ЛАГ по сравнению с пациентами контрольной группы, которые получали терапию (20,1 пмоль/л vs 5,1 пмоль/л; р=0,001). Показатели копептина не коррелировали с параметрами гемодинамики, но снижались после начала терапии ЛАГ (р=0,001). Повышенный уровень копептина был связан с ухудшением выживаемости (р<0,001) и оказался независимым предиктором смертности (ОШ 1,4; ДИ 95% 1,1-2,0; р=0,02). Результат исследования позволяет предположить, что данный полипептид может оказаться довольно значимым прогностическим маркером в стратификации риска смерти пациентов с острой ТЭЛА.
В небольшом исследовании, проведённом Кalkan AK, et al. (n=90 человек), пациенты были распределены в зависимости от результата КТ-ангиографии на 2 группы — с ТЭЛА (+) (n=47) и ТЭЛА (-) (n=43). Уровень копептина был выше в группе ТЭЛА (+) по сравнению с группой ТЭЛА (-): 7,76±4,4 vs 3,81±1,34 нг/дл; р<0,001, соответственно. Показатели копептина достоверно коррелировали с уровнем NT-proBNP (r=0,434, р<0,001), D-димера (r=0,315, р=0,003) и тропонина I (r=0,30, р=0,004). Также была выявлена обратная корреляция с насыщением артериальной крови кислородом (r=-0,533, р<0001) [19]. Таким образом, полученные к настоящему времени данные показывают, что копептин может быть рассмотрен в качестве перспективного биомаркера, который будет использован в качестве дополнения к D-димеру, тропонину I и NT-proBNP с целью повышения точности диагностики ТЭЛА [20].
Показатели клинического анализа крови
Клинический анализ крови — одна из самых распространенных первичных диагностических процедур. Это общедоступное, широко используемое и требующее малых финансовых затрат исследование. Однако целый ряд лабораторных показателей клинического анализа крови, как правило, не рассматривается клиницистами в аспекте диагностики и прогнозирования риска ВТЭО.
Ширина распределения эритроцитов (RDW)
Данный показатель — ширина распределения эритроцитов — является частью полного клинического анализа крови пациента, который отражает диапазон изменения объема эритроцитов. Основной биомолекулярный механизм связи RDW с ТЭЛА до конца не изучен, но предполагается, что повышенный уровень RDW коррелирует с острыми воспалительными маркерами и показателями вязкости крови. Существует мнение, что такие показатели, как ширина распределения эритроцитов и количество эритроцитов, являются важными факторами, способствующими формированию таких протромботических состояний, как ТЭЛА и тромбоз глубоких вен (ТГВ) [21].
В 2019г был опубликован систематический обзор Hammons L, et al., объединивший 12 ретроспективных когортных исследований, которые продемонстрировали, что высокий уровень RDW связан с повышенным риском развития острой ТЭЛА, степенью тяжести и увеличением смертности пациентов с ТЭЛА. Тем не менее, сравнение текущих исследований ограничено из-за отсутствия единых подходов к определению верхней границы RDW (каждое исследование использует различное референсное значение RDW), формированию выборки пациентов, широкого диапазона критериев исключения и включения различных методов, используемых для диагностики ТЭЛА (КТ ангиография, вентиляционно-перфузионное исследование или клинические данные). Несмотря на вышеперечисленные ограничения, авторы систематического обзора показали, что RDW в качестве маркера ТЭЛА имеет право на существование [22]. Однако, учитывая представленные данные, значимость RDW в этой области требует дальнейшего изучения.
Средний объем тромбоцитов (MPV)
MPV отражает средний объем тромбоцитов. Имеются данные, что MPV — это важная переменная, т.к. более крупные тромбоциты имеют более высокий тромботический потенциал [23]. Как самостоятельный маркёр MPV в диагностике ТЭЛА не используется. Тем не менее, определение данного показателя может быть полезным для первоначальной оценки риска развития ТЭЛА. Повышенный MPV был признан независимым фактором риска для разных клинических состояний, связанных с гиперкоагуляцией. Gulcan M, et al. (2012) показали, что MPV был значительно увеличен у пациентов с ТГВ по сравнению с контрольной группой (8,6±0,8 vs 7,7±0,9 фл, соответственно; р<0,001) [24]. Учитывая, что ТЭЛА в 50% случаев является осложнением ТГВ, MPV может иметь также и непосредственную связь с ТЭЛА [25].
Talay F, et al. опубликовали ретроспективное исследование, которое включало пациентов с подозрением на ТЭЛА. В результате последующей выборки был проведен анализ 150 пациентов с ТЭЛА, подтверждённой инструментальным методом, и 165 пациентов, у которых диагноз ТЭЛА по результатам обследования не был подтвержден (контрольная группа) [26]. MPV был значительно выше у пациентов с ТЭЛА в условиях отделения реанимации и интенсивной терапии, чем в контрольный группе (9,42±1,22 фл vs 8,04±0,89 фл, р<0,0001). Область под кривой у пациентов с клинически подозреваемым диагнозом ТЭЛА, согласно ROC-анализу, составила 0,634 (95% ДИ 0,596-0,702, р=0,023) (рис. 3). Результат этого исследования продемонстрировал умеренную связь между значением MPV и наличием ТЭЛА, если первый определялся в момент поступления пациента.

Рис. 3. ROC-анализ роли MPV у пациентов с клинически подозреваемым диагнозом ТЭЛА.
В проспективном когортном исследовании Ghaffari S, et al. также были изучены различные показатели клинического анализа крови, в т.ч. и значение MPV. По данным ROC-анализа чувствительность и специфичность MPV с точкой отсечения 9,85 фл в прогнозировании внутрибольничной летальности составила 81% и 50%, соответственно. Данный параметр имел более низкую эффективность в отношении долгосрочной смертности (AUC 0,54; ДИ 95% 0,47-0,61) по сравнению с 30-дневной летальностью. Таким образом, этот показатель тромбоцитов продемонстрировал свою значимость в определении внутрибольничных случаев смерти от всех причин [27]. Возможно, в будущем MPV сможет зарекомендовать себя простым и ранним маркёром прогнозирования риска смерти у больных с ТЭЛА, который станет частью стандартного протокола ведения пациентов с ВТЭО.
Отношение тромбоцитов к лимфоцитам (PLR) и отношение нейтрофилов к лимфоцитам (NLR)
Патофизиологический ответ лейкоцитов на стрессовую ситуацию обычно представляет собой активацию симпатической нервной системы и выброс кортизола, а также увеличение количества нейтрофилов, которое связано с уменьшением количества лимфоцитов. Это ведет к миграции нейтрофилов в зону поражения. PLR и NLR, как суррогатные маркеры воспаления, могут быть использованы для изучения связи между тромбозом и воспалением при ВТЭО. Одним из преимуществ PLR и NLR является то, что они объединяют информацию о первичном гемостазе и воспалении.
Исследование Artoni A, et al. типа “случай-контроль”, которое включало 486 пациентов с ВТЭО, продемонстрировало, что у пациентов с высоким показателем PLR или NLR не было повышенного риска развития ВТЭО (ОШ 0,89; ДИ 95% 0,46-1,76 и ОШ 0,69; ДИ 95% 0,34-1,39, соответственно) или тромбоза вен головного мозга (ОШ 1,65; ДИ 95% 0,68-4,00 и ОШ 0,39; ДИ 95% 0,09-1,72, соответственно). Авторы данного исследования сделали вывод, что связь между значениями PLR и NLR выше допустимой нормы и повышенным риском венозного тромбоза отсутствует [28]. Однако представленных данных недостаточно для широкого использования PLR и NLR в качестве маркеров в диагностике ТЭЛА, вследствие чего необходимы дальнейшие более крупные исследования в данной области.
Сурфактант-ассоциированный белок А (Sp-A) и D (Sp-D)
Сурфактант — это липопротеиновый комплекс, который состоит из нескольких фосфолипидов, нейтральных липидов (90%) и специфических белков. Белковые компоненты, половина которых состоит из двух групп, ассоциированных с сурфактантом белков: гидрофобных — B (0,7%), C (0,4%), и гидрофильных — A (5,3%) и D (0,6%), составляют приблизительно 10% легочного сурфактанта [29]. Среди данных белков Sp-A является наиболее распространенным легочным сурфактантным белком [30, 31]. Sp-A также необходим для структуры трубчатого миелина. В исследовании Liu CP, et al. на 32 крысах уровень Sp-A составлял 1,00±0,00 (контрольная группа), 0,44±0,18 (через 24 ч), 0,44±0,33 (спустя 1 нед.) и 0,52±0,32 (через 2 нед.), соответственно (р<0,05), что обусловлено развивающейся гипоксией на фоне ТЭЛА [32]. Таким образом, уровень белка Sp-A значительно снизился при острой ТЭЛА.
Снижение экспрессии Sp-A в легких на фоне эмболии может быть вызвано ограниченным количеством Sp-A-продуцирующих клеток типа II и/или сниженной Sp-A-экспрессией оставшихся неповрежденных клеток. В настоящий момент, однако, делать выводы о значимости Sp-A в диагностике и прогнозировании риска развития ТЭЛА у людей затруднительно.
Помимо Sp-A были изучены и другие белки, в частности Sp-D. Kati C, et al. представили небольшое исследование, в котором было выделено 3 группы пациентов: больные с диагностированной немассивной ТЭЛА, субмассивной ТЭЛА и контрольная группа, включавшая здоровых людей. Определение Sp-D осуществлялось методом иммунофлуоресцентного анализа. Существенных различий в показателях данного белка между контрольной группой и группой с немассивной ТЭЛА выявлено не было, однако его уровень был повышен у пациентов с субмассивной ТЭЛА [33]. Учитывая малое количество пациентов (n=60), требуются дальнейшие исследования с большим количеством случаев, включая пациентов с массивной ТЭЛА.
Таким образом, качественные и количественные изменения легочного сурфактанта, а именно его белковых фракций, являются потенциальными маркерами повреждения легких и могут быть прогностическими показателями у пациентов с ТЭЛА. В перспективе следует обратить внимание на представленные биомаркеры и провести дополнительные исследования в данной области.
Простагландин D синтаза липокалинового типа (L-PGDS)
L-PGDS можно считать белком с двойной функцией: во-первых, он действует как фермент при продуцировании простогландина D2, и, во-вторых, — как внеклеточный транспортер вследствие его липофильного характера. Впервые данный маркер вы — делен в спинномозговой жидкости человека в 1961г. МикроРНК L-PGDS была обнаружена в клетках миокарда, в эндокардиальных клетках предсердий и желудочков, в коронарных артериях, в клетках гладкой мускулатуры и даже в артериосклеротических бляшках. В последние годы роль L-PGDS все чаще изучалась в оценке функции почек в качестве альтернативы креатинину, а также в роли возможного биомаркера сердечно-сосудистых заболеваний.
В проспективном исследовании, представленном Mutlu H, et al., приняли участие 90 пациентов, которые были госпитализированы в отделение неотложной помощи с ТЭЛА, подтвержденной КТ-ангиографией, а также 40 здоровых добровольцев без каких-либо заболеваний. Уровни L-PGDS измерялись в венозной крови. Для всех пациентов был рассчитан риск смерти в течение 30 дней по индексу PESI. В результате были выявлены статистически значимые различия между уровнями L-PGDS у пациентов с ТЭЛА и контрольной группой (р=0,024), а смертность в течение 1 мес. пациентов с диагнозом ТЭЛА составила 20% (n=18). Предельное значение для L-PGDS, полученное с использованием анализа ROC-кривой для 1-месячной смертности, составило 815,26 нг/мл (чувствительность 83,33%; специфичность 79,17%; AUC 0,851; ОШ 95%; ДИ 0,760-0,917; р<0,001). Основываясь на этом пороговом значении в ходе логистического регрессионного анализа было показано, что увеличение L-PGDS одновременно с повышением класса PESI (r=0,512, р<0,001) является независимым показателем смерти в течение первого месяца. Полученный результат позволяет рассматривать L-PGDS для прогнозирования риска смертности у пациентов с ТЭЛА [34].
Циркулирующие и тканевые микроРНК
МикроРНК представляют собой эндогенно экспрессируемые молекулы РНК длиной 18-22 нуклеотида, которые подавляют экспрессию генов на посттранскрипционном уровне путем связывания с 3?-нетранслируемой областью мРНК-мишеней. МикроРНК участвуют практически во всех биологических процессах — в клеточной пролиферации, апоптозе и дифференцировке клеток. Известно, что микроРНК играют роль в патофизиологии сердечнососудистой системы, включая нарушения гемостаза [35]. Имеются доказательства того, что микроРНК секретируются из клеток в биологические жидкости человека как пассивным, так и активным способом. Такие микроРНК получили название циркулирующих. Изменение профиля экспрессии определенных циркулирующих микроРНК отражает физиологические и патологические состояния клеток, в которых микроРНК модифицируются и секретируются в биологические жидкости человека, такие как кровь, моча, спинномозговая жидкость, слюна и т.д. Циркулирующие микроРНК могут быть обнаружены в различных формах — заключенными в экзосомы или связанными с белками Ago2 (белок аргонавт, который разрезает пре-микроРНК и образует дополнительный предшественник ac-pre-miRNA). Благодаря данным формам транспорта, циркулирующие микроРНК стабильны и защищены от деградирования рибонуклеазами. Поэтому циркулирующие микроРНК рассматриваются как новые потенциальные биомаркеры, представляющие интерес при многих заболеваниях, включая ВТЭО.
Xiang Q, et al. провели анализ 12 исследований в области диагностики ВТЭО, изучавших микроРНК, и представили следующие выводы. Наиболее часто исследуемой микроРНК была miR-134, а объединенные результаты 12 исследований по прогнозирующей способности данной микроРНК с ДИ 95% показали чувствительность 0,82 (0,69-0,91) и специфичность 0,83 (0,68-0,92). Среднее значение AUC для ROC-кривых составило 0,89 (0,86-0,92). Для других микроРНК значения AUC >0,8 рассматривались как потенциальные диагностические показатели. Эти микроРНК включали miR-1233, miR-145, miR-483-3p, miR-582, miR-532 и miR-195 [36]. Таким образом, данный систематический обзор позволяет обратить внимание на представленные микроРНК в области прогнозирования развития ТЭЛА у конкретного пациента.
Исследование Kessler T, et al., которое включало малое количество пациентов (n=30), продемонстрировало, что профиль циркулирующих микроРНК-1233 позволяет отличить ТЭЛА от инфаркта миокарда без подъема сегмента ST. MикроРНК-1233 дифференцировала пациентов с ТЭЛА от пациентов с инфарктом миокарда и здоровых людей с чувствительностью 90 и 90% и специфичностью 100 и 92% (AUC 0,95, p<0,001 и AUC 0,91, p<0,001, соответственно) [37]. В исследовании Lui T, et al., которое также включало малое количество исследуемых (n=90), определялась микроРНК-221, появление которой коррелировало с уровнем NT-proBNP, тропонина I и D-димера [38]. Следовательно, некоторые микроРНК являются возможными диагностическими и прогностическими маркерами у пациентов с ТЭЛА. Однако требуются дальнейшие исследования в этой области для определения конкретных и наиболее специфичных для ТЭЛА микроРНК.
Аполипопротеины СI, СII, СIII и Е
Аполипопротеины — это белковые компоненты липопротеиновых молекул, которые характеризуют липидный спектр крови. Увеличение их концентрации ассоциировано с повышенным риском развития артериального тромбоза [39]. Кроме того, аполипопротеины потенциально могут иметь значение в оценке риска и прогноза ВТЭО, поскольку рост количества аполипопротеинов оказывает влияние на гемостаз и приводит к гиперкоагуляции.
В исследование Orsi FA, et al. было включено в общей сложности 127 пациентов с ВТЭО и 299 пациентов без отягощённого анамнеза по ВТЭО. Отбор пациентов осуществлялся случайным образом. Всем больным определялся уровень аполипопротеинов. Полученные результаты показали, что повышение уровней всех измеренных аполипопротеинов (апоС-I, C-II, C-III и E) было связано с более высокими уровнями витамин К-зависимых факторов свёртывания крови (FII, FVII, FIX, FX, FXI), природных антикоагулянтов (протеин C, протеин S, антитромбин) и временем лизиса сгустка. Кроме того, увеличение уровней фактора свёртывания крови VIII и фактора Виллебранда коррелировало с увеличением уровней апоС-III и апоЕ. Скорректированные по возрасту и полу ОШ аполипопротеинов E, C-III, CII и CI к риску венозного тромбоза составили 1,21 (95% ДИ, 0,98-1,49), 1,19 (95% ДИ, 0,99-1,44), 1,24 (95% ДИ, 0,95-1,61) и 1,06 (95% ДИ, 0,87-1,30) [40]. Авторы делают вывод, что уровни аполипопротеинов C-I, C-II, C-III и E связаны с множеством факторов свертывания крови и физиологических антикоагулянтов. В то же время в работе, выполненной Van Schouwenburg IM, et al., показатели липидного спектра не были связаны с риском развития ВТЭО [41]. Следовательно, данный вопрос к настоящему моменту остаётся спорным, и требуются дальнейшие исследования для его уточнения.
Таким образом, согласно современным клиническим рекомендациям, некоторые биологические маркёры (D-димер, сердечный тропонин I, NTproBNP) являются важными инструментами в арсенале практикующего врача при диагностике и прогнозировании риска смерти у пациентов с ТЭЛА. Однако их использование имеет ряд ограничений и недостатков, вследствие чего в настоящее время идёт изучение различных биологических молекул для диагностики ТЭЛА. Некоторые из них — GDF15, микроРНК, MPV, L-PGDS, Sp-A и Sp-D — показали хорошие прогностические способности. В то же время многие из перечисленных в данном обзоре биомаркеров не используются в обычной клинической практике ввиду недостаточной доказательной базы. Тем не менее, результаты работ, представленных на эту тему, создают фундамент для более крупных исследований и поиска новых диагностических маркёров, которые будут достоверно значимыми для диагностики и прогнозирования риска смерти при ТЭЛА.
Отношения и деятельность: авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Подлипаева А.А., Муллова И.С., Павлова Т.В., Ушакова Е.В., Дупляков Д.В. Новые биологические маркёры диагностики и прогнозирования риска смерти у пациентов с тромбоэмболией лёгочной артерии. Российский кардиологический журнал. 2020;25:4202. https://doi.org/10.15829/1560-4071-2020-4202
Скопировать