Анатомия, гистология и электронная микроскопия проводящей системы сердца. Современное представление и новые сведения: обзор
Аннотация
В литературном обзоре дано современное представление об анатомии, гистологии, иммуногистохимии, электронной микроскопии и электронной иммуноцитохимии проводящей системы сердца (ПСС) на основании литературных данных и собственных исследований автора на протяжении более 30 лет. Описаны новая специализированная х-структура ПСС, открытая автором и опубликованная в 2014г, и еще один тип клеток, входящих в состав синусного и атриовентрикулярных узлов — телоцитов, способных генерировать и проводить электрический импульс. На основании послойного препарирования и серийных гистологических срезов, выполненных на более 400 сердцах взрослых людей, дана топографическая анатомия мышечного каркаса предсердий. В статье также описана иннервация предсердий.
Морфологическое и функциональное изучение проводящей системы сердца (ПСС) ведется уже давно. В 1839г J. Purkine впервые описал волокна ПСС в «Ежегоднике медицинского факультета в Ягеллонском университете» и опубликовал эти данные в «Архиве анатомии» в 1845г [1]. В 1893г W. His выявил мышечный пучок, соединяющий предсердную мускулатуру с мышцами межжелудочковой перегородки, а A. F. S. Kent — боковые мышечные предсердно-желудочковые соединения [2]. Синусный узел (СУ) был открыт A. Keith и M. W. Flack в 1906г. В этом же году S. Tawara впервые описал атриовентрикулярный узел (АВУ), а в 1910г для предотвращения споров о существовании специализированных межузловых трактов, инициированных Ch. Thorell, в Эрлангене были выработаны критерии для специализированных структур ПСС:
- Специализированные клетки ПСС, повторяющиеся из среза в срез;
- Наличие фиброзной капсулы и жировой ткани по типу «бутерброда»;
- Наличие собственных артерий;
- Наличие нервных окончаний и ганглиев вокруг структуры [3-5].
При этом на заседании Немецкого общества патологов присутствовали J. G. Mönckeberg, L. Aschoff, Ch. Thorell, W. Koch, J. Mackenzie и Th. Lewis. Все согласились, что на этом основании никаких изолированных путей не было обнаружено в стенках предсердий, разделяющих СУ и АВУ. На протяжении последующих десятилетий XXв другие исследователи заявляли о существовании предполагаемых путей, но всегда, по-видимому, игнорировали критерии, предложенные J. G. Mönckeberg, L. Aschoff [3, 4]. Однако Th. N. James впоследствии привлек внимание кардиологов к предполагаемым специализированным путям ПСС, так что в настоящее время они изображены на обложке «Heart Rhythm» и во многих учебниках. Он утверждал, что существование таких путей было доказано на основе клинических данных, и, следовательно, его задача состояла в том, чтобы просто проиллюстрировать их расположение [6-8]. Нет никаких сомнений в том, что Th. N. James был дотошным гистологом и ведущим американским кардиологом, исследующим ПСС, но послойные гистологические срезы, препарирование предсердий со стороны эпикарда и эндокарда на >1000 сердцах наших пациентов не подтвердили наличие специализированных трактов Ch. Thorell, K. F. Wenkebach, J. Tandler.
Синусный (синусно-предсердный) узел
Узел располагается под эпикардом между верхней полой веной и ушком правого предсердия (ПП) в терминальной бороздке, образованной латеральным соединением нижней полой вены с остальной частью ПП, обычно имеет сигаровидную форму, длиной от 15 до 26 мм, шириной от 4 до 13 мм, толщиной от 1 до 3 мм. В центре или по периферии узла проходит артерия r. nodi sinuatrialis, которую можно увидеть на срезе (рис. 1 С, 2 А). Она имеет диаметр до 1 мм, в 75% случаев отходит обычно первой от правой артерии сердца, в 25% — от левой артерии. СУ нельзя однозначно распознать невооруженным глазом, но иногда в бороздке на этом месте виден белесоватый участок ткани.
При гистологическом исследовании специализированные клетки ПСС «замурованы» в плотную фиброзную ткань, состоящую из коллагеновых волокон (рис. 2). СУ окружен жировой тканью, нервными волокнами и ганглиями (рис. 2 С), содержит Р-клетки-пейсмейкеры (рис. 2 D), переходные Т-клетки, анастомозирующие друг с другом конец-в-бок (рис. 2 E), крупные клетки Пуркинье (рис. 2 F). В СУ преобладают Р-клетки, они имеют бледную цитоплазму, т. к. содержат минимальное количество миофибрилл, диаметр 4-6 мкм, располагаются обычно кластерами или по одной и контактируют с телоцитами —интерстициальными пейсмейкерами, уникальным типом клеток со специфическими отростками — телоподиями и дилатированными сегментами — подомами, которые имеют иммунофенотип одновременно интерстициальных, эндотелиальных, гладкомышечных, нервных, тучных и гемопоэтических стволовых клеток и экспрессируют connexin43 — белок щелевых межклеточных контактов — gap junctions (рис. 3) [9, 10]. Т-клетки имеют диаметр 12-15 мкм, сравнимый с диаметром рабочего миокарда. Считается, что они служат для передачи электрического импульса от Р-клеток к клеткам Пуркинье и рабочему миокарду, но в центре СУ при увеличении 400 хорошо видны контакты клеток-пейсмейкеров ПСС только с телоцитами. Клетки Пуркинье обычно располагаются по периферии СУ, содержат мало миофибрилл, имеют бледную цитоплазму, диаметр — более 20-25 мкм.
Иммуногистохимическое исследование позволяет определять экспрессию HCN4 (гиперполяризационный активируемый циклический нуклеотид-зависимый калиевый канал 4) и фактор транскрипции tbx3 в клетках ПСС, а connexin-43 — в рабочем миокарде (рис. 3 A, B). При этом HCN4 экспрессируется и в телоцитах (рис. 3 С, G), что говорит об их способности не только проводить, но и генерировать электрический импульс. Наличие этих клеток в СУ хорошо демонстрирует иммуногистохимическое исследование с коктейлями антител HCN4/CD34, S100/CD34 (рис. 3 D, E) и электронная микроскопия/иммуноцитохимия c HCN4 (рис. 3 F, G).
Важно помнить, что клетками-предшественниками специализированных клеток ПСС являются кардиомиоциты. Когда сердечная трубка формируется у раннего эмбриона, активность водителя ритма может быть зарегистрирована на венозном полюсе [11]. Электрический импульс очень медленно распространяется по миокарду, что приводит к появлению синусоидальной электрокардиографии и перистальтического паттерна сокращений. Впоследствии в отдельных участках сердечной трубки образуются предсердия и желудочки. Они экспрессируют connexin-40 и connexin-43, которые образуют щелевые каналы с высокой проводимостью, и α-субъединицу сердечного натриевого канала Nav1.5, обеспечивая этим мышечным волокнам высокую скорость проводимости. Напротив, медленно проводящая зона между предсердной и желудочковой камерами не экспрессирует эти connexins, но положительна для connexin-30.2 и connexin-45, которые образуют щелевые каналы с низкой проводимостью, чтобы задержать деполяризующий импульс. Таким образом, функция, обеспечиваемая системой проводимости, присутствует уже в раннем эмбриональном сердце и не требует образования морфологически отдельных компонентов, а путь развития, выбранный конкретным миоцитом, зависит от его положения в развивающемся сердце. При этом клетка-предшественник превратится либо в «проводящий», либо в рабочий кардиомиоцит.
Молекулярно-генетические исследования выявили функциональную потребность сети факторов транскрипции для формирования СУ и АВУ и быстропроводящих желудочковых путей. Они включают в себя широко экспрессируемые факторы транскрипции: Tbx5 и Nkx2-5 и транскрипционные репрессоры Tbx2, Tbx3 и Id2, которые экспрессируются специфически в предшественниках этих компонентов ПСС [12, 13].
Самая каудальная часть примитивной сердечной трубки экспрессирует канал водителя ритма HCN4, который необходим для активности водителя ритма у эмбриона, вероятно, отвечает за каудальную локализацию доминирующей активности водителя ритма в ранней сердечной трубке.
С развитием экспериментальных методов, изначально с микроэлектродами, а в последнее время с оптическим картированием, наше понимание функциональных свойств ПСС значительно продвинулось за последнее столетие. Так, микроэлектроды регистрируют внутриклеточные потенциалы от отдельных клеток в более крупных тканевых препаратах, а оптическое картирование основано на использовании потенциалзависимых флуоресцентных молекул красителя и позволяет регистрировать электрическую активность в форме оптических потенциалов действия от сотен до тысяч участков одновременно в пределах одного препарата [14]. Сочетание этих экспериментальных технологий с традиционными методами, такими как электрограммы, морфологический анализ, открыло дверь для все более комплексных морфофункциональных исследований сердца.
Так, Fedorov VV, et al. (2010) оптически картировали СУ в коронарно-перфузируемых препаратах из здоровых человеческих сердец (n=4, возраст 54±15 лет) с использованием красителя Di-4-ANBDQBS и блеббистатина [15]. Трехмерная структура узла была реконструирована с использованием гистологии. Это позволило выявить, что СУ электрически изолирован от большей части близлежащего миокарда предсердий фиброзной и жировой тканью за исключением нескольких мышечных пучков — мест прорыва электрического импульса в предсердие с максимальным расстоянием между ними 26,1±7,9 мм.
На наш взгляд, электрическую гетерогенность можно объяснить одновременным наличием 2 типов клеток, способных к проведению электрического импульса в СУ — Т-клеток и телоцитов, а также 2 типов клеток, способных генерировать этот импульс — Р-клеток и телоцитов. Замедленное проведение импульса в центре может быть связано и с тем, что в центральной части СУ телоцитов в 2 раза больше, чем на периферии. Густая 3D-сеть телоподий этих клеток может являться субстратом для microreentry.

Рис. 1. СУ человека.
Примечание: голубым овалом обозначена зона синусного узла, звездочкой — правое ушко, треугольником — верхняя полая вена. С, D. Послойные поперечные срезы. Хорошо видна артерия синусного узла (обведена желтым цветом). Цветное изображение доступно в электронной версии журнала.

Рис. 2. Гистологическое строение СУ человека (обозначен голубым овалом).
Примечание: А. Артерия синусного узла (выделена желтым) находится по периферии узла, который окружен жировой тканью (обозначена красными треугольниками). Окраска гематоксилином и эозином, х50. B. Окраска трихромом Массона (синее окрашивание фиброзной ткани, красное — мышечной ткани), обозначения те же; х50. С. В жировой ткани вокруг синусного узла располагается нервный ганглий (выделен зеленым цветом). Окраска гематоксилином и эозином, х50. D. Р-клетки-пейсмейкеры ПСС. E. Т-переходные клетки. F. Клетки Пуркинье (указаны стрелками). Окраска гематоксилином и эозином, х200 [9]. Цветное изображение доступно в электронной версии журнала.

Рис. 3. Иммуногистохимическое и ультраструктурное исследование СУ.
Примечание: А. Экспрессия HCN4 (коричневое окрашивание) в клетках ПСС; х100. B. Отсутствие экспрессии connexin-43 в клетках ПСС; x200. C. Экспрессия HCN4 в клетках ПСС и телоцитах; х200. D. Двойная метка connexin-43/CD34 демонстрирует колокализацию антигенов в телоците (бордовое окрашивание), который находится под базальной мембраной кластера из двух Р-клеток и обволакивает их своими телоподиями (указан стрелкой); х400. E. Двойная иммунофлуоресцентная метка S100 (зеленое свечение)/CD34 (красное свечение): желтое свечение — коэкспрессия маркеров на телоцитах; х200. F. Электронная микроскопия демонстрирует телоцит (подкрашен зеленым цветом) под базальной мембраной Р-клетки. Его телоподия контактирует также с капилляром. G. Электронная иммуноцитохимия с золотой меткой показывают экспрессию HCN4 в телоците (кластеры коллоидного золота обведены черным) [9]. Цветное изображение доступно в электронной версии журнала.
Межузловые пути проведения электрического импульса
В целом эксперименты по картированию свидетельствуют против специализированных проводящих путей, они показывают, что межпредсердная проводимость происходит преимущественно вдоль крупных, выступающих мышечных пучков с параллельной ориентацией мышечных волокон, в частности, терминального гребня, передней губы овальной ямки (рис. 4) и синусовой перегородки. Это самые прямые пути между СУ и АВУ [16].
Важно помнить, что тонкие стенки предсердий демонстрируют трехмерное расположение циркулярно и продольно ориентированных мышечных пучков, которые могут внезапно претерпевать переходы в архитектуре волокон из эндокардиального в эпикардиальный слой. Самым крупным межпредсердным пучком является пучок Бахмана, располагающийся субэпикардиально между ушками предсердий (рис. 5 A, B). Именно по нему в большинстве случаев распространяется электрический импульс в левое предсердие (ЛП). Он представлен только мышечными волокнами рабочего миокарда, как и остальные межпредсердные мышечные пучки, располагающиеся под эпикардом: задний межпредсердный, задний косо-горизонтальный, верхние межпредсердные пучки (рис. 5 C, D) [17, 18]. Послойное препарирование со стороны эндокарда и серийные гистологические срезы межпредсердной перегородки с шагом 1 мм позволили составить схему Z-образных межпредсердных пучков рабочего миокарда (рис. 5 Е).
Послойное препарирование и серийные гистологические срезы межпредсердной перегородки в направлении сверху-вниз от «крыши» предсердий к АВУ позволили выявить, что овальная ямка представлена не только фиброзной мембраной, но содержит мышечные пучки рабочего миокарда и специализированную структуру ПСС, удовлетворяющую все критерии Эрлангенского соглашения 1910г [19] (рис. 6). Средние размеры х-структуры сравнимы с АВУ — 10,3±8,2 — 4,3±1,4 — 0,6±0,2 мм, она располагается на 20±15 мм выше этого узла в овальной ямке, переходя на клапан овальной ямки, и контактирует с рабочим миокардом. Специализированные клетки х-структуры экспрессируют HCN4 и не экспрессируют connexin-43 (рис. 7), что полностью соответствует иммунофенотипу клеток ПСС [20, 21]. Представлены все типы, но преобладают Т-переходные клетки (рис. 8, 9).
Пока предназначение х-структуры ПСС неясно, но ее гистологическое исследование и послойное препарирование стенки ЛП позволили выявить, что клетки ПСС сообщаются с пучками мышечных волокон из рабочего миокарда [22], которые охватывают устья легочных вен (рис. 10). Расстояние от устья правой верхней легочной вены до ближайшей точки клапана овальной ямки составляет от 0,7 до 3,5 см, в среднем 2,18±0,68 см. При этом клапан овальной ямки не всегда четко контурируется, но во всех случаях имеет серповидную форму. Его длина составляет от 1,5 до 3 см, в среднем 2,5±1,1 см. В последнее время большое значение уделяют именно левой стороне межпредсердной перегородки, считая ее зоной риска для возникновения очаговых и reentry тахикардий [23].
В муфтах легочных вен некоторые авторы также описывают специализированные клетки ПСС (рис. 11), неравномерное расположение мышечных волокон с прохождением их пучков под углом друг к другу [24-26]. Кроме того, муфты имеют разную протяженность, толщину и высоту. Наше морфометрическое исследование на 43 сердцах взрослых пациентов показало, что в среднем наибольшую высоту мышечной муфты имеет верхняя левая легочная вена (1,4±0,5 см у мужчин и 0,4±0,4 см у женщин), тогда как средняя высота муфт остальных легочных вен — 0,3±0,2 см. Считается, что большинство пароксизмальных форм фибрилляции предсердий обусловлено очаговыми источниками, чаще всего возникающими из мышечных муфт легочных вен. В целом геометрический анализ ЛП и легочных вен важен для оценки обратного структурного ремоделирования после аблации.
Оптический микроскоп был и остается золотым стандартом для гистологических исследований ПСС. Однако, начиная с середины двадцатого века, внутриклеточные и внеклеточные микроэлектроды и электронная микроскопия вошли в исследовательский арсенал анатома. За этими инструментами последовали многочисленные мощные технологии визуализации, такие как иммуногистохимия, волоконно-оптическая конфокальная микроскопия, 3-D и отражательная конфокальная микроскопия, магнитно-резонансная томография, микрокомпьютерная томография, оптическая когерентная томография, микрокомпьютерная томография высокого разрешения и иммунофлуоресцентные конъюгаты антител с красителем, нацеленные на клеточные компоненты, для визуализации ранее не обнаруживаемых компонентов ПСС [27]. Эти методики могут обеспечить 3-D изображения сердечных волокон, профилей экспрессии белков и клеточной архитектурной организации компонентов тканей. Электрические деполяризующие волны, распространяющиеся вдоль анизотропно организованных предсердных пучков, могут распространяться быстрее в продольном направлении, чем в поперечном, поскольку распространение волн в последнем направлении сталкивается с повышенным сопротивлением со стороны боковых мембран, которые не экспрессируют соответствующие кластеры функциональных щелевых контактов, являющиеся межклеточными каналами додекамеров коннексинов, напрямую связывающих соседние клетки. Математическая модель Roney CH, et al. (2019) показала, что направление самого быстрого проведения электрического импульса имеет тенденцию соответствовать локальной ориентации волокон [28]. Теперь мы знаем, что у здоровых взрослых людей волна деполяризации СУ распространяется через предсердия и достигает АВУ примерно за 100 мс через множественные анизотропно структурированные коридоры предсердной проводимости. Эти коридоры включают сократительные миоциты, уникально снабженные на своих полярных концах соответствующими средствами для быстрой межклеточной коммуникации (щелевые контакты, натриевые каналы Nav 1.5) и анизотропно структурированные межпредсердные пучки (например, пучок Бахмана).

Рис. 4. Внутренний рельеф ПП со стороны эндокарда.
Примечание: А, B. Правое ушко с crista terminalis (CT). C, D. Вид на овальную ямку (FO), устье коронарного синуса (CS), трикуспидальный клапан (TV) [10, 17].

Рис. 5. Межпредсердные мышечные пучки.
Примечание: A, B. Пучок Бахмана. C. Задний межпредсердный пучок, идущий параллельно пучку Бахмана. D. Верхние межпредсердные пучки на «крыше» предсердий. E. Z-образные пучки рабочего миокарда: 1 — задняя стенка правого предсердия, 2 — задняя стенка левого предсердия, 3 — передняя стенка правого предсердия, 4 — передняя стенка левого предсердия, 5 — овальная ямка, 6 — Z-образные горизонтальные мышечные пучки, направляющиеся над и под овальной ямкой от задней стенки одного предсердия к передней стенке другого предсердия, 7 — мышечный пучок, идущий из верхней трети задней стенки правого предсердия к АВУ [17, 18].

Рис. 6. Овальная ямка.
Примечание: A. Мышечные пучки в овальной ямке. B. Скан серийного гистологического среза межпредсердной перегородки. Овалом выделена зона х-структуры ПСС, распространяющаяся на клапан овальной ямки. Окраска по ван Гизону. C. 3D-изображение х-структуры ПСС. D. Гистологический продольный срез х-структуры. Преобладают Т-клетки, «замурованные» в фиброзную ткань и окруженные жировой тканью с нервными ганглиями (выделены желтым); окраска гематоксилином и эозином, х200 [19]. Цветное изображение доступно в электронной версии журнала.

Рис. 7. Овальная ямка. Иммуногистохимическое исследование Х-структуры.
Примечание: экспрессия HCN4, caveolin 3 (коричневое окрашивание) в клетках ПСС [19]. Цветное изображение доступно в электронной версии журнала.

Рис. 8. Электронная микроскопия овальной ямки.
Примечание: A. Миофибриллы под углом друг к другу в Т-клетке. B. Параллельно расположенные миофибриллы в кардиомиоците рабочего миокарда.

Рис. 9. Электронная микроскопия клеток х-структуры.
Примечание: A. Круглая P-клетка, соседствующая с T-клеткой и Пуркинье-подобной клеткой. B. Плазматическая мембрана P-клетки, образующая множественные пиноцитарные пузырьки и окруженная базальной мембраной. C. P-клетка с многочисленными пучками коротких миофиламентов, которые были разрезаны под разными углами. D. Кластер из двух P-клеток, соединенных посредством сложного вставочного диска.
Сокращения: P — P-клетка, PC — Пуркинье-подобная клетка, Tc — T-клетка, pm — плазматическая мембрана, PV — пиноцитарные пузырьки, bm — базальная мембрана, m — митохондрии, n — ядро, mf — миофиламенты, id — вставочный диск, Z — Z-диски [19].

Рис. 10. Мышечные субэндокардиальные пучки рабочего миокарда ЛП.
Примечание: А. От овальной ямки (выделена синим овалом) отходят мышечные пучки к устьям легочных вен. B. Хорошо видны мышечные пучки, окутывающие устья легочных вен (указаны стрелками). Цветное изображение доступно в электронной версии журнала.
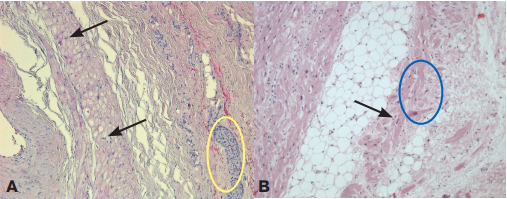
Рис. 11. Гистологические срезы муфт легочных вен.
Примечание: А. Муфта представлена Пуркинье-подобными клетками (указаны стрелками), окруженными рыхлой фиброзной тканью и нервными волокнами (обведено желтым овалом). B. В муфте находятся Т-подобные клетки (обведены овалом) и мелкие Р-подобные клетки (указаны стрелкой), окруженные фиброзной и жировой тканью. Окраска гематоксилином и эозином; х200. Цветное изображение доступно в электронной версии журнала.
АВУ и пучок Гиса
Область атриовентрикулярного (АВ) соединения — это совокупность специализированных проводящих тканей, связывающих рабочий миокард предсердий и желудочков:
- АВУ и его переходная клеточная зона;
- проникающая часть АВ-пучка (пучка Гиса);
- разветвляющаяся часть пучка.
АВУ нужно искать в направлении переднего края треугольника, образованного продолжением клапана нижней полой вены (евстахиева клапана, или сухожилия Todaro), основанием перегородочной створки трикуспидального клапана и устьем коронарного синуса (рис. 12 А). У большинства людей треугольник Коха становится хорошо различимым при натягивании клапана нижней полой вены. На вершине этого треугольника сухожилие Todaro соединяется с центральным фиброзным телом (ЦФТ), которое, в свою очередь, служит ориентиром для забора АВУ для гистологического исследования, образуя втяжение в фиброзном кольце трикуспидального клапана (рис. 12 В). Пучок Гиса находится выше и сзади от АВУ, под правой коронарной заслонкой аортального клапана (рис. 12 C, D, H). Пройдя в ткань желудочков, ствол пучка разветвляется на гребне мышечной части межжелудочковой перегородки, непосредственно под мембранозной частью.
Из тканей венечной борозды, эндокардиальных подушек и проводящей ткани формируется «сэндвич», который сохраняется и в зрелом сердце. Компактная зона зрелого АВУ и проникающая часть АВ-пучка имеют общий источник развития, который может быть назван «узловая-пучковая ось» (nodal-bundle axis). Положение границы между АВУ и проникающей частью пучка Гиса зависит от степени инволюции эндокардиальных подушек. Это зона, где изолирующая ткань ЦФТ (происходящего частично из подушек) отделяет миокард предсердий от оси узел — пучок. Поскольку при формировании АВУ межпредсердная перегородка растет вниз к стволу проводящей ткани, зрелый узел становится межпредсердной частью. Промежуточная зона между этими структурами и миокардом предсердий имеет иное происхождение. Пучок проводящей ткани, развившейся из входной части перегородки (ось узел — пучок), становится средним слоем сэндвича, образованного эндокардиальными подушками (изнутри сердечной трубки) и тканью АВ-борозды (снаружи сердечной трубки).
Функционально и гистологически АВУ можно подразделить на нижнее узловое расширение, компактную зону и нижний узловой пучок. Эта сложная структура образует медленно проводящий электрический путь, который обеспечивает критическую АВ-задержку, которая гарантирует адекватное диастолическое наполнение желудочков [29]. Дифференциальная экспрессия белков щелевых контактов и быстродействующих потенциалзависимых ионных каналов придает особые электрические характеристики каждой области. По нашим данным, средние размеры АВУ — 9,3±3,6 — 3,8±1,0 — 1,0±0,5 мм. Границей между АВУ и пучком Гиса принято считать наиболее суженную часть узла, проникающую через правый фиброзный треугольник в месте соединения его с перепончатой частью межжелудочковой перегородки. АВУ находится под эндокардом ПП на расстоянии 1-8 мм от септальной створки трикуспидального клапана, 10-22 мм от нижнего края овальной ямки и 4-11 мм от заслонки венечного синуса. С левой стороны узел граничит с ЦФТ и аортальным клапаном (рис. 12 E, F, G). В 80% случаев узел кровоснабжается ветвью правой венечной артерии.
Таким образом, основной функцией специализированной области АВ-соединения является задержка в проведении импульса. За задержку чаще всего ответственны преобладающие специализированные Т-клетки, клетки переходной зоны области АВ-соединения (рис. 12 I, J, K, L), фиброзно-жировое окружение. Некоторая задержка проведения происходит также в пучке и его ветвях, т. к. все эти структуры изолированы от миокарда межжелудочковой перегородки фиброзной тканью (рис. 12 M), а нормальный импульс должен пройти через них, прежде чем он сможет активировать миокард желудочков.
Иммунофенотип и ультраструктура клеток ПСС в АВУ идентичны таковым в СУ и х-структуре (рис. 12 K, L). В АВУ также присутствуют телоциты — интерстициальные пейсмейкеры, в культурах которых определялся К+ ток и кальциевые осцилляции, были обнаружены натриевые каналы SCN5A, что свидетельствует о возможности клеток проводить электрический импульс [30].
Пройдя в ткань желудочков, ствол пучка разветвляется на гребне мышечной части межжелудочковой перегородки, непосредственно под мембранозной частью.
Специализированная проводящая ткань левого желудочка проходит непосредственно субэндокардиально по септальной поверхности выходящего тракта левого желудочка под некоронарной створкой аортального клапана.
В фиксированном сердце обычно можно увидеть проксимальную часть левой ножки АВ-пучка, спускающуюся по левожелудочковой поверхности межжелудочковой перегородки (рис. 13).
Правая ножка АВ-пучка отходит от общего ствола пучка интрамиокардиально.
В нормально сформированном сердце хорошим ориентиром при определении ее позиции служит медиальная сосочковая мышца.
В отличие от веерообразной левой ножки пучка, правая ножка пучка представляет собой узкую, похожую на шнур структуру. Она обычно проходит интрамиокардиально, чтобы достичь правой стороны перегородки, проходя через заднюю ножку септомаргинальной трабекулы и проходя под медиальным папиллярным мышечным комплексом. Затем она простирается до верхушки правого желудочка внутри тела трабекулы, разветвляясь на верхушке желудочка. Важно помнить, что по клеточному составу пучок Гиса и желудочковая ПСС в основном представлена клетками Пуркинье >20-25 мкм в диаметре и содержащих минимальное количество миофибрилл, что способствует более быстрому проведению электрического импульса [31]. Система Гиса-Пуркинье отвечает за быструю электрическую проводимость в сердце. Она передает электрические импульсы от узлов к мышечным волокнам и, таким образом, координирует сокращение желудочков, чтобы обеспечить надлежащую насосную функцию сердца.
Аномалии развития ПСС сами по себе могут быть причиной развития нарушений ритма сердца, таких как врожденная полная блокада сердца или преждевременное возбуждение желудочков. Кроме того, структуры ПСС могут быть анатомически нормальными, но располагаться атипично из-за врожденных пороков сердца. Преждевременное возбуждение желудочков может быть вызвано несколькими анатомическими субстратами, наиболее распространенными из которых являются особенно поддающиеся хирургическому лечению [32]. Предварительное возбуждение типа Вольфа-Паркинсона-Уайта (короткий PR-широкий QRS-дельта-волна) вызывается дополнительными АВ соединениями, которые могут быть легко разделены хирургической операцией. Более редкая форма синдрома Вольфа-Паркинсона-Уайта, которая обусловлена дополнительными нодовентрикулярными или фасцикуло-вентрикулярными волокнами (волокнами «Махайма»), сама не поддается хирургическому лечению, но может иногда требовать лечения путем разделения АВ-пучка. Это, вероятно, лучше всего сделать с помощью криотермии [33], ориентиры треугольника Коха используются в качестве руководства для проникающего пучка. Преждевременное возбуждение вариации Лоуна-Ганонга-Левина (короткий PR нормальный QRS) обусловлено либо атриофасцикулярными волокнами, либо внутриузловыми обходными путями. Пока что хирургическое лечение в этих случаях ограничивается разделением проникающего пучка в случаях некупируемой тахикардии. Поэтому именно классический тип преждевременного возбуждения Вольфа-Паркинсона-Уайта чаще всего требует хирургического лечения. Здесь знание анатомии дополнительных АВ-соединений значительно облегчает их успешное хирургическое разделение. Дополнительные АВ-соединения могут быть расположены вокруг митрального отверстия, вокруг отверстия трехстворчатого клапана или внутри самой перегородки. Левосторонние митральные соединения обычно вызывают так называемое предвозбуждение типа А и имеют особенно постоянную морфологию. Они берут свое начало из миокарда предсердий прямо над митральным кольцом, а затем проходят через эпикардиальную жировую подушку на внешней стороне кольца, очень плотно его охватывая, прежде чем войти в миокард желудочков. Для аблации соединения необходимо будет рассечение жировой подушки на эпикардиальной стороне кольца. Также следует иметь в виду, что эти соединения могут быть множественными. Правосторонние соединения обычно вызывают так называемый тип B преждевременного возбуждения. Они также могут быть множественными и могут распространяться через эпикардиальную жировую подушку, чтобы соединить миокард предсердий и желудочков. Трикуспидальное кольцо, однако, гораздо менее хорошо сформировано, чем митральное, и эти соединения могут пересекать фиброзное кольцо субэндокардиально через дефекты в нем. Тем не менее разрез на кольце с рассечением в эпикардиальной жировой подушке обычно необходим, чтобы быть уверенным в достижении разделения правостороннего соединения. Септальные добавочные соединения являются наиболее трудными для лечения, как с точки зрения локализации, так и хирургического разделения.

Рис. 12. АВ-соединение.
Примечание: А. Треугольник Коха (выделен желтым пунктиром). B. Линия разреза для забора АВУ. C, D. Проекция и разрез зоны пучка Гиса под заслонкой аортального клапана (указаны пинцетом). E, F. Срезы АВУ. G. Срезы пучка Гиса. H. 3D-cхема атриовентрикулярного соединения (из электронных ресурсов интернета). I. Компактная зона АВУ с центральной артерией узла и преобладающими Т-клетками. Окраска гематоксилином и эозином, х50. J. Компактная зона АВУ с артерией и Т-клетками. Окраска гематоксилином и эозином, х200. K. Экспрессия HCN4 (коричневое окрашивание) в специализированных клетках ПСС. L. Экспрессия HCN4 (синее окрашивание) и connexin-43 (красное окрашивание) в одних и тех же клетках переходной зоны АВУ в рабочий миокард; х200.
M. Пучок Гиса и его правая ножка (окрашены красным цветом); окраска трихромом Массона; х50. Цветное изображение доступно в электронной версии журнала.
Сокращения: АВУ — атриовентрикулярный узел, АК — аортальный клапан, МЖП — межжелудочковая перегородка, СУ — синусный узел, ТК — трикуспидальный клапан, ЦФТ — центральное фиброзное тело.

Рис. 13. Левая ножка пучка Гиса в фиброзном и фиброзно-жировом «футляре» (указана стрелками).
Примечание: A, B. Окраска по ван Гизону, х50. C. Окраска гематоксилином и эозином, х100. D. Клетки Пуркинье в левой ножке пучка Гиса. Полутонкий срез окрашен толуидиновым синим, х400. Цветное изображение доступно в электронной версии журнала.
Иннервация сердца и его проводящей системы
За иннервацию сердца в целом отвечают:
- Верхний, средний и нижний шейные узлы, шейно-грудной звездчатый узел симпатического ствола — верхние, средние и нижние шейные сердечные нервы;
- I-VI грудные узлы симпатического ствола — грудные сердечные нервы;
- Блуждающий нерв (парасимпатическая система). В основном формирует ветви заднего сплетения предсердий;
- Грудное аортальное сплетение (ветви шейных и грудных узлов симпатического ствола, блуждающие, диафрагмальные, возвратные нервы, ветви шейной петли — более 200 нервов);
- Субэпикардиальные, эпикардиальные, миокардиальные и эндокардиальные нервные сплетения [34].
К субэпикардиальным сплетениям относят:
- Переднее левое – левая поверхность легочного ствола, передняя поверхность левого желудочка;
- Переднее правое – правая поверхность легочного ствола, восходящая аорта, передняя поверхность правого желудочка;
- Заднее правое – между полыми венами, до коронарного синуса;
- Заднее левое – латеральнее устьев легочных вен, ветви к ЛП, межпредсердной и межжелудочковым перегородкам;
- Заднее сплетение предсердий – между устьями легочных вен;
- Переднее сплетение предсердий – передние стенки предсердий и передние отделы межпредсердной и межжелудочковой перегородок.
При этом максимальная плотность нервных ганглиев в субэпикардиальных нервных сплетениях зафиксирована в зоне «крыши» предсердий (рис. 14 А). Наше морфометрическое исследование плотности нервных ганглиев и волокон в 23 зонах стенок предсердий, межпредсердной перегородки, СУ, АВУ на 41 сердце взрослых пациентов показало, что максимальная плотность этих структур сосредоточена не в зонах ПСС, а вокруг коронарного синуса и между верхними и нижними легочными венами [35]. Кроме того, иммуногистохимическое исследование показало, что в одних и тех же ганглиях и нервных волокнах одновременно присутствует экспрессия антигенов симпатической и парасимпатической системы, в частности, адренергических и ацетилхолиновых рецепторов, ацетилхолинэстеразы (рис. 14 B, C). Сравнивая результаты своих исследований с литературными данными, мы пришли к выводу о чрезмерном завышении роли нервной системы в деятельности сердца, а тем более влияния ее на ПСС. Одно лишь несомненно — это влияние на частоту и силу сокращений органа.

Рис. 14. Распределение ганглиев и рецепторов.
Примечание: А. Распределение нервных ганглиев в сердце (по R. Smith, 1971г). B. Экспрессия ацетилхолиновых рецепторов MR1 (коричневое окрашивание) в нервном ганглии эпикарда в зоне коронарного синуса. C. Экспрессия адренергических рецепторов ARβ1 (коричневое окрашивание) в нервном ганглии эпикарда в зоне коронарного синуса; х100. Цветное изображение доступно в электронной версии журнала.
Заключение
Таким образом, несмотря на прицельное изучение ПСС с 1839г, все еще остаются «серые зоны». В частности, необходимо дальнейшее изучение роли интерстициальных пейсмейкеров, нервной системы и специализированной структуры ПСС в овальной ямке.
Отношения и деятельность: автор заявляет об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Митрофанова Л.Б. Анатомия, гистология и электронная микроскопия проводящей системы сердца. Современное представление и новые сведения: обзор. Российский кардиологический журнал. 2024;29(4S):6191. https://doi.org/10.15829/1560-4071-2024-6191. EDN: KUNMPI
Скопировать