Хроническая болезнь почек при метаболическом синдроме
Аннотация
Метаболический синдром (МС) является значимым модифицируемым фактором риска развития и прогрессирования хронической болезни почек (ХБП). Представлены данные о взаимосвязях между МС в целом и его отдельными компонентами с ХБП. Рассмотрены ключевые патогенетические механизмы развития ХБП при МС, включая инсулинорезистентность, ожирение, артериальную гипертензию, системное воспаление и окислительный стресс, активацию нейрогуморальных систем, липотоксичность. Обсуждаются вопросы особенностей диагностики и лечения ХБП у пациентов с МС. Особое внимание уделено комплексному подходу к лечению пациентов с ХБП, направленному на снижение риска прогрессирования ХБП и сердечно-сосудистых осложнений.
Эпидемиология хронической болезни почек при метаболическом синдроме
Метаболический синдром (МС) является традиционным модифицируемым фактором риска развития и прогрессирования хронической болезни почек (ХБП)1. МС и ХБП характеризуются двунаправленными взаимосвязями и оказывают влияние друг на друга. Многочисленные исследования подтвердили, что МС может приводить к изменениям структуры и функции почек, в т.ч. снижению скорости клубочковой фильтрации (СКФ) и повышению альбуминурии. Согласно метаанализу 66 исследований с участием >11 млн человек МС увеличивает риск ХБП на 50% [1]. Метаанализ 24 наблюдательных когортных исследований с участием >6,5 млн человек продемонстрировал связь МС с увеличением риска развития ХБП в 1,42 раза, альбуминурии или протеинурии — в 1,43 раза, быстрого снижения функции почек — в 1,25 раза [2].
Существуют доказательства, что каждый компонент МС ассоциирован с ХБП. Чем больше компонентов, тем выше риск ХБП (коэффициент шансов 1,96; 95% доверительный интервал (ДИ): 1,71-2,34) [1][2]. Одним из ключевых компонентов МС является ожирение. Была продемонстрирована его тесная связь с развитием и прогрессированием ХБП [3]. В крупном метаанализе индивидуальных данных пациентов, проведенном Консорциумом по прогнозированию ХБП, повышенный индекс массы тела (ИМТ), окружность талии (ОТ) и отношение ОТ к росту были независимыми факторами риска снижения СКФ и смерти у лиц с нормальной или сниженной расчетной СКФ (рСКФ) [4]. Данные метаанализа 13 исследований с включением >113 тыс. участников предполагают, что фенотипирование, основанное на показателях ОТ и уровне триглицеридов (ТГ), может быть использовано в качестве скринингового инструмента для прогнозирования риска ХБП. Наиболее значимая независимая связь выявлена между ХБП и фенотипом «высокая ОТ — высокие ТГ» (скорректированное отношение шансов 1,61; 95% ДИ: 1,39-1,88) по сравнению с фенотипом «нормальная ОТ — нормальные ТГ» [5]. Метаанализ 8 проспективных когортных исследований, включавших ~5 млн участников с медианой наблюдения от 3 до 14 лет, показал, что по сравнению с метаболически здоровым нормальным весом при метаболически здоровом ожирении, метаболически нездоровом нормальном весе, метаболически нездоровом ожирении риск развития ХБП был выше в 1,41, 1,50 и 1,94 раза, а рСКФ ниже на 2,04, 2,69 и 3,65 мл/мин/1,73 м2, соответственно. Таким образом, метаболически здоровое ожирение и метаболически нездоровая нормальная масса тела также ассоциированы с более высоким риском развития ХБП [6]. Биомаркеры, связанные с инсулинорезистентностью (метаболический индекс инсулинорезистентности METS-IR, гомеостатическая модель инсулинорезистентности (HOMA-IR), индекс ТГ/глюкоза (TyG) и отношение ТГ и глюкозы к ИМТ (TyG-ИМТ)), коррелировали с распространенностью ХБП. Более того, отношение ТГ и глюкозы к ОТ и росту (TyG-WHtR) улучшало стратификацию пациентов по риску ХБП и смертности от всех причин [7]. Индекс TyG был сильнее связан с ХБП у лиц ≤50 лет, мужчин и пациентов с сахарным диабетом (СД) [8].
Аналогичным образом, частота МС у пациентов с ХБП значительно выше, чем в общей популяции. С прогрессированием ХБП частота МС постепенно увеличивается [9]. Исследования, проведенные в разных странах среди пациентов с различными стадиями ХБП, показали, что распространенность МС у пациентов с ХБП, не получающих диализ, составляла 42,0-82,1%, а у пациентов с ХБП 3-5 стадии — 39,0-72,3%, 57,0-73,4% и 46,0-72,7%, соответственно [10]. Распространенность МС у пациентов, находящихся на диализе, составляла 38,6-55,7%; у пациентов, перенесших трансплантацию почки, -34-68% [11][12]. Необходим скрининг МС у пациентов с ХБП.
Патогенез ХБП при МС
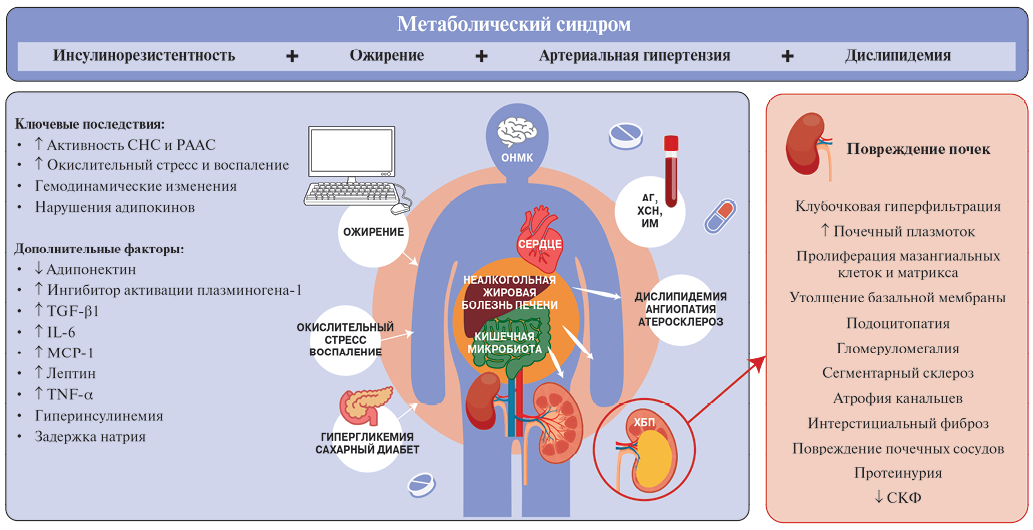
Патогенетические механизмы, связывающие МС и ХБП, сложны и не до конца изучены. Тесная взаимосвязь компонентов МС с абдоминальным ожирением и инсулинорезистентностью затрудняет выявление основных факторов, обусловливающих повышенный риск развития ХБП у пациентов с МС. Вместе с тем понимание потенциальных путей развития ХБП важно для разработки новых терапевтических подходов с целью замедления прогрессирования заболевания почек. Обсуждаются в т.ч. следующие ключевые факторы патогенеза ХБП при МС: инсулинорезистентность и гипергликемия, ожирение, артериальная гипертензия (АГ), липотоксичность, активация нейрогуморальных систем, окислительный стресс и хроническое воспаление (рис. 1) [13].
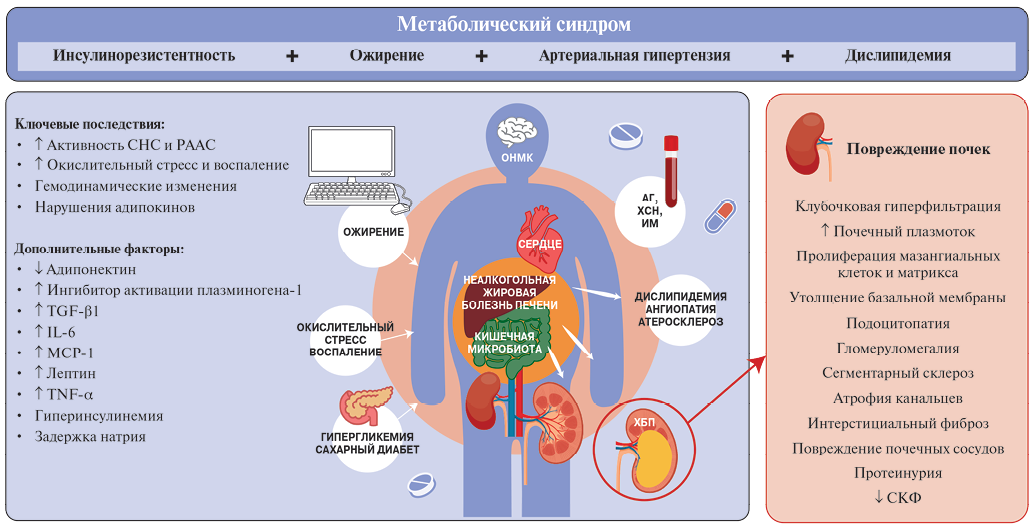
Рис. 1. Патогенез ХБП при МС.
Сокращения: АГ — артериальная гипертензия, ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, РААС — ренин-ангиотензин-альдостероновая система, СКФ — скорость клубочковой фильтрации, СНС — симпатическая нервная система, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, IL-6 — интерлейкин-6, MCP-1 — моноцитарный хемотаксический протеин-1, TGF-β1 — трансформирующий фактор роста бета 1, TNF-α — фактор некроза опухоли-альфа.
Инсулинорезистентность и гипергликемия
Инсулинорезистентность приводит к нарушению утилизации глюкозы, усилению окислительного стресса и активации ренин-ангиотензин-альдостероновой системы (РААС), что сопровождается эндотелиальной дисфункцией, повреждением подоцитов и гломерулярной гиперфильтрацией, способствуя развитию ХБП.
Хроническое воспаление и окислительный стресс
МС связан с провоспалительным состоянием и усилением окислительного стресса. Повышенное высвобождение провоспалительных молекул вызывает эндотелиальную дисфункцию и фиброз, что, в свою очередь, приводит к микрососудистому ремоделированию и повреждению паренхимы почек, развитию гломерулосклероза и тубулоинтерстициальной атрофии.
АГ
Повышенное артериальное давление приводит к клубочковой гипертензии и гиперфильтрации, что ускоряет повреждение почек и прогрессирование ХБП. В качестве основных механизмов рассматриваются снижение числа нефронов, задержка натрия с последующим увеличением объема внеклеточной жидкости, повышенная активность симпатической нервной системы и РААС, а также дисфункция эндотелия.
Ожирение
Повреждение почек, вызванное ожирением, можно объяснить множеством механизмов [14]. Избыток жировой ткани активирует симпатическую нервную систему и РААС, что способствует клубочковой гиперфильтрации и усилению реабсорбции натрия в проксимальных канальцах и толстом восходящем колене петли Генле. Это снижает доставку натрия в плотное пятно, активируя тубулогломерулярную обратную связь и увеличивая гиперфильтрацию. Альдостерон и ангиотензин, секретируемые жировой тканью, также усиливают реабсорбцию натрия [15]. Эти механизмы приводят к снижению функции почек, появлению или ухудшению АГ, инициируя порочный круг повреждения почек. Жировая ткань вырабатывает цитокины (адипокины), в т.ч. лептин, фактор некроза опухоли-α и интерлейкин, ответственные за усиление воспаления и окислительного стресса [15]. Накопление жира в подоцитах повреждает их, приводя к прогрессирующей альбуминурии, окислительному стрессу, инсулинорезистентности и интерстициальному фиброзу [16]. При гиперфильтрации клубочков увеличивается напряжение сдвига подоцитов, что сопровождается удлинением базальной мембраны клубочков, гипертрофией и повреждением подоцитов, образованием синехий и сегментарным склерозом. Кроме того, механическое напряжение изменяет постгломерулярные структуры, увеличивается проксимальная реабсорбция натрия гипертрофированными клетками и секреция цитокинов, и, как следствие, развивается тубулоинтерстициальное воспаление и фиброз [17]. Наконец, генетические факторы, гестационный диабет, снижение массы почек (низкая масса тела при рождении, нефрэктомия, ХБП), старение, синдром апноэ во сне, легочная гипертензия, метаболически ассоциированная жировая болезнь печени (МАЖБП), врожденные аномалии почек и мочевыводящих путей, социально-экономические проблемы также предрасполагают к ожирению и повреждению почек [18].
Выделяют гломерулопатию, ассоциированную с ожирением (О-ГП), которая часто встречается у взрослых молодого и среднего возраста, преимущественно у мужчин [19]. Гломеруломегалия, очаговый сегментарный гломерулосклероз, локальное расширение приносящей артериолы и снижение плотности подоцитов с легкой сглаженностью их ножек являются гистологическими признаками О-ГП [20]. Недавно было показано, что низкая плотность подоцитов связана с худшим долгосрочным исходом заболевания почек при О-ГП [21]. Поскольку О-ГП развивается только у небольшой подгруппы людей с ожирением, выдвинута гипотеза о генетической или приобретенной предрасположенности, способствующей развитию О-ГП [22].
Патофизиологическим признаком ранней стадии О-ГП является повышение СКФ отдельных нефронов [20]. При прогрессировании О-ГП, несмотря на стойкое увеличение среднего объема клубочков, СКФ отдельных нефронов снижается параллельно с усугублением протеинурии [23]. Накопление висцерального жира приводит к стимуляции продукции альдостерона адипоцитарными факторами, такими как лептин, но также увеличивается и локальная продукция альдостерона вследствие активации минералокортикоидных рецепторов [24]. Повышенная чувствительность к соли при ожирении, обусловленная активацией внутрипочечной РААС и симпатических нервов почек, приводит к развитию соль-чувствительной АГ [19]. Развитию О-ГП способствует и эктопическое накопление липидов [25]. Изолированная субнефротическая протеинурия с медленно снижающейся СКФ или без нее является наиболее распространенным клиническим проявлением О-ГП. Отсутствие явного нефротического синдрома и результаты биопсии могут помочь дифференцировать О-ГП от первичного фокально-сегментарного гломерулосклероза. Зачастую трудно определить О-ГП как первичную этиологию заболевания почек у пациентов с СД, поскольку оба этих заболевания могут присутствовать у одних и тех же пациентов, а протеинурия является неспецифическим проявлением [26, 27]. О-ГП может привести к более быстрому прогрессированию ХБП различной этиологии.
Липотоксичность
Атерогенная дислипидемия, характеризующаяся повышенным уровнем ТГ и низким уровнем холестерина (ХС) липопротеинов высокой плотности, способствует развитию ХБП вследствие чрезмерного накопления липидов в почечном синусе, непосредственного цитотоксического действия за счет внутриклеточных ТГ и токсичных метаболитов. Повышенное поглощение жирных кислот подоцитами и канальцевыми клетками может вызывать апоптоз [26]. Токсичные метаболиты жирных кислот также способствуют апоптозу и атрофии канальцев [28]. Накопление жира в паренхиме почек и синусах может сдавливать почечные сосуды, повышать гидростатическое давление и активировать РААС, способствуя повреждению почек. Адипокины, секретируемые жиром почек, способствуют воспалению и фиброзу. Параренальный и паранефральный жир по отдельности и вместе коррелируют с АГ, инсулинорезистентностью, альбуминурией, МС и ХБП [27].
МАЖБП и ХБП
Систематический обзор и метаанализ показали, что неалкогольная жировая болезнь печени (НАЖБП) была связана с повышением риска развития ХБП в 1,45 раза, при этом риск ХБП оказался выше у пациентов с прогрессированием НАЖБП [29]. Другие эпидемиологические исследования подтвердили эту связь [30-32]. Пациенты с НАЖБП/МАЖБП и предшествующим умеренным или тяжелым стеатозом печени имели более высокий риск развития ХБП [33]. Сочетание метаболических и гемодинамических изменений, липидной нефротоксичности и генетических полиморфизмов (PNPLA3, HSD17B13, TM6SF2, MBOAT7 и GCKR), вероятно, способствуют развитию ХБП у лиц с НАЖБП/МАЖБП [34]. Одними из ключевых механизмов являются дисфункция жировой ткани с повышенной продукцией воспалительных цитокинов, изменениями активности рецептора g, активируемого пролифератором пероксисом, эктопическое отложение липидов. Изменения в высвобождении гепатокинов при МАЖБП также могут способствовать развитию ХБП [35].
В экспериментальной модели на мышах изучены функция и гистологические характеристики почек, транскриптомные и липидомные профили при метаболически ассоциированном стеатогепатите (МАСГ). Эктопическое накопление липидов в эпителиальных клетках канальцев при прогрессировании МАСГ способствовало развитию фиброза почек. Тяжесть заболевания почек коррелировала с фиброзом печени, наблюдался регресс прогрессирования ХБП у мышей с МАСГ после ортотопической трансплантации печени [36].
Кишечная микробиота и ХБП
Появляется всё больше доказательств, подтверждающих наличие изменений в составе и/или снижении разнообразия микробиоты кишечника при ожирении [37][38]. Предполагается роль уремических токсинов в развитии ХБП при ожирении. В частности, уровни p-крезила и индоксила, которые в печени преобразуются в р-крезилсульфат и индоксилсульфат, повышаются при ХБП, связанной с ожирением [39]. Эти уремические токсины продуцируются микробиотой кишечника и их уровень, наряду с триметиламином и жирными кислотами с разветвлённой цепью, повышается при ХБП, связанной с ожирением [40].
Диагностика ХБП при МС
Диагностика ХБП при МС осуществляется в соответствии с актуальными клиническими рекомендациями1 [41].
На ранних стадиях ХБП протекает без явных клинических симптомов. Отсутствие чувствительных и специфичных биомаркеров затрудняет и отдаляет раннюю диагностику. Точная оценка функции почек у пациентов с МС крайне важна для определения стадии заболевания почек, мониторинга его прогрессирования и коррекции дозирования лекарственных препаратов.
Разработаны формулы расчета СКФ CKD-EPI, учитывающие как сывороточный креатинин, так и цистатин С, что повышает точность оценки рСКФ. Показано, что формула CKD-EPI обеспечивает точную оценку СКФ при рСКФ <60 мл/мин/1,73 м2 при условии, что ИМТ <40 кг/м2. Однако при более высоких ИМТ оценка СКФ по формулам часто неточно отражает фактическую функцию почек. Индексация СКФ по некоторым параметрам тела, таким как площадь поверхности тела (ППТ) или объём внеклеточной жидкости, у лиц с тяжёлым ожирением вызывает споры, поскольку значительно занижает СКФ, а значение измеренной СКФ (иСКФ) более надежно, чем индексированная рСКФ [42][43]. Выполнено исследование с участием >900 человек с избыточным весом или ожирением, с и без ХБП, для оценки функции почек с применением 56 уравнений, основанных на креатинине или цистатине С сыворотки крови. Обнаружены значительные ошибки в рСКФ по сравнению с иСКФ (клиренсом йогексола из плазмы), особенно в уравнениях, учитывающих вес или рост. Корректировка иСКФ/рСКФ на ППТ приводила к занижению функции почек как минимум на 10 мл/мин в 25% случаев [44]. В другом исследовании продемонстрирована значительная разница между СКФ, рассчитанной на основании цистатина C (75,4±38,9 мл/мин/1,73 м2), и креатинина (97,4±21,4 мл/мин/1,73 м2), что согласуется с исследованиями, указывающими на преимущества использования цистатина C по сравнению с креатинином в качестве маркера дисфункции почек у лиц с избыточным весом [45]. У пациентов с ожирением и ХБП 1-5 стадий показано, что уравнения рСКФ не так точны при сохраненной функции почек и гиперфильтрации [46]. Наиболее надежный способ оценки СКФ у лиц с тяжелым ожирением — это ее измерение методом, не основанным на креатинине (йогексол и т.д.), и выражение без индексации [47]. Однако эти методы не являются общедоступными, что делает их неприменимыми для рутинной клинической практики. Для оценки рСКФ, основанной на креатинине, по формуле CKD-EPI предлагалась деиндексация: рСКФ CKD-EPId (деиндексированная) = рСКФ CKD-EPI × ППТ пациента/1,73 [48]. Измерение СКФ посредством трансдермального клиренса флуоресцентных меток может стать приемлемой альтернативой для таких пациентов, необходимы дальнейшие исследования [49][50].
Хотя в настоящее время оценка ХБП основана на рСКФ и альбуминурии, новые биомаркеры наряду с методами протеомики и метаболомики могут обеспечить более быструю диагностику ХБП, ассоциированной с МС [51]. Многочисленны исследования по поиску биомаркеров, наиболее пригодных для ранней диагностики и прогнозирования исходов ХБП. Наиболее часто тестируемыми молекулами были биомаркеры, связанные с воспалительным процессом, повреждением почек и ремоделированием внеклеточного матрикса. Однако в большинстве этих исследований гистологически полученные результаты не были подтверждены, а в исследованиях, в которых проводилось прямое сравнение серологических и гистологических данных, результаты оказались неоднородными. В связи с этим оптимальным представляется использование панели, объединяющей различные биомаркеры, а не какого-то одного, что позволит учитывать различные аспекты развития и прогрессирования ХБП, ассоциированной с МС, и окажет значительное влияние на клиническую практику за счет максимального улучшения профилактики, диагностики и лечения [51-53].
Ультразвуковое исследование (УЗИ) почек — неинвазивный, широкодоступный и недорогой метод визуализации, позволяющий отслеживать структурные изменения и фиброз почек с течением времени. Цветная допплерография позволяет оценить внутрипочечный кровоток и гемодинамику, УЗИ с контрастным усилением — перфузию почек на ранних стадиях нефропатии, ультразвуковая эластография — наличие и степень фиброза почек. Толщина параренального и периренального жира по данным УЗИ может служить ценным инструментом для выявления эктопического накопления липидов в почке (жировая дистрофия почек) [54]. Для оценки ХБП, связанной с ожирением, УЗИ почек остается наиболее широко используемым методом визуализации [55].
Вместе с тем ценными методами неинвазивной визуализации структуры и функции почек, включая количественную оценку эктопического жира, являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) [40]. Рентгенологические характеристики абдоминальной жировой ткани (внутрибрюшной жир, околопочечный эктопический жир и жир почечных синусов) могут служить индикаторами риска ХБП и должны быть документированы в рентгенологических (КТ, МРТ) отчетах [56]. Многочисленные работы последних лет свидетельствуют о независимой связи параметров почечного эктопического жира, оцененного при КТ или МРТ, с функцией почек и почечными исходами. МРТ маркеры почечного жира (фракция жира по плотности протонов, объем жира почечного синуса и толщина околопочечного жира) независимо от пола, возраста, СД и АГ связаны с рСКФ у лиц с ожирением, что предполагает их возможную роль в раннем выявлении почечного повреждения при ожирении [57]. У пациентов с СД 2 типа модель, объединяющая возраст, пара- и периренальный жир, может эффективно предсказывать развитие ХБП [58]. В многофакторных моделях линейной регрессии накопление жира в почечных синусах связано с дисфункцией почек и гемодинамическими нарушениями независимо от висцерального ожирения: объем почечного синуса, нормализованный к объему почки, достоверно связан с 24-ч клиренсом креатинина, индексом резистентности почечных артерий, глобальным гломерулярным склерозом, интерстициальным фиброзом и канальцевой атрофией [59]. Среди пациентов с ХБП объем жира в почечном синусе, индексированный к объему почки, оцененный по КТ, связан с неблагоприятными почечными исходами (снижением рСКФ более чем на 50%) [60].
Оценка риска прогрессирования ХБП у пациентов с МС
Стратификация риска ХБП по тепловой карте KDIGO подчеркивает важность использования как рСКФ, так и отношения альбумин/креатинин в моче для оценки тяжести и прогноза ХБП на популяционном уровне, но не позволяет прогнозировать индивидуальный риск [41]. Для пациентов с ХБП разработано несколько инструментов прогнозирования риска, которые позволяют оценивать абсолютный риск как для отдельных пациентов, так и для конкретных исходов. Уравнение риска почечной недостаточности является инструментом прогнозирования риска прогрессирования ХБП 3-5 стадии до почечной недостаточности, требующей заместительной почечной терапии в течение следующих 2 или 5 лет [61]. Хотя оно не было специально разработано для пациентов с МС (и не включает компоненты МС в качестве переменных), модели широко проверены в различных популяциях пациентов с ХБП, включая пациентов с МС [62][63]. Пациенты с МС и ХБП 1-2 стадии могут иметь риск быстрого прогрессирования, но низкий риск почечной недостаточности в течение следующих 5 лет, в связи с чем были разработаны альтернативные уравнения прогнозирования риска, например, основанные на снижении рСКФ на ≥40% [64].
В дополнение к инструментам прогнозирования риска почечных исходов стадирование кардио-рено-гепато-метаболического синдрома (КРГМС) включает тепловую карту KDIGO и отражает спектр сердечно-сосудистого риска [65][66]. Разработанная шкала PREVENT позволяет оценивать 10- и 30-летний риск для всех сердечно-сосудистых заболеваний (ССЗ) и включает рСКФ в качестве предиктора с возможностью добавления отношения альбумина к креатинину в моче [67]. Особо следует отметить учет риска сердечной недостаточности (СН) наряду с риском атеросклеротических ССЗ, что подчеркивает значимость шкалы PREVENT как инструмента для выявления лиц с повышенным сердечно-сосудистым риском при ХБП, где СН и структурные заболевания сердца становятся все более распространенными по мере снижения рСКФ [68].
Лечение ХБП при МС
У пациентов с неконтролируемым МС риск быстрого снижения функции почек был в 3,28 раза выше, чем у тех, у кого МС был под контролем [69]. Следовательно, оправдано раннее лечение МС для предотвращения и замедления прогрессирования заболевания почек. Меры включают изменение образа жизни, контроль веса, лечение АГ, гиперлипидемии, нарушений углеводного обмена. Необходимо стремиться к управлению заболеваниями и достижениям целевых показателей каждого компонента МС в соответствии с клиническими рекомендациями1 2 [70][71]. Недавние достижения в лечении заболеваний, связанных с КРГМС, подчеркивают важность основанной на доказательствах терапии, адаптированной к индивидуальным особенностям пациента. Ключевые препараты, включая ингибиторы натрийглюкозного котранспортера 2 типа (иНГЛТ-2), агонисты рецепторов глюкагоноподобного пептида 1 типа (арГПП-1), агонисты рецепторов двойного действия ГПП-1/глюкозозависимого инсулинотропного полипептида, нестероидный антагонист минералокортикоидных рецепторов (нсАМКР) финеренон, обеспечивают значительные преимущества при лечении КРГМС [66][72].
Контроль ожирения
Пациентам с ХБП рекомендуется достигать оптимального ИМТ и заниматься физической активностью, совместимой со здоровьем сердечно-сосудистой системы и толерантностью1 [41]. Это обоснованно, поскольку недостаточная физическая активность является модифицируемым фактором риска ССЗ и смертности в общей популяции, а регулярные тренировки связаны с улучшением здоровья у лиц с ХБП [73][74]. Исследование Look AHEAD продемонстрировало, что интенсивное вмешательство в образ жизни (по сравнению с поддержкой и обучением пациентов) снизило частоту возникновения ХБП очень высокого риска на 31% в течение медианы наблюдения 9,6 лет у 5145 пациентов с избыточным весом и ожирением, страдающих СД [75]. Рандомизированное контролируемое исследование показало, что у 6719 лиц с избыточной массой тела/ожирением с изменениями образа жизни (соблюдение средиземноморской диеты, физическая активность, поведенческая поддержка) после среднего периода наблюдения 1 год скорость снижения рСКФ была значительно ниже (0,66 vs 1,25 мл/мин/1,73 м2), а рСКФ <60 мл/мин/1,73 м2 значительно реже, чем в контрольной группе [76].
В последнее время арГПП-1 произвели революцию в лечении ожирения [77]. В исследовании SELECT (Semaglutide Effects on Cardiovascular Outcomes in People with Overweight or Obesity) назначение семаглутида (2,4 мг в нед. подкожно) по сравнению с плацебо в течение 2,8 лет сопровождалось снижением первичного сердечно-сосудистого комбинированного исхода на 20% (отношение рисков (ОР) 0,80; 95% ДИ: 0,72-0,90), риска СН на 18% (ОР 0,82; 95% ДИ: 0,71-0,96) у 17604 пациентов с избыточным весом или ожирением и ССЗ, но без СД [78]. Субанализы SELECT показали нефропротективный эффект в этой популяции с меньшей частотой комбинированного почечного исхода при применении семаглутида по сравнению с плацебо (1,8% vs 2,4%; ОР 0,78; 95% ДИ: 0,63-0,96) [79]. Наряду с этим в исследовании FLOW (Evaluate Renal Function with Semaglutide Once Weekly) продемонстрировано, что лечение семаглутидом (1,0 мг в нед. подкожно) по сравнению с плацебо в течение 3,4 лет привело к снижению риска серьезных событий, связанных с заболеванием почек, или смерти по почечным или сердечно-сосудистым причинам (ОР 0,76; 95% ДИ: 0,66-0,88) у 3533 пациентов с СД 2 типа и ХБП с альбуминурией [80]. Данные, полученные в ходе крупных исследований, в значительной степени подтверждают эффективность и безопасность применения арГПП-1 у пациентов с избыточным весом/ожирением с СД 2 типа и ХБП [78][80].
Бариатрическая хирургия эффективна для снижения веса и улучшения факторов риска ХБП, таких как АГ и СД. Она также снижает протеинурию и клубочковую гиперфильтрацию, что в долгосрочной перспективе может оказывать благоприятное воздействие. В наблюдательных исследованиях бариатрическая хирургия ассоциирована с улучшением показателей функции почек, основанных на креатинине, однако необходимы дополнительные исследования с использованием других маркеров фильтрации, менее коррелирующих с массой тела [81].
Контроль гликемии. иНГЛТ-2
Пациентам с ХБП и СД рекомендуется индивидуальный целевой показатель гликированного гемоглобина в диапазоне от <6,5% до <8,0%, с более высокими целевыми значениями у пациентов с высоким риском гипогликемии [41][82]. Влияние более интенсивного по сравнению с менее интенсивным контролем гликемии на риск почечной недостаточности неопределенно, но такой подход снижает риск развития или прогрессирования альбуминурии. Более интенсивный контроль гликемии у пациентов с СД 2 типа может умеренно снизить риск атеросклеротических сердечно-сосудистых событий (но не СН) [83-85].
Значимое кардионефропротективное действие иНГЛТ-2 предполагает, что эти препараты должны быть приоритетными у пациентов с ХБП независимо от статуса диабета или контроля гликемии. Метаанализ 13 крупных рандомизированных контролируемых исследований иНГЛТ-2, включавших 90413 участников, показал значимые пропорциональные преимущества в отношении стандартизированного результата прогрессирования заболевания почек (ОР 0,63; 95% ДИ: 0,58-0,69). В трех исследованиях по изучению прогрессирования ХБП использование иНГЛТ-2 снижало риск почечной недостаточности на 34% (ОР 0,66; 95% ДИ: 0,56-0,77) по сравнению с плацебо [86]. Также отмечено снижение риска комбинированного исхода сердечно-сосудистой смерти или госпитализации по поводу СН на 23% (ОР 0,77; 95% ДИ: 0,74-0,81). Эти кардиоренальные преимущества были схожи при ХБП различной этиологии, а также у пациентов с СД и без него [86][87]. Согласно российским и международным рекомендациям у пациентов с ХБП и СД 2 типа для снижения риска прогрессирования ХБП и сердечно-сосудистых событий рекомендуется включение в терапию иНГЛТ-2 1 3 [41]. У пациентов с ХБП недиабетической этиологии в дополнение к терапии ингибиторами ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов ангиотензина II (БРА) для снижения рисков прогрессирования ХБП, развития острого почечного повреждения, сердечно-сосудистой смертности и госпитализаций рекомендуются иНГЛТ-2 с доказанной эффективностью в этой популяции — в настоящее время дапаглифлозин и эмпаглифлозин1 [41].
Контроль артериального давления. Блокада РААС
РААС играет ключевую роль в развитии АГ и вовлечена в патогенез ожирения, дислипидемии и инсулинорезистентности, что позволяет предположить, что она может быть связующим звеном между компонентами МС. Помимо снижения артериального давления, ингибиторы РААС снижают риск почечной недостаточности у пациентов с СД и альбуминурией, а также имеются данные о нефропротекции у пациентов с протеинурическими недиабетическими заболеваниями почек [88]. У пациентов с СД с нормоальбуминурией рекомендовано использование иАПФ для торможения развития и прогрессирования диабетического поражения почек и снижения риска смерти1. У пациентов с ХБП С1-С5 вне зависимости от наличия СД и АГ и в отсутствие противопоказаний рекомендовано использование иАПФ или БРА для снижения протеинурии и рисков прогрессирования дисфункции почек (ренопротекции), сердечно-сосудистых событий1 [41].
Альдостерон оказывает профибротическое и воспалительное действие на сердце, сосудистую систему и почки [89]. Хотя пациенты, принимающие иАПФ или БРА, частично защищены от повышения уровня альдостерона, их применение может привести к гиперактивации минералокортикоидных рецепторов из-за неполного подавления альдостерона сыворотки [90]. Признавая целесообразность воздействия на повышенный уровень альдостерона, изучены эффекты нсАМКР и, в последнее время, ингибиторов альдостеронсинтазы. У пациентов с СД 2 типа и ХБП с альбуминурией нсАМКР финеренон, как было показано в двух крупных исследованиях (FIDELIO-DKD (Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease) и FIGARO-DKD (Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease)), способствует снижению кардиоренального риска при приеме в дополнение к ингибиторам РААС. В объединенном анализе этих исследований с исследованием FINEARTS-HF (Finerenone Trial to Investigate Efficacy and Safety Superior to Placebo in Patients With Heart Failure), проведенным у пациентов с СН с сохраненной фракцией выброса, было показано, что финеренон снижает комбинированный почечный исход на 20% (ОР 0,80; 95% ДИ: 0,72-0,90) и риск госпитализации по поводу СН на 17% (ОР 0,83; 95% ДИ: 0,75-0,92) у 18991 участника в течение 2,9 лет [91]. У пациентов с СД 2 типа и ХБП с рСКФ >25 мл/мин/1,73 м2 рекомендовано применение финеренона для снижения риска прогрессирования ХБП и сердечно-сосудистых событий1 [41]. Текущие и будущие крупные исследования прояснят, могут ли нсАМКР и ингибиторы альдостеронсинтазы также оказывать положительное влияние на почки и сердечно-сосудистую систему у пациентов с недиабетическим заболеванием почек и у пациентов без значительной альбуминурии.
Липидмодифицирующая терапия
У пациентов с ХБП часто встречается дислипидемия, сходная с таковой при МС: высокий уровень ТГ, низкий ХС липопротеинов высокой плотности и повышение ХС липопротеинов низкой плотности (ЛНП). Однако среди 6245 участников с ХБП, не находившихся на диализе при рандомизации, снижение ХС ЛНП на 0,96 ммоль/л с помощью симвастатина 20 мг и эзетимиба 10 мг в течение 5 лет не оказало существенного влияния на прогрессирование заболевания почек [92]. Хотя снижение уровня ХС ЛНП с помощью терапии статинами не оказывает клинически значимого влияния на риск почечной недостаточности, у лиц с ХБП и без нее установлено благоприятное влияние в отношении снижения риска атеросклеротических ССЗ [93]. Пациентам с ХБП показана липидснижающая терапия согласно рекомендациям [71]. Кроме того, противовоспалительное, антиоксидантное, антитромботическое, антифибротическое действие статинов, а также их способность улучшать функцию эндотелиальных клеток, могут снизить протеинурию у пациентов с МС и замедлить прогрессирование заболевания почек [94]. Ингибиторы пропротеинконвертазы субтилизин-кексин 9 являются альтернативой или дополнительной терапией к статинам, снижающей уровень ХС ЛНП, с потенциалом обеспечить дальнейшее снижение риска атеросклеротических ССЗ у пациентов с легкой и умеренной ХБП [95]. Бемпедоевая кислота также снижает уровень ХС ЛНП и связана со снижением риска серьезных сердечно-сосудистых событий, включая пациентов с легкой и умеренной ХБП [96].
Перспективные направления
Лечение заболеваний, связанных с КРГМС, быстро развивается, и в разработке находится несколько новых подходов, способных улучшить исходы пациентов. К ним относятся тройные агонисты рецепторов (ГПП-1/глюкозозависимого инсулинотропного полипептида/глюкагон), антагонисты рецепторов лизофосфатидной кислоты, селективные антагонисты минералокортикоидных рецепторов второго поколения, которые направлены на новые пути, вовлеченные в патофизиологию заболеваний, связанных с КРГМС [97-99].
В нескольких текущих исследованиях изучается потенциал комбинирования иНГЛТ-2 с другими методами лечения пациентов с ХБП и связанных с ними заболеваний. ZENITH-CKD (NCT04724837) оценивает зиботентан (селективный антагонист рецепторов эндотелина А) в сочетании с дапаглифлозином по сравнению с дапаглифлозином у пациентов с ХБП [100]. Проводятся исследования (NCT06531824, NCT06268873, NCT06742723) двойной терапии ингибиторов альдостеронсинтазы и иНГЛТ-2 для улучшения результатов лечения ХБП4 [101]. Важным признаком МС является хроническое низкоинтенсивное воспаление, характеризующееся продукцией воспалительных цитокинов и активных форм кислорода. Текущие исследования изучают, может ли воздействие на воспалительные пути обеспечить дополнительные преимущества в снижении сердечно-сосудистого риска и кардиоренальных исходов [102].
Внедрение в клиническую практику
Российские и международные эксперты рекомендуют ингибиторы РААС, терапию на основе статинов и иНГЛТ-2 для большинства пациентов с ХБП для обеспечения кардио- и нефропротекции1 [41]. У пациентов с СД 2 типа и ХБП с альбуминурией нсАМКР финеренон и арГПП-1 семаглутид обеспечивают дополнительные преимущества для кардионефропротекции и должны применяться в сочетании с другими методами терапии первой линии [103][104]. Предполагается, что эти пять классов препаратов имеют различные, но взаимодополняющие механизмы действия, и кардиоренальные преимущества иНГЛТ-2 остаются неизменными независимо от применения нсАМКР или арГПП-1, и наоборот [105][106]. Они хорошо переносятся в комбинации. Например, снижение риска серьезной гиперкалиемии при применении иНГЛТ-2 может противодействовать гиперкалиемии, вызванной ингибиторами РААС, нсАМКР и ингибиторами альдостеронсинтазы [107][108]. Следовательно, комбинированное применение риск-модифицирующей терапии следует инициировать у пациентов с ХБП незамедлительно, если она хорошо переносится, для оптимизации сердечно-сосудистого, почечного и метаболического здоровья. Если такое лечение прекращается во время госпитализации, необходимо уделить особое внимание возобновлению лечения после выписки, поскольку частота повторного начала лечения низкая, а положительный эффект от лечения кратковременный [109][110]. Преемственность между амбулаторным и стационарным звеном, мультидисциплинарный подход способствуют эффективному внедрению лечения, уменьшая терапевтическую инертность [111].
Широкое внедрение технологий искусственного интеллекта может существенно облегчить своевременное выявление МС [112-114] и повысить эффективность терапии каждого из его компонентов, в т.ч. за счет персонализированного подхода и поддержания мотивации к здоровому образу жизни и лечению в долгосрочной перспективе [115][116].
Заключение
Во всем мире наблюдается значительный рост бремени МС, который является фактором риска развития и прогрессирования ХБП. Раннее выявление ХБП и осведомленность о различных методах терапии, модифицирующих риск, уменьшит бремя почечной недостаточности и ССЗ, связанных с ХБП. Ключевым моментом становится вопрос о том, когда и как применять все более широкий спектр фармакотерапии с мультисистемным действием, которая замедляет прогрессирование заболевания почек, обеспечивает кардиопротекцию и/или улучшает метаболический контроль. Так, для пациентов с СД 2 типа и ХБП с альбуминурией, многие из которых будут иметь признаки МС, в настоящее время существует 5 основанных на доказательствах методов лечения (ингибиторы РААС, терапия на основе статинов, иНГЛТ-2, финеренон и семаглутид), которые улучшают сердечно-сосудистое, почечное и метаболическое здоровье. Комплексный подход, объединяющий эти методы лечения со стратегиями раннего выявления, необходим для эффективного снижения кардиоренального риска ХБП среди пациентов с МС, в то время как текущие и будущие исследования позволят определить дальнейшие методы снижения бремени заболевания в этой группе высокого риска.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Клинические рекомендации «Хроническая болезнь почек», https://cr.minzdrav.gov.ru/preview-cr/469_3.
2 Клинические рекомендации «Ожирение» 2024, https://cr.minzdrav.gov.ru/preview-cr/28_3. Клинические рекомендации «Сахарный диабет» 2024.
3 Клинические рекомендации «Сахарный диабет» 2024.
4 A phase III study to investigate the efficacy and safety of baxdrostat in combination with dapagliflozin on CKD progression in participants with CKD and high blood pressure. Accessed June 5, 2025. https://classic.clinicaltrials.gov/ct2/show/NCT06268873; A Phase III Renal Outcomes and Cardiovascular Mortality Study to Investigate the Efficacy and Safety of Baxdrostat in Combination With Dapagliflozin in Participants With Chronic Kidney Disease and High Blood Pressure (BaxDuo-Pacific). Accessed June 5, 2025. https://clinicaltrials.gov/study/NCT06742723.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Виллевальде С.В., Звартау Н.Э. Хроническая болезнь почек при метаболическом синдроме. Российский кардиологический журнал. 2025;30(1S):6537. https://doi.org/10.15829/1560-4071-2025-6537
Скопировать