Хирургическое лечение абсцесса корня аорты: 10-летний опыт одного центра
Аннотация
Вопрос о выборе оптимального объема хирургического вмешательства у пациентов с абсцессом корня аорты вследствие инфекционного эндокардита остается открытым, поскольку существуют разные стратегии и методики коррекции этой тяжелой патологии, кроме того, рекомендации не отдают предпочтение какому-либо конкретному виду хирургического вмешательства и рекомендуют индивидуальный подход к каждой ситуации. В исследование включены 25 пациентов с абсцессом корня аорты вследствие инфекционного эндокардита аортального клапана. Наиболее часто выполняемым хирургическим вмешательством у пациентов была операция Росса (n=12, 48%). 8 (32%) пациентам центра выполнено протезирование корня аорты гомографтом по методике «полый корень аорты». Комбинированное хирургическое вмешательство применено у 7 (28%) пациентов: 3 (12%) вмешательство на митральном клапане (всем пациентам выполнена пластика митрального клапана в связи с распространением абсцесса на митральный клапан), 3 (12%) выполнено аортокоронарное шунтирование и 1 (4%) протезирование восходящей аорты в связи с дилатацией. Пяти- и десятилетняя выживаемость после хирургического лечения больных с абсцессом корня аорты составила 86,9% и 78,6%, соответственно. Повторного хирургического вмешательства и рецидива инфекционного эндокардита в отдаленном периоде не было.
Инфекционный эндокардит (ИЭ) — инфекционно-воспалительное заболевание эндокарда клапанных структур, пристеночного эндокарда и внутрисердечных искусственных устройств, обусловленное инвазией микроорганизмами (бактериями, грибами), с развитием полипозно-язвенного поражения структур сердца, протекающее с системным воспалением, прогрессирующей сердечной недостаточностью (СН), тромбогеморрагическими и иммунокомплексными внесердечными проявлениями [1]. Совместная тактика ведения пациентов с осложненным течением ИЭ (СН, абсцессы сердца или эмболические осложнения) кардиологом и сердечно-сосудистым хирургом считается обязательной: приблизительно половине пациентов с ИЭ в период госпитализации выполняется хирургическое вмешательство [1].
Парааннулярные осложнения (абсцедирование, псевдоаневризмы и фистулы) встречаются в 9,8-40% случаев ИЭ аортального клапана (АК) [1][2], а перивальвулярные абсцессы АК — в 10-40% случаев ИЭ нативного клапана, 56-100% случаев ИЭ протезированного клапана [1]. В клинической картине абсцесс корня аорты может проявляться в виде сердечной фистулы или разрыва камеры сердца, прогрессивного разрушения аортожелудочковой мембраны сердца и распространения патологии на митральный клапан, псевдоаневризмы или аритмии, приводящей к нестабильности гемодинамики, инфекционным осложнениям, сепсису и летальному исходу [3-5]. Консервативная антибактериальная тактика ведения обычно не эффективна, поэтому ранняя и радикальная хирургическая коррекция абсцесса корня аорты может иметь определяющее значение. Любая задержка хирургического вмешательства может увеличить риск разрушения аортожелудочковой мембраны сердца и распространения патологии на митральный клапан, однако тактика ведения этой группы пациентов представляет собой сложную хирургическую задачу.
Цель исследования: проанализировать непосредственные и отдаленные результаты хирургического лечения абсцессов корня аорты, обусловленного ИЭ.
Материал и методы
В исследование включены 25 пациентов с абсцессом корня аорты вследствие ИЭ АК, прооперированных в течение десятилетнего периода (01.04.2009 — 31.12.2019) в ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Министерства здравоохранения Российской Федерации, г. Астрахань.
Критерии включения в исследование: возраст ?18 лет, наличие абсцесса корня аорты вследствие ИЭ. Диагноз ИЭ установлен на основании модифицированных критериев Duke согласно клиническим рекомендациям Минздрава России по ИЭ и инфекции внутрисердечных устройств [1], Европейского общества кардиологов по ведению больных с ИЭ [2].
Во время госпитализации в стационар всем пациентам трехкратно (до, во время и после хирургического вмешательства) в соответствии с рекомендациями Европейской ассоциации сердечно-сосудистой визуализации [6] выполнялось эхокардиографическое исследование (ЭхоКГ). До и во время хирургического вмешательства для определения степени тяжести клапанных пороков сердца и показаний к оперативному лечению оценивались локализация, размер, подвижность, эхогенность вегетаций и наличие абсцедирования, псевдоаневризмы и фистулы, клапанная регургитация и/или стеноз, функция правого желудочка, систолическое давление в легочной артерии, наличие и количество перикардиального выпота [1][6][7]. После выписки из стационара для оценки функции протеза ЭхоКГ выполнялось или в ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России, г. Астрахань, или по месту жительства. До и после хирургического вмешательства выполнялось трансторакальное ЭхоКГ, интраоперационно ? чреспищеводное ЭхоКГ.
Пациентам ?35 лет до хирургического вмешательства с целью оценки показаний к оперативному лечению выполнялась коронарография.
Медиана периода наблюдения составила 73,0 [ 6,0-90,5] мес. Конечные точки: госпитальная летальность и постоперационные осложнения (острое нарушение мозгового кровообращения, имплантация постоянного электрокардиостимулятора, периоперационный инфаркт миокарда, острое почечное повреждение). Информация по отдаленным результатам (выживаемость, свобода от рецидива ИЭ) получена из историй болезни, путем телефонного опроса пациентов или их родственников, почтовой переписки и приглашения пациентов в клинику.
Статистический анализ. Статистическая обработка материала выполнена с использованием пакета программного обеспечения IBM SPSS Statistics 26 (Chicago, IL, USA). Учитывая то, что количество пациентов <50 больных, количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка. Количественные признаки, имеющие распределение, близкое к нормальному, описаны в форме среднего значения и стандартного отклонения (M±SD) с 95% доверительным интервалом, в случае отличного от нормального распределения в виде медианы и 25-й, 75-й процентили (Me [Q1-Q3]). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Время до первого клинического события: летального исхода, рецидива ИЭ оценено с использованием метода Каплана-Майера.
Результаты
Демографические и дооперационные характеристики пациентов, включенных в исследование (n=25, 76% — мужчины), представлены в таблице 1. Средний возраст составил 43,4±15,5 лет, медиана индекса массы тела — 23,6 [ 21,0-31,5] кг/м?.
Таблица 1
Демографические и дооперационные характеристики пациентов
|
Параметры |
n=25 |
|
Возраст, лет (M±SD с 95% ДИ) |
43,4±15,5 (37-50) |
|
Мужчины, n (%) |
19 (76) |
|
Индекс массы тела, кг/м? (Me [Q1-Q3]) |
23,6 [ 21,0-31,5] |
|
Анамнез сопутствующих заболеваний, n (%) |
|
|
Ишемическая болезнь сердца Сахарный диабет Инфаркт миокарда в анамнезе Острое нарушение мозгового кровообращения Фибрилляция предсердий |
4 (16) 1 (4) 1 (4) 1 (4) 1 (4) |
|
Анамнез перенесенных вмешательств, n (%) |
|
|
Кардиохирургические «открытые» вмешательства Вмешательства на АК ЧКВ в анамнезе |
3 (12) 3 (12) 2 (8) |
|
Классификация, клиника ИЭ, n (%) |
|
|
Наличие вегетаций на клапане Нативный АК Протезированный АК |
23 (92) 22 (88) 3 (12) |
|
Первичный Вторичный |
6 (24) 19 (76) |
|
Острый Подострый |
7 (28) 18 (72) |
|
Наличие СН, n (%) I-II функциональный класс NYHA, n (%) III-IV функциональный класс NYHA, n (%) |
25 (100) 11 (44) 14 (56) |
|
Эмболия на фоне ИЭ В церебральные сосуды В селезеночную артерию с развитием |
5 (20) 3 (12) 2 (8) |
|
Эхокардиографические показатели |
|
|
ФВ ЛЖ, % (M±SD с 95% ДИ) |
58,8±7,4 (56-62) |
|
СДЛА, мм рт.ст. (Me [Q1-Q3]) |
30 [ 24-40] |
|
Двухстворчатый АК, n (%) |
11 (44) |
|
Диаметр ФК АК, мм (M±SD с 95% ДИ) |
24,3±3,7 (23-26) |
Сокращения:
АК — аортальный клапан,
ДИ — доверительный интервал,
ИЭ — инфекционный эндокардит,
СН — сердечная недостаточность,
СДЛА — систолическое давление в легочной артерии,
ФК АК — фиброзное кольцо аортального клапана,
ФВ ЛЖ — фракция выброса левого желудочка,
ЧКВ — чрескожное коронарное вмешательство,
NYHA — New York Heart Association.
Проанализирован анамнез сопутствующих заболеваний и перенесенных вмешательств: наиболее часто (n=3, 12%) у пациентов в анамнезе ? ишемическая болезнь сердца, кардиохирургические «открытые» вмешательства на сердце и вмешательства на АК.
У большинства пациентов ИЭ протекал с наличием вегетаций (n=23, 92%), ИЭ нативного АК зарегистрирован у 22 пациентов (88%; у половины из которых (n=11, 44%) АК — двустворчатый), вторичный и подострый (n=19, 76%). У 7 (28%) пациентов ИЭ диагностирован как активный процесс: получены положительные бактериологические посевы с участков пораженных клапанов интраоперационно, либо положительные дооперационные посевы крови: выявлены грамположительные кокки, спектр которых отражен в таблице 2, и у 5 (20%) — на его фоне произошла эмболия (n=3, 12% — в церебральные сосуды, n=2, 8% — в селезеночную артерию с развитием инфаркта селезенки). У всех пациентов (n=25, 100%) наблюдались признаки СН, обусловленной ИЭ, более половины пациентов (n=14, 56%) имели выраженную симптоматику — III или IV функциональный класс NYHA.
Таблица 2
Спектр микроорганизмов, полученный в результате
посева тканей нативного клапана (протеза) интраоперационно
или посева крови пациента в дооперационном периоде
|
Микроорганизм |
Количество случаев, n (%) |
|
Нет роста Положительный посев |
18 (72) 7 (28) |
|
Staphylococcus epidermidis aureus |
3 (12) 2 (8) 1 (4) |
|
Streptococcus viridans неуточненного вида |
2 (8) 1 (4) 1 (4) |
|
Enterococcus gallinarum faecium |
2 (8) 1 (4) 1 (4) |
Интраоперационная характеристика пациентов представлена в таблице 3. Медиана риска оперативного вмешательства по шкале EuroSCORE II составила 3 [ 1-5] балла, длительности хирургического вмешательства — 240 [ 185-290] мин, искусственного кровообращения — 144 [ 115-181] мин, среднее время ишемии миокарда — 117,5±38,3 (95% доверительный интервал: 104-136) мин.
Таблица 3
Интраоперационная характеристика пациентов
|
Параметры |
n=25 |
|
Срединная стернотомия, n (%) |
25 (100) |
|
Длительность, мин |
|
|
Операции, Me [ Q1-Q3] |
240 [ 185-290] |
|
Искусственного кровообращения, Me [ Q1-Q3] |
144 [ 115-181] |
|
Ишемии миокарда, M±SD с 95% ДИ |
117,5±38,3 (104-136) |
|
Выполненная операция на АК, n (%) |
|
|
Росса |
12 (48) |
|
Аортальный гомографт |
8 (32) |
|
Комбинированные вмешательства, n (%) Хирургия митрального клапана, n (%) Коронарное шунтирование, n (%) Протезирование восходящей аорты, n (%) |
7 (28) 3 (12) 3 (12) 1 (4) |
|
Протезирование биологическим протезом |
3 (12) |
|
Протезирование механическим протезом Ozaki |
1 (4) 1 (4) |
Сокращения:
АК – аортальный клапан,
ДИ – доверительный интервал.
Все операции выполнены через полную срединную стернотомию. Защиту миокарда выполняли с использованием холодовой кардиоплегии «Кустодиол» (в корень аорты, при наличии аортальной регургитации — в устья коронарных артерий). Производилось иссечение инфицированных или некротических тканей вокруг кольца АК, абсцесса корня аорты с последующей обработкой образовавшихся полостей раствором повидона-йода. При наличии разрушений структур корня аорты восстановление последних проводилось с помощью заплаты из ксеноперикарда. Имплантация механических или биологических протезов осуществлялась с использованием П-образных швов с или без прокладок, с предварительной обработкой манжеты раствором повидона-йода. Имплантация аортального гомографта (Санкт-Петербургский банк гомографтов, г. Санкт-Петербург, Россия) или имплантация легочного аутографта при операции Росса производились по методике «полный корень аорты» одиночными швами.
Наиболее часто выполняемым хирургическим вмешательством у пациентов была операция Росса (n=12, 48%).
8 (32%) пациентам центра выполнено протезирование корня аорты гомографтом по методике «полый корень аорты». Комбинированное хирургическое вмешательство применено у 7 (28%) пациентов: 3 (12%) вмешательство на митральном клапане (всем пациентам выполнена пластика митрального клапана в связи с распространением абсцесса на митральный клапан), 3 (12%) выполнено коронарное шунтирование и 1 (4%) протезирование восходящей аорты в связи с дилатацией (табл. 3).
В послеоперационном периоде пациентам c имплантированным механическим или биологическим протезом назначался прием таблетированного непрямого антикоагулянта варфарина с контролем значений международного нормализованного отношения в пределах 2,0-3,0. До достижения целевого уровня международного нормализованного отношения всем больным назначался гепарин, при достижении которого он отменялся. Пациенту с имплантированным механическим протезом прием непрямых антикоагулянтов был рекомендован пожизненно, пациентам с биологическими протезами — в течение первых 3 мес. после операции. Аспирин в дозировке 75-100 мг в течение 6 мес. после хирургического вмешательства назначался пациентам после операции Росса, Ozaki и протезирования аортальным гомографтом. В течение 6 нед. после проведения хирургического вмешательства всем пациентам рекомендовалась антибиотикотерапия.
Послеоперационная характеристика пациентов представлена в таблицах 4 и 5. Медиана времени нахождения в реанимации составила 29,5 [ 18,2-83] ч, а медиана госпитализации — 14 [ 12-15] дней c летальным исходом у 1 (4%) пациента (причина летального исхода — сепсис). В структуре нелетальных осложнений госпитального периода отмечены рестернотомия по поводу кровотечения (n=3, 12%), имплантация постоянного электрокардиостимулятора по поводу нарушения проводимости (n=1, 4%) и острое почечное повреждение, потребовавшее заместительной почечной терапии методом гемодиализа (n=1, 4%).
Таблица 4
Постоперационная характеристика пациентов
|
Параметры |
n=25 |
|
Время нахождения в реанимации, ч (Me [ Q1-Q3]) |
29,5 [ 18,2-83] |
|
Период госпитализации, дней (Me [ Q1-Q3]) |
14 [ 12-15] |
|
Госпитальная летальность, % |
1 (4) |
|
Рестернотомия по поводу кровотечения, n (%) |
3 (12) |
|
Имплантация постоянного ЭКС, n (%) Острое почечное повреждение, n (%) Сепсис, n (%) |
1 (4) 1 (4) 1 (4) |
Сокращения: ЭКС – электрокардиостимулятор.
Таблица 5
ЭхоКГ данные в послеоперационном периоде
|
Параметры |
n=25 |
|
Ранний послеоперационный период |
|
|
ФВ ЛЖ, % (M±SD с 95% ДИ) |
56±6 (53-59) |
|
Пиковый градиент на АК, мм рт.ст. (Me [ Q1-Q3]) |
7 [ 5-10] |
|
Средний градиент на АК, мм рт.ст. (M±SD с 95% ДИ) |
8±6 (2-15) |
|
АР ?2 степени, n (%) |
0 (0) |
|
Отдаленный послеоперационный период |
|
|
ФВ ЛЖ, % (M±SD) |
59±10 |
|
Пиковый градиент давления на АК, мм рт.ст. |
7 [ 6-10] |
|
Средний градиент давления на АК, мм рт.ст. |
3 [ 3-3] |
|
АР ?2 степени, n (%) |
0 (0) |
Сокращения:
АК — аортальный клапан,
АР — аортальная регургитация,
ДИ — доверительный интервал,
ФВ ЛЖ — фракция выброса левого желудочка.
Медиана периода наблюдения составила 73,0 [ 6,0-90,5] мес. Летальный исход в отдаленном периоде у 3 (11,5%) пациентов (n=1, 4% — тромбоэмболия легочной артерии, n=2, 8% — причина смерти неизвестна). Пяти- и десятилетняя выживаемость после хирургического лечения больных с абсцессом корня аорты составила 86,9% и 78,6%, соответственно (рис. 1). Повторного хирургического вмешательства и рецидива ИЭ в отдаленном периоде не было.

Рис. 1. Кривая Каплана-Мейера для общей выживаемости.
ЭхоКГ в отдаленном периоде выполнено 17 (70,8%) пациентам. Фракция выброса левого желудочка по Симпсону составила 59±10%, пиковый градиент протезированного АК — 7 [ 6-10] мм рт.ст., cредний градиент давления — 3 [ 3-3] мм рт.ст., ни у одного из пациентов не выявлено умеренной или тяжелой регургитации протезированного АК (табл. 5).
Обсуждение
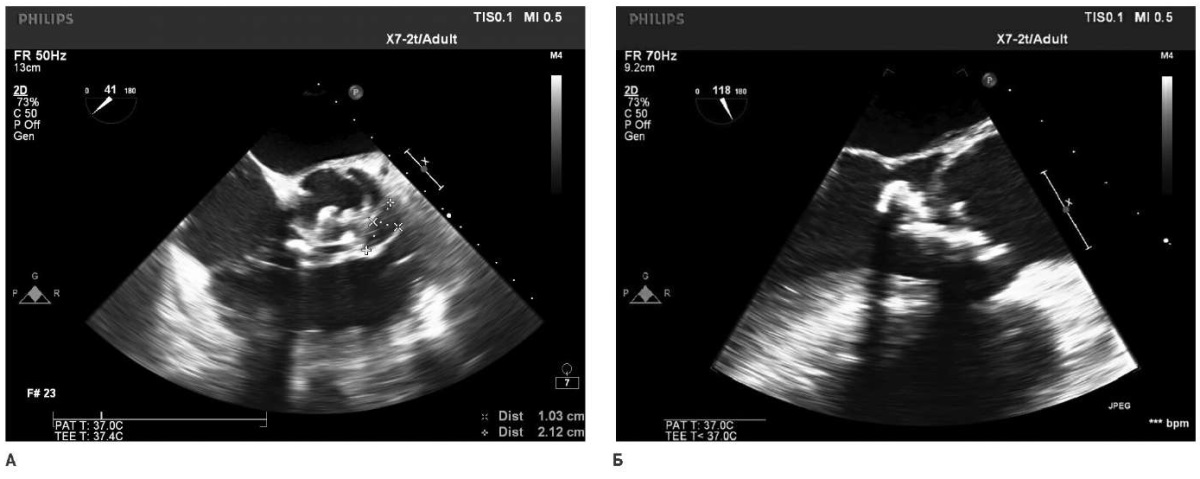
Абсцесс — это перивальвулярная полость с некрозом и гнойным содержимым, не связанная с просветом сердечно-сосудистой системы, визуализируемая при ЭхоКГ как утолщенная эхонегативная или эхопозитивная негомогенная перивальвулярная область (рис. 2) [1][2]. После установления диагноза ИЭ c формированием абсцесса корня аорты необходимо незамедлительно приступить к подготовке пациента вне зависимости от результатов бактериального посева, особенно в случае наличия высоковирулентного штамма бактерий. Наиболее частыми осложнениями в этом случае являются формирование ложной аневризмы, фистулы аорты в какую-либо камеру сердца, прогрессивное разрушение фиброзной аортожелудочковой мембраны сердца и распространение патологии на митральный клапан [3-5][8]. Кроме того, увеличивается риск эмболических осложнений [5], что в нашем исследовании наблюдалось у каждого пятого пациента (n=5, 20%).

Рис. 2. Интраоперационное ЭхоКГ пациента, включенного в исследование.
Примечание:
А) короткая ось левого желудочка, визуализируются вегетации АК
и абсцесс корня аорты размерами 10?21 мм;
Б) длинная ось левого желудочка — визуализируются вегетации АК
и абсцесс корня аорты.
Сокращение: АК — аортальный клапан.
При ретроспективном анализе данных пациентов центра уточнить локализацию абсцесса корня аорты в процентном соотношении оказалось невозможным, однако по опубликованным данным в 40-52% случаев абсцесс корня аорты локализуется в области фиброзного кольца АК в проекции некоронарного синуса Вальсальвы либо в зоне митрально-аортального контакта [5][9].
Полученные в результате нашего исследования данные о положительных бактериологических посевах с участков пораженных клапанов интраоперационно, либо дооперационно с выявлением грамположительных кокков коррелируют с известной доказательной базой: основными возбудителями являются грамположительные кокки, при этом наиболее вирулентным является золотистый стафилококк, при наличии которого встречаются наиболее выраженные повреждения корня аорты и прилежащих структур [3-5][8].
Тяжелое клиническое состояние, сложность реконструкции интраоперационно приводят к высоким показателям госпитальной летальности, достигающей 31%, а в случаях протезного эндокардита — 65% [3][10][11] с высокой частотой необходимости проведения повторных операций (от 3 до 30%) из-за рецидива инфекции [10][11]. В нашем исследовании рассчитанный риск хирургического вмешательства по шкале EuroSCORE II составлял 3 [ 1-5]%, что коррелировало с госпитальной летальностью — 4%.
Вопрос о выборе оптимального объема операции остается открытым, поскольку существуют разные стратегии и методики коррекции [5][10][11], рекомендации не отдают предпочтение какому-либо конкретному виду хирургического вмешательства и рекомендуют индивидуальный подход к каждой ситуации [1][2][11].
Считается, что замещение инфицированных клапанов сердца, а также синтетических и механических протезов другими синтетическими протезами даже при их предварительной обработке антибиотиками связано с высоким риском рецидива инфекционного процесса [10]. После дебридмента инфицированных или разрушенных тканей выполняется закрытие дефекта или полости абсцесса заплатами из синтетических материалов, перикарда или имплантация протеза в неанатомическую позицию [5][10], затем выполняется протезирование АК с фиксацией манжеты протеза к неофиброзному кольцу.
Выбор протеза представляет собой трудное решение у молодых людей с эндокардитом АК: механические клапаны связаны с риском осложнений кровотечения от 0,5% до 2% на пациента в год [11] и некомплаентностью пациента в отношении антикоагулянтной терапии, а биологические — с ранним риском разрушения конструкции клапана и повторных хирургических вмешательств [11].
Криосохраненные гомографты остаются «золотым стандартом» в лечении инфекционного и протезного эндокардита [10-12]. Применение гомографтов при наличии активного инфекционного процесса может иметь значительные преимущества перед механическими и каркасными биологическими протезами, однако имеются исследования, показывающие отсутствие преимуществ гомографтов перед механическими протезами [10-12], кроме того, их доступность, беспокойство за их долговечность у молодых людей и технические трудности при повторном хирургическом вмешательстве ограничивают их использование [11].
На сегодняшний день в литературе описано лишь небольшое количество ограниченных серий пациентов, перенесших операцию Росса при ИЭ [13]. В опытных центрах операция Росса является надежной альтернативой протезированию или замене АК гомотрансплантатом у пациентов с активным эндокардитом АК, с низким операционным риском и хорошими долгосрочными результатами [11][13]. Она обеспечивает аутологичный тканевый клапан с хорошими гемодинамическими показателями и высокой устойчивостью к инфекции и в случае перивальвулярного поражения позволяет выполнить реконструкцию выводного тракта левого желудочка без необходимости в каком-либо протезе или перикардиальной заплате [11]. Основной проблемой операции Росса является риск повторной операции на аутотрансплантате, оцениваемый в 0,78% пациенто-лет [11]: чаще всего повторное хирургическое вмешательство взаимосвязано с дилатацией легочного аутографта при использовании классической методики, но с помощью модифицированных методов (имплантация легочного аутографта внутри собственного корня аорты пациента, укутывание легочного аутографта дакроновым протезом) этой прогрессирующей дилатации аутотрансплантата можно избежать [11]. В нашем центре операция Росса выполнялась как по классической (с 2009г), так и по модифицированной методике (c 2014г).
Выбор тактики хирургического вмешательства у пациентов центра осуществлялся с учетом преимуществ и недостатков каждого метода, а также возраста пациента и его периоперационных рисков и опыта хирурга, выполнявшего оперативное лечение, что согласуется с рекомендациями по лечению ИЭ — индивидуальным подходом к каждому пациенту.
Заключение
- У большинства пациентов ИЭ протекал с наличием вегетаций (n=23, 92%), ИЭ нативного АК зарегистрирован у 22 пациентов (88%; у половины из которых (n=11, 44%) АК — двустворчатый), вторичный и подострый (n=19, 76%). У 7 (28%) пациентов ИЭ диагностирован как активный процесс, и у 5 (20%) — на его фоне произошла эмболия (n=3, 12% — в церебральные сосуды, n=2, 8% — в селезеночную артерию с развитием инфаркта селезенки). У всех пациентов (n=25, 100%) наблюдались признаки СН, обусловленной ИЭ, более половины пациентов (n=14, 56%) имели выраженную симптоматику — III или IV функциональный класс NYHA.
- Наиболее часто выполняемым хирургическим вмешательством у пациентов была операция Росса (n=12, 48%). 8 (32%) пациентам центра выполнено протезирование корня аорты гомографтом по методике «полный корень аорты». Комбинированное хирургическое вмешательство на сердце применено у 7 (28%) пациентов.
- Пяти- и десятилетняя выживаемость после хирургического лечения больных с абсцессом корня аорты составила 86,9% и 78,6%, соответственно. Повторного хирургического вмешательства и рецидива ИЭ в отдаленном периоде не было.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Энгиноев С.Т., Зеньков А.А., Магомедов Г.М., Абдулмежиджидова У.К., Гулиев М.А., Чернов И.И., Губарева Е.Ю. Хирургическое лечение абсцесса корня аорты: 10-летний опыт одного центра. Российский кардиологический журнал. 2023;28(3S):5453. https://doi.org/10.15829/1560-4071-20235453. EDN: EUCYNB
Скопировать