Экспериментальные модели тромбоэмболии легочной артерии
Тромбоз играет решающую роль в различных сердечно-сосудистых заболеваниях (ССЗ), таких как острый инфаркт миокарда, тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА), которые являются основными причинами заболеваемости и смертности населения всего земного шара [1][2]. Венозная тромбоэмболия, которая включает в себя тромбоз вен и ТЭЛА, занимает третье место в структуре сердечно-сосудистой смертности после острого инфаркта миокарда и инсульта. Ежегодная заболеваемость венозной тромбоэмболией составляет порядка 300-600 тыс. случаев в мире [3]. Диагностика ТЭЛА осложняется тем, что отсутствуют специфические клинические проявления, а также функциональные и лабораторные показатели для раннего выявления легочной эмболии. Своевременная диагностика ТЭЛА остается важнейшей нерешенной проблемой современного здравоохранения [4-6], в т.ч. и потому, что при жизни диагноз ТЭЛА устанавливается менее чем в 70% наблюдений [6][7].
Подавляющее большинство случаев острой ТЭЛА (~95%) развивается в результате отрыва и перемещения тромбов из сосудов нижних конечностей при ТГВ, и в более редких случаях — из других сосудов, таких как подключичная, плечевая и почечные вены [6] или правых отделов сердца.
В связи с недостаточной эффективностью существующих методов выявления и лечения пациентов c ТЭЛА и ТГВ [8][9] необходимы дальнейшие исследования по поиску новых диагностических и лечебно-профилактических подходов. Огромную роль в изучении патофизиологии и доклинической оценке методов диагностики и лечения ТЭЛА сыграли экспериментальные исследования на лабораторных животных.
Для экспериментального моделирования ТЭЛА используются следующие методы: внутривенная инфузия тромбина, аденозиндифосфат-индуцированная ТЭЛА, индукция ТЭЛА при помощи тромбопластина, человеческого рекомбинантного тканевого фактора или высокомолекулярных полифосфатов (ВМП); моделирование ТЭЛА посредством коллаген-адреналиновой смеси, внутривенное введение готовых тромбов, приготовленных ex vivo, хирургические модели (временная окклюзия нижней полой вены (НПВ), окклюзия бедренной вены).
Идеальная модель ТЭЛА должна иметь хорошую воспроизводимость венозного тромбоза и позволять в реальном времени наблюдать и изучать клеточные механизмы роста тромба. К сожалению, подобной модели ТЭЛА на данный момент не существует, в связи с чем при исследовании определенных аспектов ТЭЛА следует использовать конкретную модель, с учетом характерных для нее особенностей и ограничений.
Ниже мы приведем описание нескольких, наиболее часто использующихся моделей ТЭЛА и обозначим основные преимущества и недостатки каждой конкретной модели.
Внутривенная инфузия (инъекция) тромбина
Тромбин является активированным фактором II (IIа) свертывания крови и образуется под действием протромбиназного комплекса (Xа, Vа, тромбоцитарный тромбопластин, ионы Са2+) из II неактивированного фактора (протромбина). По механизму действия тромбин относится к ферментам подкласса сериновых протеаз класса гидролаз. Тромбин катализирует жизненно-необходимую реакцию превращения фибриногена (I неактивного фактора) в фибрин (I активный фактор), который является основной составляющей тромба для остановки кровотечения и восстановления целостности сосуда при его повреждении [10][11]. Тромбин широко используется в практической медицине (в качестве гемостатического препарата для наружного и местного применения), клинической лабораторной диагностике (тромбин является основным составляющим реагента для определения таких показателей коагулограммы, как фибриноген и тромбиновое время, а также для оценки агрегации тромбоцитов) [12][13]. В дополнение к этим сферам применения внутривенное введение тромбина лабораторным животным используется в экспериментальной кардиологии для индукции ТЭЛА [14][15].
Temme S, et al. (2015) индуцировали ТЭЛА у лабораторных мышей при помощи внутривенной инъекции тромбина в сочетании с перфторуглеродными наноэмульсиями (ПФУ). Для индуцирования ТЭЛА мышам вводили смесь человеческого тромбина (Sigma-Aldrich, Seelze, Германия; 10 Ед/25 г массы тела) и ПФУ. В данном случае ПФУ — эмульгированные биологически инертные перфторуглероды — используются в качестве контрастного вещества для отслеживания клеток ex vivo или in vivo, меченных ПФУ. Выживаемость мышей после инъекции составила 80%. На данной модели исследователи разработали новый метод неинвазивной молекулярной визуализации раннего венозного тромбоза с помощью магнитно-резонансной томографии 19F с ПФУ [14].
В другом исследовании Brandt M, et al. (2018) изучали патогенез хронической тромбоэмболической легочной гипертензии, возникающей чаще всего в результате ТГВ и ТЭЛА. Моделирование ТЭЛА осуществлялось посредством внутривенного введения тромбина. Обезболивание мышей проводилось 2-4% изофлураном в сочетании с подачей кислорода (0,2 л/мин 100% О2). Острые экспериментальные легочные эмболии индуцировали ретроорбитальной инъекцией 166 Ед/кг массы тела ?-тромбина (бычий, Sigma-Aldrich, Сент-Луис, США), растворенного в 100 мл физиологического раствора. После каждой инъекции проводили эхокардиографию и оценку клинической картины у животных. Сразу после инъекции тромбина ТЭЛА была подтверждена на основании комплекса клинических и функциональных данных: внезапной брадикардии или асистолии, апноэ или брадипноэ, а также повышением давления в легочной артерии, оцениваемой при помощи эхокардиографии. Следующую инъекцию выполняли через 15 мин. Всего на одно животное было проведено до трех инъекций. При помощи данного протокола исследования удалось вызвать гемодинамически значимую, но нелетальную ТЭЛА. Ученые установили, что дозы тромбина, превышающие 166 Ед/кг массы тела, были смертельными для значительного числа лабораторных животных, в то время как более низкие дозы и интервальное выполнение инъекций повышали выживаемость животных, делая возможным изучение патогенеза ТЭЛА и оценку лечебных и диагностических возможностей в долгосрочной перспективе [15]. Также в исследовании было обнаружено, что инъекция тромбина лабораторным животным не только вызывала ТЭЛА, но и приводила к деформации и дилатации правого желудочка, уплощению внутрижелудочковой перегородки, а также сдавлению левого желудочка [15].
Для того, чтобы вызвать ТЭЛА, человеческий тромбин можно вводить внутривенно с использованием катетера для хвостовой вены. Более медленное введение обеспечивает выживание приблизительно 80% исследуемых животных. В зависимости от дозы и концентрации тромбина исследователи вызывали развитие разных форм ТЭЛА. Так, на основании размера сосуда и степени его обструкции легочная тромбоэмболия была разделена на четыре группы по массивности поражения (с I по IV степень), при этом чаще всего у животных развивалась ТЭЛА I-III степени, а IV встречалась гораздо реже. В качестве группы сравнения использовались животные, которым в легочные сосуды вводился физиологический раствор, при этом тромбоз не развивался.
Инъекция человеческого тромбина приводила к формированию легочных тромбов различных размеров, что подтверждается иммуногистохимическими методами с использованием антител против маркера тромбоцитов — CD41. Уровень смертности среди лабораторных животных после инъекции человеческого тромбина составил ~20%, что соответствовало результатам ряда предшествующих исследований с использованием данной модели [15][16].
Аденозиндифосфат-индуцированная ТЭЛА
Аденозиндифосфат (АДФ) является низкомолекулярным соединением, относится к нуклеотидам и состоит из аденина, рибозы и двух остатков фосфорной кислоты. АДФ выполняет в организме человека ряд функций, к числу которых относится и участие в гемостазе. АДФ в значительных количествах локализуется в составе гранул тромбоцитов, высвобождаясь при их активации и способствуя адгезии и агрегации [17]. В клинической лабораторной диагностике данный реагент используется для исследования тромбоцитарного звена системы гемостаза — АДФиндуцированной агрегации тромбоцитов [18]. АДФ также нашел применение в экспериментальной кардиологии для индуцирования тромбозов различных сосудов, в частности — легочной артерии [19][20].
В экспериментальном исследовании на самцах мышей C57BL/6J обнаружено, что внутривенное введение АДФ приводит к зависимому от дозы обратимому прекращению кровотока, которое можно обнаружить в брыжеечных сосудах с помощью лазерной доплеровской флуометрии. Животных анестезировали с помощью внутримышечной инъекции кетамина и седазина и помещали на хирургический стол, обеспечивая контроль температуры тела. Брюшную полую вену канюлировали с использованием пластикового катетера 22G. АДФ, растворенный в концентрации 2,5 мг/мл в физиологическом растворе, вводили в брюшную полую вену с помощью инфузионного насоса (BBraun, Германия) в течение 10 сек с поддержанием скорости потока, что приводило к конечным дозам от 0,5 до 10 мг/кг массы тела [19]. При этом было обнаружено снижение количества циркулирующих тромбоцитов и накопление тромбоцитарных агрегатов в сосудах легких. Такой эффект может быть объяснен тем фактом, что легкие являются первой капиллярной системой на пути венозной крови, подвергающейся действию АДФ, и, поскольку этот агонист имеет относительно короткое действие, весь процесс агрегации и дезагрегации тромбоцитов происходит преимущественно в легких [20].
В зависимости от дозы АДФ возможно развитие разных форм ТЭЛА. В одном из исследований сообщалось, что для того, чтобы индуцировать измеримое накопление тромбоцитарных агрегатов в сосудах легких, минимальная доза АДФ должна составлять 0,4 мкг/кг массы тела [20]. Эффективными дозами для моделирования разных степеней тяжести ТЭЛА были признаны от 15 до 400 мкг/кг веса животного. Примечательно, что для тромбоза и угнетения кровотока в брыжеечных сосудах минимальная доза АДФ составляет 500 мкг/кг массы тела, т.е. несколько выше, чем для моделирования ТЭЛА.
Модели ТЭЛА, индуцированные введением тканевого фактора (тромбопластин-индуцированная ТЭЛА)
Тромбопластин является III фактором свертывания крови, который по химической природе относится к сложным белкам и состоит из апопротеина III и фосфолипидов. В условиях здорового организма тканевой фактор высвобождается только при повреждении сосуда, после чего активирует фактор свертывания VII, инициируя каскад гемостатических реакций и обеспечивая образование тромбина [21]. Тромбопластин широко используется в практической медицине, клинической лабораторной диагностике (в качестве реагента для определения показателей коагулограммы — протромбинового индекса, международного нормализованного отношения) и экспериментальной кардиологии [22-25].
В ряде исследований моделирование тромбопластин-индуцированной ТЭЛА использовалось для изучения патофизиологии данного заболевания и доклинической оценки эффективности лекарственных препаратов. Так, L?on C изучал роль пуринергических рецепторов тромбоцитов в развитии ТЭЛА и потенциальные возможности данных рецепторов в качестве мишеней для антитромботических препаратов [22]. Принцип модели тромбопластин-индуцированной ТЭЛА заключается во введении тромбопластина в яремную вену лабораторных животных. Для обезболивания/анестезирования лабораторных животных использовалась смесь 0,2% ксилазина и 1% кетамина в физиологическом растворе [23].
Инъекция тромбопластина приводила к значимому повышению комплекса тромбин-антитромбин в плазме крови мышей, что непосредственно отражало образование тромбина. Мыши с дефицитом пуринергических рецепторов (P2Y) оказались более чувствительны к тромбопластин-индуцированной ТЭЛА, чем мыши дикого типа, что свидетельствует о важной роли P2Y в патогенезе ТЭЛА и терапевтических возможностях антагонистов P2Y [24].
Smyth S, et al. с коллегами изучали вклад тромбоцитарного интегрина ?IIb?3 (GPIIb/IIIa) в развитии тромбоза на модели тромбопластин-индуцированной ТЭЛА [23].
Weiss E, et al. доказали роль рецепторов, активируемых протеазами (PAR3) в патогенезе ТЭЛА на экспериментальной модели. Моделирование ТЭЛА осуществлялось при помощи тромбопластина (SigmaAldrich), полученного из мозга кроликов. Каждый флакон с тромбопластином (3-4 мг лиофилизированного порошка) растворяли в 4 мл физиологического раствора и 100 мл этого раствора вводили лабораторным мышам в хвостовую вену. В таких дозах выживаемость мышей составила 100%. Было установлено, что в тромбоцитах мышей PAR3 функционирует как кофактор, который связывает тромбин, а ингибирование PAR3 может быть использовано для профилактики или лечения тромбозов у людей [24].
Моделирование ТЭЛА также используется для изучения диагностических возможностей ряда методов. Так, Page M, используя мышиную модель тромбопластин-индуцированной ТЭЛА, разработал неинвазивный способ визуализации ТЭЛА с помощью инфракрасной флуоресценции и позитронно-эмиссионной томографии [25].
Модели легочной эмболии, индуцированные инфузией рекомбинантного человеческого тканевого фактора или ВМП
Banno F, et al. [26] моделировали ТЭЛА при помощи рекомбинантного человеческого тканевого фактора (Dade Innovin) и ВМП. ВМП получены по методу, разработанному Smith SA, et al. [27]. Метафосфат натрия (Sigma-Aldrich Japan, Токио, Япония) дважды промывали очищенной водой и растворяли в 250 мл хдорида лития. ВМП (длиной 40-1200 фосфатных единиц) осаждали, добавляя 2,5 объема ацетона, и растворяли в дистилированной воде.
В эксперименте мышей анестезировали 2,5% 2,2,2-трибромэтанолом, и вводили 15 мкл/г массы тела реагента рекомбинантного тканевого фактора (разведение 1/30) или ВМП (1,67 г/л). Дозу тканевого факторы и ВМП подбирали таким образом, чтобы после инфузии выживало ~20% мышей дикого типа. Средняя продолжительность жизни от момента инъекции составляла ~20 мин, при этом смерть определялась как остановка дыхания, которая сохранялась в течение не менее 2 мин. Через две минуты после остановки дыхания или по завершении 20-мин периода наблюдения лабораторным животным вводили 0,5 мл 1% синего Эванса в правый желудочек. Легкие были вырезаны, сфотографированы и оценены на наличие дефектов синей перфузии Эванса с использованием шкалы баллов (от 0 для отсутствия окклюзии до 4 для полной окклюзии) [26]. Используя эту модель, исследователи пришли к выводу, что мутация K196E в белке S является специфичным генетическим фактором риска развития ТЭЛА [28].
Внутривенное введение готовых тромбов, приготовленных ex vivo
Данная модель была разработана отечественными исследователями Амосовым В. И. и Золотницкой В.П. Принцип метода заключается во введении готовых тромбов, приготовленных ex vivo, в бедренную вену лабораторных животных. Данный способ прост в исполнении, однако его важным недостатком является то, что он не позволяет оценить ключевые аспекты тромбообразования, в связи с чем эта модель не соответствует физиологическим условиям формирования тромба и, как следствие, не подойдет для доклинической оценки антитромботических препаратов [29]. В то же время эта модель является весьма удобной для оценки эффективности новых методов диагностики ТЭЛА [30].
Хирургические модели ТЭЛА
Данный способ моделирования разработан отечественным ученым Самородовым А.В., и его принцип основан на временной окклюзии НПВ [Самородов А.В., Халиуллин Ф.А., Камилов Ф.Х., Халимов А. Р. Способ моделирования тромбоэмболии легочной артерии у крыс (патент на изобретение). 2017]. В качестве объекта исследования были использованы крысы. Стандартная предоперационная подготовка включала бритье, обработку операционного поля и наркоз (внутрибрюшинное введение тиопентала натрия (50 мг/кг веса животного)). Оперативный доступ осуществлялся путем срединной лапаротомии. После чего на НПВ временно накладывалась клипса. Исследователи экспериментальным путем установили, что в зависимости от длительности наложения клипсы на НПВ возможно возникновение разных форм ТЭЛА: 1) если клипса накладывается на 0-1,4 ч, то ТЭЛА маловероятна, либо она незначительна и развивается только на уровне мелких артерий; 2) если клипса на НПВ накладывается на 1,5-3,0 ч, то случается ТЭЛА на уровне сегментарных артерий; 3) при наложении клипсы на НПВ на срок 3,1-6,0 ч тромбоз развивается на уровне долевых артерий; 4) наложение клипсы на НПВ >6 ч приводит к организации и фиксации тромба к стенке вены и формирование формы ТЭЛА будет иметь непредсказуемый характер — от тромбоза мелких ветвей до массивной ТЭЛА [Самородов А.В., Халиуллин Ф.А., Камилов Ф.Х., Халимов А. Р. Способ моделирования тромбоэмболии легочной артерии у крыс (патент на изобретение). 2017]. Недостаток данного хирургического способа — инвазивность и необходимость участия квалифицированного хирургического персонала, а ключевыми преимуществами являются высокая эффективность модели, соответствие частым клиническим ситуациям и возможность моделирования конкретной формы ТЭЛА в зависимости от поставленных целей и задач исследования.
Еще одна часто используемая хирургическая модель ТЭЛА была разработана Ji Y, et al. [31]. Ее принцип основан на наложении зажима на бедренную вену лабораторных животных для индуцирования формирования тромба, последующей его экстракции и введении в противоположную интактную бедренную вену. Данная модель обладает рядом недостатков: инвазивность и необходимость участия квалифицированного хирурга, двухэтапное оперативное вмешательство, несоответствие основным физиологическим условиям, отсутствие возможности моделирования конкретной формы ТЭЛА в отличие от вышеописанной модели [Самородов А.В., Халиуллин Ф.А., Камилов Ф.Х., Халимов А.Р. Способ моделирования тромбоэмболии легочной артерии у крыс (патент на изобретение). 2017].
В таблице представлены вышеописанные экспериментальные модели ТЭЛА с основными их принципами, преимуществами и недостатками (табл. 1).
Таблица 1
Основные экспериментальные модели ТЭЛА

Сокращения: АДФ — аденозиндифосфат, ВМП — высокомолекулярные полифосфаты, ПЖ — правый желудочек, ПФУ — перфторуглеродные наноэмульсии, ТЭЛА — тромбоэмболия легочной артерии.
Собственные результаты
Также нам хотелось бы привести собственный опыт создания искусственной модели ТЭЛА на животных. Целью нашего исследования являлось изучение маркеров ТЭЛА в условиях искусственной модели ТЭЛА на животных. Задачами исследования были: создать искусственную модель ТЭЛА на животных; изучить концентрацию сердечного тропонина I, мозгового натрийуретического пептида, показатели общего и биохимического анализа крови у кроликов с острой ТЭЛА.
Эксперимент выполнен на лабораторных животных — 6 кроликов породы Шиншилла весом от 2,0 до 3,0 кг в возрасте 3-6 мес. Исследование проводилось на базе Центральной научно-исследовательской лаборатории ФГБОУ ВО Самарского государственного медицинского университета Министерства здравоохранения Российской Федерации.
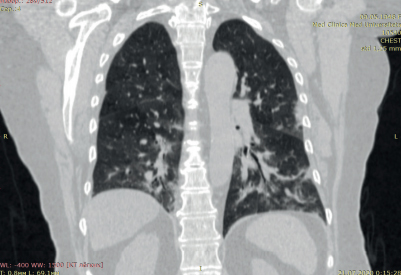
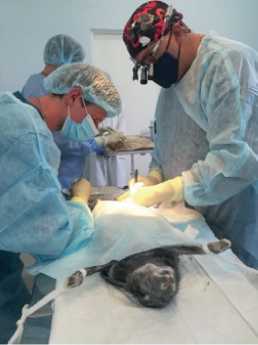
Кроликам внутримышечно вводился золетил и рометар для общей анестезии. Затем кроликов иммобилизовали на операционном столе в положении лежа на спине, по срединной линии бедра с медиальной стороны выполняли разрез 10 см, выделяли бедренную вену (рис. 1). Из бедренной вены была взята кровь, сформирован сгусток на водяной бане (рис. 2). Сгусток вводился через иглу в систему НПВ. Производилась эвтаназия и осуществлялся забор комплекса сердцелегкие для дальнейшего исследования. Взятие крови для анализа осуществлялось трёхкратно: до эксперимента, через 1 ч, перед выведением животного из эксперимента. В ходе патологоанатомического исследования были обнаружены тромбы в стволе, бифуркации и ветвях легочной артерии, а также в правом предсердии (рис. 3-6).

Рис. 1. Выделение бедренной вены.

Рис. 2. Формирование сгустка.

Рис. 3. Ствол и бифуркация легочной артерии с тромбом.

Рис. 4. Легкое с тромбами.

Рис. 5. Тромб в левой легочной артерии.

Рис. 6. Тромб в правом предсердии.
Важными критериями, подтверждающими успешность моделирования ТЭЛА в нашем случае, являлись: подтверждение ТЭЛА патологоанатомически, повышение уровня биомаркеров: тропонина, N-концевого фрагмента промозгового натрийуретического пептида, D-димера после введения тромба (табл. 2-4). Мы наблюдали повышение показателей: количества тромбоцитов, уровня креатинина, аланинаминотрансферазы, аспартатаминотрансферазы, снижение показателей гемоглобина. В пилотном исследовании была создана модель ТЭЛА для изучения патогенеза и новых возможностей лечения данного заболевания, однако требуется дальнейшее продолжение экспериментальных исследований на большей группе животных для подтверждения её эффективности.
Таблица 2
Динамика N-концевого фрагмента промозгового натрийуретического пептида

Таблица 3
Динамика D-димера

Таблица 4
Динамика тропонина

Заключение
ТЭЛА является одним из самых распространенных острых ССЗ с высоким уровнем смертности. Для изучения патофизиологии, оценки эффективности новых методов диагностики и доклинической оценки эффективности лекарственных препаратов широко используются различные способы экспериментального моделирования ТЭЛА, каждый из которых обладает рядом преимуществ и недостатков. Однако до настоящего времени единого оптимального способа моделирования ТЭЛА не разработано.
Необходимо проведение дальнейших исследований по изучению и поиску новых перспективных биомаркеров для раннего выявления ТЭЛА, патофизиологических механизмов и новых мишеней для терапевтического воздействия.
Благодарности. Авторы выражают признательность заведующей лабораторией экспериментальной морфологии Института экспериментальной медицины и биотехнологий Самарского государственного медицинского университета Нефёдовой И.Ф., заведующей лабораторией Самарского областного клинического кардиологического диспансера им. В. П. Полякова, к.м.н. Ушаковой Е.В., врачукардиологу Грабовому Д.А., клиническому ординатору Гришину С.А. за оказанную помощь при проведении данного исследования и написании настоящей статьи.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Чтобы читать статью войдите с логином и паролем от scardio.ru
Ключевые слова
Для цитирования
Муллова И.С., Чаулин А.М., Свечков Н.А., Павлова Т.В., Лимарева Л.В., Дупляков Д.В. Экспериментальные модели тромбоэмболии легочной артерии. Российский кардиологический журнал. 2022;27(1S):4887. https://doi.org/10.15829/1560-4071-2022-4887
Скопировать